Первый слайд презентации: 19.02.2025 Дистанционная работа Тема: Химические свойства азота, фосфора и их соединений
Слайд 2
Азот Положение в периодической системе химических элементов Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Слайд 3
Химические свойства азота При нормальных условиях азот химически малоактивен. 1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами. 1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000 о С), на электрической дуге (в природе – во время грозы) : Процесс эндотермический, т.е. протекает с поглощением теплоты.
Слайд 4
1.2. При сильном нагревании (3000 о С-5000 о С или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений: Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
Слайд 5
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак : Этот процесс экзотермический, т.е. протекает с выделением теплоты.
Слайд 6
1.4. Азот реагирует с активными металлами : с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения- нитриды. Например, литий реагирует с азотом с образованием нитрида лития:
Слайд 7
Аммиак Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды. Химические свойства аммиака 1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе: Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Слайд 8
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония. Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты ), либо средней соли – сульфата аммония (при избытке аммиака):
Слайд 9
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды. Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
Слайд 10
4. Аммиак горит на воздухе, образуя азот и воду: Если реакцию проводить в присутствии катализатора ( Pt ), то азот окисляется до NO:
Слайд 11
6. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества. Например, аммиак окисляется хлором до молекулярного азота:
Слайд 12
Азотная кислота Строение молекулы и физические свойства Азотная кислота HNO 3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Слайд 13
Химические свойства Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства. 1. Азотная кислота практически полностью диссоциирует в водном растворе.
Слайд 14
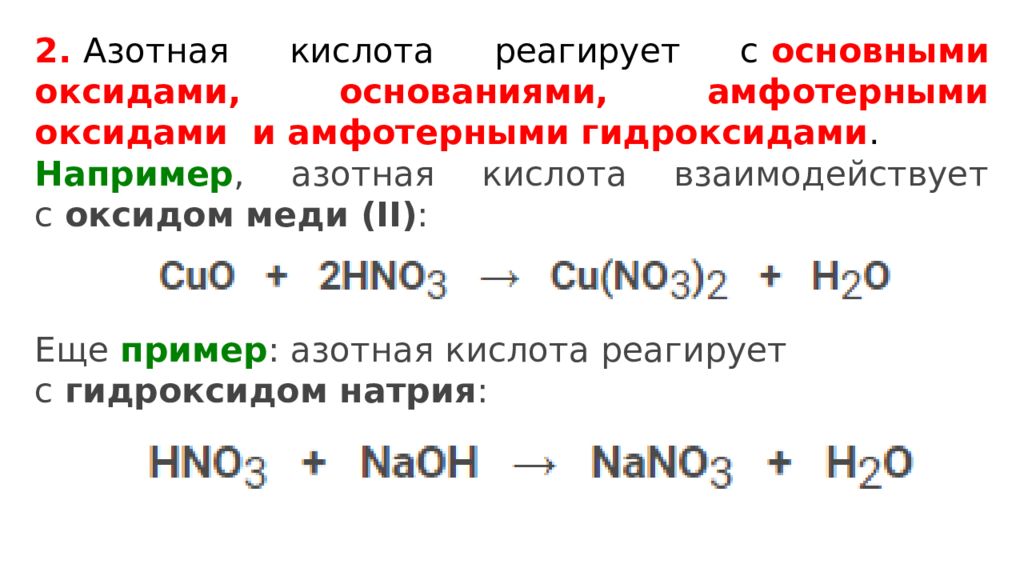
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами. Например, азотная кислота взаимодействует с оксидом меди (II) : Еще пример : азотная кислота реагирует с гидроксидом натрия :
Слайд 15
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов). Например, азотная кислота взаимодействует с карбонатом натрия: 4. Азотная кислота частично разлагается при кипении или под действием света:
Слайд 16
Фосфор Положение в периодической системе химических элементов Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Слайд 17
Химические свойства фосфора При нормальных условиях фосфор довольно химически активен. 1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами. 1.1. При взаимодействии с кислородом воздуха образу ются оксиды – ангидриды соответствующих кислот :
Слайд 19
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal 3 и PHal 5 : Фосфор реагирует с бромом:
Слайд 21
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами. Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Слайд 22
1.5. С водородом фосфор непосредственно не взаимодействует. 2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами. 2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты. Например, азотная кислота окисляет фосфор до фосфорной кислоты :
Слайд 23
Серная кислота также окисляет фосфор: Соединения хлора, например, бертолетова соль, также окисляют фосфор: Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Слайд 24
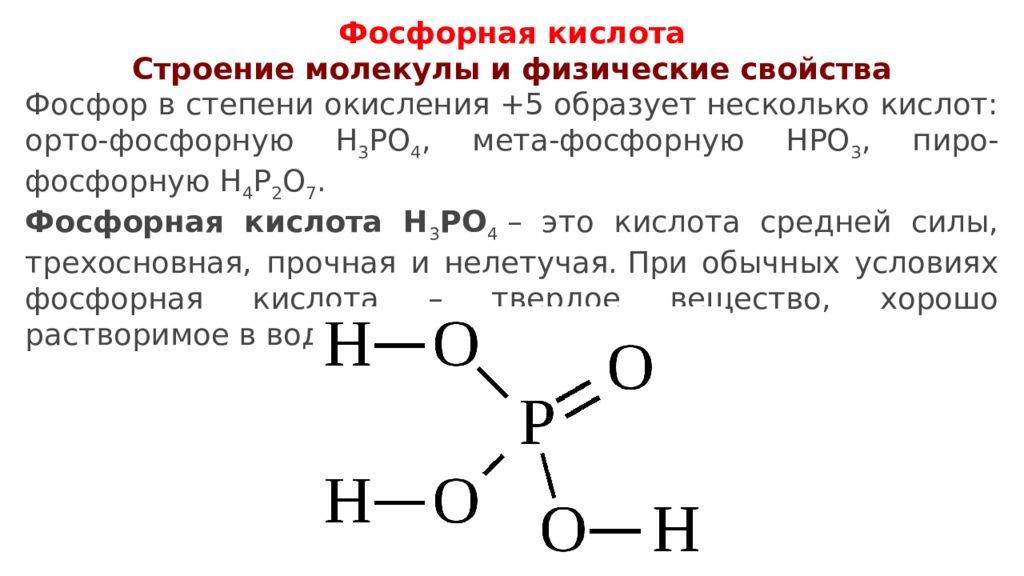
Фосфорная кислота Строение молекулы и физические свойства Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H 3 PO 4, мета-фосфорную HPO 3, пиро -фосфорную H 4 P 2 O 7. Фосфорная кислота H 3 PO 4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Слайд 25
Химические свойства Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая). 1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
Слайд 26
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами. Например, фосфорная кислота взаимодействует с оксидом магния : Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты :
Слайд 27
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями. Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Слайд 28
4. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород. Например, фосфорная кислота реагирует с магнием :
Слайд 29
6. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра :
Слайд 30
Видеоматериал по теме: https://youtu.be/virY-NjVeI8?si=2EzW8xvH-PHyeVN- https://youtu.be/civLqcY9TkU?si=nOs4_HPfalPCkoVy Домашнее задание, инструктаж по его выполнению Габриелян О.С., Остроумов И.Г., Сладков С.А. Химия. 11 класс. – 4-е изд. – М.:Просвещение, 2022. –127с. Составить конспект, выполнить письменно: 1. Укажите характеристики, которые относятся к аммиаку: 2. Валентность и степен окисления азота в молекуле аммиака равны соответственно:
Последний слайд презентации: 19.02.2025 Дистанционная работа Тема: Химические свойства азота, фосфора и их
Какой цвет имеют в растворе гидроксида аммония индикаторы: а) метилоранж; б) лакмус; в) фенолфталеин. При горении аммиака на воздухе образуется преимущественно: 5. Напишите уравнение взаимодействия фосфора с избытком кислорода. Какой фосфор, белый или красный, активнее реагирует с кислородом? Какой атом, фосфор или кислород, является более электроотрицательным? Какие свойства, окислительные или восстановительные, проявляет фосфор в этой реакции? 6. При горении фосфора образуется оксид: