Первый слайд презентации: 38 Формы нахождения в природе и способы получения простых веществ элементов IV А группы
Слайд 3: Нахождение в природе
Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных и горючих ископаемых В атмосфере и гидросфере находится в виде диоксида углерода СО 2, (в воздухе 0,046 % СО 2 по массе). Углерод входит в состав растений и животных (~18 %). Общее содержание углерода в организме человека достигает 21 %.
Слайд 5: Горючие ископаемые
битум Горючие ископаемые торф нефть природный газ антрацит каменный уголь
Слайд 6
Уголь. При термическом разложении углеродистых соединений образуется черная масса — уголь и выделяются летучие продукты. Уголь представляет собой тонкоизмельченный графит. Наиболее важными сортами угля являются кокс, древесный уголь и сажа. Кокс. Кокс получается при нагревании каменного угля без доступа воздуха. Древесный уг о ль получается при обугливани и древесины (нагревание без доступа или при незначительном доступе воздуха). Сажа. Сажа получается из углеводородов (природного газа, ацетилена, скипидара и др.) сжиганием их при ограниченном доступе воздуха (или термическим разложением в отсутствие воздуха). Получение углерода Углерод в чистом виде специально не получают, так как он встречается в природе в чистом виде. Широко используется уголь, графит, производные углерода, как неорганические, так и органические.
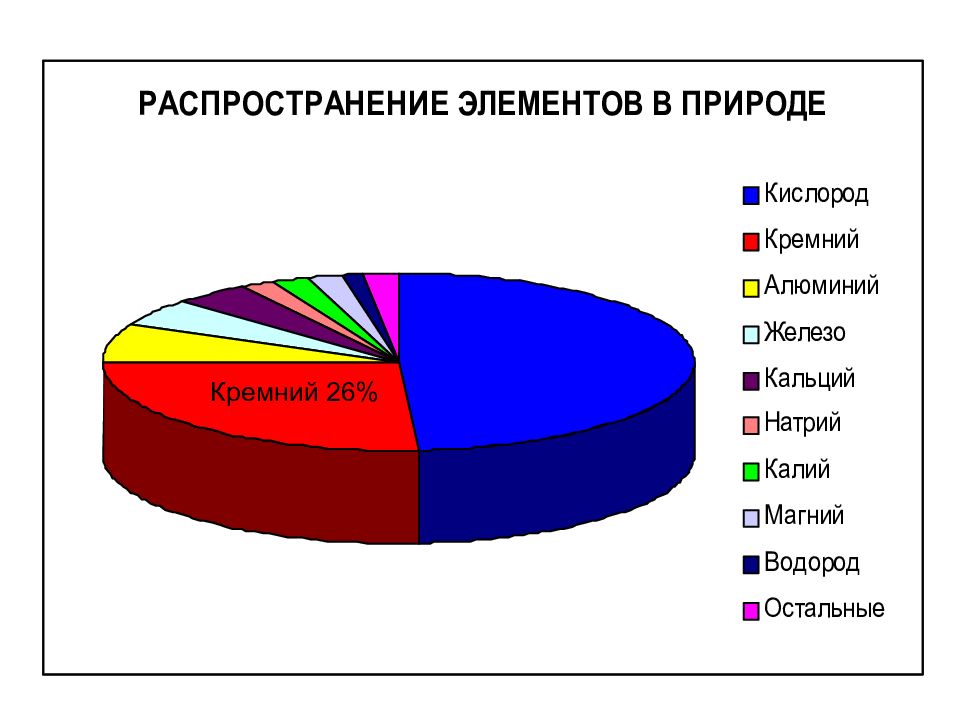
Слайд 8: Нахождение в природе
Кремний в природе содержится в минералах в виде оксида SiO 2 (кремнезем). Общее число минералов, содержащих кремнезем, превышает 400. Нахождение в природе кремния
Слайд 12: Оловянная чума
Есть у олова свойство, которое называют «оловянной чумой». Металл «простужается» на морозе уже при температуре ниже -18°С постепенно разрушаться. При температуре -33 °С свойство прогрессирует с невероятной быстротой — оловянные изделия превращаются в серый порошок. Именно из-за оловянной чумы до нас не дошли известнейшие коллекции оловянных солдатиков из прошлого. Почему сейчас не случаются подобные истории? Только по одной причине: оловянную чуму научились «лечить». Выяснена ее физико-химическая природа, установлено, как влияют на восприимчивость металла к «чуме» те или иные добавки. Оказалось, что алюминий и цинк способствуют этому процессу, а висмут, свинец и сурьма, напротив, противодействуют ему.
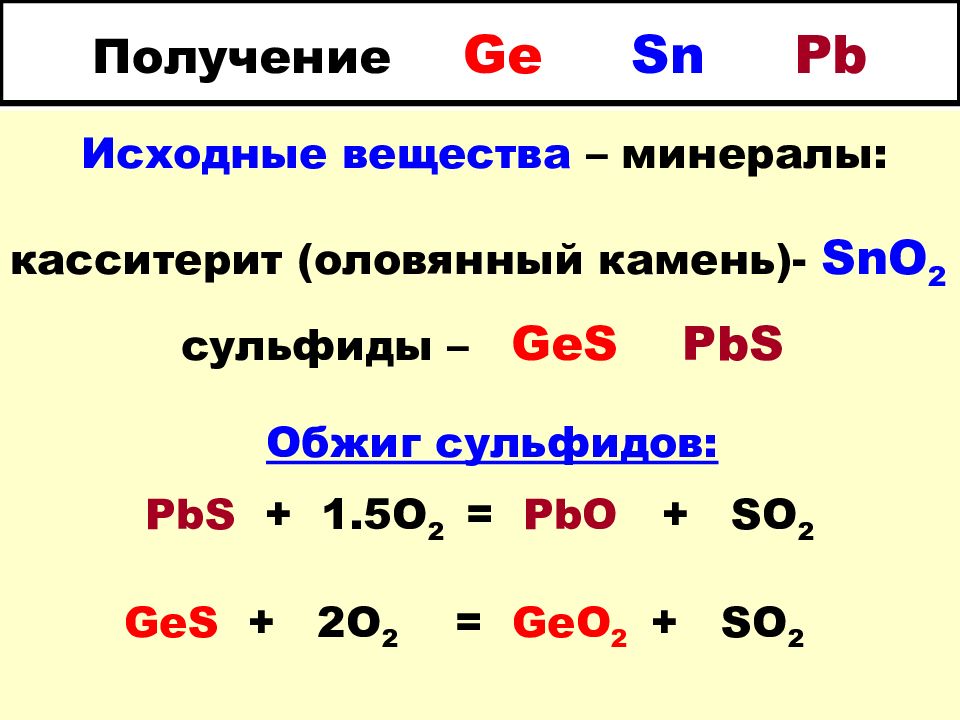
Слайд 16: Получение Ge Sn Pb
Исходные вещества – минералы: касситерит (оловянный камень)- SnO 2 сульфиды – GeS PbS Обжиг сульфидов: PbS + 1.5O 2 = PbO + SO 2 GeS + 2O 2 = GeO 2 + SO 2
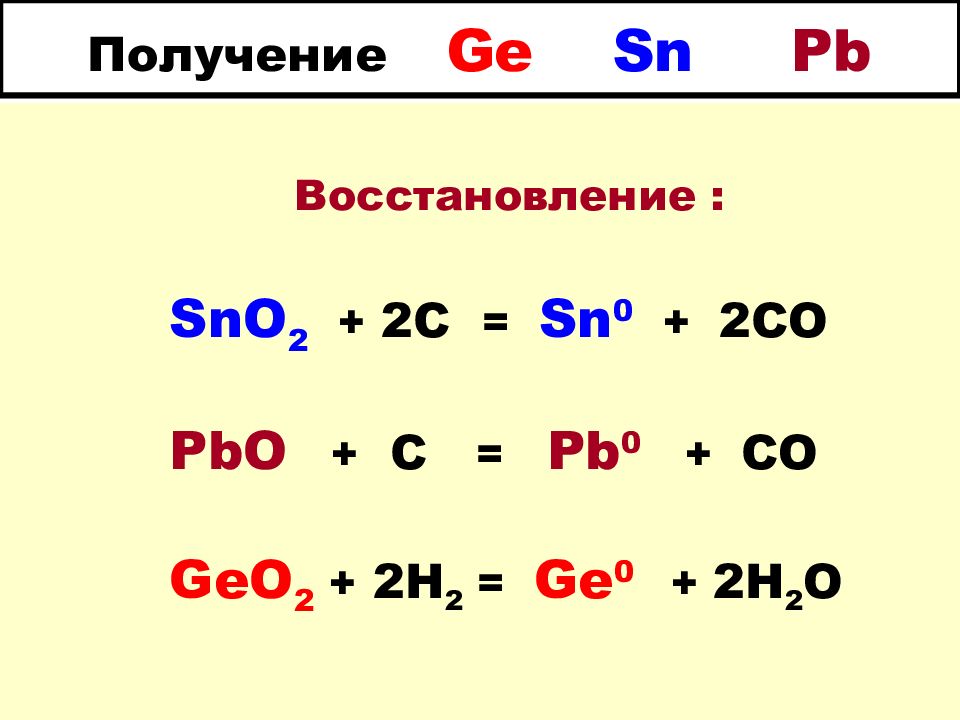
Слайд 17: Получение Ge Sn Pb
Восстановление : SnO 2 + 2C = Sn 0 + 2CO PbO + C = Pb 0 + CO GeO 2 + 2H 2 = Ge 0 + 2H 2 O
Слайд 18: Получение Ge высокой чистоты
GeCI 4 – жидкость ( т – ра кип. 83 0 С ) Сначала GeCI 4 очищают путем дистилляции. GeCI 4 нерастворим в HCI конц. При обработке GeCI 4 кислотой часть примесей уходит в водный слой HCI
Слайд 19: Получение Ge высокой чистоты
Вы c око чистый GeCI 4 подвергают гидролизу : GeCI 4 ( ж ) + 2H 2 O = GeO 2 тв + 4HCI Затем GeO 2 восстанавливают водородом : GeO 2 + 2H 2 = Ge + 2H 2 O