Слайд 2
А Л К А Н Ы — Э Т О У Г Л Е В О Д О Р О Д Ы, В М О Л Е К У Л А Х К О Т О Р Ы Х А Т О М Ы У Г Л Е Р О Д А С О Е Д И Н Е Н Ы Т О Л Ь К О О Д И Н А Р Н Ы М И С В Я З Я М И. С – С В М О Л Е К У Л А Х Э Т И Х С О Е Д И Н Е Н И Й В С Е А Т О М Ы У Г Л Е Р О Д А И М Е Ю Т М А К С И М А Л Ь Н У Ю В А Л Е Н Т Н О С Т Ь, Р А В Н У Ю Ч Е Т Ы Р Е М, П О Э Т О М У И Х Н А З Ы В А Ю Т П Р Е Д Е Л Ь Н Ы М И, И Л И Н А С Ы Щ Е Н Н Ы М И. Т А К И М О Б Р А З О М, В Р Е А Л И З У Ю Т С Я Т О Л Ь К О О Д И Н А Р Н Ы Е А Л К А Н А Х Σ - С В Я З И. О Б Щ А Я Ф О Р М У Л А В соответствии с названием, их молекулы состоят из атомов углерода, образующих скелет, и атомов водорода. Углеродный скелет представляет собой открытую линейную ("нормальные" алканы) или разветвленную цепь
Слайд 3: Гомологический ряд алканов
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом. Самый первый представитель гомологического ряда алканов – метан CH4., или Н–СH2–H Каждый последующий алкан в гомологическом ряду отличается от предыдущего на одну метиленовую группу –СН2–. Такая систематизация позволяет предсказать свойства и поведение алканов, а также облегчает их изучение и применение в различных областях химии и промышленности. Таким образом, гомологический ряд алканов является важным инструментом для химиков, позволяя систематизировать и изучать свойства этих углеводородов, а также находить им практическое применение в повседневной жизни и промышленности.
Слайд 4: СН4 метан (т. пл. = –182.5, т. кип. = –164.0)
Гомологический ряд алканов начинается с метана, имеющего один углеродный атом. Первые четыре члена ряда имеют тривиальные (случайные или исторические) названия, названия же остальных представителей являются производными греческих и латинских числительных в соответствии с количеством атомов углерода в наиболее длинной цепи молекулы. Физические свойства гомологов плавно меняются с изменением молярной массы, что особенно заметно по температурам кипения алканов (°С): СН4 метан (т. пл. = –182.5, т. кип. = –164.0) СН3- СН3 этан (т. пл. = –183.3, т. кип. = –88.6) СН3-СН2- СН3 пропан (т. пл. = –189.7, т. кип. = –42.1) СН3-СН2-СН2- СН3 бутан (т. пл. = –138.4, т.кип = –0.5) СН3-СН2-СН2-СН2- СН3 пентан (т. пл. = –129.7, т. кип. = 36.1) СН3(СН2)4СН3 гексан (т. пл. = –95, т. кип. = 69) СН3(СН2)5СН3 гептан (т. кип. = –90.5, т. кип. = 98.4) СН3(СН2)6СН3 октан (т. кип. = –56.8, т. кип. = 125.7)
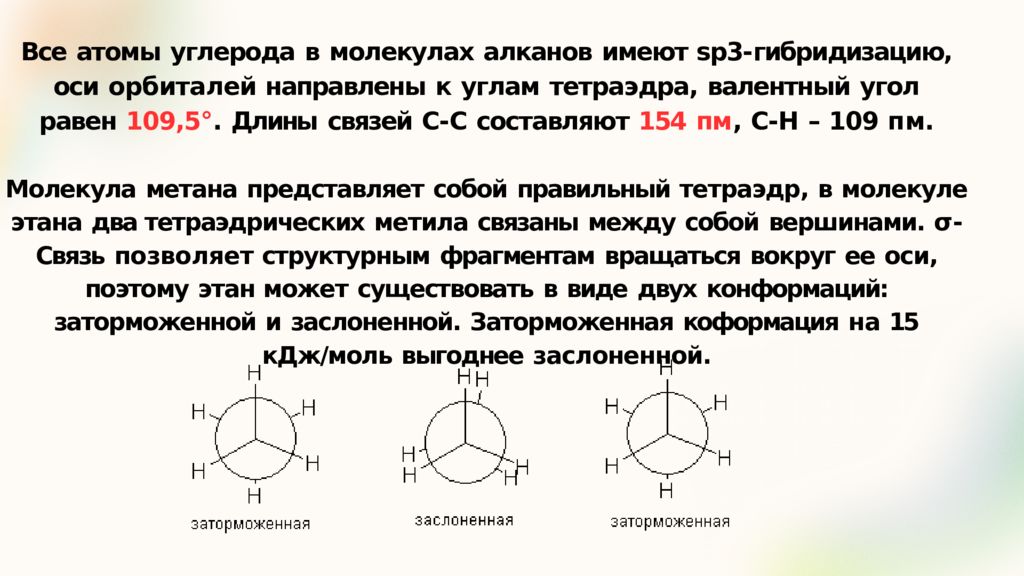
Слайд 5: Все атомы углерода в молекулах алканов имеют sp3- гибридизацию, оси орбиталей направлены к углам тетраэдра, валентный угол равен 109,5°. Длины связей С- С составляют 154 пм, С- Н – 109 пм
Молекула метана представляет собой правильный тетраэдр, в молекуле этана два тетраэдрических метила связаны между собой вершинами. σ - Связь позволяет структурным фрагментам вращаться вокруг ее оси, поэтому этан может существовать в виде двух конформаций: заторможенной и заслоненной. Заторможенная коформация на 15 кДж/моль выгоднее заслоненной.
Слайд 6
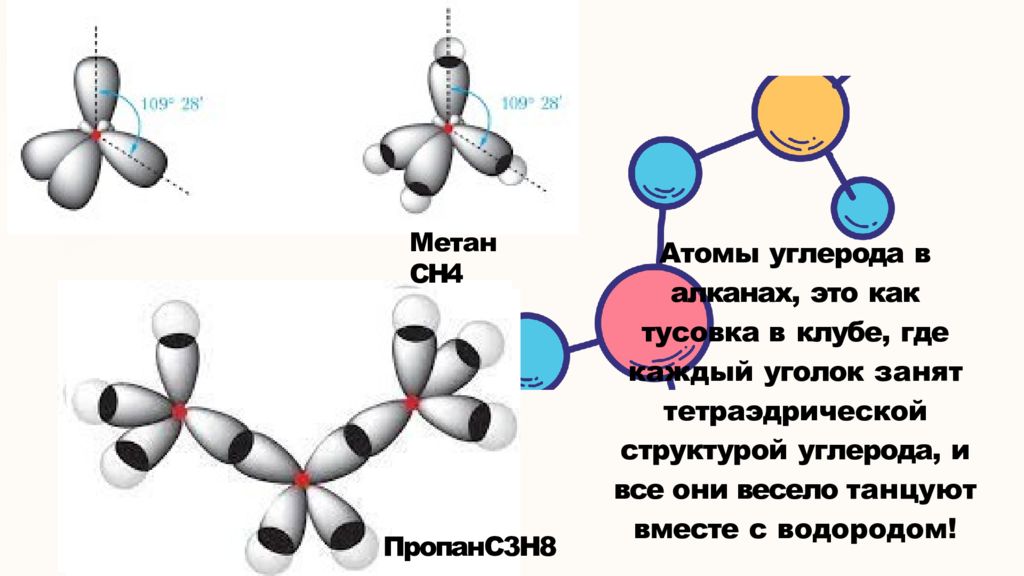
Метан СН4 ПропанС3Н8 Атомы углерода в алканах, это как тусовка в клубе, где каждый уголок занят тетраэдрической структурой углерода, и все они весело танцуют вместе с водородом!
Слайд 7
Поскольку все связи в молекулах алканов слабо полярны, то на атомах в молекулах отсутствуют какие- либо значительные заряды. Поэтому молекулы алканов слабо взаимодействуют друг с другом. В результате — это газы, или летучие жидкости, или твёрдые, легкоплавкие вещества. Метан СН4 – 161 Газ н- Бутан С4Н10 – 0,5 Газ н- Пентан С5Н12 + 36,1 – 138,3 Жидкость н- Гептан С7Н16 + 98,4 – 90,6 Жидкость н- Эйкозан С20Н42 + 342,7 + 36,8 Твёрдый Смесь газообразных алканов называется природный газ, если образуется в природе. Такая смесь содержит в основном метан. Неполярные углеводороды практически нерастворимы в полярном растворителе, например в воде, но прекрасно растворяются в неполярных растворителях, т. е. друг в друге. Поэтому смесь жидких алканов (уайт- спирит, бензин, керосин) является неполярным растворителем. Начиная с n=16, алканы являются твёрдыми веществами. Очищенные твёрдые предельные углеводороды называют парафином.
Слайд 8: Газообразные и твердые алканы не пахнут, жидкие алканы обладают характерным «бензиновым» запахом. Метан - в обычных условиях легкий бесцветный газ, без вкуса и запаха. Однако в метан, используемый в качестве технического газа, могут добавляться одоранты – вещества, имеющие резкий неприятный запах для предупреждения его утечки
Наибольшее распространение в качестве одоранта получил этилмеркаптан — жидкость с резким запахом. Наличие паров одоранта в газе должно быть таким, чтобы резкий запах ощущался уже при небольшой объемной концентрации. Меркаптаны- вещества с самым неприятным запахом,который можно себе представить. Их присутствие ощущается даже в крошечных концентрациях, и именно поэтому их добавляют в природный газ, чтобы предупреждать людей о возможных утечках.. Эти соединения также встречаются в природе: они выделяются некоторыми растениями и животными, а также образуются в результате разложения органических веществ. .
Слайд 9: Получение:
в промышленности: Все алканы целесообразно получать из природных источников: природного газа,нефти, каменного угля, горного воска, древесины и торфа : СH4- образуется при действии анаэробных(развивающихся без доступа воздуха) микроорганизмов на различные органические растительные остатки: n(C6H10O5)+ nH2O=3nCO2+3nCH4 (гниение) Метан относится к парниковым газам, которые значительно влияют на изменение климата. Он обладает гораздо более высоким потенциалом глобального потепления по сравнению с углекислым газом, несмотря на то что его концентрация в атмосфере значительно ниже. Источники метана включают сельское хозяйство, особенно животноводство, свалки, утечки из газовых скважин и трубопроводов, а также другие промышленные процессы.
Слайд 10: Крекинг
Наибольшее распространение для промышленного применения в современных условиях получили два вида крекинга: с меньшими термический крекинг нефти. Более простая технология капитальными затратами на обустройство производства. каталитический крекинг нефти Крекинг- разложение нефтяных продуктов в специальных установках при температуре 450— 550°С, во многих случаях — с применением высокого давления и катализатора Крекинг
Слайд 11: Термический крекинг
При сильном нагревании алканов с длинной углеродной цепью без доступа воздуха происходит крекинг, цепь разрывается, образуется алкан и алкен, например, крекинг пентана может пройти так: Каталитический крекинг В настоящее время крекинг проводят в присутствии катализаторов, каталитический крекинг проводят на более сложных установках при высоком давлении. Такой крекинг проходит быстрее и сопровождается изомеризацией продуктов (об изомеризации см. ниже), разветвленные алканы – более ценное топливо, чем линейные. Термический крекинг Процесс можно выразить схемой CnH2n+2=CmH2m+CpH2p+2, где m+p=n Термический крекинг открыт русским ученым В.Г. Шуховым в 1891 году.
Слайд 12: Синтез Фишера- Тропша – это химическая реакция в присутствии катализатора, в которой моноксид углерода (CO) и водород (H2) преобразуются в различные жидкие углеводороды
Синтез- газ (водяной газ, генераторный газ) — преимущественно смесь монооксида углерода и водорода. В промышленности получают паровой конверсией метана, парциальным окислением метана, плазменной газификацией отходов и сырья, газификацией угля. nCO + (2n+1)H2 = CnH2n+2 + nH2O CO+H2- синтез- газ
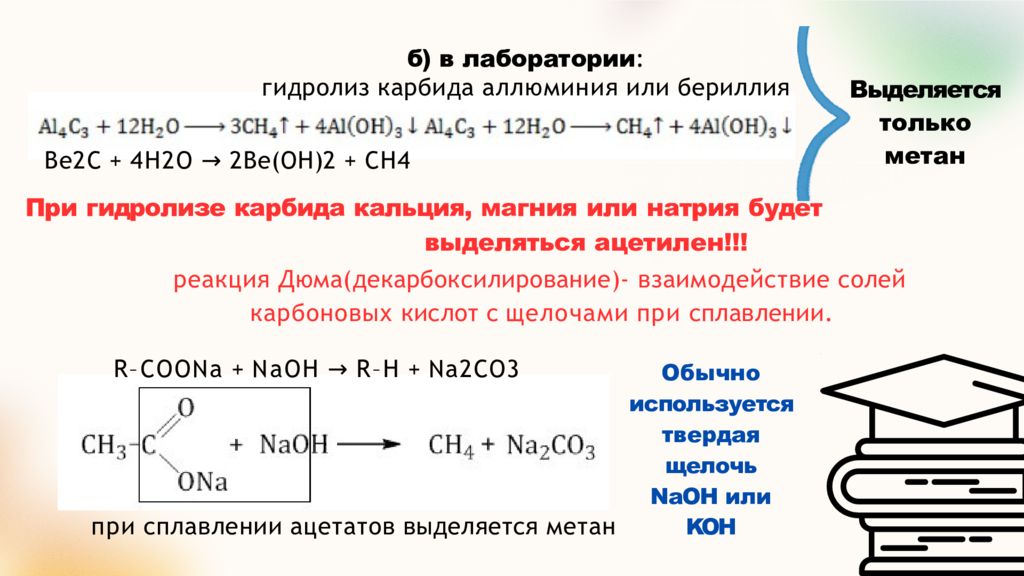
Слайд 13: б) в лаборатории : гидролиз карбида аллюминия или бериллия
Выделяется только метан Be2C + 4H2O → 2Be(OH)2 + CH4 При гидролизе карбида кальция, магния или натрия будет выделяться ацетилен!!! реакция Дюма(декарбоксилирование)- взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Обычно используется твердая щелочь NaOH или KOH при сплавлении ацетатов выделяется метан
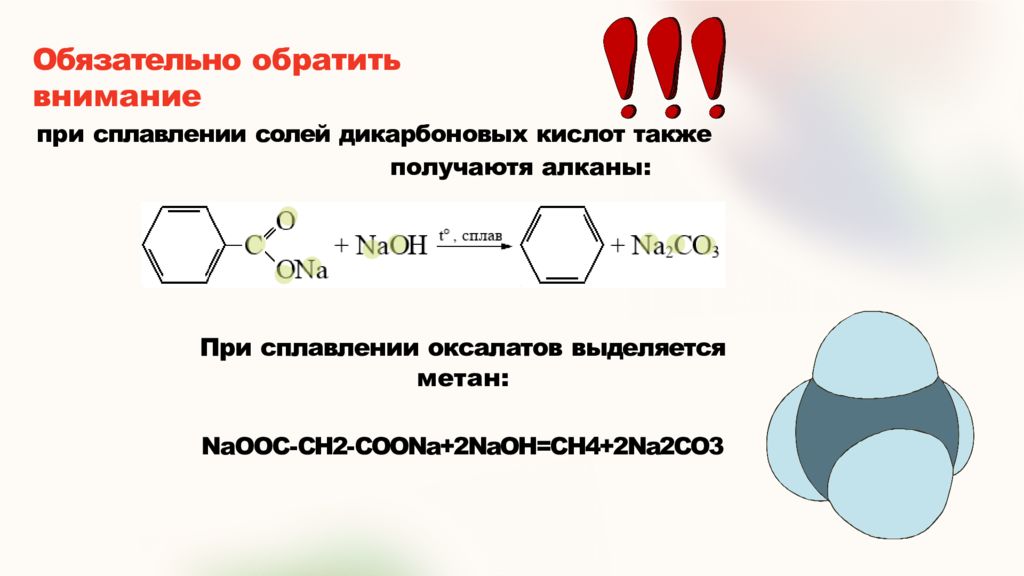
Слайд 14: Обязательно обратить внимание
при сплавлении солей дикарбоновых кислот также получаютя алканы: При сплавлении оксалатов выделяется метан: NaOOC- CH2- COONa+2NaOH=CH4+2Na2CO3
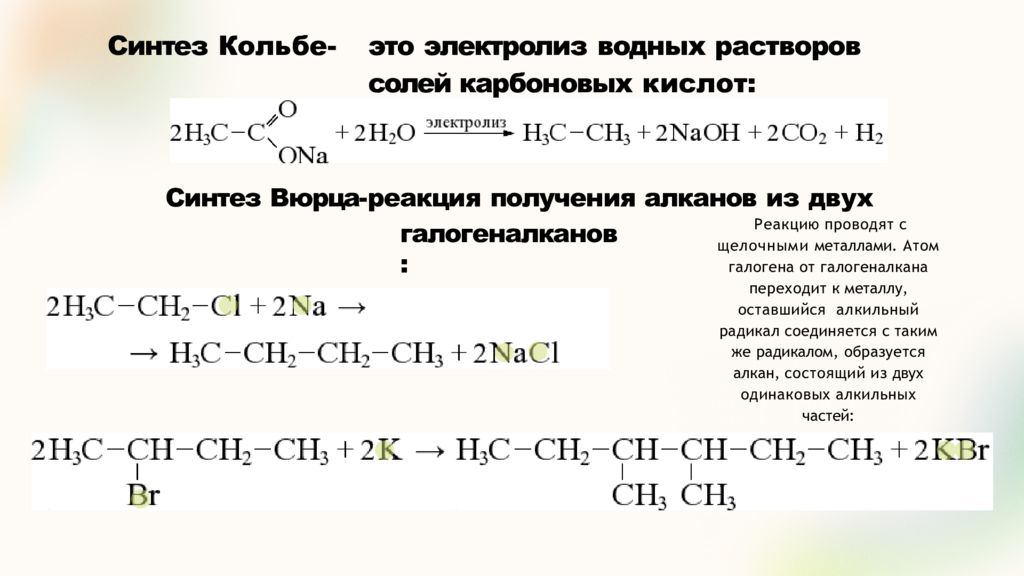
Слайд 15: Синтез Кольбе- это электролиз водных растворов солей карбоновых кислот:
галогеналканов: Синтез Вюрца- реакция получения алканов из двух Реакцию проводят с щелочными металлами. Атом галогена от галогеналкана переходит к металлу, оставшийся алкильный радикал соединяется с таким же радикалом, образуется алкан, состоящий из двух одинаковых алкильных частей:
Слайд 16
Синтез Гриньяра- это реакции с использованием алкилмагнийгалогенидов (реактивов Гриньяра). Важнейшие синтезы Гриньяра: Реакция с галогеналканами напоминает реакцию Вюрца, однако с помощью синтеза Гриньяра можно получать не только симметричные алканы: Реактивы Гриньяра или алкилмагнийгалогениды – это металлоорганическиеw соединения вида R–Mg–Hal. Реактивы Гриньяра – очень химически активные соединения, они широко используются в органическом синтезе.
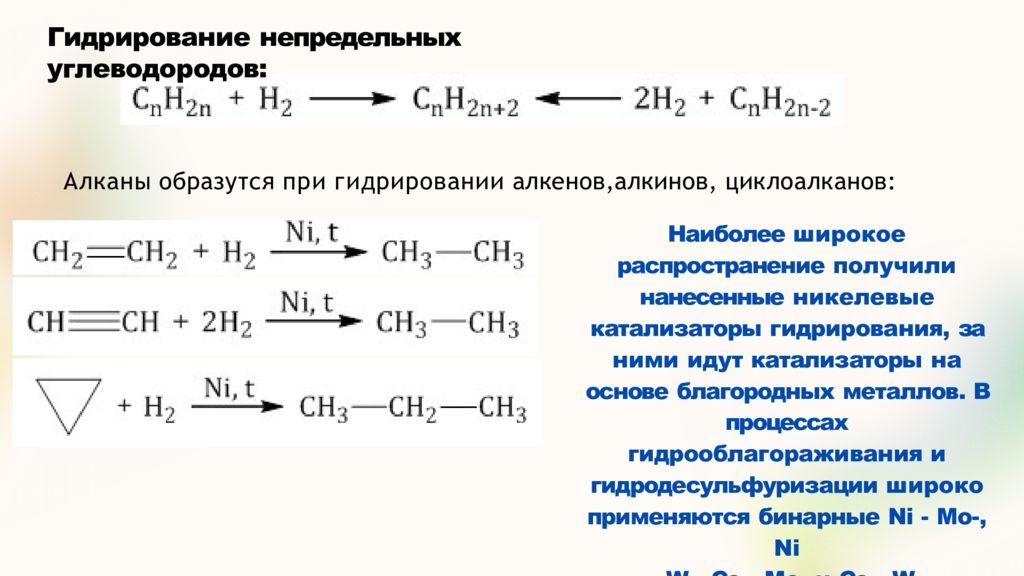
Слайд 17: Гидрирование непредельных углеводородов:
Алканы образутся при гидрировании алкенов,алкинов, циклоалканов: Наиболее широкое распространение получили нанесенные никелевые катализаторы гидрирования, за ними идут катализаторы на основе благородных металлов. В процессах гидрооблагораживания и гидродесульфуризации широко применяются бинарные Ni - Mo-, Ni - W-, Co - Mo- и Co - W- катализаторы.
Слайд 18: Восстановление спиртов с помощью HI:
Восстановление иодалканов в кислой среде: C3H7I+HI=C3H8+I2
Слайд 19: Задания:
АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ, В МОЛЕКУЛАХ КОТОРЫХ АТОМЫ УГЛЕРОДА СВЯЗАНЫ ТОЛЬКО ОДИНАРНЫМИ σ- СВЯЗЯМИ НАЗЫВАЮТ, ИХ ОБЩАЯ ФОРМУЛА ВСЕ АТОМЫ УГЛЕРОДА В МОЛЕКУЛАХ АЛКАНОВ НАХОДЯТСЯ В СОСТОЯНИИ ГИБРИДИЗАЦИИ: 1) sp 2) sp2 3) sp3 4) sp3d 2 УГЛЕВОДОРОД, В КОТОРОМ ВСЕ АТОМЫ УГЛЕРОДА ИМЕЮТ sp3- ГИБРИДИЗАЦИЮ: 1) изобутан 2) бутадиен- 1,3 3) пропин 4) бензол. Задания:
Слайд 20
4.Установите соответствие: ПОЛУЧЕНИЕ АЛКАНОВ ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ С2Н2 + 2Н2 → А. C4H10 + 2NaCl 2C2H5Cl + 2Na → Б. C2H6 + Na2CO3 C4H8 + H2 → С8Н18 → В. C4H10 + C4H8 Г. C4H10 + Cl2 Д. С4Н10 Е. C2H6 Ж. С2Н4 + С6Н14 5.СВОЙСТВО, КОТОРОЕ НЕ ЗАВИСИТ ОТ ВЕЛИЧИНЫ УГЛЕВОДОРОДНОГО РАДИКАЛА: 1) температуры кипения и плавления 2) растворимость в воде 3) специфический запах 4) плотность
Слайд 21
6.СН3- СН2-СН2-СН2-СН2- СН3 → СН2 = СН- СН3 + СН3-СН2- СН3 ХИМИЧЕСКИЙ ПРОЦЕСС, ОПИСАННЫЙ СХЕМОЙ, НАЗЫВАЕТСЯ пиролизом крекингом изомеризацией разложением ХИМИЧЕСКИЙ ПРОЦЕСС, ОПИСАННЫЙ СХЕМОЙ, СН4 → С + 2Н2 НЕ МОЖЕТ НАЗЫВАТЬСЯ: 1) пиролизом 2) крекингом 3) изомеризацией 4) разложением МЕТАН В ОДНУ СТАДИЮ НЕЛЬЗЯ ПОЛУЧИТЬ ПО РЕАКЦИИ: 1) C + 2H2 → CH4 2) Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 3) C2H6 → 2CH4 4) CH3COONa + NaOH(тверд.) → CH4 + Na2CO3
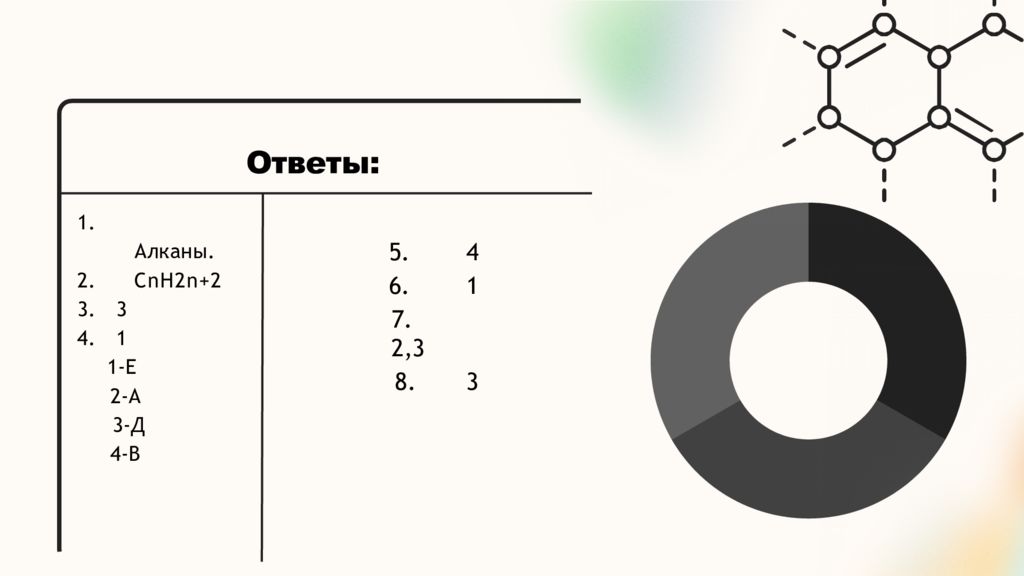
Слайд 22: Ответы:
2. 3. 4. 1. Алканы. CnH2n+2 3 1 1- E 2- А 3- Д 4- В 5. 4 6. 1 7. 2,3 8. 3