Первый слайд презентации: АНИОНЫ I аналитической группы
Федеральное государственное бюджетное образовательное учреждение высшего образования «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого » Министерства здравоохранения Российской Федерации к.п.н. Агафонова И.П.
Слайд 2: Классификация анионов
Группа Анионы Групповой реагент 1 SO 4 2-, SO 3 2-, S 2 O 3 2-, CO 3 2-, PO 4 3- BO 2 - или B 4 O 7 2-, CrO 4 2- или Cr 2 O 7 2-, C 2 O 4 2- BaCl 2 2 Cl -, Br -, I -, S 2- AgNO 3 3 NO 2 -, NO 3 -, CH 3 COO - -
Слайд 3
Ва 2+ + SO 4 2- → BaSO 4 ↓ Pb 2+ + SO 4 2- → PbSO 4 ↓ Ва 2+ + СО 3 2- → ВаСО 3 ↓ Общепринятого систематического хода анализа анионов не имеется
Слайд 4: АНИОНЫ I АНАЛИТИЧЕСКОЙ ГРУППЫ
SO 4 2- (сульфат- ион) SO 3 2- (сульфит -ион) S 2 O 3 2- (тиосульфат-ион) CO 3 2- (карбонат-ион) PO 4 3- (фосфат-ион) или Н PO 4 2- ( гидрофосфат-ион ) BO 2 - (борат-ион) или B 4 O 7 2- ( тетраборат-ион ) C 2 O 4 2- (оксалат-ион) CrO 4 2- (хромат-ион) или Cr 2 O 7 2- (дихромат) C 2 O 4 2- (оксалат-ион)
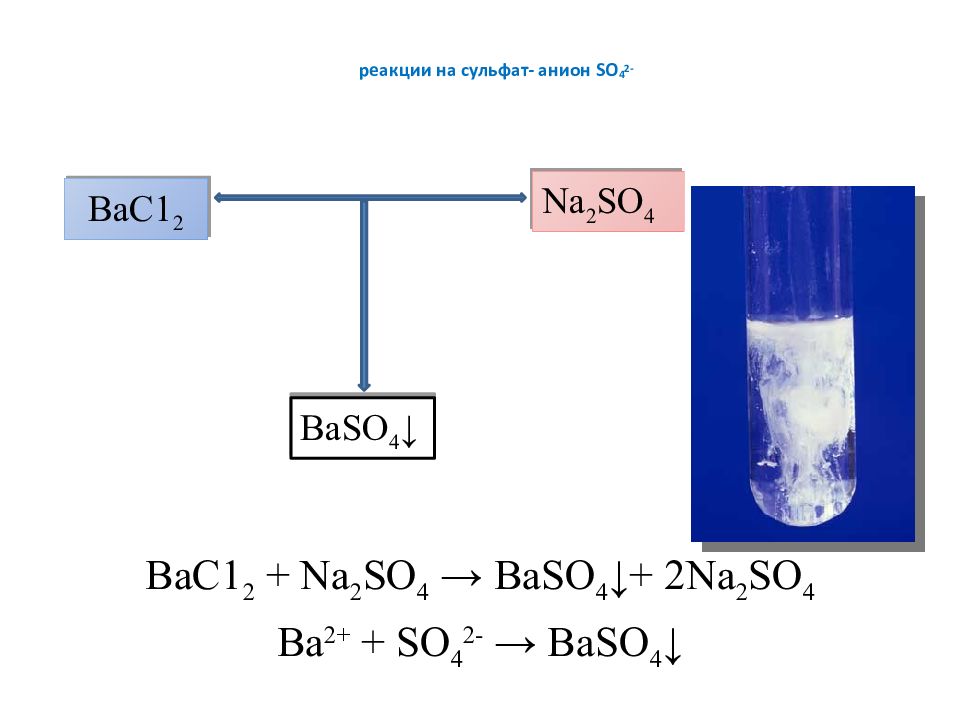
Слайд 5: реакции на сульфат- анион SO 4 2-
ВаС1 2 + Na 2 SO 4 → BaSO 4 ↓+ 2 Na 2 SO 4 Ва 2+ + SO 4 2- → BaSO 4 ↓ ВаС1 2 Na 2 SO 4 BaSO 4 ↓
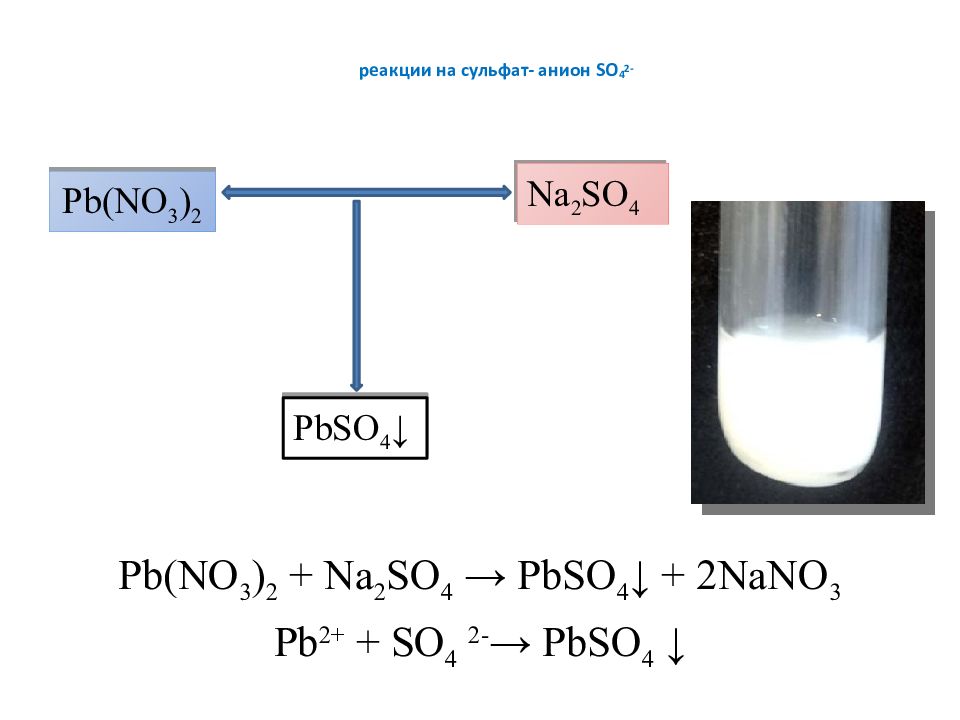
Слайд 6: реакции на сульфат- анион SO 4 2-
Pb (NO 3 ) 2 + Na 2 SO 4 → PbSO 4 ↓ + 2NaNO 3 Pb 2+ + SO 4 2- → PbSO 4 ↓ Pb (NO 3 ) 2 Na 2 SO 4 PbSO 4 ↓
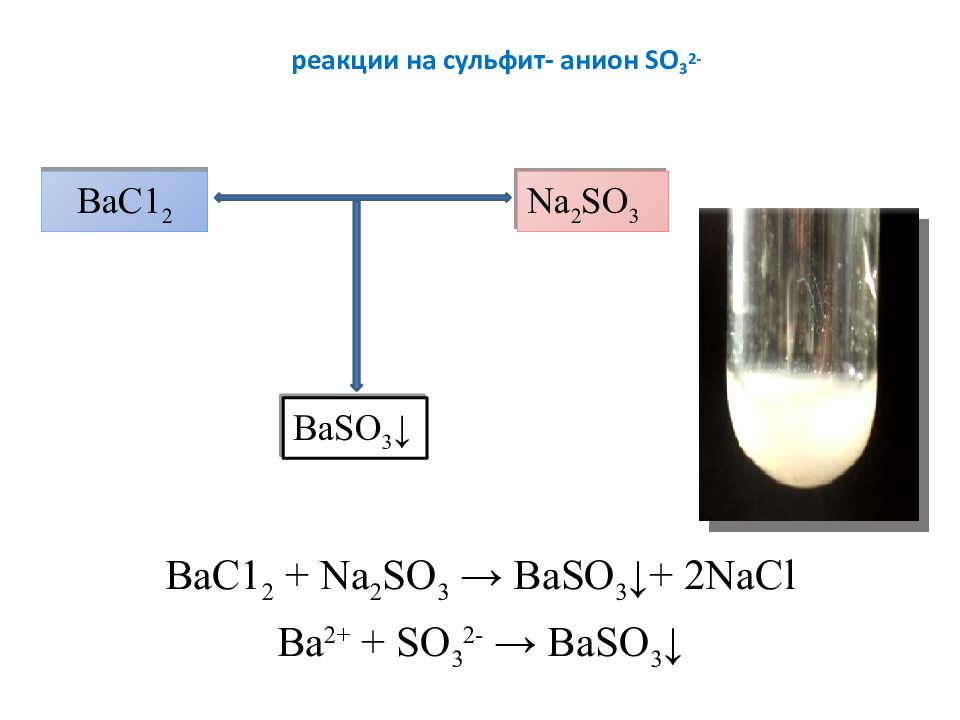
Слайд 7: реакции на сульфит- анион SO 3 2-
ВаС 1 2 + Na 2 SO 3 → BaSO 3 ↓+ 2NaCl Ва 2+ + SO 3 2- → BaSO 3 ↓ ВаС 1 2 Na 2 SO 3 BaSO 3 ↓
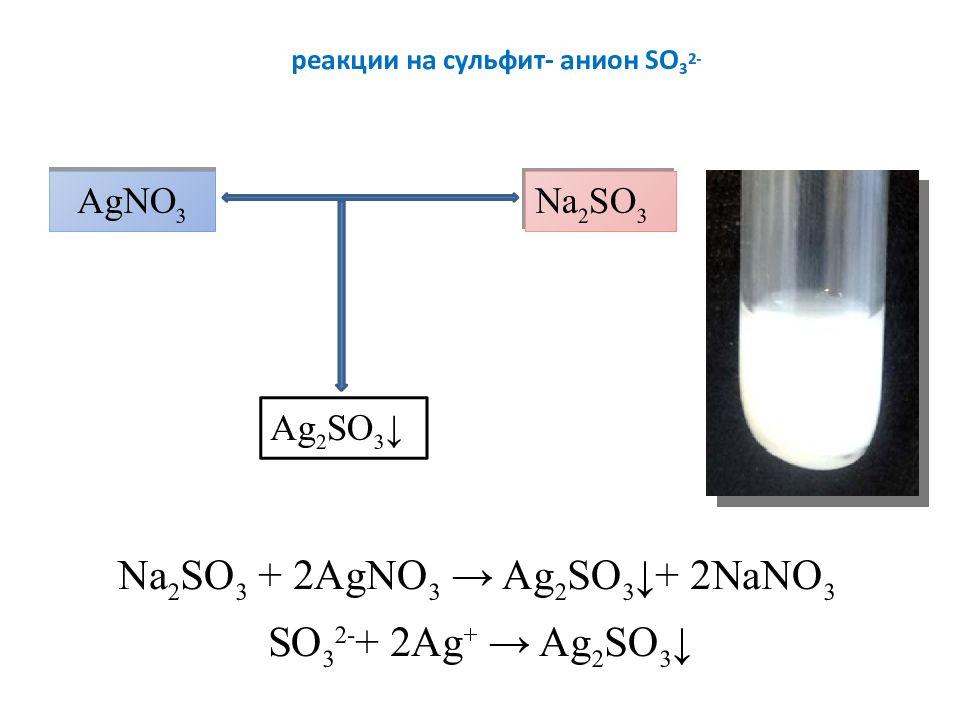
Слайд 8: реакции на сульфит- анион SO 3 2-
Na 2 SO 3 + 2 AgNO 3 → Ag 2 SO 3 ↓+ 2 NaNO 3 SO 3 2- + 2 Ag + → Ag 2 SO 3 ↓ AgNO 3 Na 2 SO 3 Ag 2 SO 3 ↓
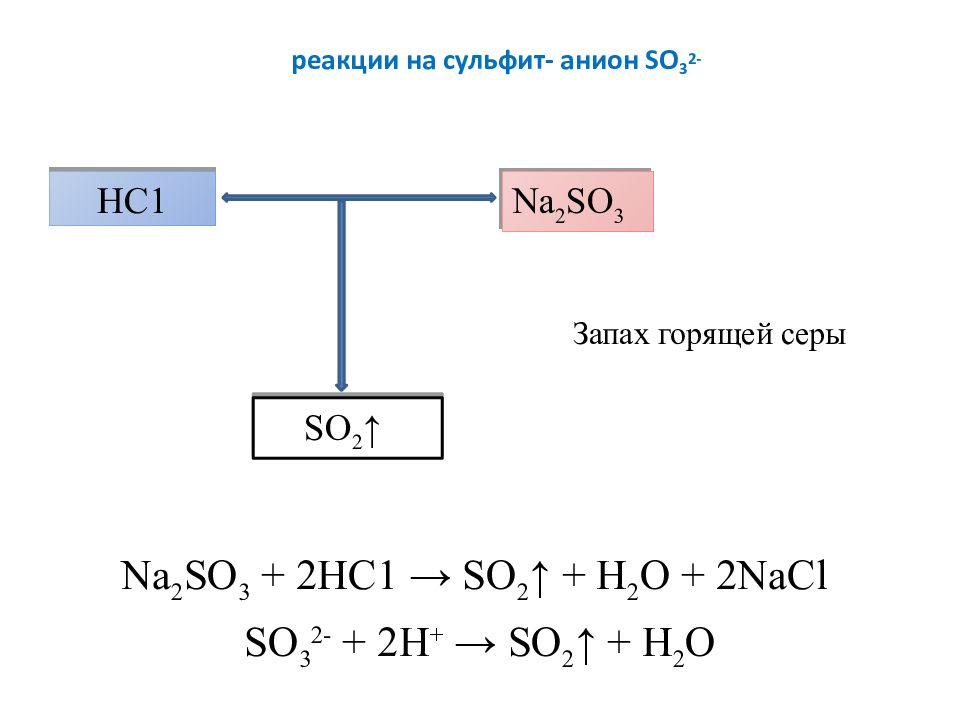
Слайд 9: реакции на сульфит- анион SO 3 2-
Na 2 SO 3 + 2НС1 → SO 2 ↑ + Н 2 О + 2 NaCl SO 3 2- + 2Н + → SO 2 ↑ + Н 2 О НС1 Na 2 SO 3 SO 2 ↑ Запах горящей серы
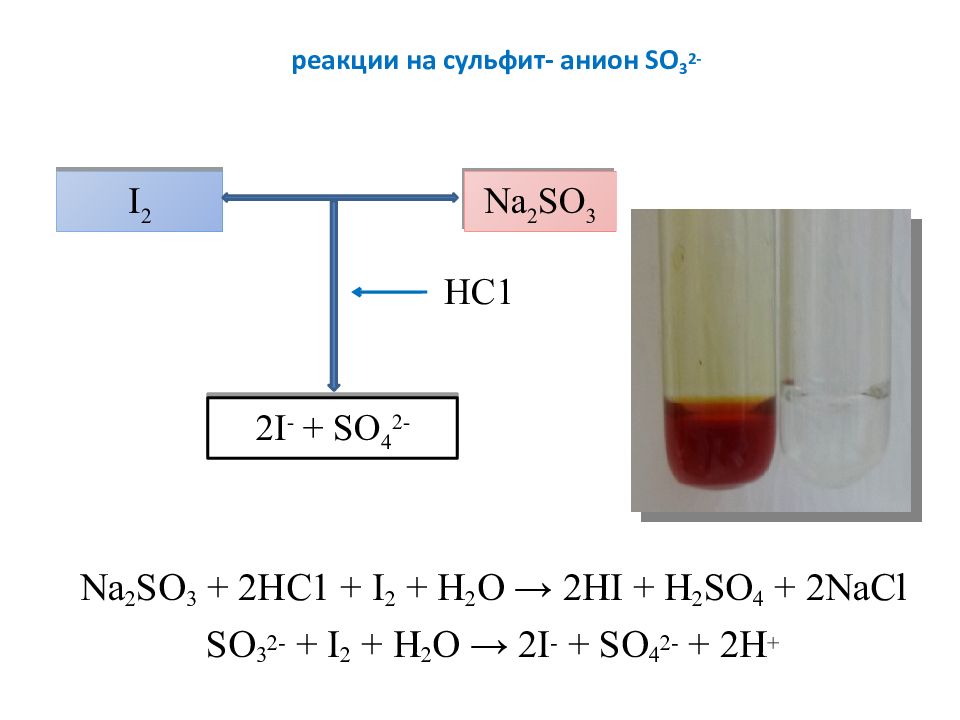
Слайд 10: реакции на сульфит- анион SO 3 2-
Na 2 SO 3 + 2 НС 1 + I 2 + Н 2 О → 2HI + H 2 SO 4 + 2NaCl SO 3 2- + I 2 + Н 2 О → 2I - + SO 4 2- + 2H + I 2 Na 2 SO 3 2I - + SO 4 2- НС1
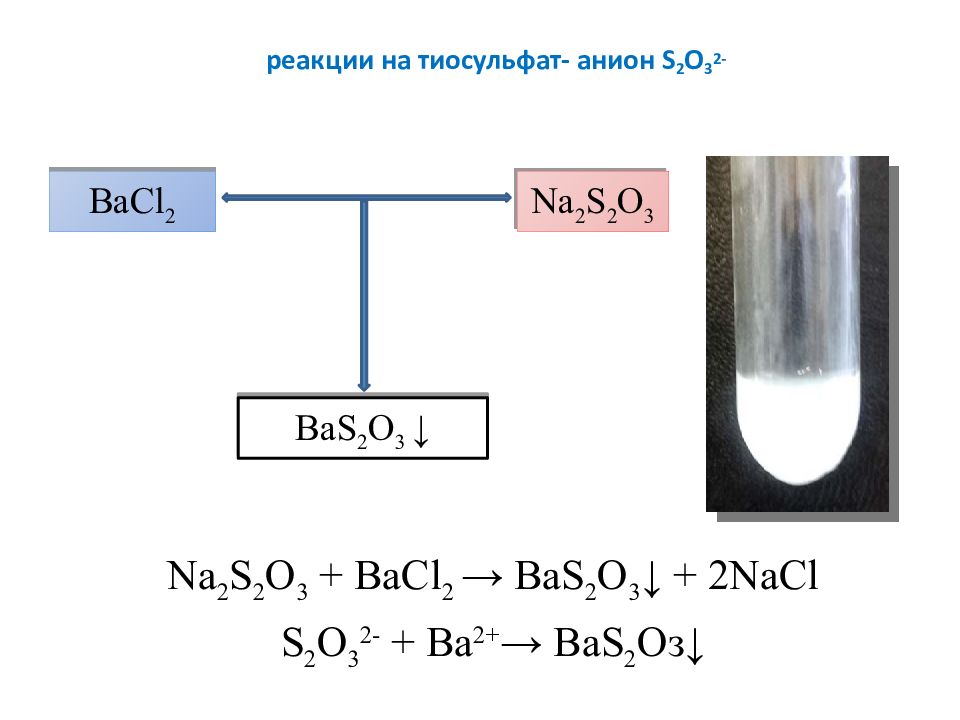
Слайд 11: реакции на тиосульфат- анион S 2 O 3 2-
Na 2 S 2 O 3 + BaCl 2 → Ва S 2 О 3 ↓ + 2NaCl S 2 O 3 2- + Ba 2+ → Ва S 2 Оз ↓ BaCl 2 Na 2 S 2 O 3 Ва S 2 О 3 ↓
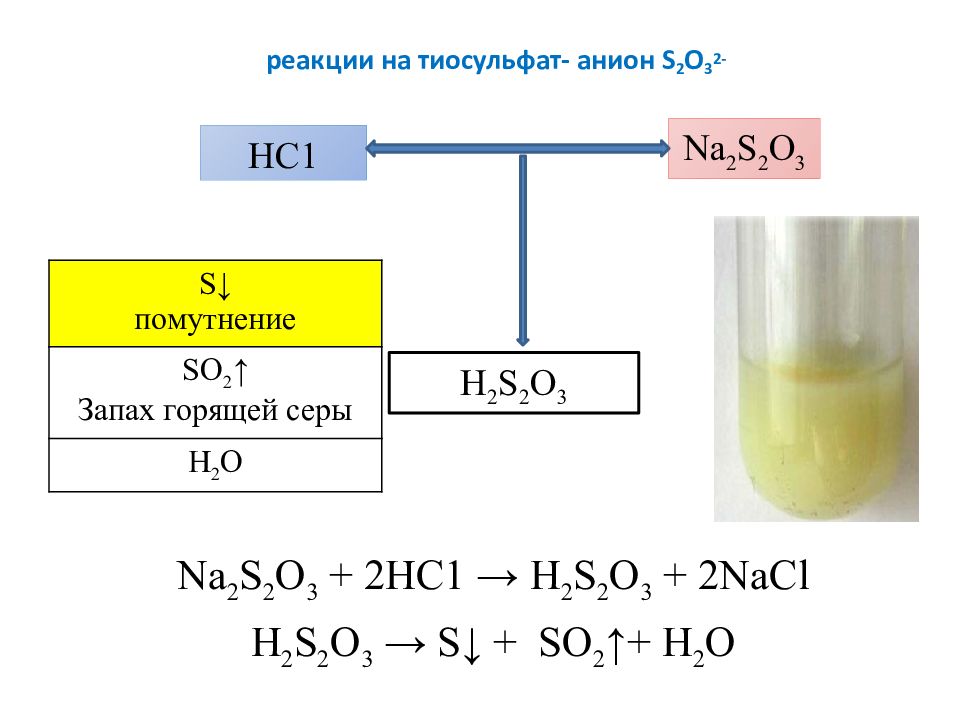
Слайд 12: реакции на тиосульфат- анион S 2 O 3 2-
Na 2 S 2 O 3 + 2 HC 1 → H 2 S 2 O 3 + 2 NaCl H 2 S 2 O 3 → S ↓ + SO 2 ↑+ Н 2 О HC 1 Na 2 S 2 O 3 H 2 S 2 O 3 S ↓ помутнение SO 2 ↑ Запах горящей серы Н 2 О
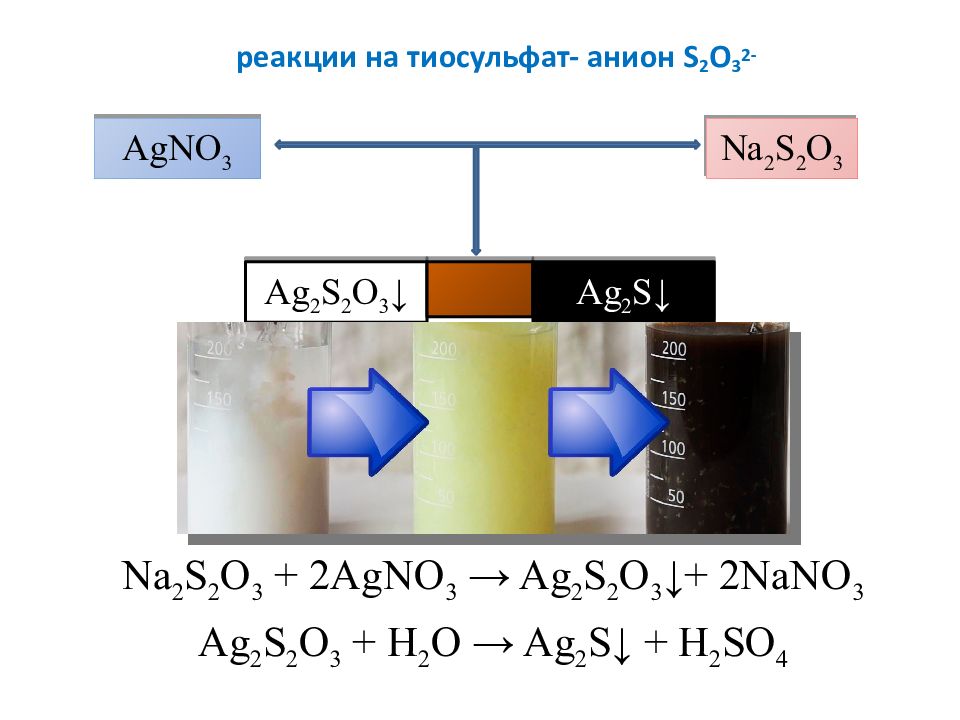
Слайд 13: реакции на тиосульфат- анион S 2 O 3 2-
Na 2 S 2 O 3 + 2AgNO 3 → Ag 2 S 2 O 3 ↓+ 2NaNO 3 Ag 2 S 2 O 3 + H 2 O → Ag 2 S↓ + H 2 SO 4 AgNO 3 Na 2 S 2 O 3 Ag 2 S 2 O 3 ↓ Ag 2 S↓
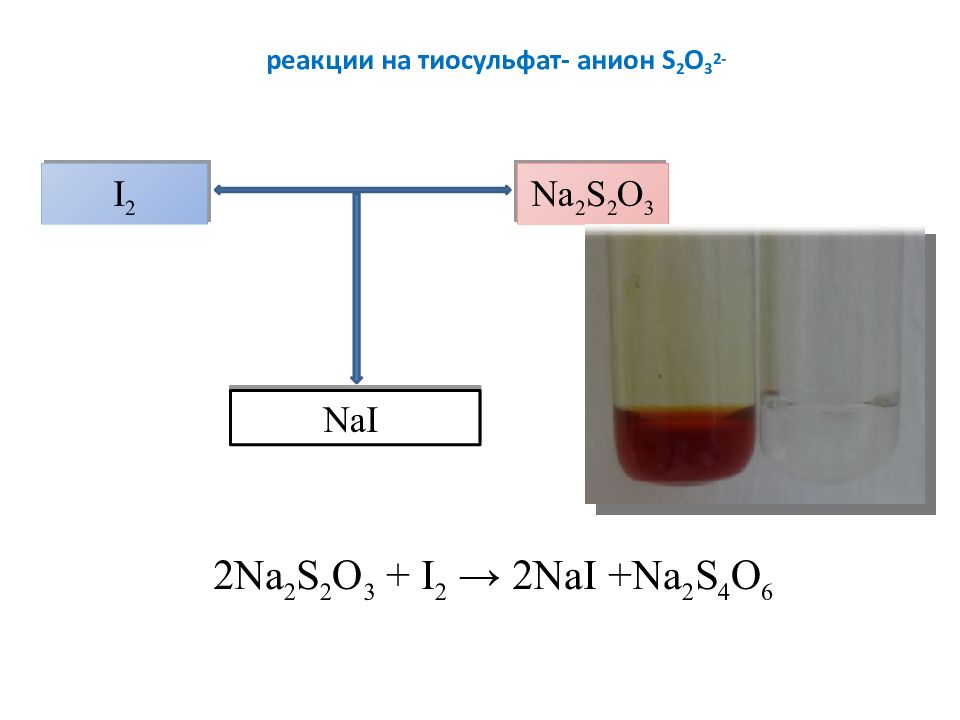
Слайд 14: реакции на тиосульфат- анион S 2 O 3 2-
2 Na 2 S 2 O 3 + I 2 → 2 NaI + Na 2 S 4 O 6 I 2 Na 2 S 2 O 3 NaI
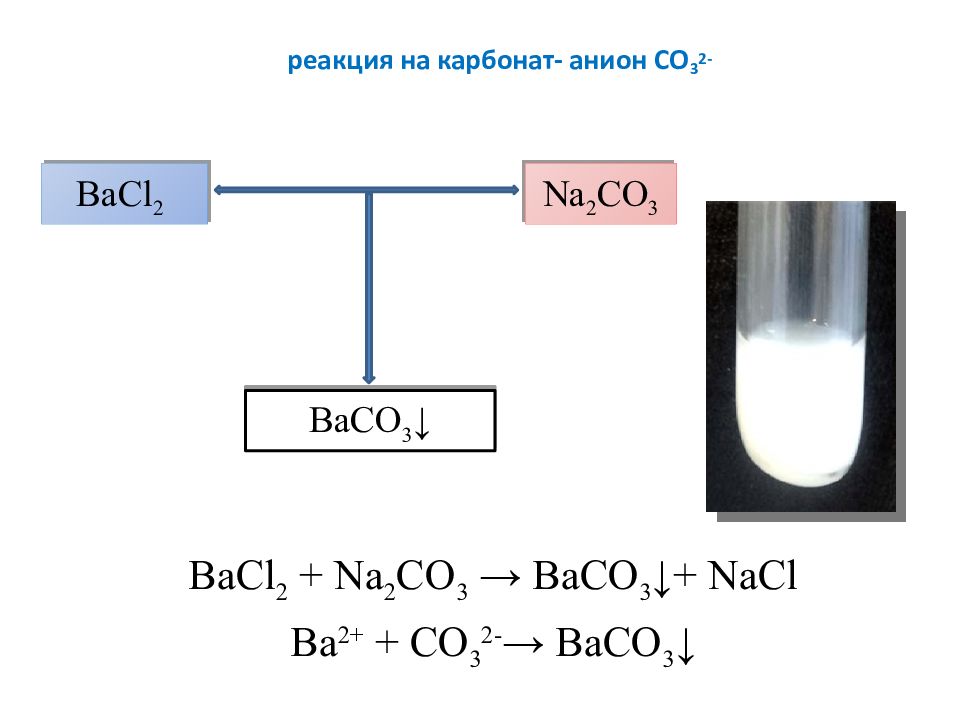
Слайд 15: реакция на карбонат- анион СО 3 2-
ВаС l 2 + Na 2 CO 3 → ВаСО 3 ↓+ NaCl Ва 2+ + СО 3 2- → ВаСО 3 ↓ ВаС l 2 Na 2 CO 3 ВаСО 3 ↓
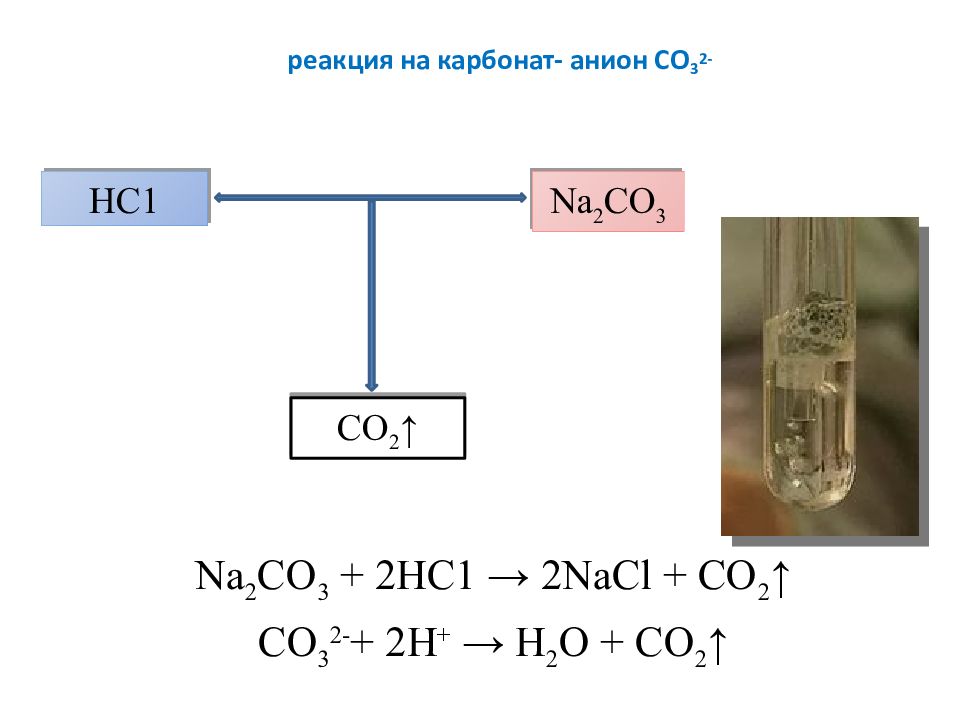
Слайд 16: реакция на карбонат- анион СО 3 2-
Na 2 CO 3 + 2HC1 → 2NaCl + CO 2 ↑ CO 3 2- + 2H + → H 2 O + CO 2 ↑ HC1 Na 2 CO 3 CO 2 ↑
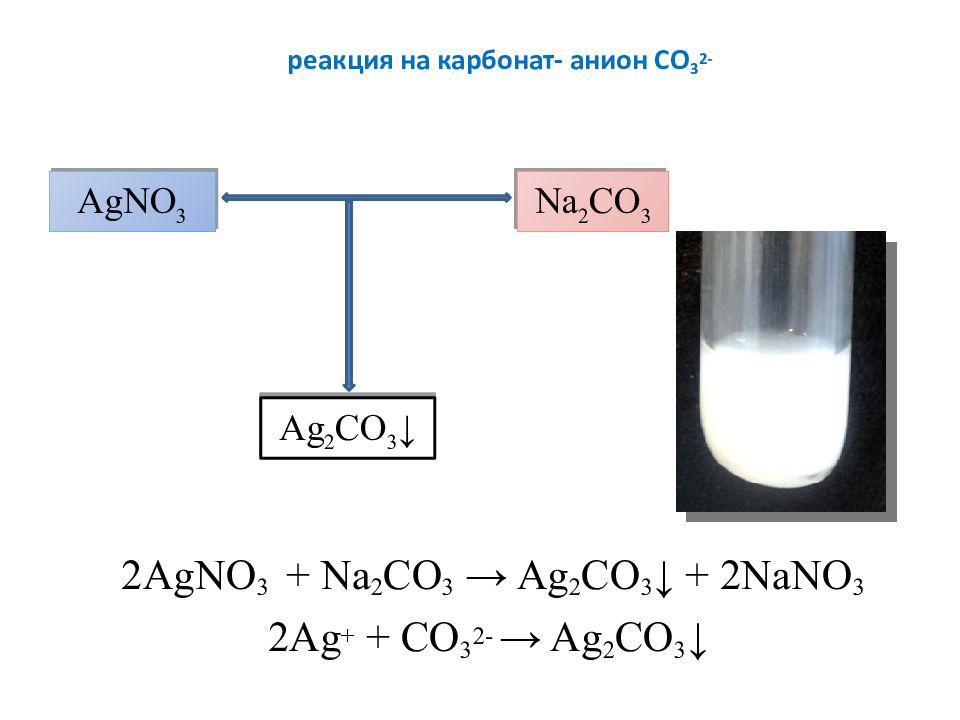
Слайд 17: реакция на карбонат- анион СО 3 2-
2AgNO 3 + Na 2 CO 3 → Ag 2 CO 3 ↓ + 2NaNO 3 2Ag + + CO 3 2- → Ag 2 CO 3 ↓ AgNO 3 Na 2 CO 3 Ag 2 CO 3 ↓
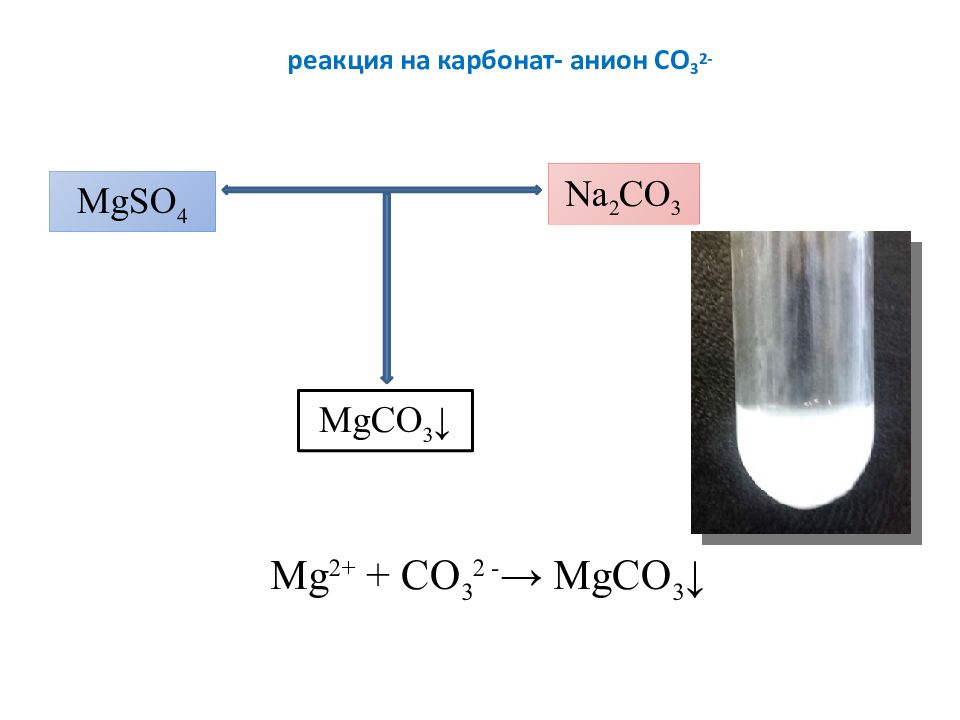
Слайд 18: реакция на карбонат- анион СО 3 2-
М g 2+ + CO 3 2 - → М gCO 3 ↓ М gSO 4 Na 2 CO 3 М gCO 3 ↓
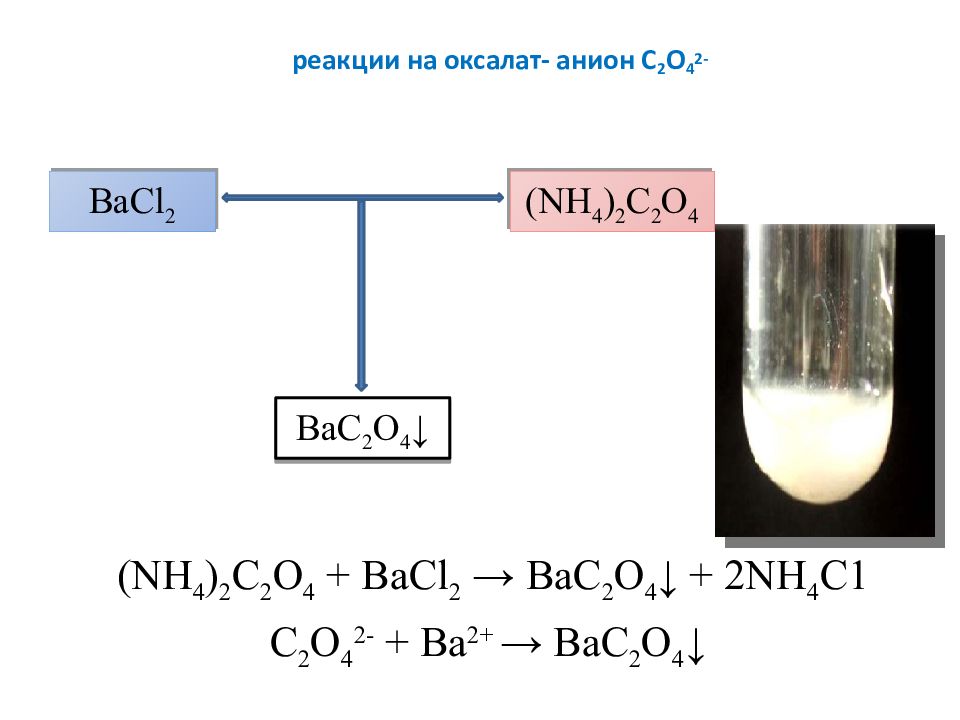
Слайд 19: реакции на оксалат- анион C 2 O 4 2-
( NH 4 ) 2 C 2 O 4 + BaCl 2 → ВаС 2 O 4 ↓ + 2 NH 4 C 1 C 2 O 4 2- + Ba 2+ → ВаС 2 O 4 ↓ BaCl 2 ( NH 4 ) 2 C 2 O 4 ВаС 2 O 4 ↓
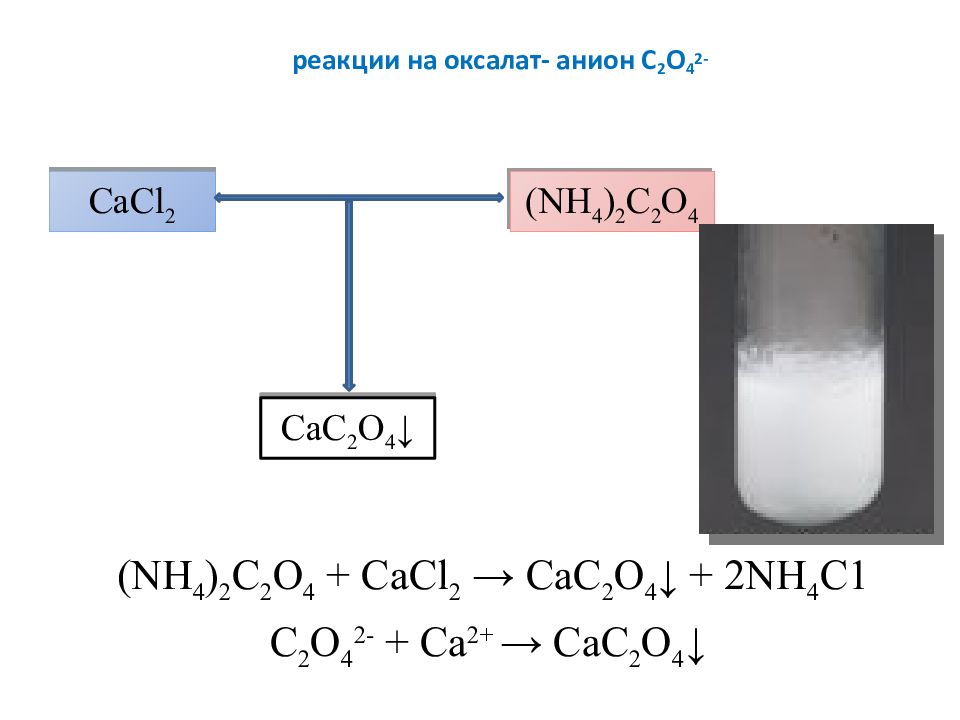
Слайд 20: реакции на оксалат- анион C 2 O 4 2-
( NH 4 ) 2 C 2 O 4 + CaCl 2 → C аС 2 O 4 ↓ + 2 NH 4 C 1 C 2 O 4 2- + Ca 2+ → C аС 2 O 4 ↓ CaCl 2 ( NH 4 ) 2 C 2 O 4 C аС 2 O 4 ↓
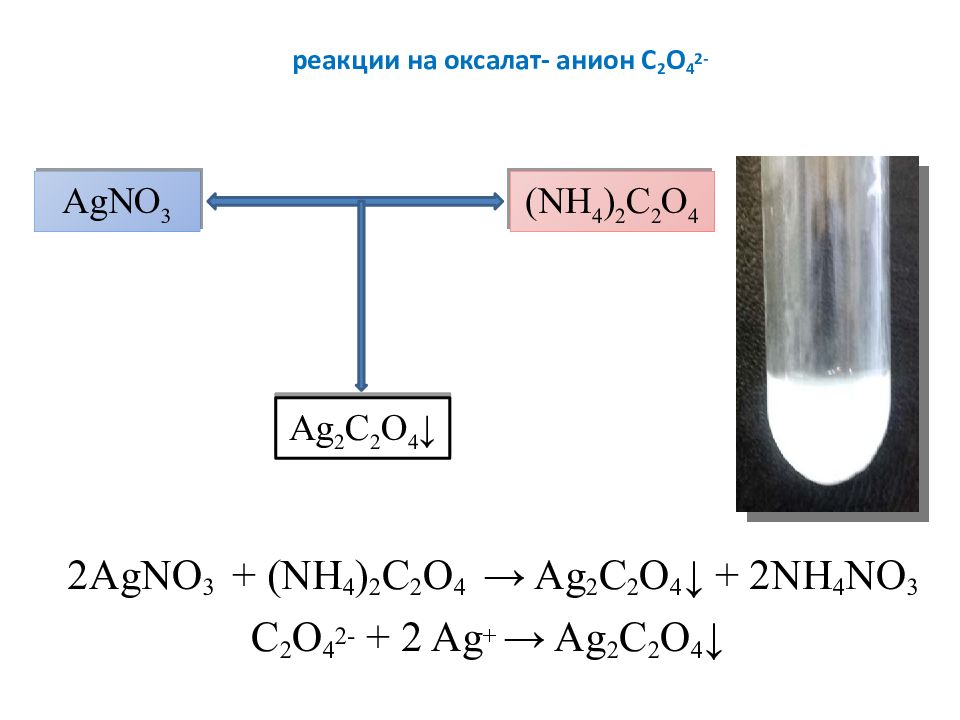
Слайд 21: реакции на оксалат- анион C 2 O 4 2-
2AgNO 3 + ( NH 4 ) 2 C 2 O 4 → Ag 2 С 2 O 4 ↓ + 2NH 4 NO 3 C 2 O 4 2- + 2 Ag + → Ag 2 С 2 O 4 ↓ AgNO 3 ( NH 4 ) 2 C 2 O 4 Ag 2 С 2 O 4 ↓
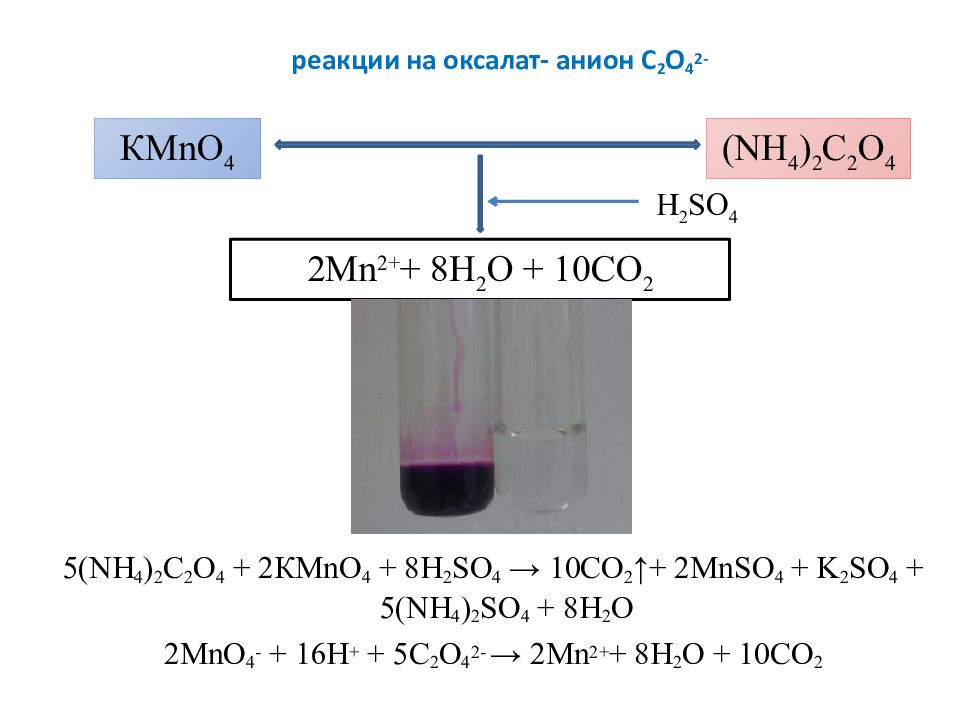
Слайд 22: реакции на оксалат- анион C 2 O 4 2-
5(NH 4 ) 2 C 2 O 4 + 2 КМ n О 4 + 8H 2 SO 4 → 10CO 2 ↑+ 2MnSO 4 + K 2 SO 4 + 5(NH 4 ) 2 SO 4 + 8H 2 O 2 М nO 4 - + 16 Н + + 5C 2 O 4 2- → 2Mn 2+ + 8H 2 O + 10CO 2 КМ n О 4 ( NH 4 ) 2 C 2 O 4 2Mn 2+ + 8H 2 O + 10CO 2 H 2 SO 4
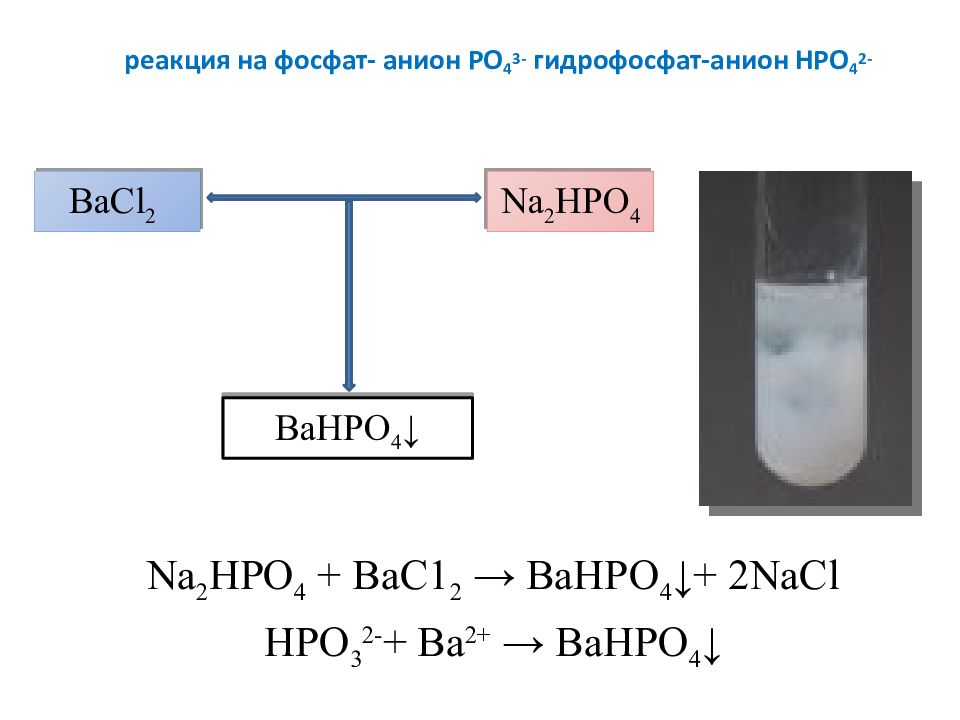
Слайд 23: реакция на фосфат- анион PO 4 3- гидрофосфат-анион Н PO 4 2-
Na 2 HPO 4 + ВаС1 2 → ВаНРО 4 ↓+ 2 NaCl НРО 3 2- + Ва 2+ → ВаНРО 4 ↓ ВаС l 2 Na 2 HPO 4 ВаНРО 4 ↓
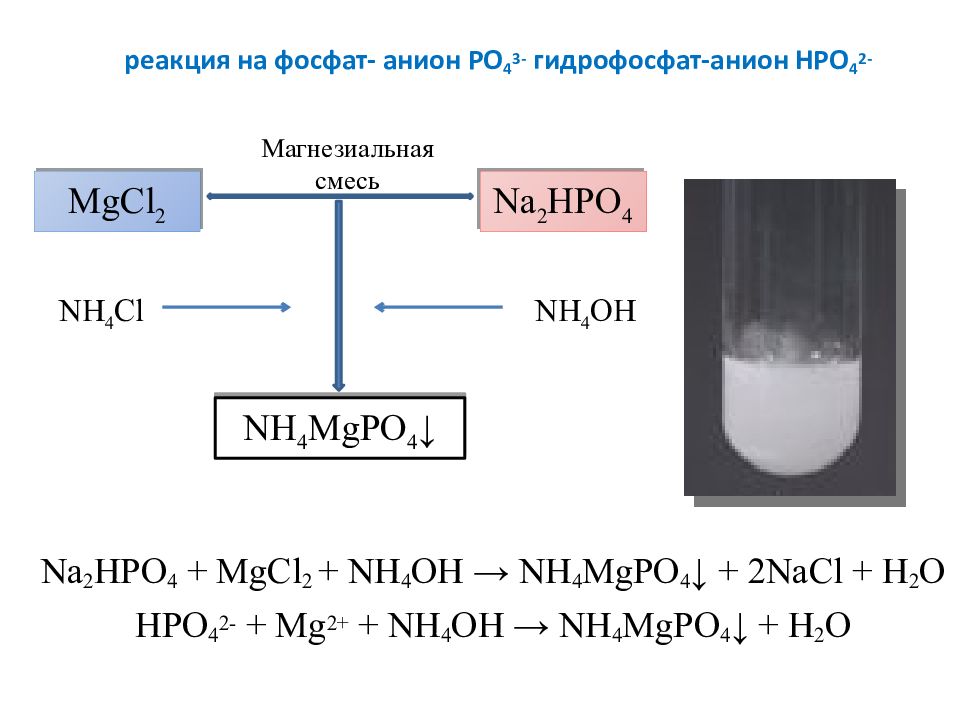
Слайд 24: реакция на фосфат- анион PO 4 3- гидрофосфат-анион Н PO 4 2-
Na 2 HPO 4 + MgCl 2 + NH 4 OH → NH 4 MgPO 4 ↓ + 2 NaCl + H 2 O HPO 4 2- + Mg 2+ + NH 4 OH → NH 4 MgPO 4 ↓ + H 2 O MgCl 2 Na 2 HPO 4 NH 4 MgPO 4 ↓ NH 4 OH NH 4 Cl Магнезиальная смесь
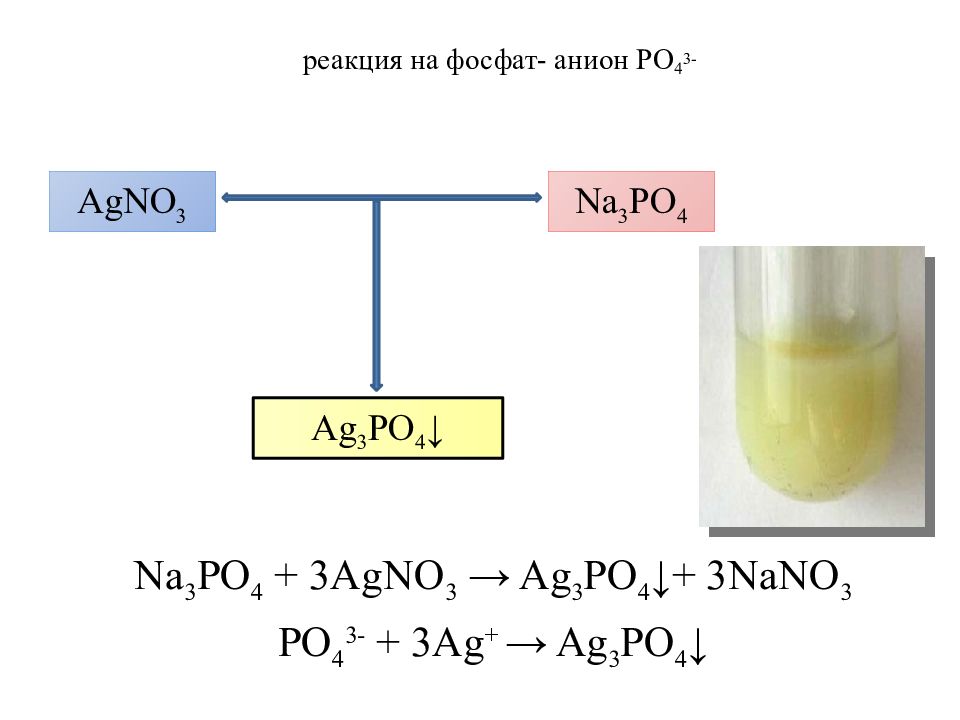
Слайд 25: реакция на фосфат- анион PO 4 3-
Na 3 PO 4 + 3 AgNO 3 → Ag 3 PO 4 ↓+ 3 NaNO 3 PO 4 3- + 3 Ag + → Ag 3 PO 4 ↓ AgNO 3 Na 3 PO 4 Ag 3 PO 4 ↓
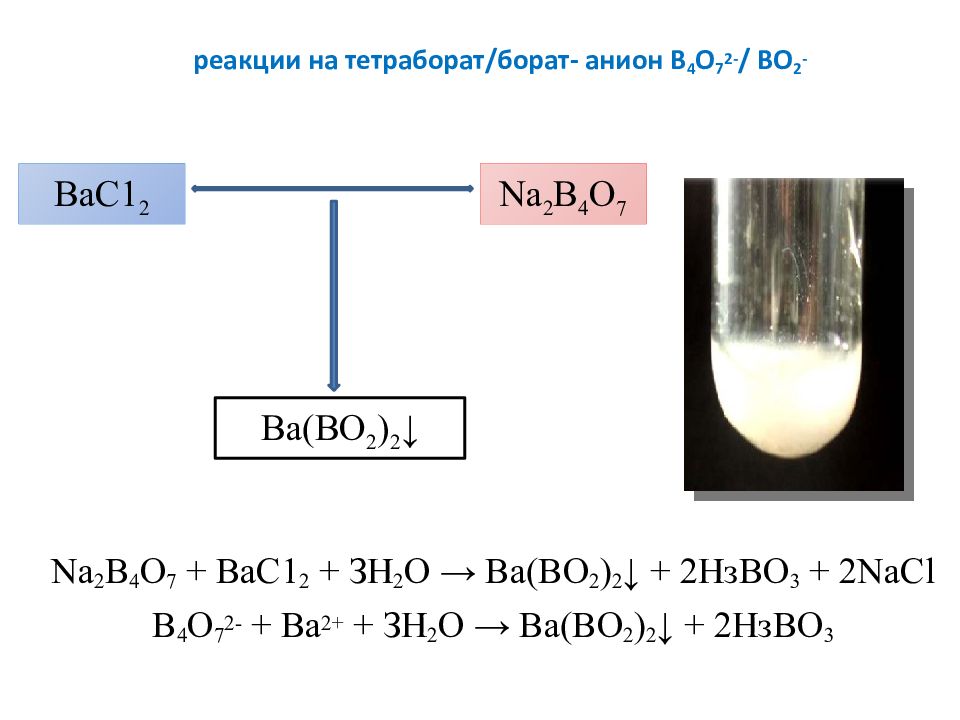
Слайд 26: реакции на тетраборат /борат- анион В 4 О 7 2- / ВО 2 -
Na 2 B 4 O 7 + ВаС1 2 + ЗН 2 О → Ba ( BO 2 ) 2 ↓ + 2НзВО 3 + 2 NaCl В 4 О 7 2- + Ва 2+ + ЗН 2 О → Ba ( B О 2 ) 2 ↓ + 2НзВО 3 ВаС1 2 Na 2 B 4 O 7 Ba ( BO 2 ) 2 ↓
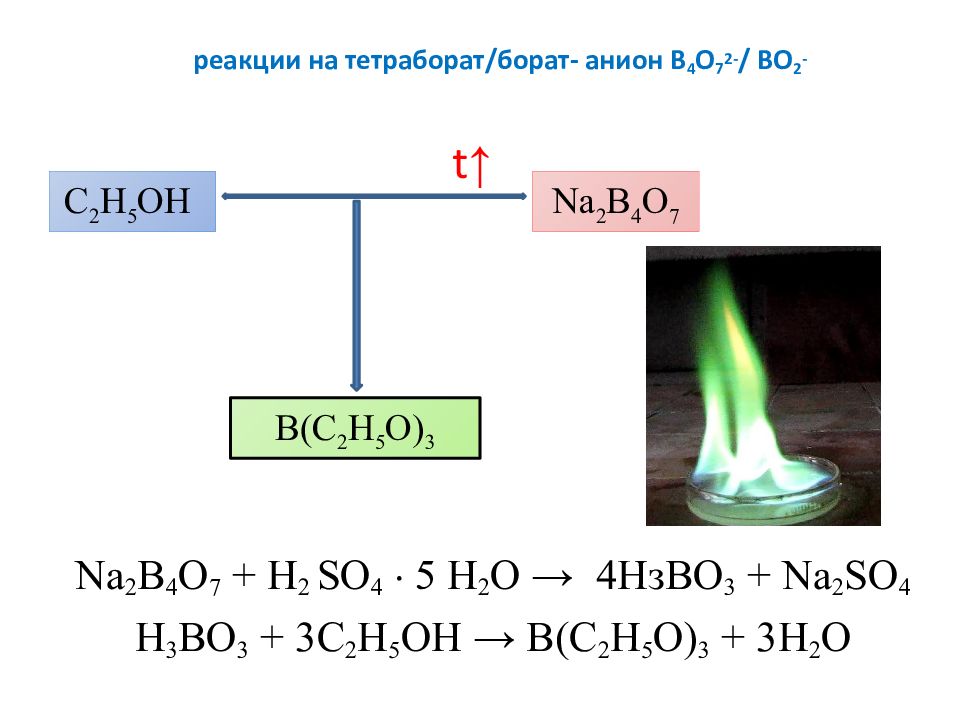
Слайд 27: реакции на тетраборат /борат- анион В 4 О 7 2- / ВО 2 -
Na 2 B 4 O 7 + Н 2 S О 4 5 H 2 O → 4 НзВО 3 + Na 2 SO 4 H 3 BO 3 + 3C 2 H 5 OH → B(C 2 H 5 O) 3 + 3H 2 O C 2 H 5 OH Na 2 B 4 O 7 B(C 2 H 5 O) 3 t ↑
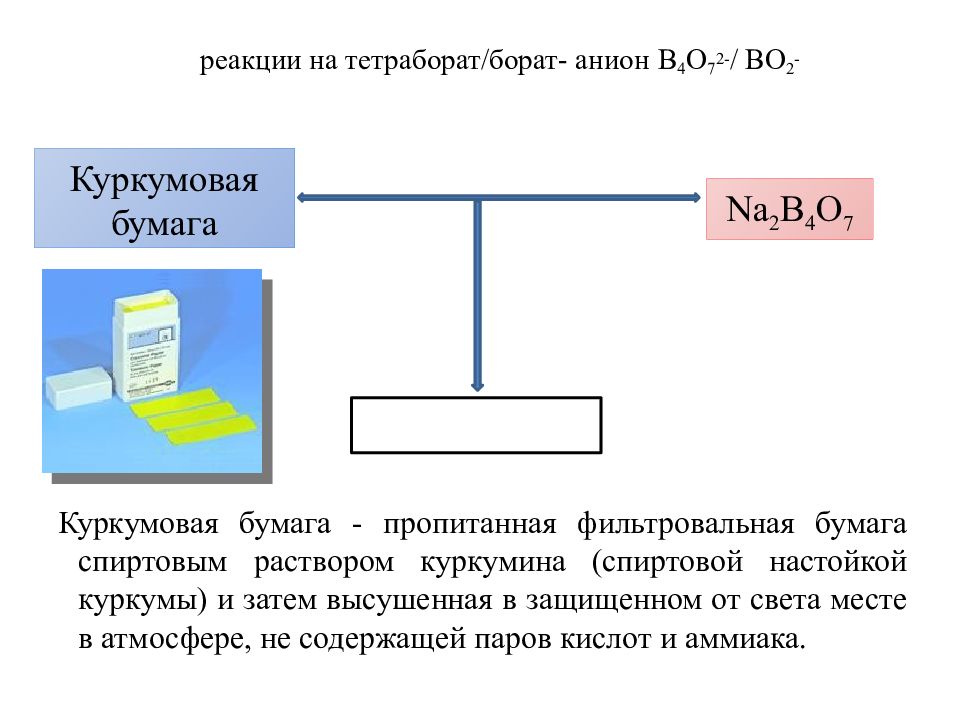
Слайд 28: реакции на тетраборат /борат- анион В 4 О 7 2- / ВО 2 -
Куркумовая бумага - пропитанная фильтровальная бумага спиртовым раствором куркумина (спиртовой настойкой куркумы) и затем высушенная в защищенном от света месте в атмосфере, не содержащей паров кислот и аммиака. Куркумовая бумага Na 2 B 4 O 7