Слайд 2: Жоспар :
Термохимия Химиялық реакциялардың жылу эффектісі Гесс заңы, салдарлары Реакцияның жылу эффектісінің температураға тәуелділігі
Слайд 3: ТЕРМОХИМИЯ
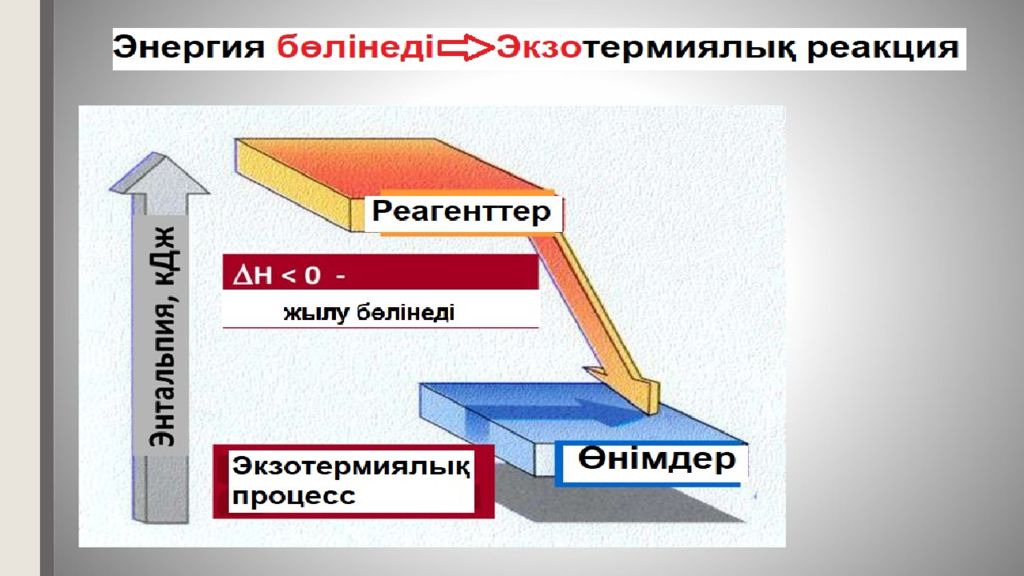
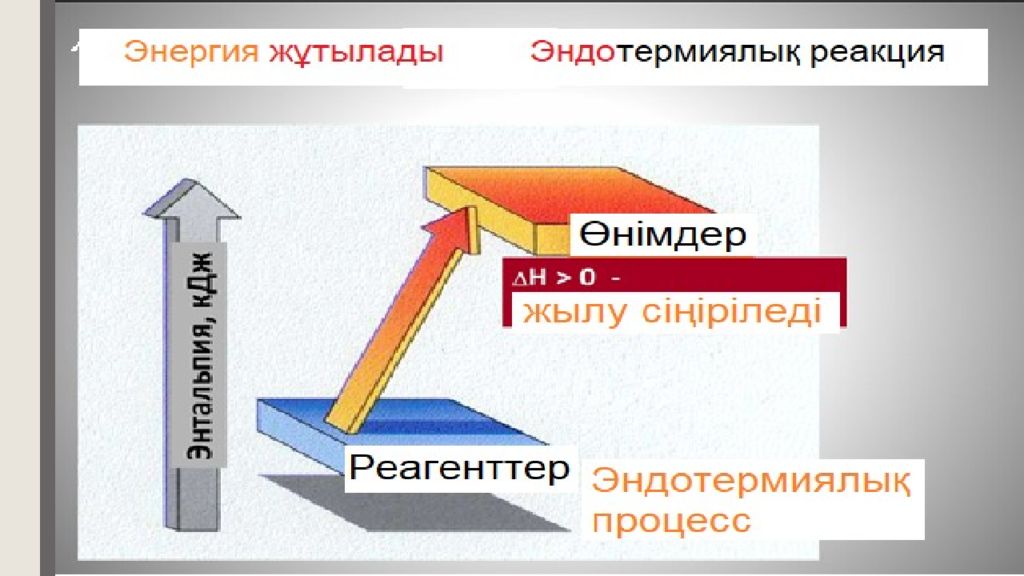
Термохимия - химиялық реакцияларда жылуды бөле (экзотермиялық реакциялар) немесе сіңіре (эндотермиялық реакциялар) жүруін зерттейтін термодинамиканың бір бөлімі. +Q
Слайд 7
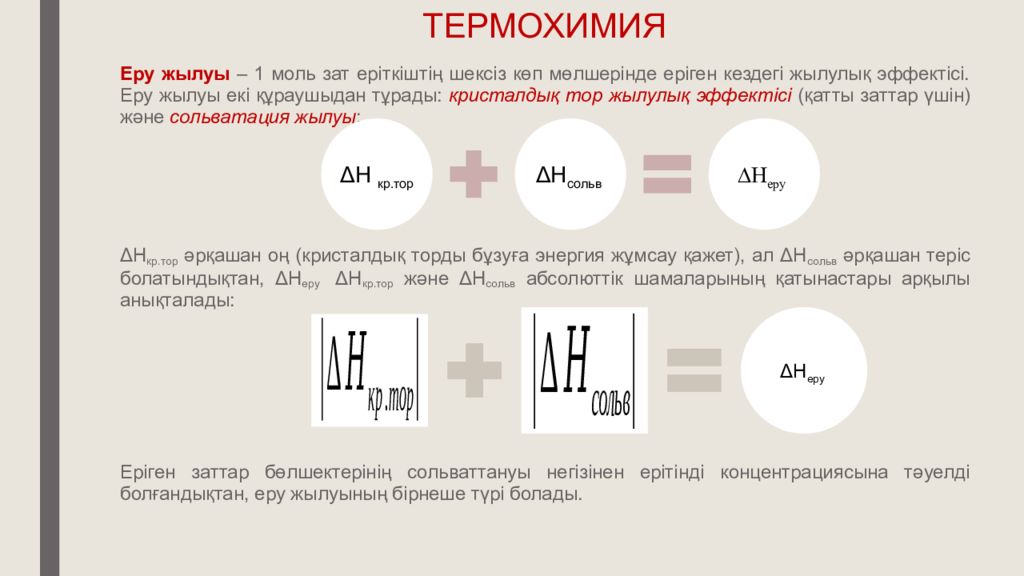
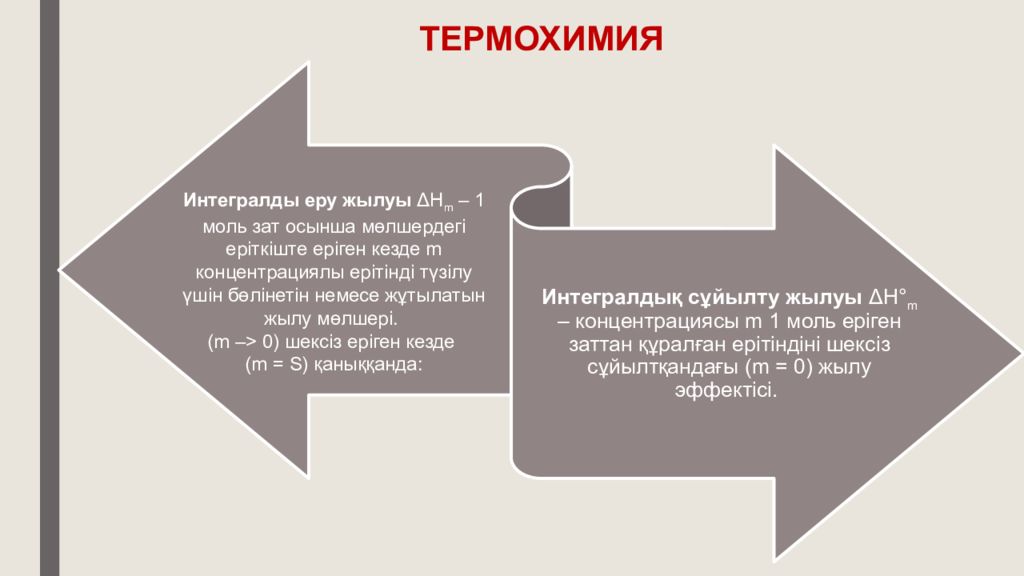
Еру жылуы – 1 моль зат еріткіштің шексіз көп мөлшерінде еріген кездегі жылулық эффектісі. Еру жылуы екі құраушыдан тұрады: кристалдық тор жылулық эффектісі (қатты заттар үшін) және сольватация жылуы : Δ Н кр.тор әрқашан оң (кристалдық торды бұзуға энергия жұмсау қажет), ал Δ Н сольв әрқашан теріс болатындықтан, Δ Н еру Δ Н кр.тор және Δ Н сольв абсолюттік шамаларының қатынастары арқылы анықталады: Еріген заттар бөлшектерінің сольваттануы негізінен ерітінді концентрациясына тәуелді болғандықтан, еру жылуының бірнеше түрі болады. ТЕРМОХИМИЯ
Слайд 9: Бақылау сұрақтары :
Термохимия нені зерттейді ? Заттың еру жылуы қандай екі негізгі құраушыдан тұрады және олардың әрқайсысының жылу эффектісінің белгісі қандай ? Интегралды сұйылту жылуы мен аралық сұйылту жылуының айырмашылығы неде ?
Слайд 10: Химиялық реакциялардың жылу эффектісі
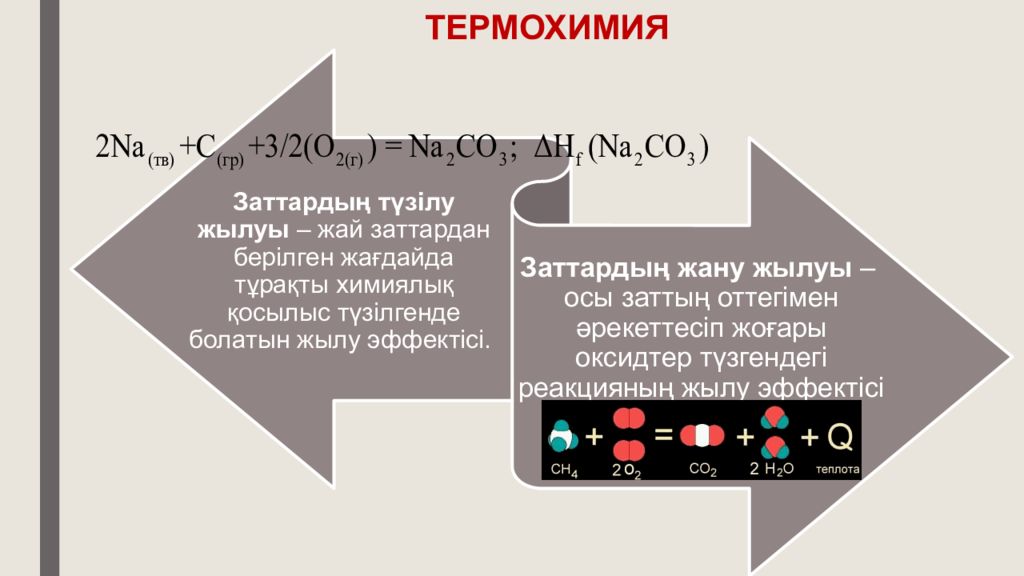
Химиялық реакциялардың жылу эффектісі – реакция барысында бөлініп шығатын немесе сіңірілетін жылу мөлшері. Жылу мөлшері көрсетіліп жазылатын теңдеулер – термохимиялық теңдеулер деп аталады. .
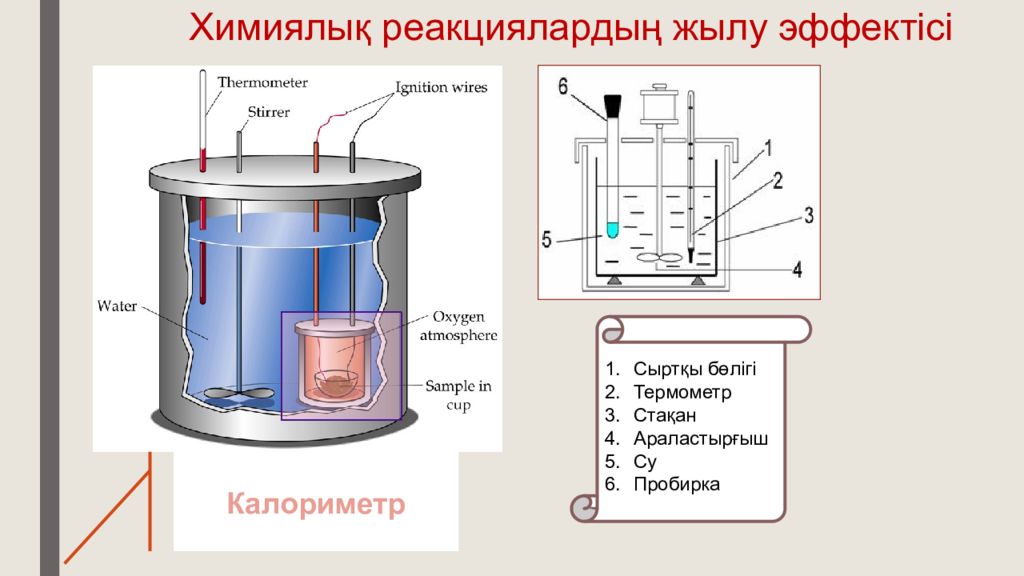
Слайд 13: Химиялық реакциялардың жылу эффектісі
Калориметр Сыртқы бөлігі Термометр Стақан Араластырғыш Су Пробирка
Слайд 14: Бақылау сұрақтары :
Термохимиялық теңдеулер дегеніміз не? Термохимиялық теңдеулерді жазу ерекшелігі ? Химиялық реакциялардың жылу эффектісін немен өлшейді ? Калориметр құрылысы?
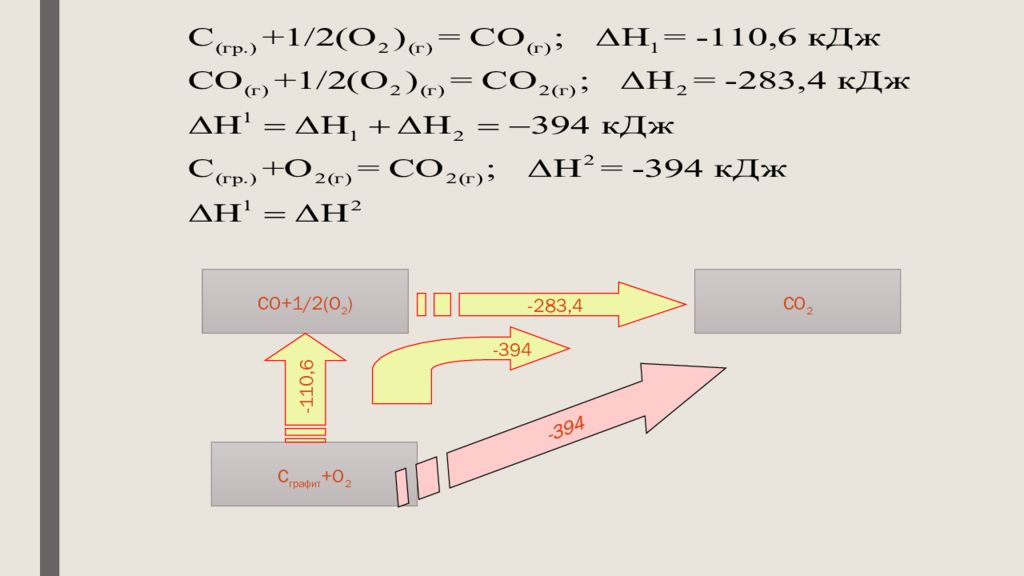
Слайд 15: Гесс заңы
химиялық реакцияның жылу эффектісі оның жүру жолына тәуелді емес, тек реагенттер мен өнімдердің күйіне тәуелді.
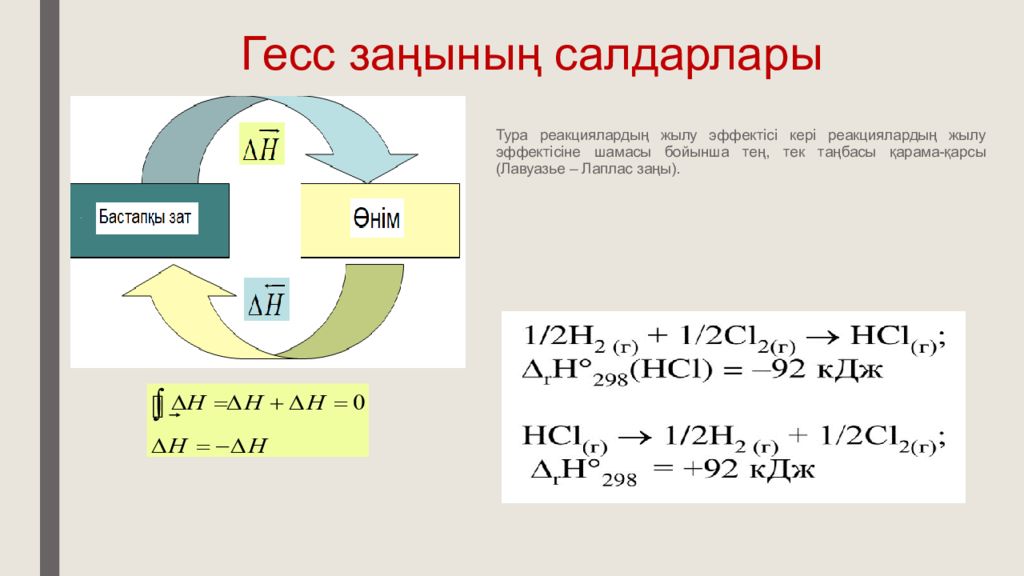
Слайд 17: Гесс заңының салдарлары
Тура реакци ялардың жылу эффектісі кері реакци ялардың жылу эффектісіне шамасы бойынша тең, тек таңбасы қарама-қарсы (Лавуазье – Лаплас з а ңы ).
Слайд 18: Гесс заңы
2. Бастапқы реагенттері бірдей, бірақ соңғы күйлері әр түрлі екі реакция үшін жылу эффектілерінің айырымы өнімнің бір түрден екінші түрге ауысу кезіндегі жылу эффектілерінің айырымына тең.
Слайд 19: Гесс заңы
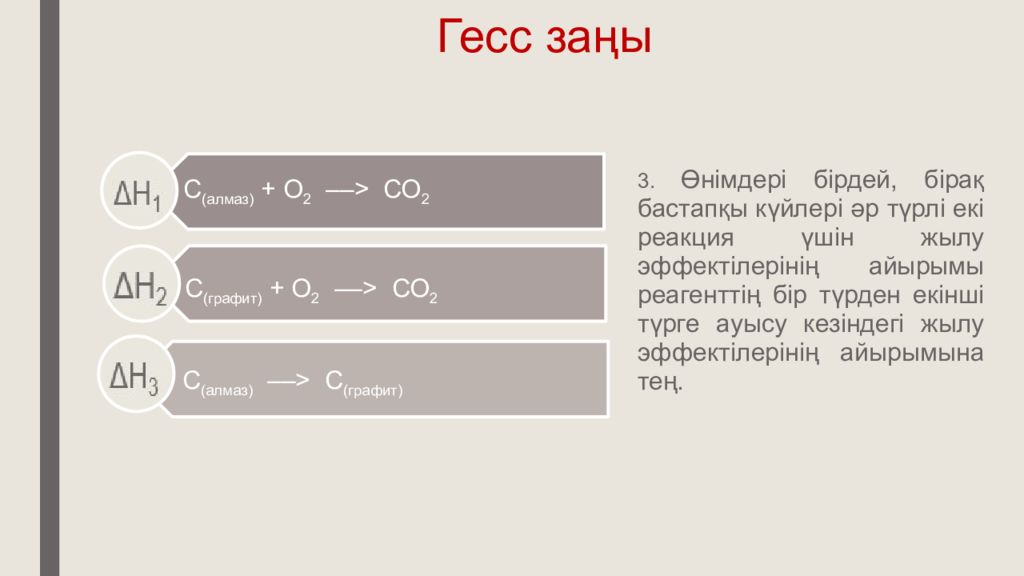
3. Өнімдері бірдей, бірақ бастапқы күйлері әр түрлі екі реакция үшін жылу эффектілерінің айырымы реагенттің бір түрден екінші түрге ауысу кезіндегі жылу эффектілерінің айырымына тең.
Слайд 20: Гесс заңы
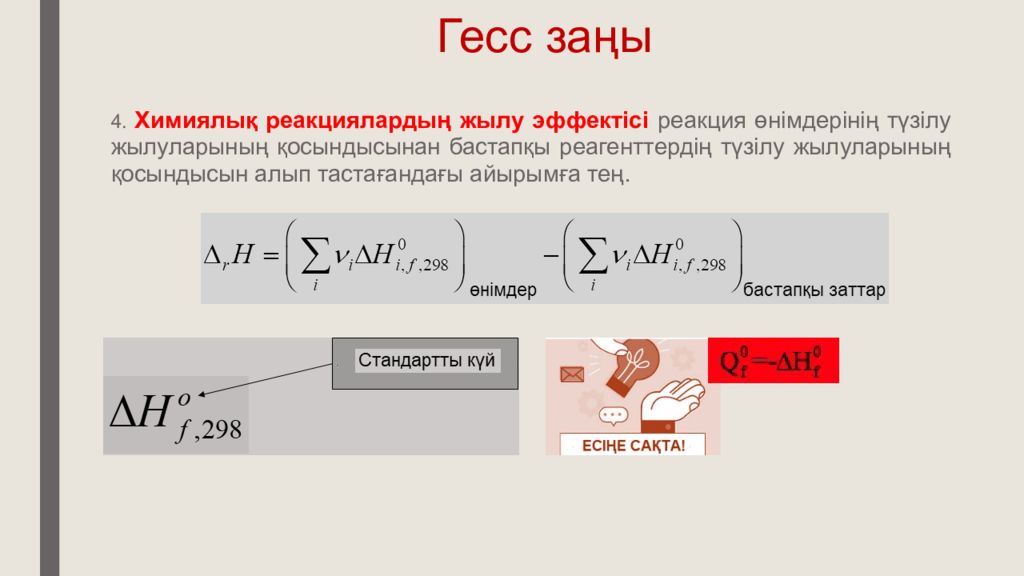
4. Х ими ялық реакциялардың жылу эффектісі реакция өнімдерінің түзілу жылуларының қосындысынан бастапқы реагенттердің түзілу жылуларының қосындысын алып тастағандағы айырымға тең.
Слайд 21: Есеп
Анықтамалық мәндерді қолданып, пиритті күйдіру реакциясының жылу эффектісін есепте. Термохимиялық теңдеуін жаз.
Слайд 22: Гесс заңы
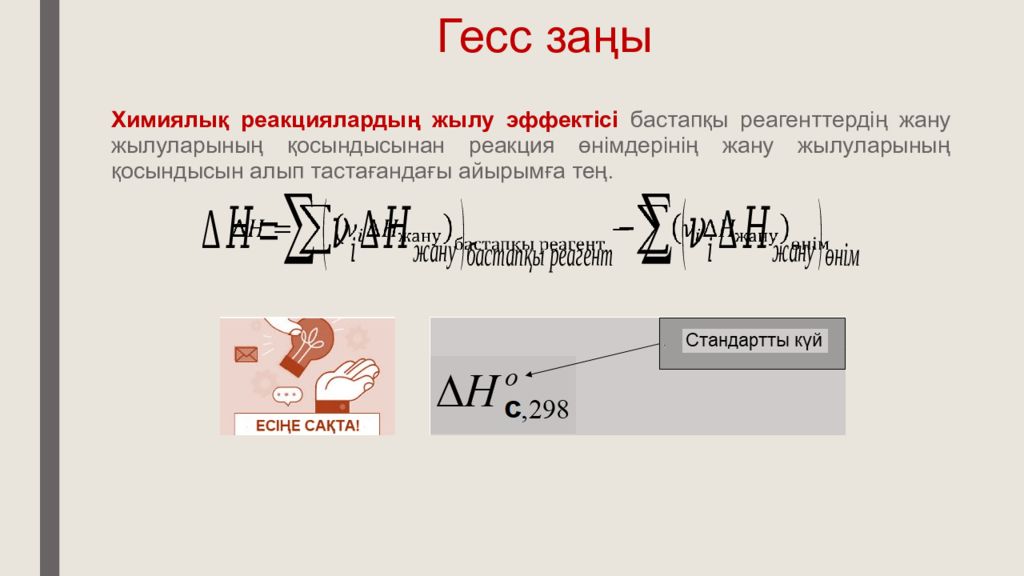
Х ими ялық реакциялардың жылу эффектісі бастапқы реагенттердің жану жылуларының қосындысынан реакция өнімдерінің жану жылуларының қосындысын алып тастағандағы айырымға тең.
Слайд 23: Графиттің алмазға аллотропиялық ауысу жылуын есептеңдер, егер графит пен алмаздың көміртек ( IV ) оксидіне дейін жану энтальпиясы сәйкесінше тең -393,5 және 391,6 кДж/моль
Графит пен алмаздың түзілу жылуларынан есептелген графит/алмаз ауысу шамаларына сәйкес келеді. Көміртектің ең тұрақты ( стандартты ) күйі оның графит түріндегі модификациясы СО 2 (газ) С( графит) С( алмаз) Δ Н х -? Δ Н 1 =-39 1, 6 Δ Н 2 = Δ Н x +(-393,5) Есеп
Слайд 24: Анықтамалықта мәндері жоқ немесе тәжірибелік жолмен анықталмайтын реакциялардың жылу эффектілерін есептеу мақсатында, жылу эффектілері белгілі термохимиялық теңдеулерден циклдер құрастырылады. Термохимиялық теңдеулерді оларға кез - келген арифметикалық амалдарды (қосу, алу, бөлу, көбейту) қолдану арқылы комбинирлеуге болады
Слайд 25: Есеп
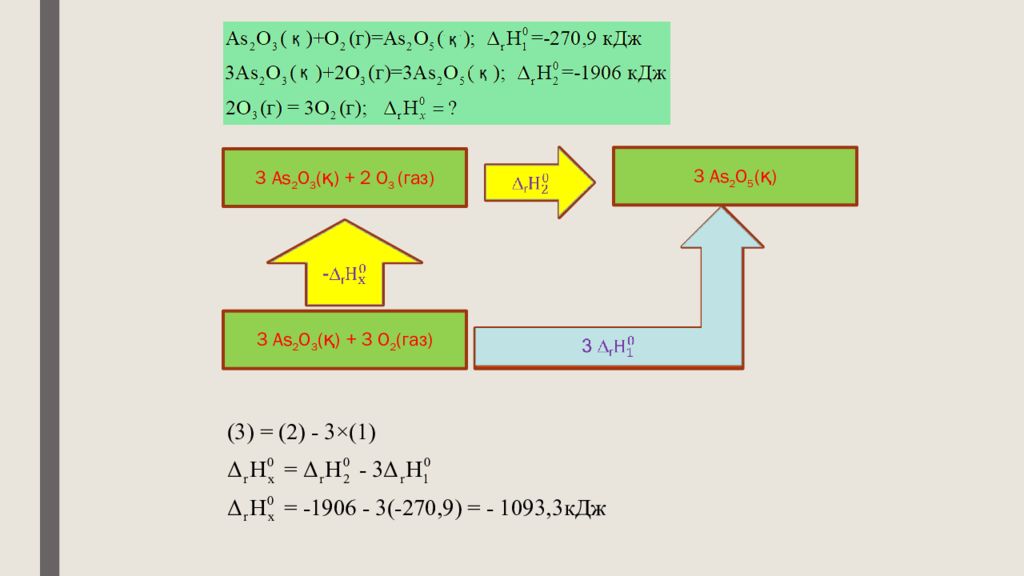
Оттегі мен озоннан мышьяк ( III ) оксидін алу реакциясының мәндерін қолданып, озонның ыдырауының термохимиялық теңдеуін құрыңдар.
Слайд 26
3 As 2 O 5 (қ) 3 As 2 O 3 (қ) + 3 O 2 (газ ) 3 As 2 O 3 (қ) + 2 O 3 (газ) - ∆ r ∆ r 3 ∆ r
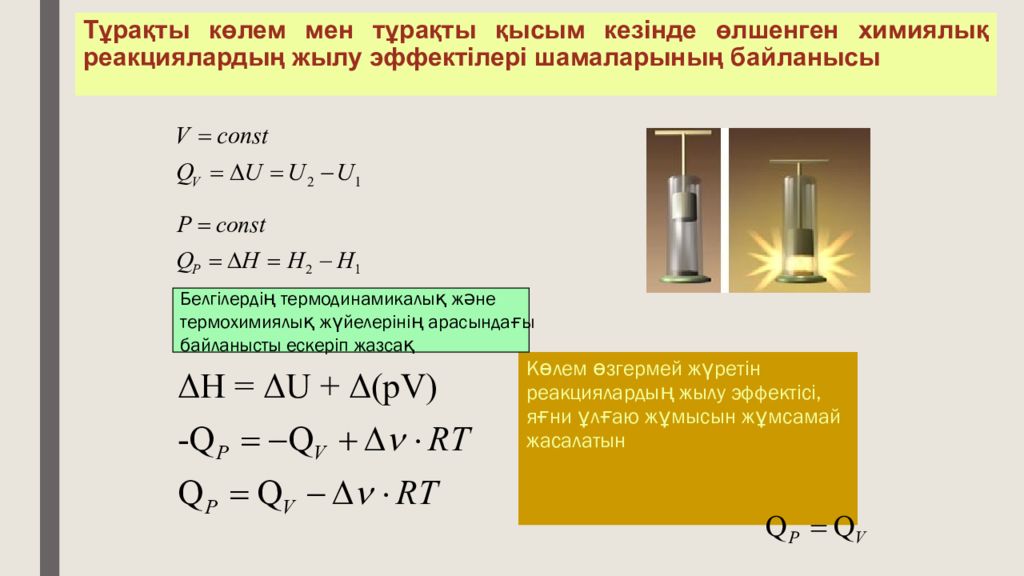
Слайд 27: Тұрақты көлем мен тұрақты қысым кезінде өлшенген химиялық реакциялардың жылу эффектілері шамаларының байланысы
Көлем өзгермей жүретін реакциялардың жылу эффектісі, яғни ұлғаю жұмысын жұмсамай жасалатын Белгілердің термодинамикалық және термохимиялық жүйелерінің арасындағы байланысты ескеріп жазсақ
Слайд 28: Бақылау сұрақтары :
Гесс заңының тұжырымдамасы Гесс заңының салдарлары Термохимиялық теңдеулер дегеніміз не?
Слайд 29: Реакцияның жылу эффектісінің температураға тәуелділігі
Кирхгоф заңы Реакцияның жылу эффектісінің температуралық коэффициенті осы реакцияға қатысатын заттардың жылусыйымдылық өзгерістеріне тең. Реакцияның жылу эффектісінің температураға тәуелділігі
Слайд 31: Реакцияның жылу эффектісінің ( Дж ) температураға аналитикалық тәуелділігін қорытып шығар
Слайд 32: Бақылау сұрақтары :
Реакцияның жылу эффектісінің температураға тәуелділігі Кирхгоф заңы Негізгі формуласын көрсет
Слайд 33: ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ:
Оспанов Х.Қ., Қамысбаев Д.Х., Абланова Е.Х., Шәбікова Г.Х. Физикалық химия. – Өскемен, ШҚМУ, 2017 ж. – 576 бет. Қоқанбаев Ә.Қ. Физикалық химияның қысқаша курсы. Алматы: Білім, 2016 ж. – 224 бет. Жайлауов С. Физикалық химия. Алматы: Рауан, 2012 ж. – 255 бет.