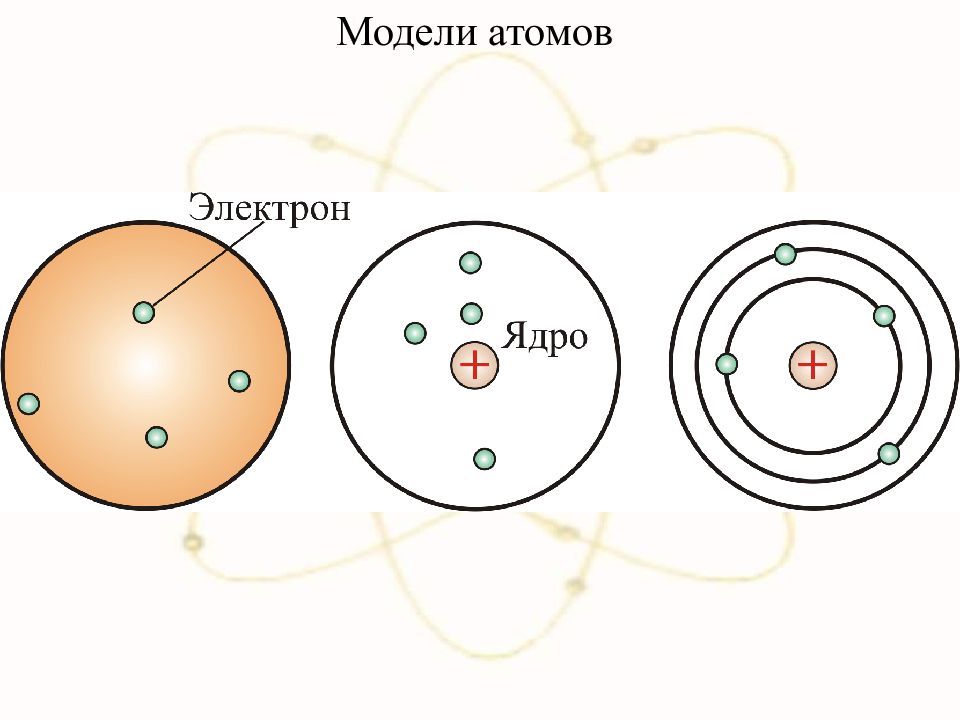
Слайд 2: А́том (от др.-греч. «атомос» — неделимый, неразрезаемый) — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств
Слайд 3
Атомизм - учение о гетерогенном (дискретном) строении вещества: мир состоит из мельчайших элементарных частиц. Начало – Древняя Греция (5 – 3 вв. до н.э.)- Демокрит, Эпикур («атом» – т.е. «неделимый » ). античных времен до 19 века предположения об атомном строении вещества – гипотезы, накопление фактов, обобщений, сведений о простых элементах (H, Fe, Cu). В 17 в. - Р.Бойль («дым, - как и все тела – падает »)положил атомистику в основу своих химических представлений и объяснил все химические изменения соединением и разъединением атомов.
Слайд 4
1869 г. – Дм.И.Менделеев – Периодический Закон Менделеева : Периодическая зависимость химических свойств элементов от их атомного веса – от заряда атомных ядер. Классификация элементов по универсальной системе. Предугадывание ядерной физики – благодаря этой системе позднее открывались новые элементы (в т.ч. – искусственные), новые свойства (в т.ч. – делимость ядер).
Слайд 5
Конец XIX - начало ХХ века - Атомная физика - 1897 г. - открытие электрона (термин: «электрон»), измерение удельного заряда ( - 1,7588 1011 Кл/кг) - Опыт Дж.Дж. Томсона : прохождение катодных лучей через систему параллельных металлических пластин (электрическое поле), и катущек (магнитное поле). Выводы: Скорость частиц ниже скорости света, есть масса. Отношение заряда к массе для катодных лучей не зависят от материала источника.
Слайд 6
Результаты: Минимальный заряд - е = 1,6 ∙ 10-19 Кл ( заряд электрона ). Масса электрона – 1/ 1840 от массы атома водорода. Вывод: внутри атома есть электрические заряды
Слайд 7
Естественная радиоактивность 1896 г. – открытие радиоактивности (А. Беккерель) - урановая соль на закрытой фотопластинке 1903 г. - А.Беккерель и М.Кюри – Нобелевская премия за открытие самопроизвольного распада атомов с испусканием заряженных частиц.
Слайд 8
Естественная радиоактивность Термин: «радиоактивность ». Выводы: В природе есть нестабильные вещества, из атомов которых вылетают заряженные частицы В результате - образуются новые вещества (новые элементы) 1898 г. – М.Кюри – Торий, Полоний, Радий. В результате – образуются заряженные атомы (ионы) – легкие и тяжелые В результате – первое воздействие радиоактивности на человека: 0,1 г Ро из 1 т руды!, А.Беккерель – ожог от пробирки с радием в кармане, М.Кюри – лучевой рак крови; В результате – модель ядра и атома
Слайд 12
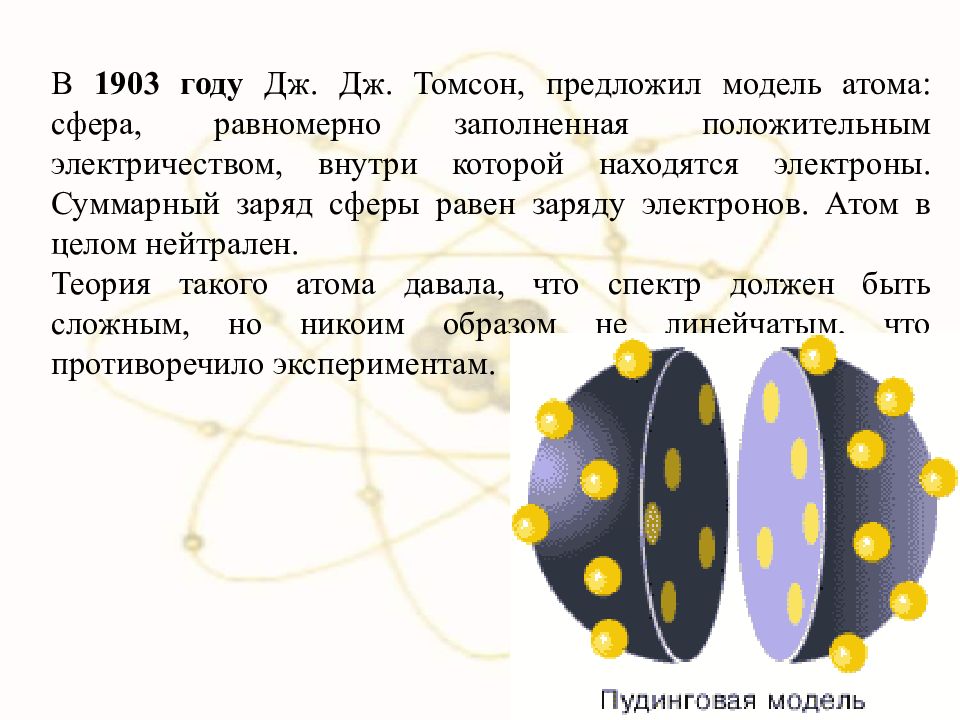
В 1903 году Дж. Дж. Томсон, предложил модель атома: сфера, равномерно заполненная положительным электричеством, внутри которой находятся электроны. Суммарный заряд сферы равен заряду электронов. Атом в целом нейтрален. Теория такого атома давала, что спектр должен быть сложным, но никоим образом не линейчатым, что противоречило экспериментам.
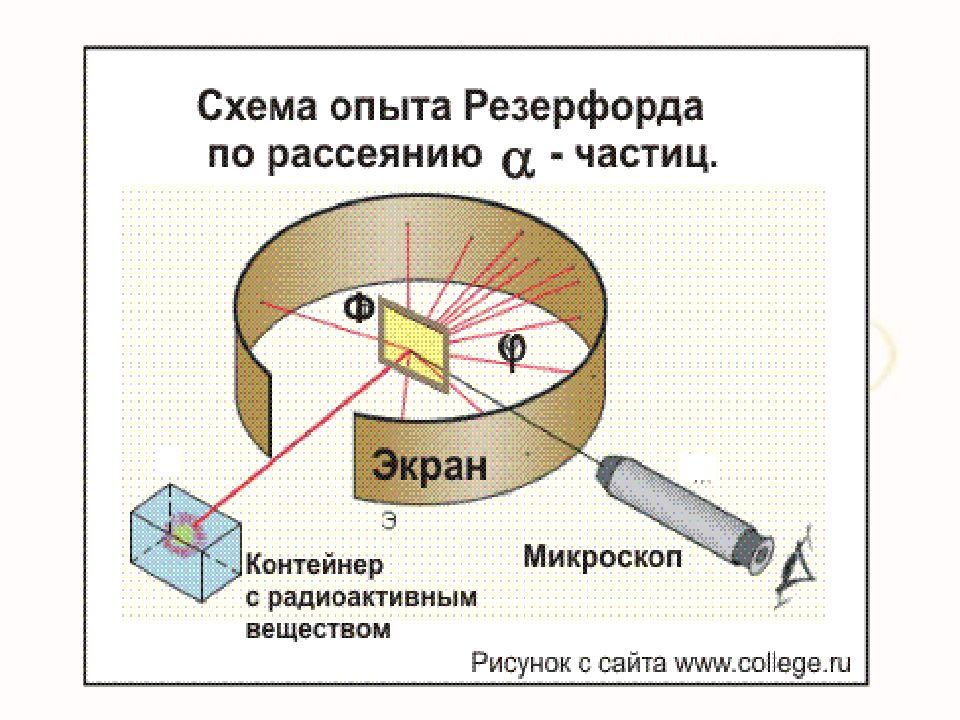
Слайд 13: Модель Томсона нуждалась в экспериментальной проверке. Важно было убедиться, действительно ли положительный заряд распределён по всему объёму атома с постоянной плотностью. В 1909г. Эрнест Резерфорд совместно со своими сотрудниками Г. Гейгером и Э. Марсденом провёл ряд опытов по исследованию состава и строения атомов
.
Слайд 14
В 1903 г. доказал, что альфа-лучи состоят из положительно заряженных частиц. Предсказал существование трансурановых элементов. В 1908 г. ему была присуждена Нобелевская премия. Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его исследования посвящены атомной и ядерной физике, радиоактивности. В 1899 г. открыл альфа - и бета-лучи. Вместе с Ф. Содди в 1903 г. разработал теорию радиоактивного распада и установил закон радиоактивных превращений. 14
Слайд 15: Идея опыта Резерфорда:
Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса альфа-частицы в 8000 раз больше массы электрона. Электрический заряд альфа-частицы в 2 раза больше заряда электрона. Скорость альфа-частицы около 15 000 км/с. Альфа-частица является ядром атома гелия.
Слайд 17: Опыты показали: Подавляющая часть альфа-частиц проходит сквозь фольгу практически без отклонения или с отклонением на малые углы; Некоторая небольшая часть альфа-частиц при прохождении через фольгу отклоняется на значительные углы ( 90,120,150 градусов);
Слайд 18
Обнаружилось, что некоторые α-частицы отклонялись на большие углы, до 180º. Резерфорд понял, что такое отклонение возможно лишь при встрече с положительно заряженной частицей большой массы. Малая вероятность отклонения на большие углы говорила о том, что эта положительная частица имеет малые размеры, порядка 10 –14 м. Электроны, по Резерфорду, движутся вокруг ядра. Оказалось, что радиус ядра R (10 14 ÷ 10 15 )м и зависит от числа нуклонов в ядре.
Слайд 19: Выводы из опытов:
Положительный заряд сосредоточен в малой части атома – ядре; Практически вся масса атома сосредоточена в этом ядре; Отклонения альфа-частиц на большие углы происходят в результате столкновения альфа – частиц с ядром одного из атомов; Теоретические расчеты позволили оценить размеры ядер атомов – порядка 10 - 14 м, тогда как размеры атома в 10 000 раз больше.
Слайд 21
Недостатки атома Резерфорда Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики вращающийся вокруг ядра электрон должен непрерывно излучать электромагнитные волны, а поэтому терять свою энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента.
Слайд 22
БОР Нильс Хендрик Давид (1885–1962) датский физик-теоретик, один из создателей современной физики. Сформулировал идею о дискретности энергетических состояний атомов, построил атомную модель, открыв условия устойчивости атомов. Создал первую квантовую модель атома, основанную на двух постулатах, которые прямо противоречили классическим представлениям и законам. Элементарная теория Бора
Слайд 23
Постулаты Бора Электроны движутся только по определенным (стационарным) орбитам. При этом не происходит излучения энергии. Условие для стационарных орбит: из всех орбит электрона возможны только те, для которых момент импульса электрона, равен целому кратному постоянной Планка: n = 1, 2, 3,… главное квантовое число. m e v r = nħ
Слайд 24
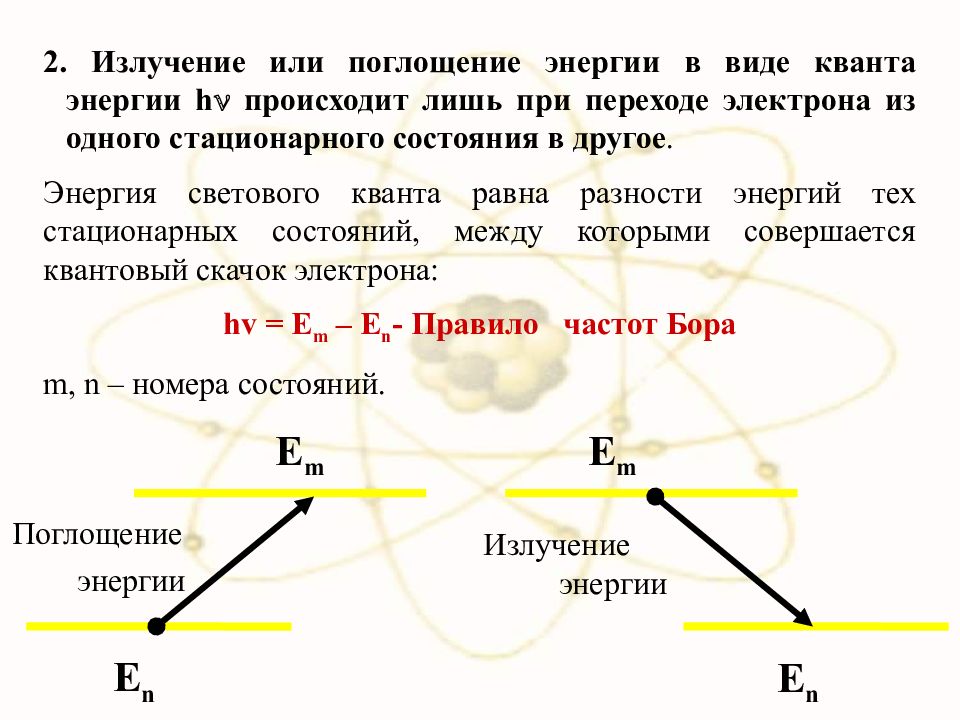
Излучение или поглощение энергии в виде кванта энергии h происходит лишь при переходе электрона из одного стационарного состояния в другое. Энергия светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона: hv = E m – E n - Правило частот Бора m, n – номера состояний. Е n E m Поглощение энергии Е n E m Излучение энергии
Слайд 26
Радиус первой орбиты водородного атома называют Боровским радиусом: При n =1, Z = 1 для водорода имеем: = 0,529·10 –10 м. Å=
Слайд 27
Внутренняя энергия атома слагается из кинетической энергии электрона и потенциальной энергией взаимодействия электрона с ядром: Энергия электрона может принимать только дискретные значения, т.к. n = 1, 2, 3,… Отсюда
Слайд 28
При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией : и частота излучения, Мы получили обобщенную формулу Бальмера, которая хорошо согласуется с экспериментом, где постоянная Ридберга
Слайд 29
Швейцарский физик Й. Бальмер в 1885 году установил, что длины волн серии в видимой части спектра водорода могут быть представлены формулой ( формула Бальмера ) : 0 = const, n = 3, 4, 5,… R = 1, 09·10 7 м -1 – постоянная Ридберга, n = 3, 4, 5,… В физике постоянной Ридберга называют и другую величину равную R = R · с. R = 3,29·10 15 c -1 или
Слайд 30
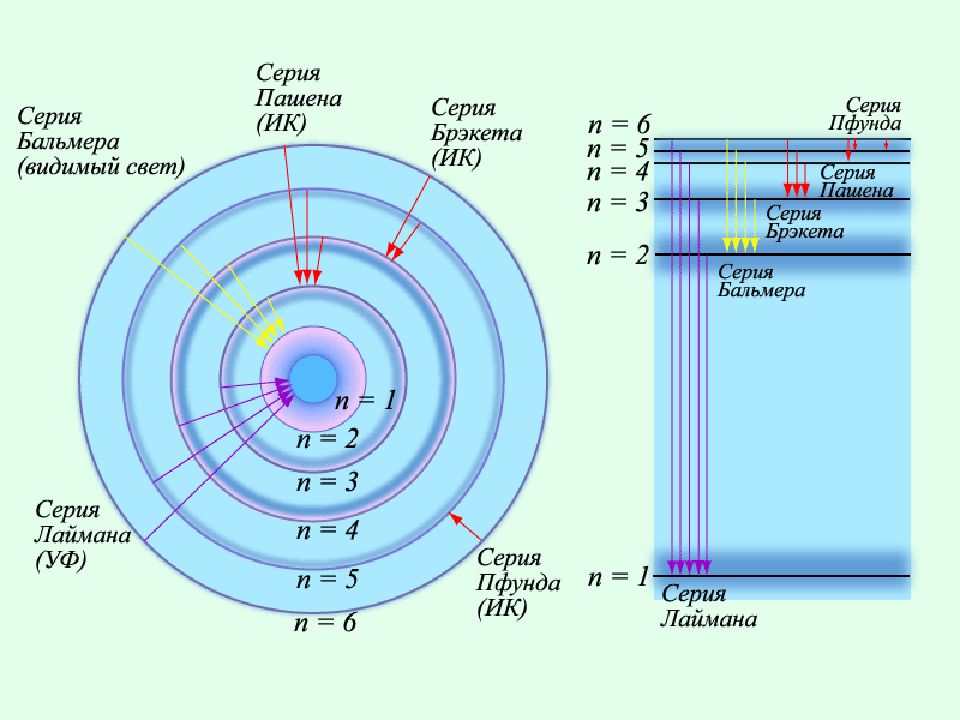
Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий : Серия Лаймона n = 2, 3, 4,… Серия Пашена n = 4, 5, 6,… Серия Брэкета n = 5, 6, 7,… Серия Пфунда n = 6, 7, 8,…
Слайд 31
Обобщенная формула Й. Бальмера где k = 1, 2, 3,…, n = k + 1, k + 2,…. или
Слайд 33
У спехом теории Бора явилось: вычисление постоянной Ридберга для водородоподобных систем объяснение структуры их линейчатых спектров.
Слайд 34
Бор теоретически вычислил отношение массы протона к массе электрона m p / m e = 1847, это находится в соответствии с экспериментом. Все это было важным подтверждением основных идей, содержащихся в теории Бора. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913 – 1925 г.г.) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.
Слайд 35
Опыт Франка и Герца Существование дискретных энергетических уровней атома и доказательство правильности теории Бора подтверждается опытом Франка и Герца. Немецкие ученые Джеймс Франк и Густав Герц, за экспериментальные исследования дискретности энергетического уровня получили Нобелевскую премию в 1925 г.
Слайд 36
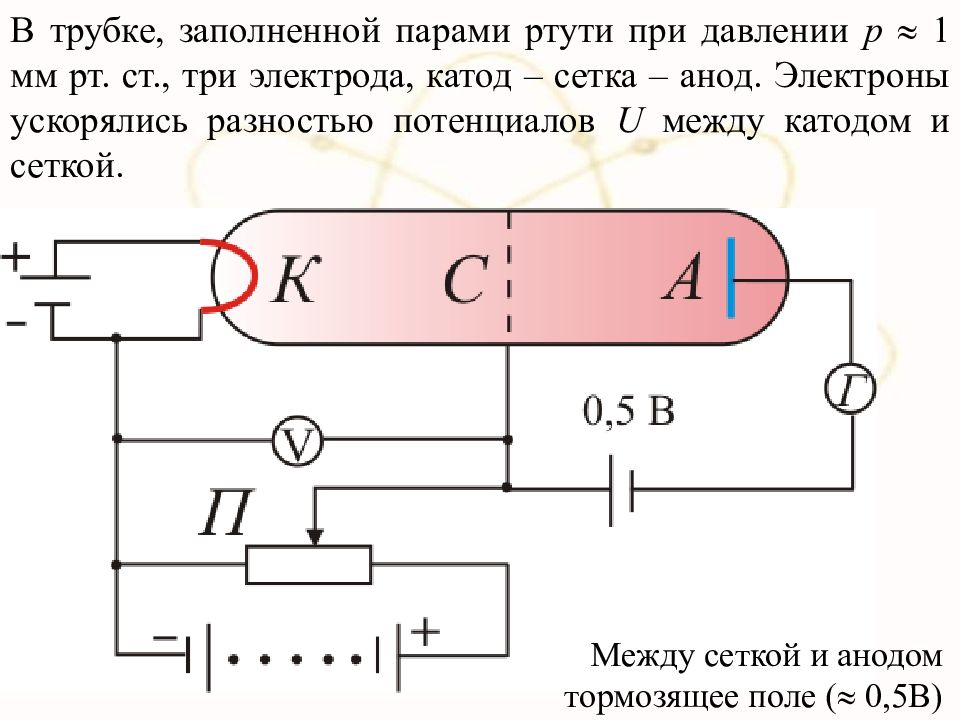
В трубке, заполненной парами ртути при давлении р 1 мм рт. ст., три электрода, катод – сетка – анод. Электроны ускорялись разностью потенциалов U между катодом и сеткой. Между сеткой и анодом тормозящее поле ( 0,5В)
Слайд 37
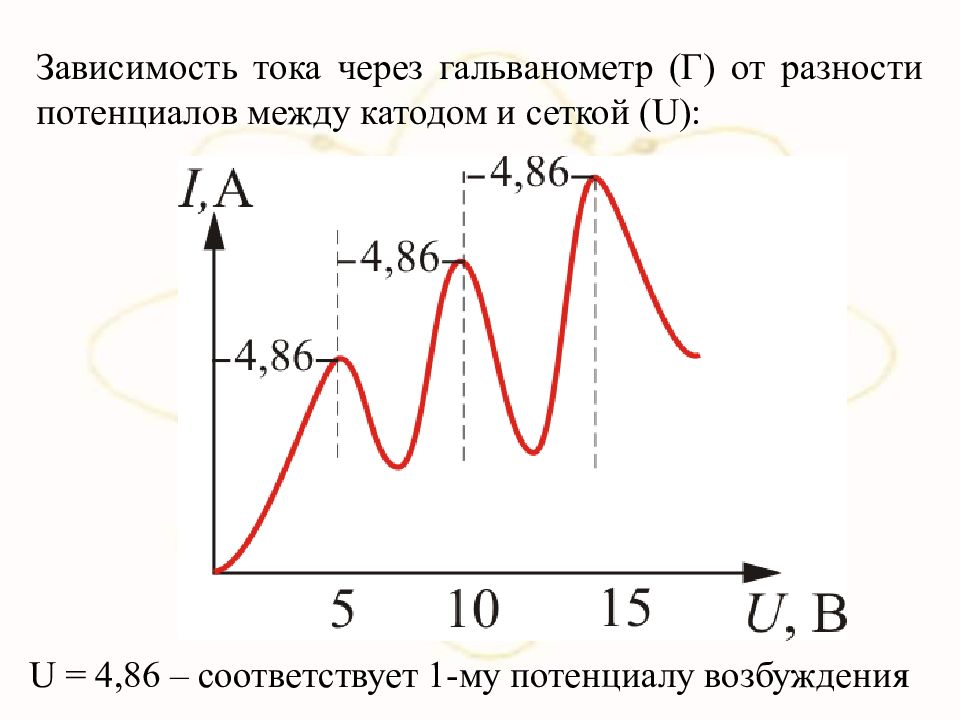
Зависимость тока через гальванометр ( Г) от разности потенциалов между катодом и сеткой ( U ): U = 4,86 – соответствует 1-му потенциалу возбуждения
Слайд 38
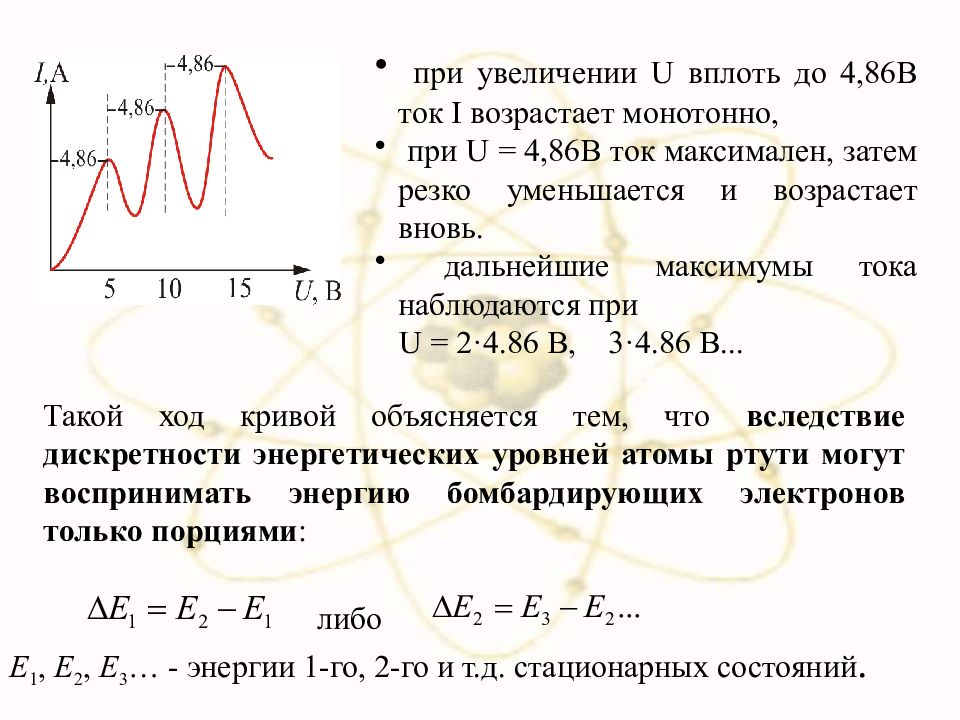
Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы ртути могут воспринимать энергию бомбардирующих электронов только порциями : либо Е 1, Е 2, Е 3 … - энергии 1-го, 2-го и т.д. стационарных состояний. при увеличении U вплоть до 4,86В ток I возрастает монотонно, при U = 4,86 В ток максимален, затем резко уменьшается и возрастает вновь. дальнейшие максимумы тока наблюдаются при U = 2·4. 86 B, 3 ·4.86 B...
Слайд 39
При U< 4,86В энергия электронов меньше Δ Е 1 ; соударения между электронами и атомами ртути носят упругий характер. При U =4,86В энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути энергию Δ Е 1 и продолжает двигаться с меньшей скоростью; число электронов, достигающих А, резко уменьшается и ток падает атом ртути переходит в возбужденное состояние. При U, кратном 4,86 В электроны могут испытывать с атомами ртути 2, 3, … неупругих соударения, теряя при этом полностью свою энергию. анодный ток каждый раз резко уменьшается.
Слайд 40
Атомы ртути, получившие при соударении с электронами энергию Δ Е 1 и перешедшие в возбужденное состояние, спустя время ~ 10 -8 с должны вернуться в основное состояние, излучая, согласно второму постулату Бора фотон с частотой (правило частот): При этом длина волны светового кванта: - что соответствует ультрафиолетовому излучению. Опыт действительно обнаруживает ультрафиолетовую линию с
Слайд 41
Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый, но и второй постулат Бора. Эти опыты сыграли огромное значение в развитии атомной физики.
Слайд 42
Однако наряду с успехами в теории Бора с самого начала обнаружились существенные недостатки. Внутренняя противоречивость теории : механическое соединение классической физики с квантовыми постулатами. Теория не могла объяснить вопрос об интенсивностях спектральных линий. Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров гелия ( He ) (два электрона на орбите, и уже теория Бора не справляется).
Слайд 43
Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и правильной теории. Такой теорией и являлась квантовая (волновая) механика. Дальнейшее развитие квантовой механики привело к отказу от механической картины движения электрона в поле ядра.
Слайд 45
Де Бройль первым понял, что если волны могут вести себя как частицы, то и частицы могут вести себя как волны. Он применил теорию Эйнштейна - Бора о дуализме волна-частица к материальным объектам. По аналогии с соотношением между длиной волны света и энергией фотона де Бройль высказал гипотезу о существовании соотношения между длиной волны и импульсом частицы (массы, умноженной на скорость частицы). Импульс непосредственно связан с кинетической энергией. Таким образом, быстрый электрон соответствует волне с более высокой частотой (более короткой длиной волны), чем медленный электрон.
Слайд 46: Двойственная природа электрона
Его движение не может быть описано определенной траекторией, траектория размывается, появляется «полоса неопределенности», в которой находится ē. Чем точнее мы будем стараться определить местонахождения электрона, тем менее точно будем знать о его скорости. Второй закон квантовой механики звучит так: «Невозможно одновременно с любой заданной точностью определить координаты и импульс (скорость) движущегося электрона»
Слайд 48
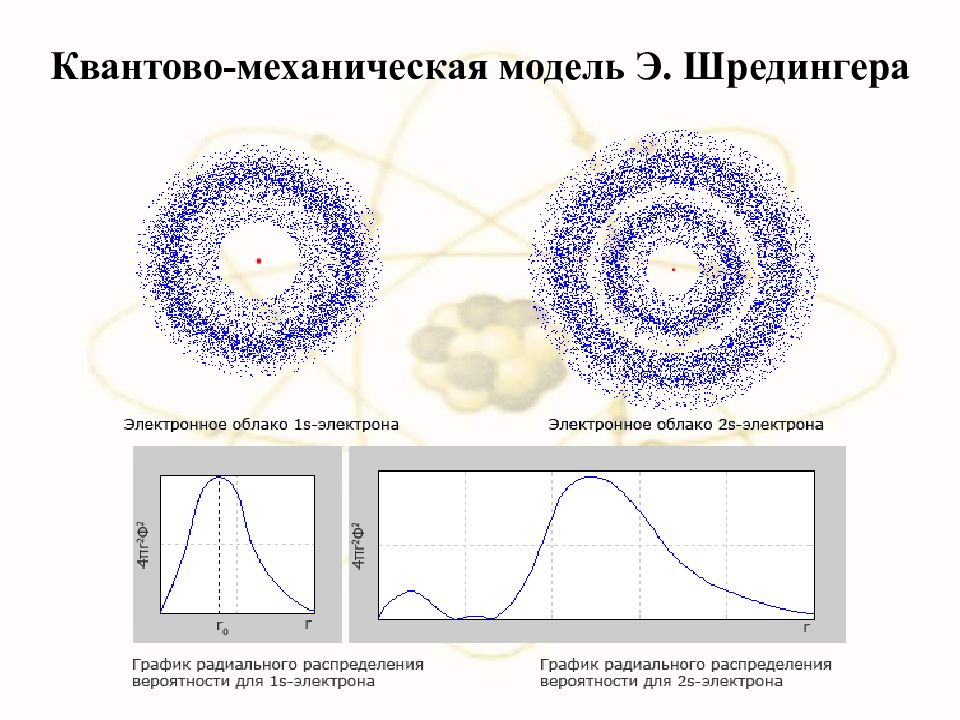
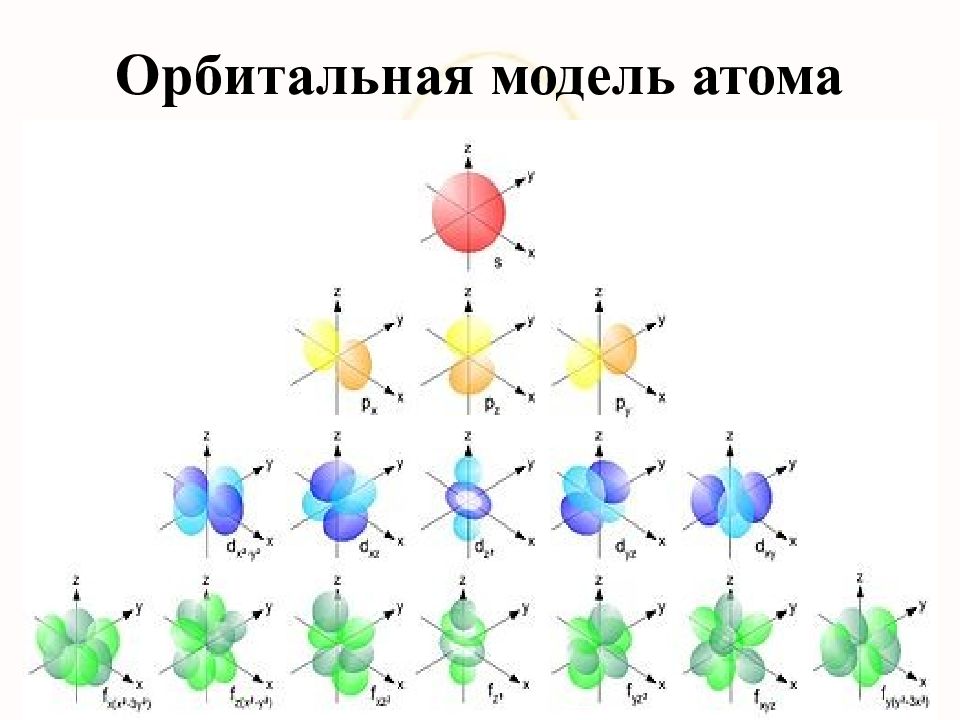
В 1926 г. Э. Шредингер предложил для описания движения электрона в атоме волновое уравнение, получившее название уравнения Шредингера. Решением уравнения Шредингера является волновая функция ψ, называемая также орбиталью. Волновая функция может иметь как действительные, так и мнимые решения. Поэтому физический смысл имеет только квадрат модуля волновой функции |ψ| 2, который характеризует вероятность нахождения электрона в данном объеме пространства. Термином орбиталь обозначают также область пространства, в которой наиболее вероятно нахождение электрона. Орбиталь может быть представлена, в частности, с помощью так называемых граничных поверхностей, т.е. пространственных фигур, внутри которых вероятность нахождения электрона составляет 95 %. Решение уравнения Шредингера определяется набором четырех чисел, получивших название квантовых чисел.
Слайд 50: Орбитали
s - подоболочка названа по «резкой» s - линии – sharp; p - по «главной» p - линии – principal; d - по «диффузной» d - линии – diffuse; f - по «фундаментальной» f -линии – fundamental Экспериментально было установлено, что s - линия не расщепляется р - линия расщепляется на 3 d - линия – на 5 f - линия – на 7 если атомы элементов помещены во внешнее магнитное поле
Слайд 51: Кольцегранная модель атома Снельсена
В кольцегранных моделях пары электронов с различными знаками спин обозначаются парами колец, располагаемыми симметрично, относительно ядра атома. Разные цвета колец обозначают различную ориентацию электронов (их вектора спин) относительно ядра молекула С H 3 OH
Слайд 52
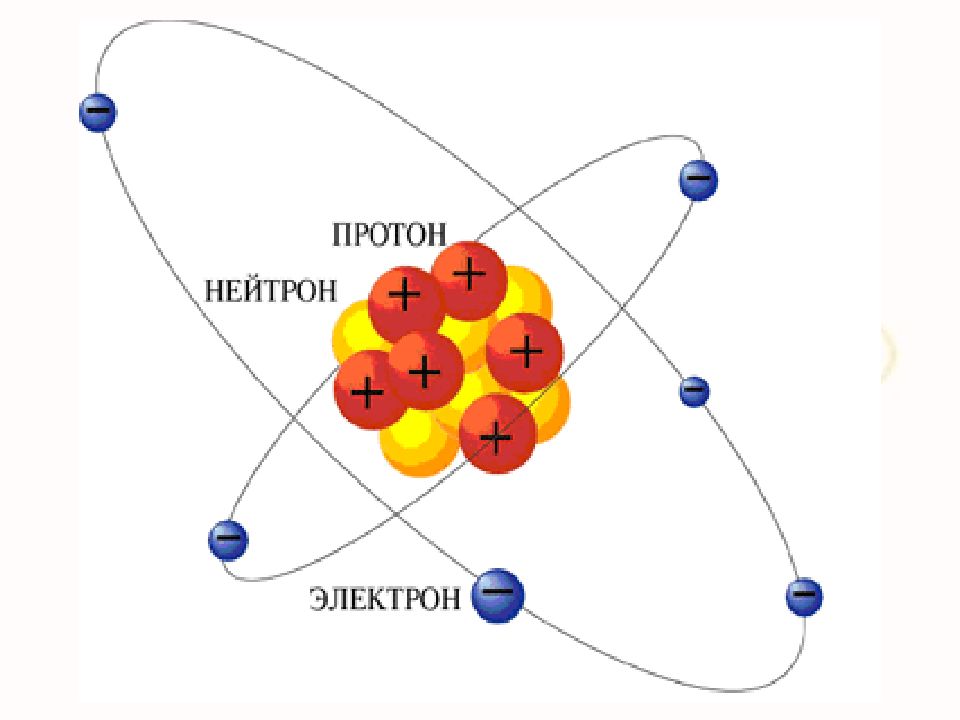
Выводы: В центре атома находится положительно заряженное ядро, вокруг которого вращаются по определенным орбитам электроны Основная масса атома сосредоточена в ядре m ядра = 99,4 % массы атома D атома = 10 -10 м D ядра ~ 10 -14 – 10 -15 м Атом электрически нейтрален – абсолютное значение суммарного отрицательного заряда электронов равно положительному значению заряда ядра. Сумму количества протонов (Z) и числа нейтронов (N) в ядре называют массовым числом A A = Z + N Планетарная модель атома
Слайд 53
Радиоактивность - явление самопроизвольного превращения неустойчивых ядер в устойчивые, сопровождающееся испусканием частиц и излучением энергии. Открытие - 1896 год
Слайд 54: ОТКРЫТИЕ РАДИОАКТИВНОСТИ
Беккерель обнаружил, что излучение урановых солей ионизирует воздух, подобно рентгеновским лучам, и разряжает электроскоп. Испробовав различные химические соединения урана, он установил очень важный факт: интенсивность излучения определяется только количеством урана в препарате и совершенно не зависит от того, в какие соединения он входит. Следовательно, это свойство присуще не соединениям, а химическому элементу урану, его атомам.
Слайд 55
Через два года Пьер Кюри и Мария Склодовская-Кюри открыли радиоактивность тория и выделили из солей урана полоний и радий, радиоактивность которых оказалась в миллионы раз сильнее радиоактивности урана.
Слайд 56: ОТКРЫТИЕ РАДИОАКТИВНОСТИ
Радий имеет относительную атомную массу, равную 226, и занимает в таблице Д. И. Менделеева клетку под номером 88. До открытия Кюри эта клетка пустовала. По своим химическим свойствам радий принадлежит к щелочно-земельным элементам.
Слайд 57: Полоний
Поло́ний (лат. Polonium ; обозначается символом Po ) — химический элемент с атомным номером 84 в периодической системе, радиоактивный полуметалл серебристо-белого цвета. Не имеет стабильных изотопов.
Слайд 58: Радий
Ра́дий — элемент главной подгруппы второй группы, седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 88. Обозначается символом Ra (лат. Radium ). Простое вещество радий (CAS-номер: 7440-14-4) — блестящий щёлочноземельный металл серебристо-белого цвета, быстро тускнеющий на воздухе. Обладает высокой химической активностью. Радиоактивен; наиболее устойчив нуклид 226 Ra (период полураспада около 1600 лет).
Слайд 59
Впоследствии было установлено, что все химические элементы с порядковым номером более 83 являются радиоактивными.
Слайд 60: Виды радиоактивных излучений
Естественная радиоактивность; Искусственная радиоактивность. Свойства радиоактивных излучений Ионизируют воздух; Действуют на фотопластинку; Вызывают свечение некоторых веществ; Проникают через тонкие металлические пластинки; Интенсивность излучения пропорциональна концентрации вещества; Интенсивность излучения не зависит от внешних факторов (давление, температура, освещенность, электрические разряды).
Слайд 61
Альфа-излучение представляет собой поток альфа-частиц, распространяющихся с начальной скоростью около 20 тыс. км/с. Лист плотной бумаги полностью задерживает их. Надежной защитой от альфа-частиц является также одежда человека. Поскольку альфа-излучение имеет наибольшую ионизирующую, но наименьшую проникающую способность, внешнее облучение альфа-частицами практически безвредно, но попадание их внутрь организма весьма опасно. Бета-излучение — поток бета-частиц, которые в зависимости от энергии излучения могут распространяться со скоростью, близкой к скорости света (300 тыс. км/с). На практике бета-частицы почти полностью поглощают оконные или автомобильные стекла и металлические экраны толщиной в несколько миллиметров. Одежда поглощает до 50 % бета-частиц.. Поэтому внешнее бета-облучение представляет серьезную опасность лишь при попадании радиоактивных веществ непосредственно на кожу (особенно на глаза) или же внутрь организма. Так, после Чернобыльской аварии наблюдались бета-ожоги ног за 50—100 км от АЭС.
Слайд 62
Гамма-излучение — это электромагнитное излучение, испускаемое ядрами атомов при радиоактивных превращениях. Оно, как правило, сопровождает бета-распад, реже альфа-распад. Оно испускается отдельными порциями (квантами) и распространяется со скоростью света. Гамма-излучение имеет наибольшую проникающую способность и в воздухе может распространяться на сотни метров. Для ослабления его энергии в два раза необходим слой вещества (слой половинного ослабления) толщиной: воды — 23 см, стали — около 3, бетона — 10, дерева — 30 см. Из-за наибольшей проникающей способности гамма-излучение является важнейшим фактором поражающего действия радиоактивных излучений при внешнем облучении. Хорошей защитой от гамма-излучений являются тяжелые металлы, например свинец, который для этих целей используется наиболее часто.
Слайд 63: Радиоактивные превращения
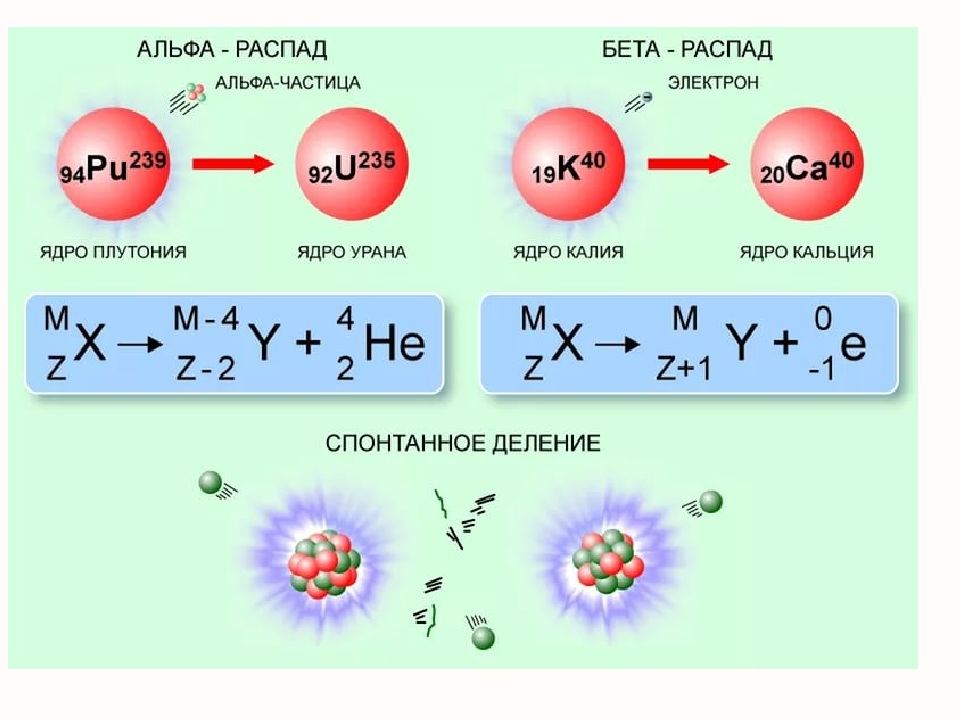
1) α -распад. α -частица – ядро атома гелия 2 4 Не. Правило смещения : Элемент смещается на две клетки к началу периодической системы. Ядро теряет положительный заряд 2е и масса его убывает на 4 а.е.м.. 2) β -распад. β -лучи – поток электронов; нейтрон распадается на протон, электрон, антинейтрино. Правило смещения : элемент смещается на одну клетку ближе к концу периодической системы. Ядро теряет электрон. Заряд ядра увеличивается на 1е, масса почти не изменяется. 3) γ -лучи. Электромагнитные волны.
Слайд 65: Закон сохранения массового числа и заряда
Сумма массовых чисел до распада, равна сумме массовых чисел после распада. Сумма зарядов до распада равна сумме зарядов после распада.
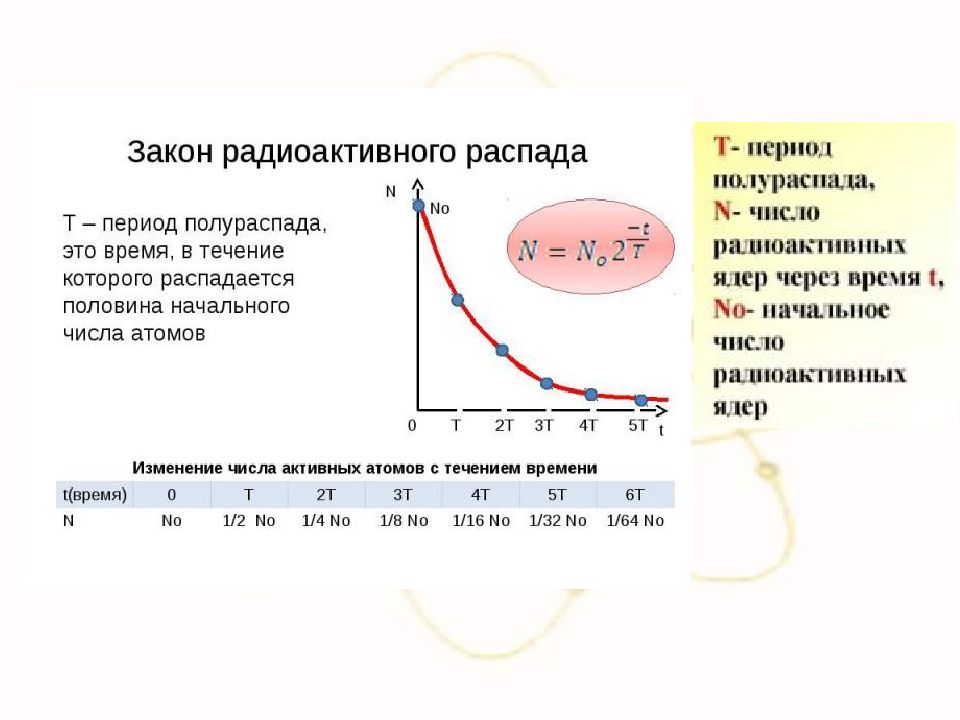
Слайд 66: Закон радиоактивного распада
1) Период полураспада – промежуток времени, в течение которого распадается половина начального числа атомов. 2) Закон радиоактивного распада N(t) = N 0 2 -t / T
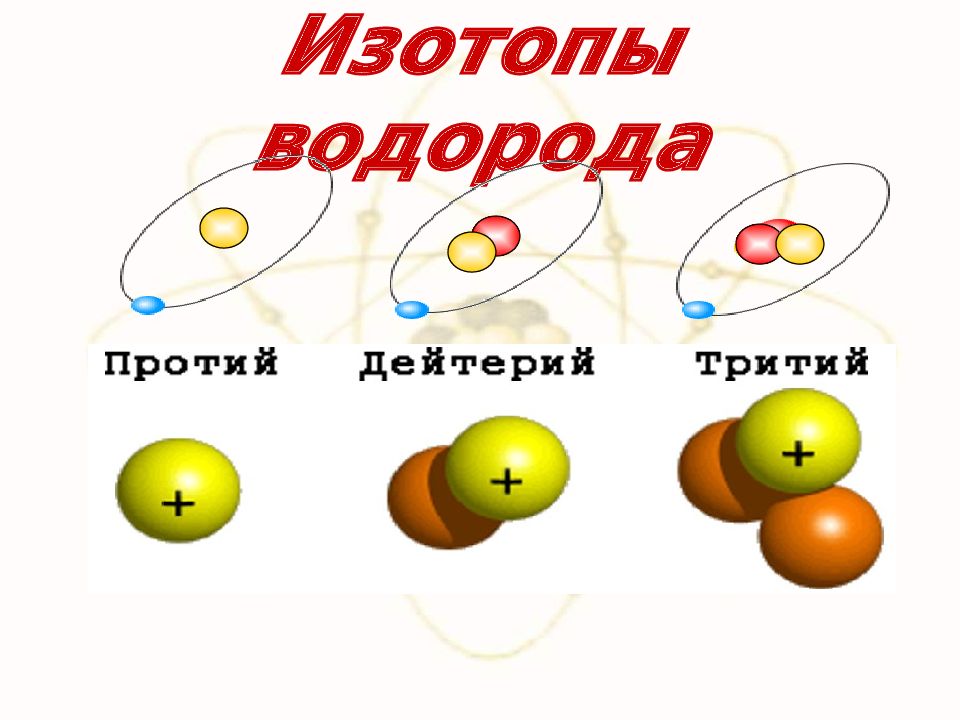
Слайд 68: Изотопы
1911 год, Ф.Содди Существуют ядра одного и того же химического элемента с одинаковым числом протонов, но различным числом нейтронов – изотопы. Изотопы имеют одинаковые химические свойства (обусловлены зарядом ядра), но разные физические свойства (обусловлено массой).
Слайд 71: Свойства ядерных сил
Сил, действующие между нуклонами в ядре. 1) очень велики; 2) короткодействующие (имеют малый радиус действия – порядка 10 -14 – 10 -15 м; 3) обладают зарядовой независимостью.
Слайд 72
Удивительным было постоянство, с которым радиоактивные элементы уран, торий и радий испускают излучения. На протяжении суток, месяцев и даже лет интенсивность излучения заметно не изменялась. На нее не оказывали никакого влияния такие обычные воздействия, как нагревание и увеличение давления. Химические реакции, в которые вступали радиоактивные вещества, также не влияли на интенсивность излучения.
Слайд 73
Для разных веществ период полураспада имеет сильно различающиеся значения. Так, период полураспада урана U равен 4,5 млрд лет. Именно поэтому активность урана на протяжении нескольких лет заметно не меняется. Период полураспада радия значительно меньше — он равен 1600 лет. Поэтому активность радия значительно больше активности урана. Есть радиоактивные элементы с периодом полураспада в миллионные доли секунды.
Слайд 74
После открытия радиоактивности выяснилось, что радиоактивность сопровождается выделением энергии. Пьер Кюри поместил ампулу с хлоридом радия в калориметр. В нем поглощались а-, b - и у-лучи, и за счет их энергии калориметр нагревался. Кюри определил, что радий массой 1 г выделяет за 1 ч энергию, примерно равную 582 Дж. И такая энергия выделяется непрерывно на протяжении многих лет!
Слайд 75
Атомные ядра при взаимодействиях испытывают превращения. Эти превращения сопровождаются увеличением или уменьшением кинетической энергии участвующих в них частиц.
Слайд 76
Энергетическим выходом ядерной реакции называется разность энергий покоя ядер и частиц до реакции и после реакции. Согласно вышесказанному энергетический выход ядерной реакции равен также изменению кинетической энергии частиц, участвующих в реакции.
Слайд 77
Открытие нейтрона в 1932 году (Джеймс Чедвик) можно считать началом современной ядерной физики.
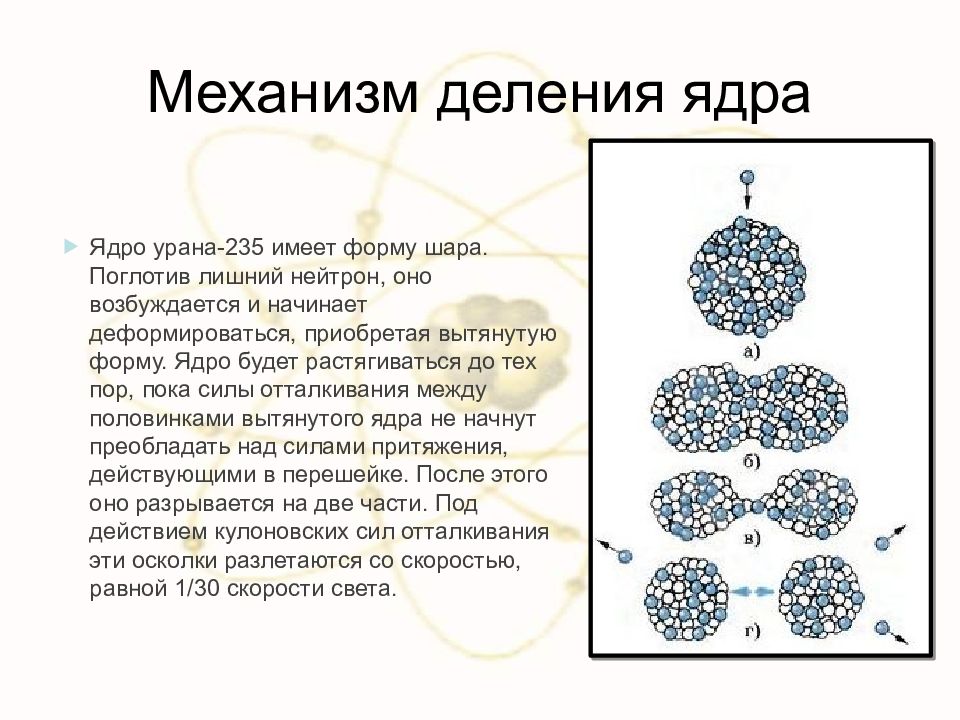
Слайд 78: Механизм деления ядра
Ядро урана-235 имеет форму шара. Поглотив лишний нейтрон, оно возбуждается и начинает деформироваться, приобретая вытянутую форму. Ядро будет растягиваться до тех пор, пока силы отталкивания между половинками вытянутого ядра не начнут преобладать над силами притяжения, действующими в перешейке. После этого оно разрывается на две части. Под действием кулоновских сил отталкивания эти осколки разлетаются со скоростью, равной 1/30 скорости света.
Слайд 79
Фундаментальный факт ядерного деления — испускание в процессе деления двух-трех нейтронов. Именно благодаря этому оказалось возможным практическое использование внутриядерной энергии.
Слайд 80
Ядерная энергия ( атомная энергия ) — энергия, содержащаяся в атомных ядрах и выделяемая при ядерных реакциях и радиоактивном распаде.
Слайд 81: ПРИМЕНЕНИЕ ЯДЕРНОЙ ЭНЕРГИИ
Применение ядерной энергии для преобразования ее в электрическую впервые было осуществлено в нашей стране в 1954 г. В г. Обнинске была введена в действие первая атомная электростанция (АЭС) мощностью 5000 кВт. Энергия, выделяющаяся в ядерном реакторе, использовалась для превращения воды в пар, который вращал затем связанную с генератором турбину.
Слайд 83
Ядерные реакторы устанавливаются также на атомных подводных лодках и ледоколах
Слайд 84: ЯДЕРНОЕ ОРУЖИЕ
Неуправляемая цепная реакция с большим коэффициентом увеличения нейтронов осуществляется в атомной бомбе.
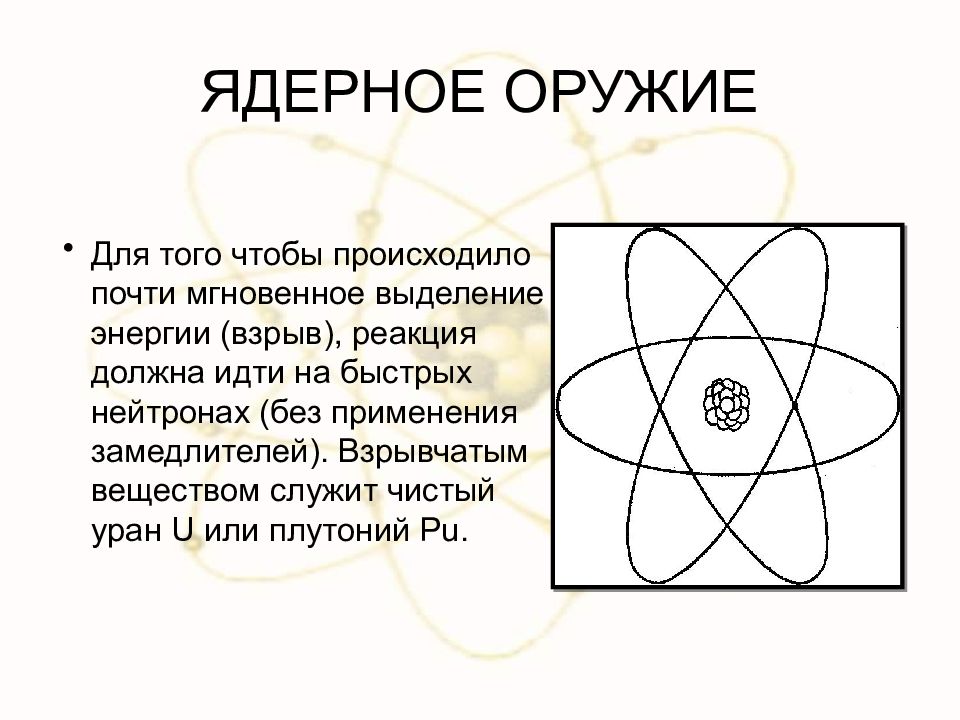
Слайд 85: ЯДЕРНОЕ ОРУЖИЕ
Для того чтобы происходило почти мгновенное выделение энергии (взрыв), реакция должна идти на быстрых нейтронах (без применения замедлителей). Взрывчатым веществом служит чистый уран U или плутоний Р u.
Слайд 86: ЯДЕРНОЕ ОРУЖИЕ
При взрыве атомной бомбы температура достигает десятков миллионов кельвин. При такой высокой температуре очень резко повышается давление и образуется мощная взрывная волна. Одновременно возникает мощное излучение. Продукты цепной реакции при взрыве атомной бомбы сильно радиоактивны и опасны для жизни живых организмов.
Слайд 87: ЯДЕРНОЕ ОРУЖИЕ
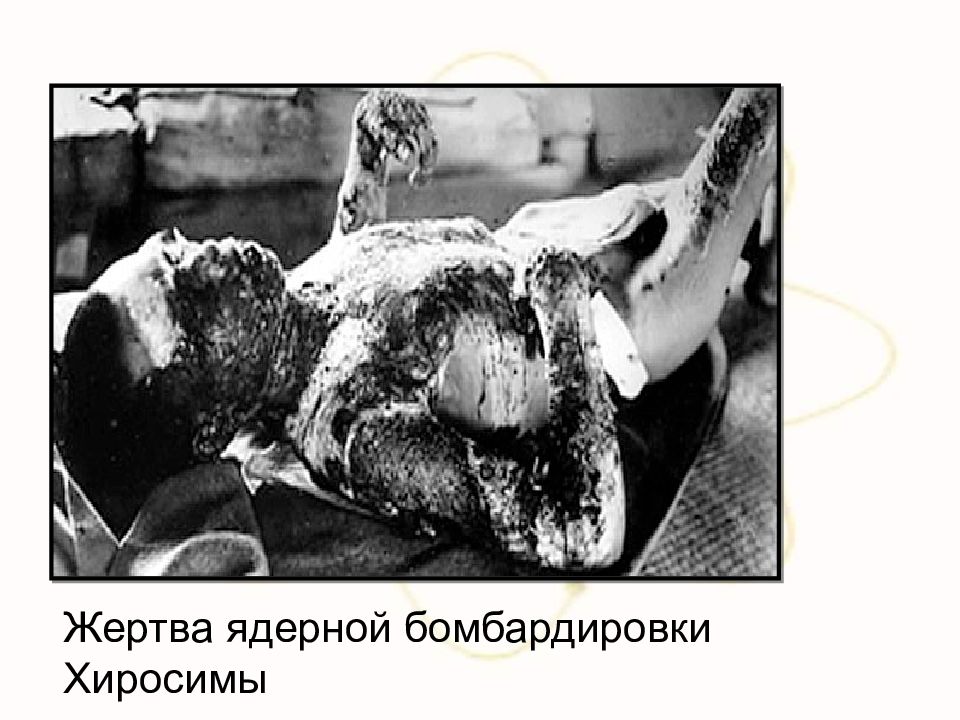
Атомные бомбы применили США в конце Второй мировой войны против Японии. В 1945 г. были сброшены атомные бомбы на японские города Хиросима и Нагасаки. Это был единственный случай в истории планеты, когда атомное оружие было целенаправленно использовано на уничтожение людей.
Слайд 89: БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ РАДИОАКТИВНЫХ ИЗЛУЧЕНИЙ
Излучения радиоактивных веществ оказывают очень сильное воздействие на все живые организмы. Даже сравнительно слабое излучение, которое при полном поглощении повышает температуру тела лишь на 0,001 °С, нарушает жизнедеятельность клеток.
Слайд 90: БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ РАДИОАКТИВНЫХ ИЗЛУЧЕНИЙ
При большой интенсивности излучения живые организмы погибают. Опасность излучений усугубляется тем, что они не вызывают никаких болевых ощущений даже при смертельных дозах.
Слайд 91: БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ РАДИОАКТИВНЫХ ИЗЛУЧЕНИЙ
Механизм биологического действия излучения, поражающего объекты, еще недостаточно изучен. Но ясно, что оно сводится к ионизации атомов и молекул и это приводит к изменению их химической активности. Наиболее чувствительны к излучениям ядра клеток, особенно клеток, которые быстро делятся. Поэтому в первую очередь излучения поражают костный мозг, из-за чего нарушается процесс образования крови. Далее наступает поражение клеток пищеварительного тракта и других органов.
Слайд 92: БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ РАДИОАКТИВНЫХ ИЗЛУЧЕНИЙ
Сильное влияние оказывает облучение на наследственность, поражая гены. В большинстве случаев это влияние является неблагоприятным.
Слайд 93: БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ РАДИОАКТИВНЫХ ИЗЛУЧЕНИЙ
Облучение живых организмов может оказывать и определенную пользу. Быстроразмножающиеся клетки в злокачественных (раковых) опухолях более чувствительны к облучению, чем нормальные. На этом основано подавление раковой опухоли у-лучами радиоактивных препаратов, которые для этой цели более эффективны, чем рентгеновские лучи.