Первый слайд презентации
Доклад на тему: Расстройства водного обмена. Отек. Нарушения КОС. Подготовил: студент 3 курса Факультета “ Лечебное дело ” Группы 03012215 Гребцов Андрей Александрович Преподаватель: ассистент кафедры патологии Виктория Игоревна Чепкая
Слайд 4
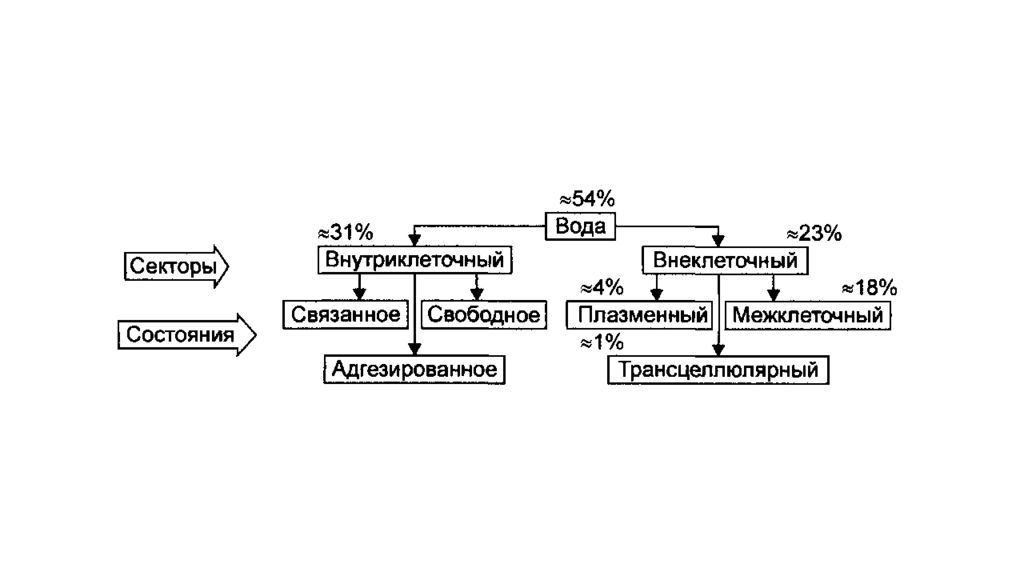
Осмотическая концентрация — суммарная концентрация всех растворённых частиц. Осмотическое давление – сила с которой растворитель переходит через полупроницаемую мембрану из менее концентрированного в более концентрированный раствор.
Слайд 5
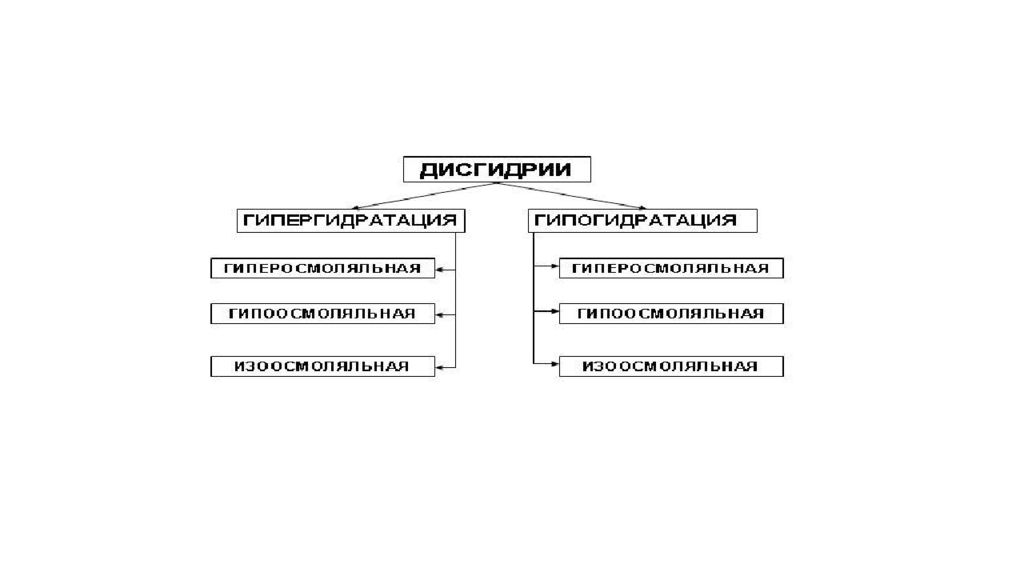
Гипогидратация. Для всех видов гипогидратации характерен отрицательный водный баланс: преобладание потерь воды над ее поступлением в организм. Причины гипогидратации : Недостаточность поступления воды в организм: Водное голодание Нервно-психические болезни Соматические болезни 2. Повышенная потеря воды: Полиурия ЖКК расстройства Массивная кровопотеря Продолжительное потоотделение Гипертермические состояния Патологические процессы с выделением большого количества жидкости
Слайд 6
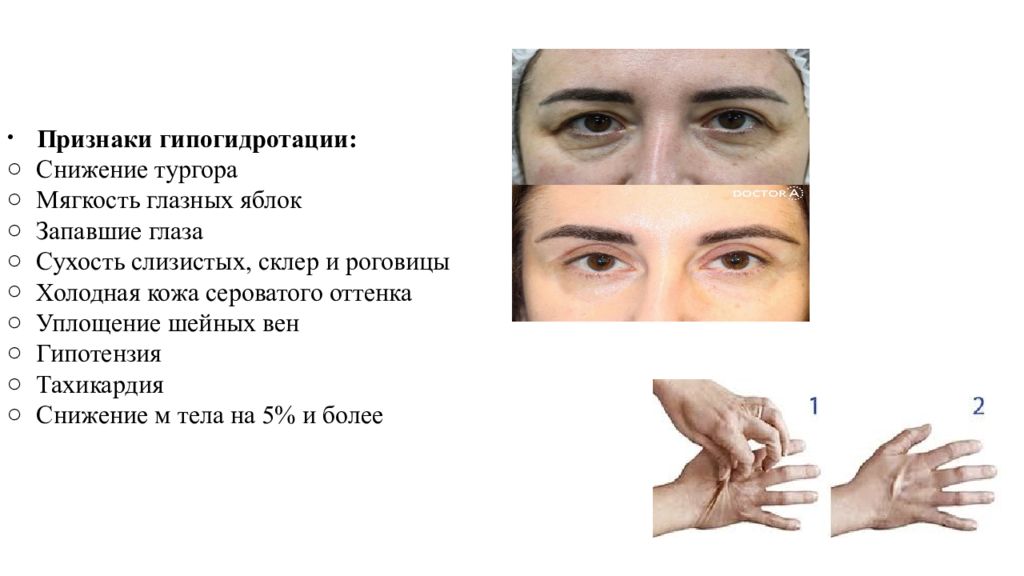
Признаки гипогидротации : Снижение тургора Мягкость глазных яблок Запавшие глаза Сухость слизистых, склер и роговицы Холодная кожа сероватого оттенка Уплощение шейных вен Гипотензия Тахикардия Снижение м тела на 5% и более
Слайд 7
Гипоосмоляльная гипогидратация : При гипоосмоляльной гипогидратации преобладают потери организмом солей по сравнению с потерями воды и снижением осмоляльности внеклеточной жидкости. При этом количество внутриклеточной жидкости увеличивается. Причины гипоосмоляльной гипогидратации : Гипоальдостеронизм Продолжительное потоотделение с выделением большого числа ионов Неукратимая рвота Полиурия Профузные поносы Неправильный диализ
Слайд 8
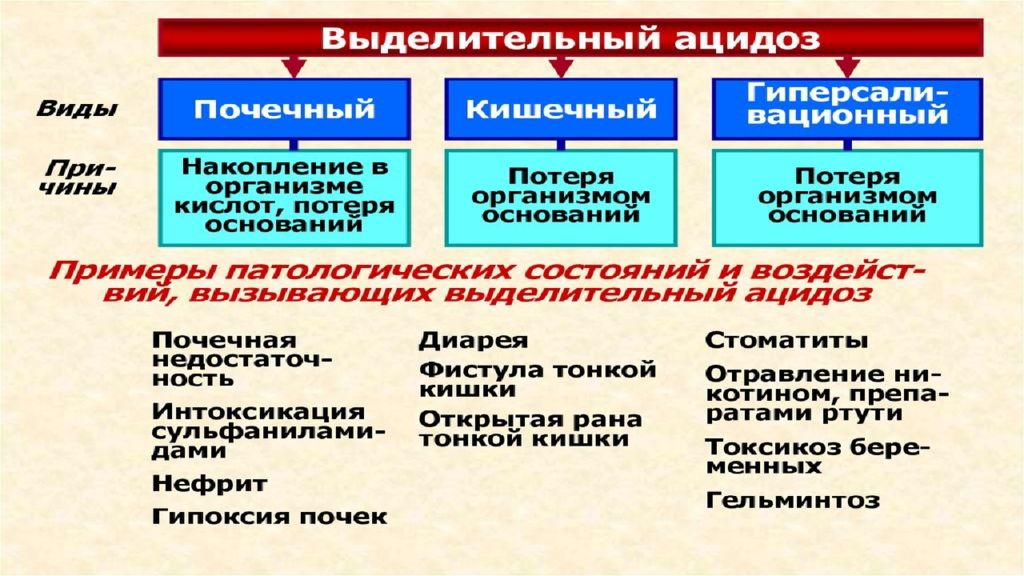
Последствия: уменьшение ОЦК; увеличение вязкости крови в связи с уменьшением объема ее плазмы и повышением гематокрита (Н t ); расстройства центральной, органотканевой и микрогемоциркуляци ; расстройства КОС (развитие негазового выделительного алкалоза при рвоте желудочным содержимым или негазового выделительного ацидоза при поносах); гипоксия, вызываемая нарушением кровообращения (циркуляторная), потерей крови ( гемическая ), расстройством перфузии легких (респираторная), обмена веществ в тканях (тканевая); сухость слизистых оболочек и кожи, снижение секреции слюны ( гипосаливация ), уменьшение эластичности и напряжения (тургора) кожи, мышц, западение и мягкость глазных яблок, снижение объема суточной мочи.
Слайд 9
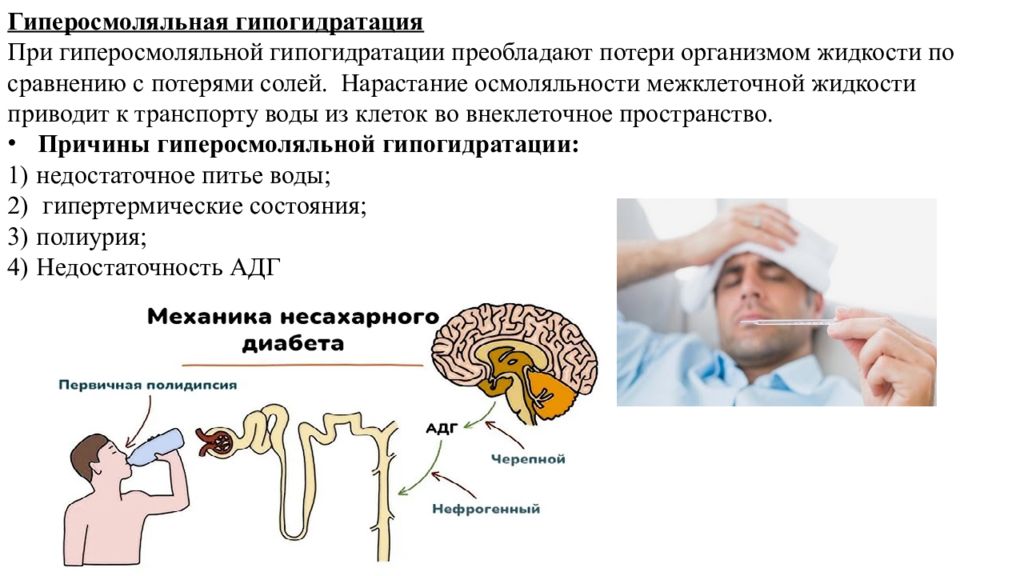
Гиперосмоляльная гипогидратация При гиперосмоляльной гипогидратации преобладают потери организмом жидкости по сравнению с потерями солей. Нарастание осмоляльности межклеточной жидкости приводит к транспорту воды из клеток во внеклеточное пространство. Причины гиперосмоляльной гипогидратации : недостаточное питье воды; гипертермические состояния; полиурия; Недостаточность АДГ
Слайд 10
Последствия: уменьшение ОЦК; увеличение вязкости крови в связи с уменьшением объема ее плазмы и повышением гематокрита (Н t ); расстройства кровообращения нервно-психические нарушения мучительная жажда
Слайд 11
Изоосмоляльная гипогидратация При изоосмоляльной гипогидратации происходит примерно эквивалентное уменьшение содержания в организме и воды, и солей. Причины изоосмоляльной гипогидротации : острая массивная кровопотеря; обильная повторная рвота; профузный понос; ожоги большой площади; Полиурия (диуретики)
Слайд 12
Последствия изоосмоляльной гипогидратации : уменьшение ОЦК; повышение вязкости крови; нарушение центральной, органотканевой и микрогемоциркуляции ; расстройства КОС (например, ацидоз при профузных поносах и острой кровопотере. алкалоз при повторной рвоте); гипоксия (особенно после массивной кровопотери).
Слайд 13
Гипергидратация. Для гипергидратации характерен положительный водный баланс. Гипоосмоляльная гипергидратация Гипоосмоляльная гипергидратация характеризуется избытком в организме внеклеточной жидкости со сниженной осмоляльностью. Для гипоосмоляльной гипергидратации характерно увеличение объема жидкости как во вне-, так и во внутриклеточном секторах, так как избыток внеклеточной жидкости по градиенту осмотического и онкотического давления поступает в клетки. Причины гипергидратации : избыточное введение в организм жидкостей с пониженным содержанием в них солей или их отсутствием. повышенное содержание в крови АДГ; почечная недостаточность; тяжелая СН НК
Слайд 14
Последствия гипоосмоляльной гипергидратации : увеличение ОЦК; полиурия гемолиз эритроцитов появление в плазме внутриклеточных структур рвота или диарея психоневрологические нарушения гипоосмоляльный синдром
Слайд 15
Гиперосмоляльная гипергидратация. Характеризуется повышенной осмоляльностью внеклеточной жидкости, превышающей таковую в клетках. Причины гиперосмоляльной гипергидратации : вынужденное питье морской воды; введение в организм растворов с повышенным содержанием солей; гиперальдостеронизм ; почечная недостаточность Последствия: Увеличение ОЦК, УО, АД, МОК, ВД Отек мозга Отек легких СН Гипоксия Нервно-психические нарушения Сильная жажда Гиперосмоляльный синдром
Слайд 16
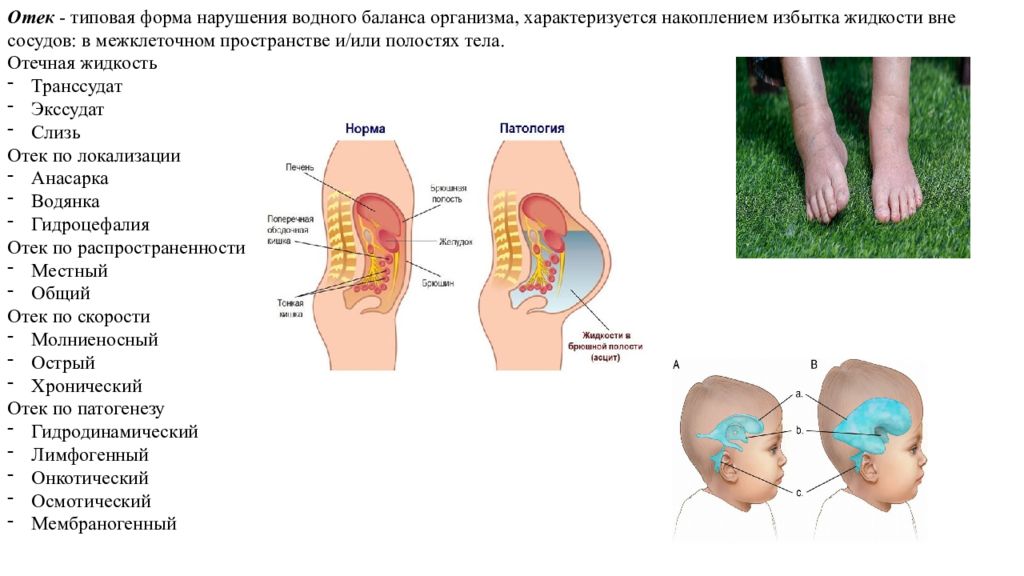
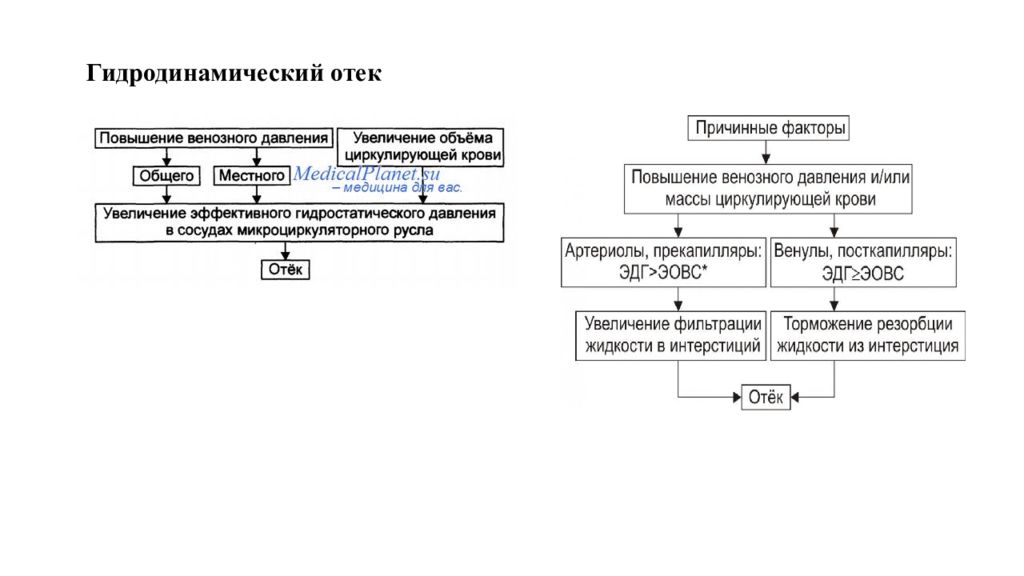
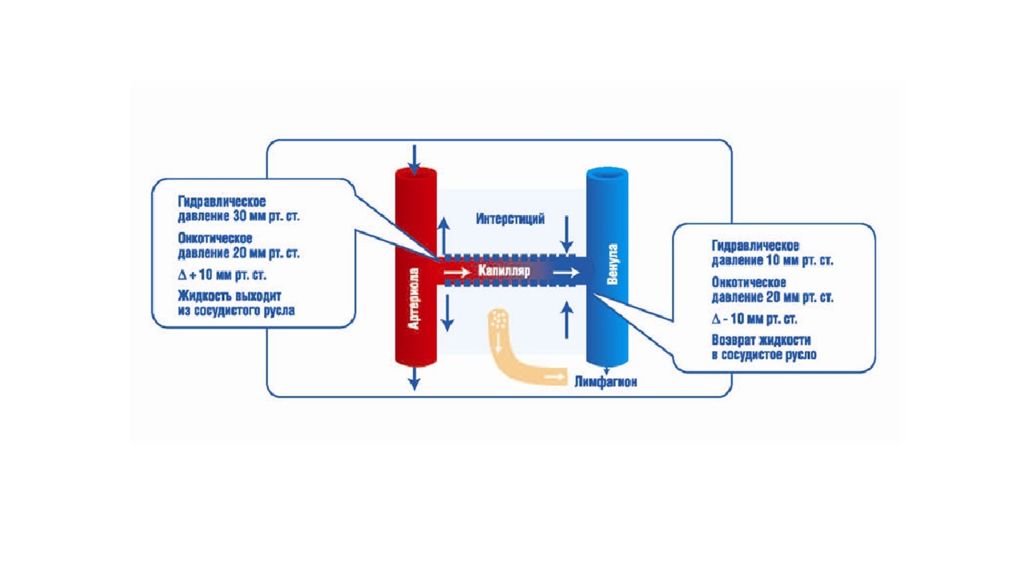
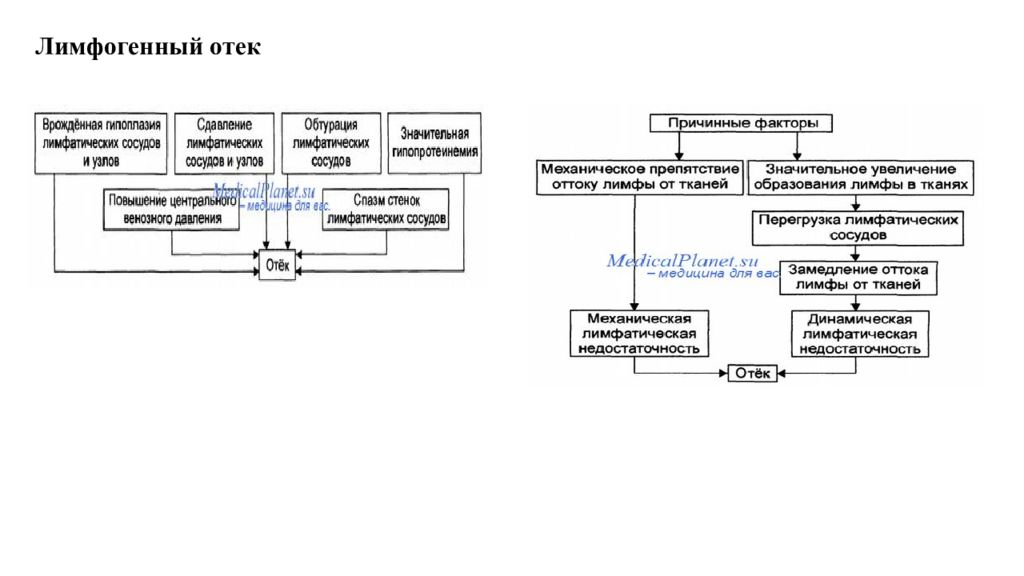
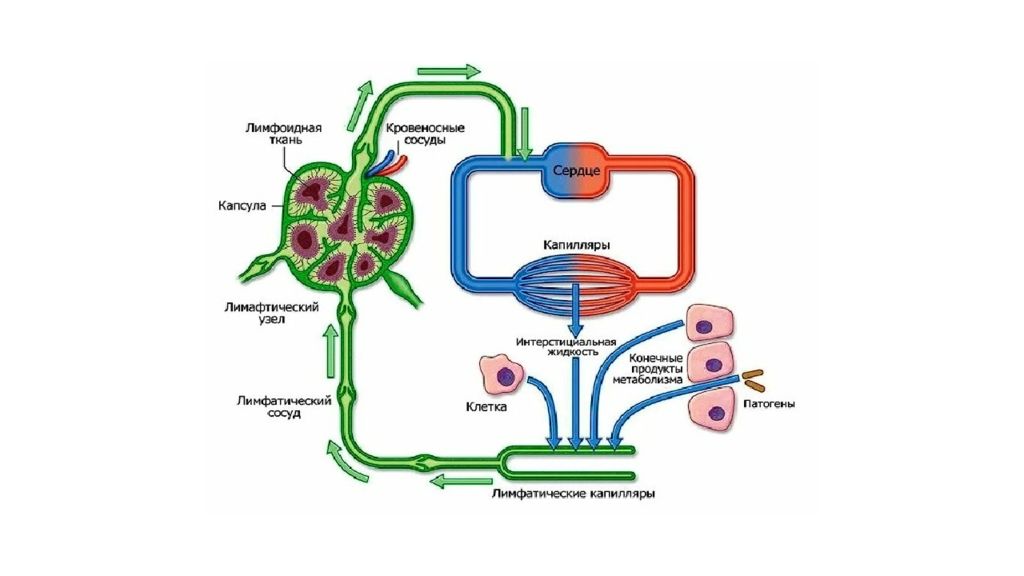
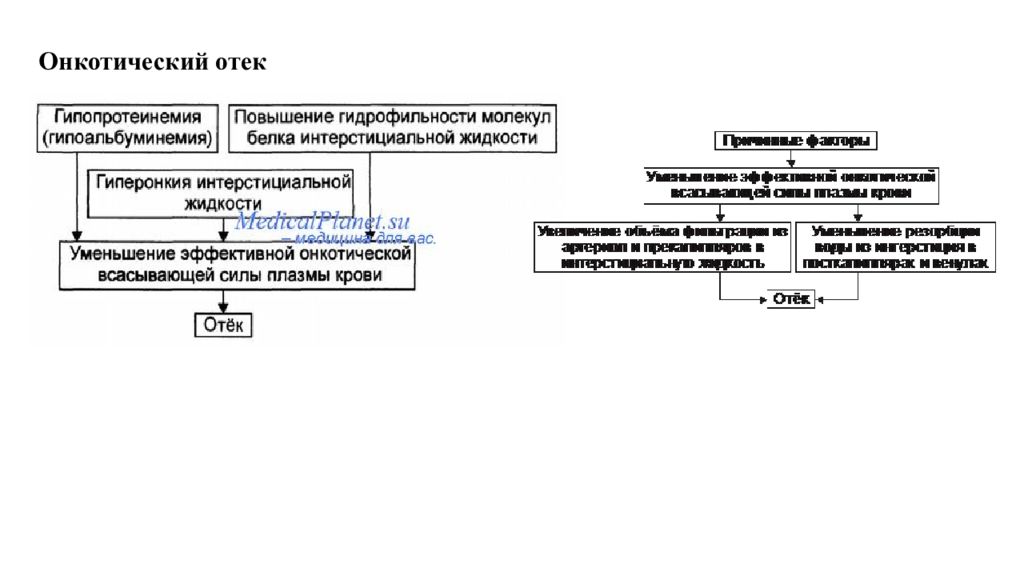
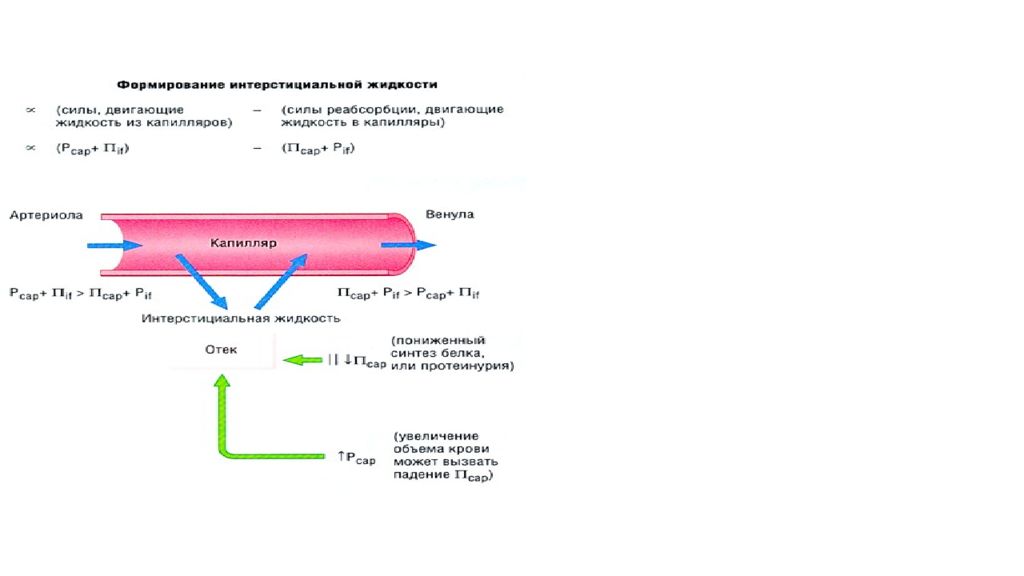
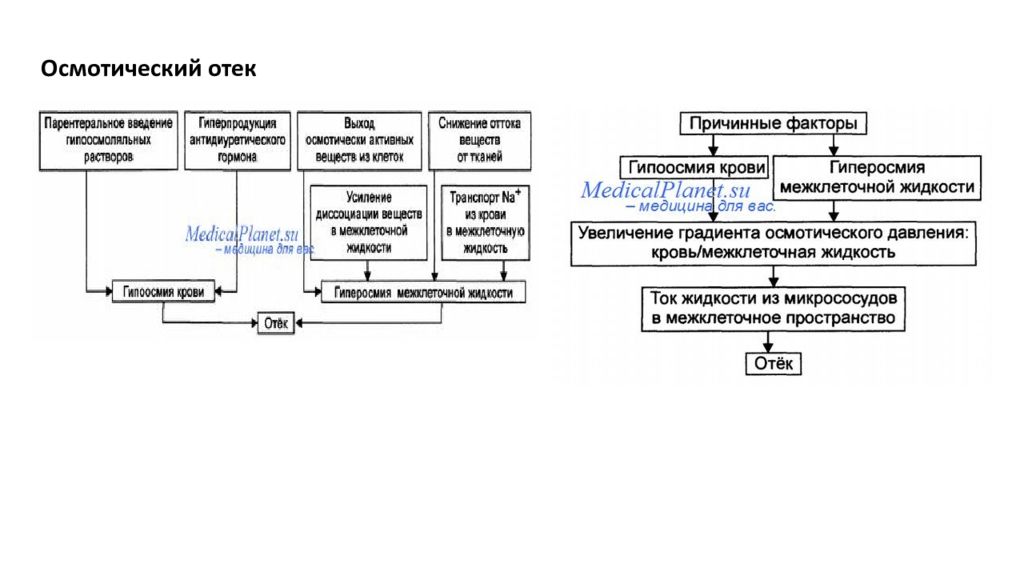
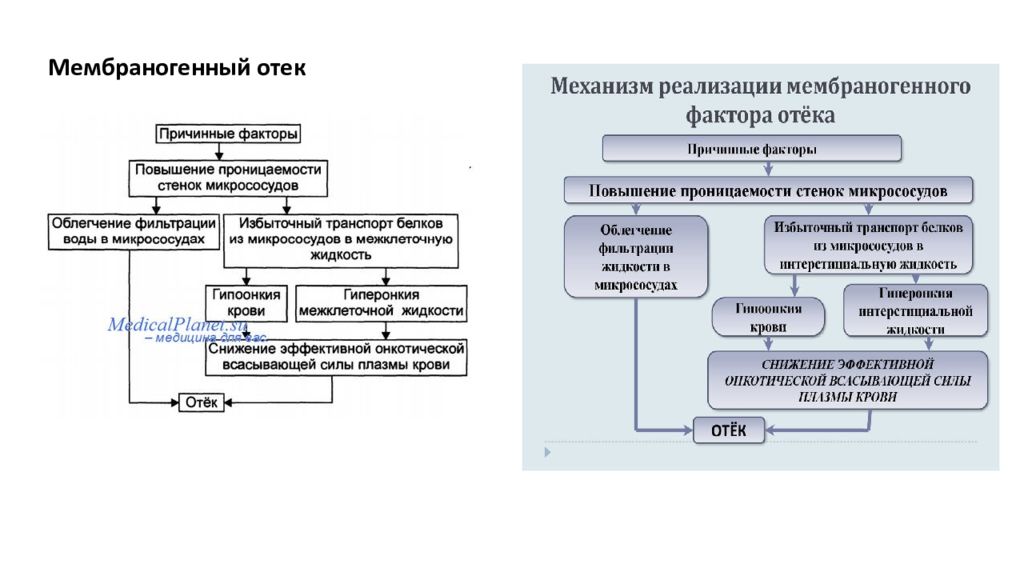
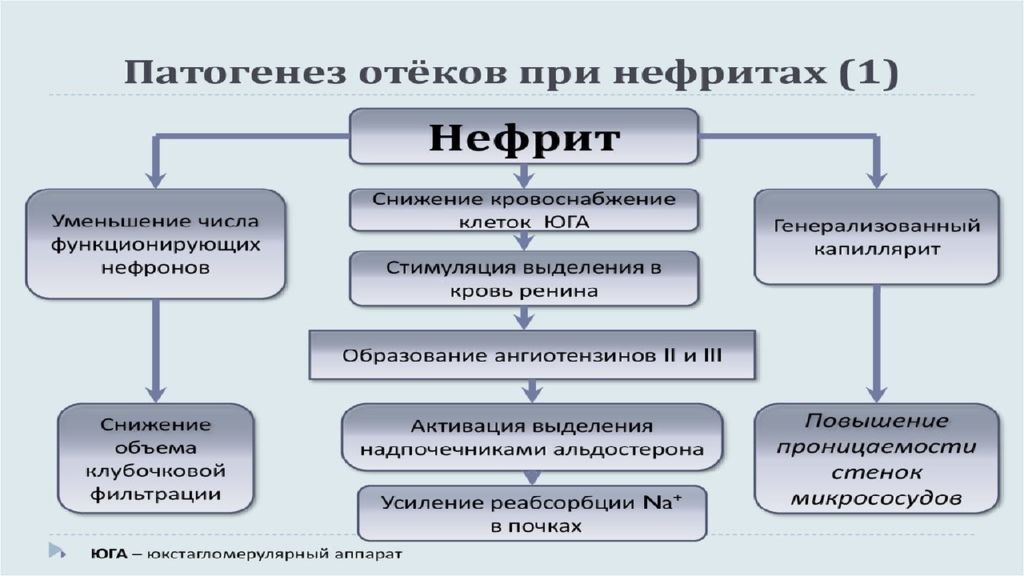
Отек - типовая форма нарушения водного баланса организма, характеризуется накоплением избытка жидкости вне сосудов: в межклеточном пространстве и/или полостях тела. Отечная жидкость Транссудат Экссудат Слизь Отек по локализации Анасарка Водянка Гидроцефалия Отек по распространенности Местный Общий Отек по скорости Молниеносный Острый Хронический Отек по патогенезу Гидродинамический Лимфогенный Онкотический Осмотический Мембраногенный
Слайд 25
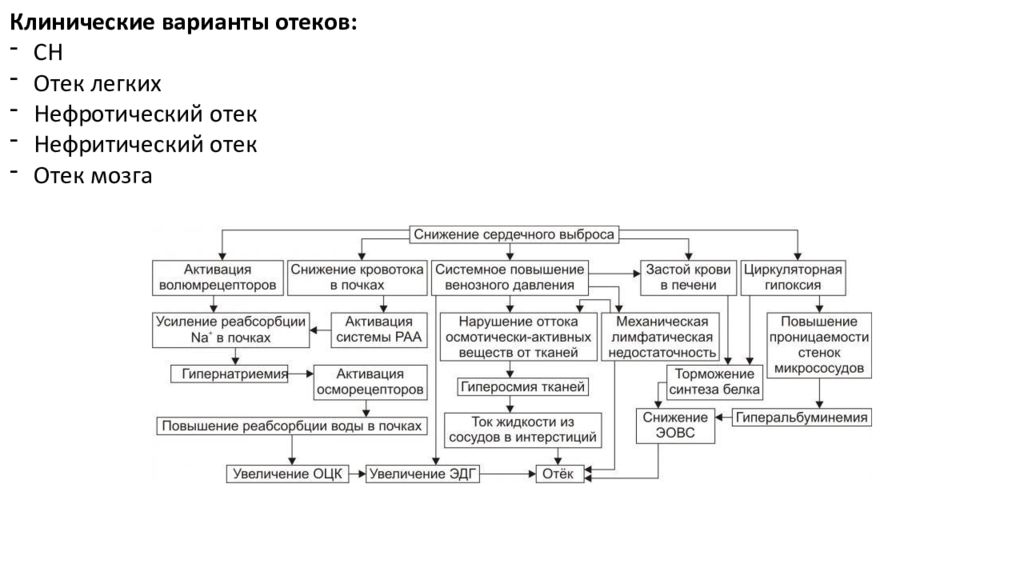
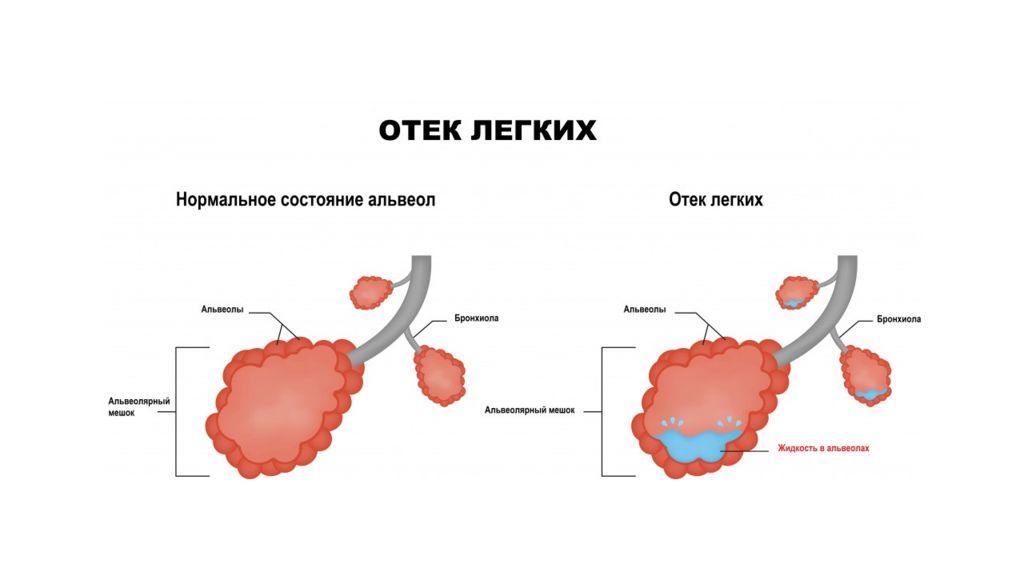
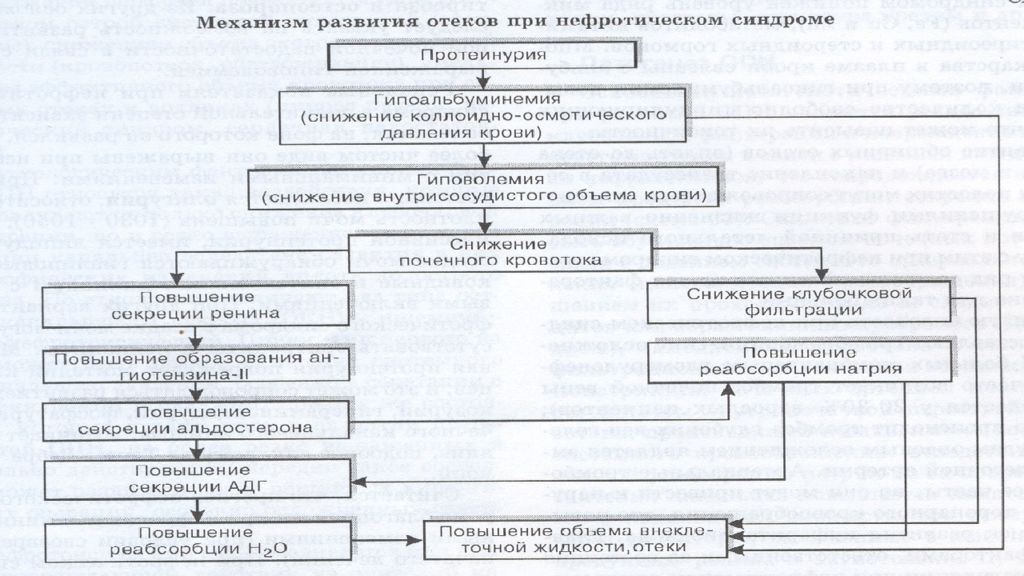
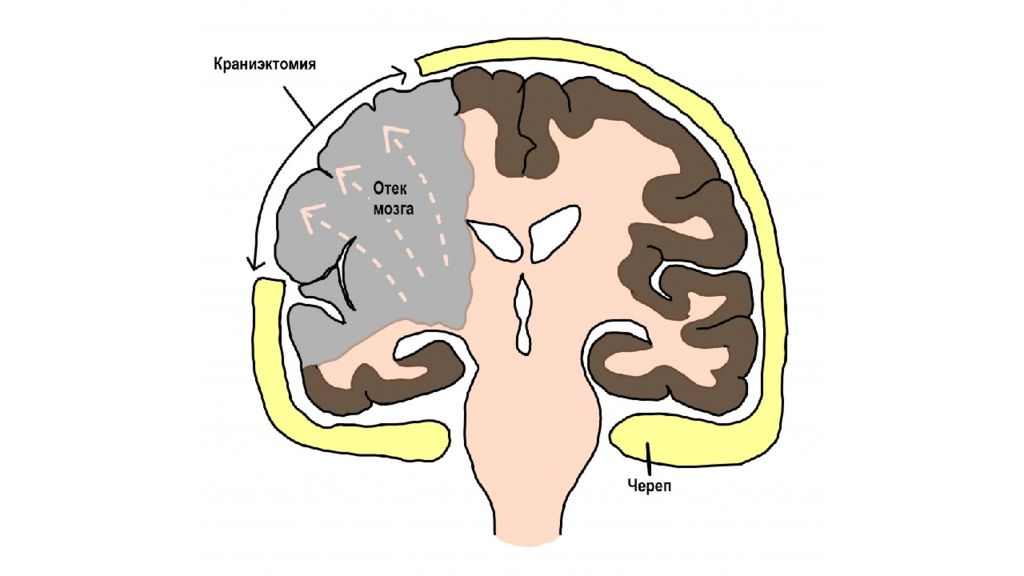
Клинические варианты отеков: СН Отек легких Нефротический отек Нефритический отек Отек мозга
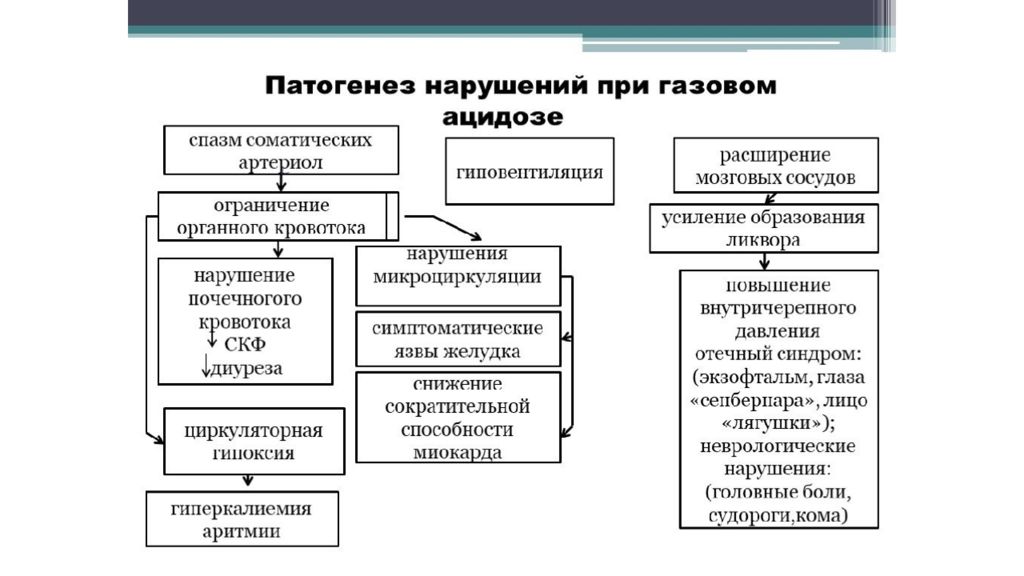
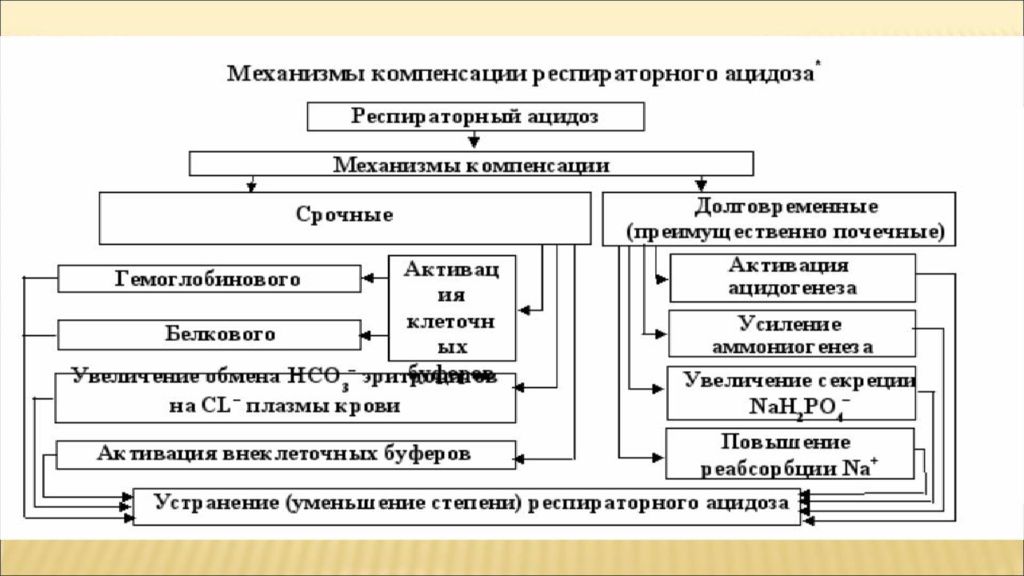
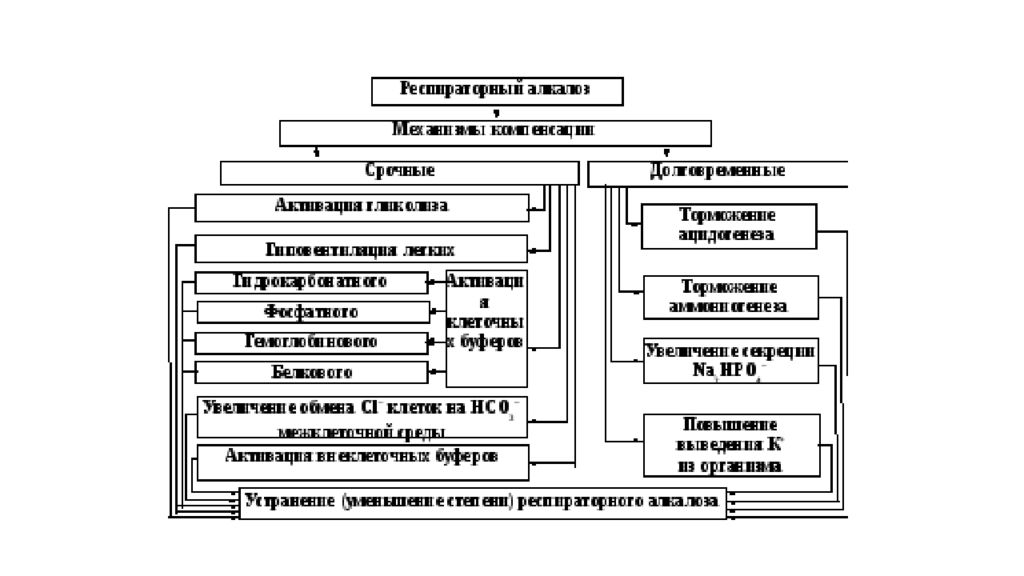
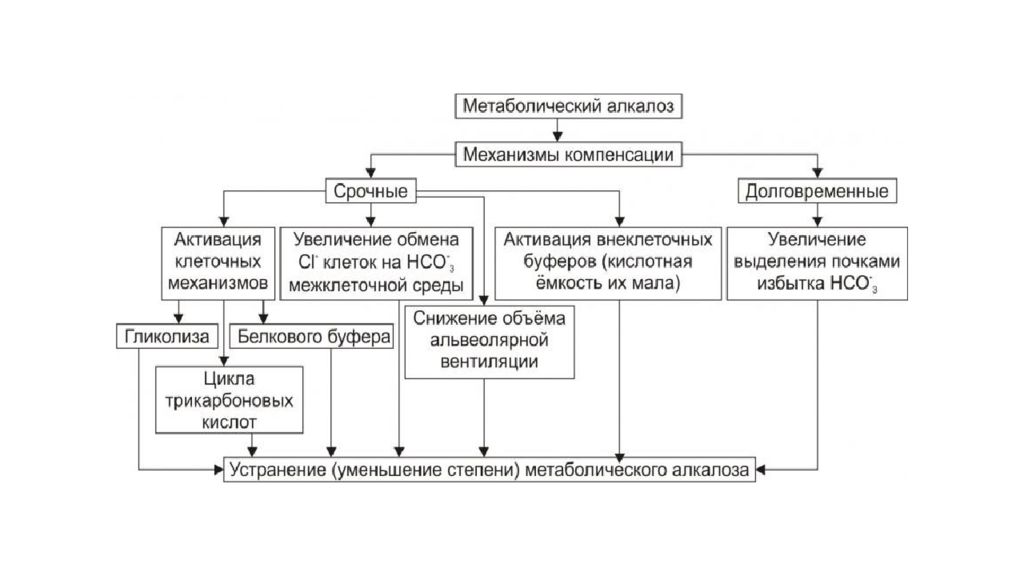
Слайд 30: Нарушения КОС
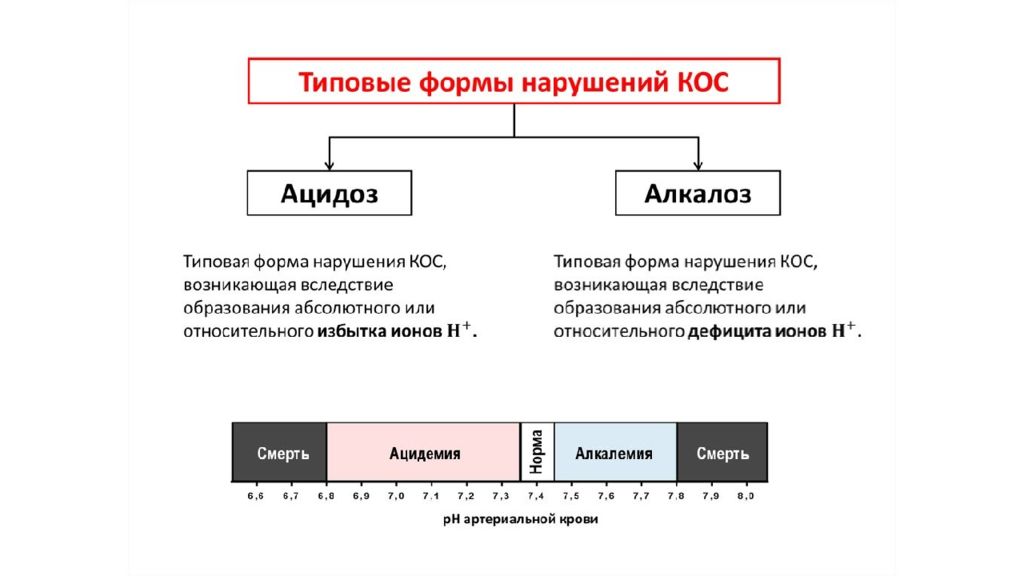
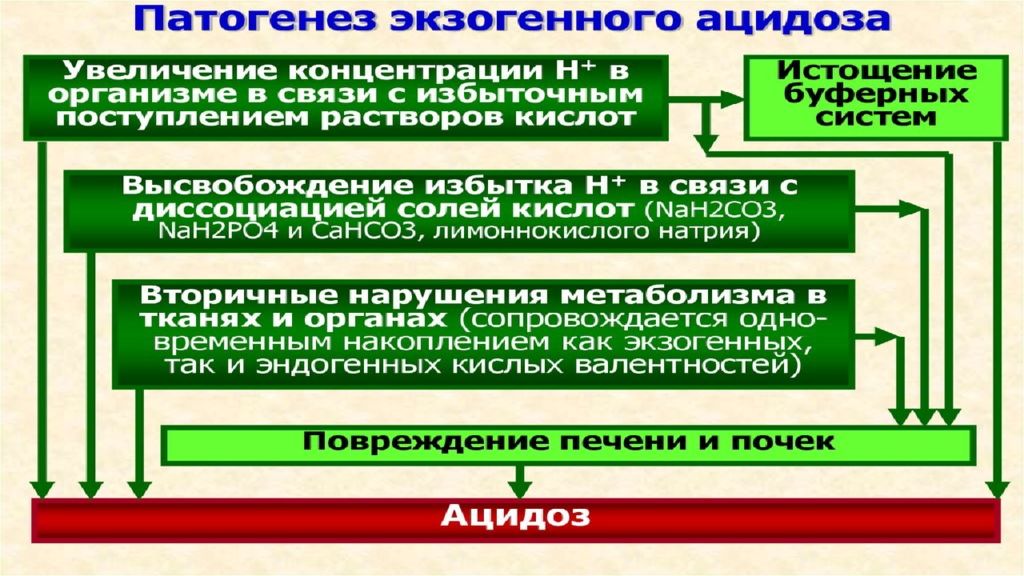
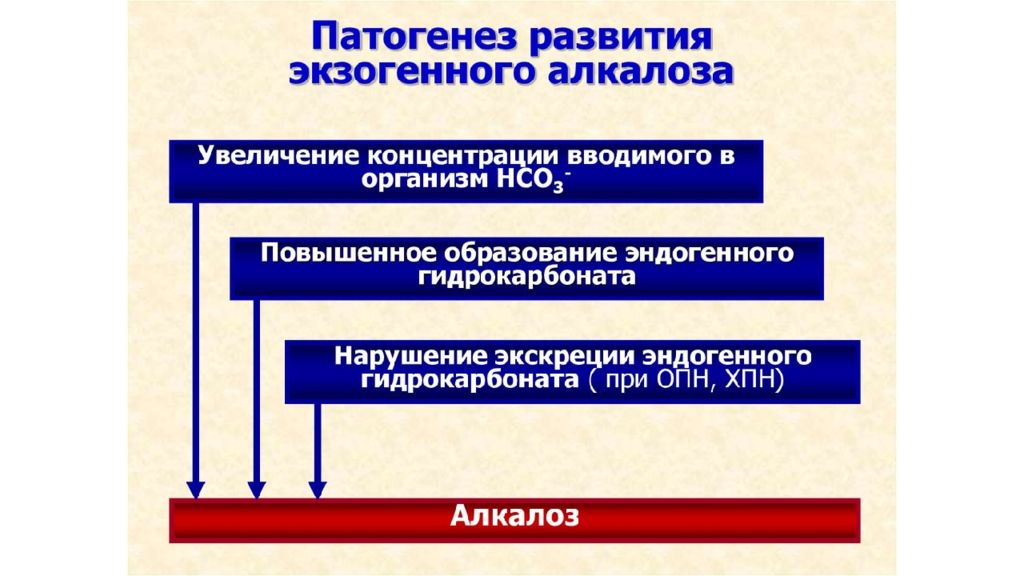
Концентрация ионов водорода pH в клетках и биологических жидкостях — один из важных параметров обеспечения гомеостаза/ гомеокинеза организма. pH существенно влияет практически на все жизненно важные функции (например, на кинетику ферментативных реакций, физико-химическое и структурное состояние мембран, конформацию макромолекул, сродство НЬ к кислороду, чувствительность рецепторов к БАВ, интенсивность генерации активных форм кислорода и липопероксидных процессов, возбудимость и проводимость нервных структур). Отклонения pH от оптимального диапазона приводят к нарушениям метаболизма, жизнедеятельности клеток (вплоть до их гибели), тканей, органов и организма в целом. Сдвиг показателя рН в диапазоне ±0,1 обусловливает расстройства дыхания и кровообращения; ±0,3 — потерю сознания, нарушения гемодинамики и вентиляции легких; в диапазоне ±0,4 и более чреват гибелью организма.
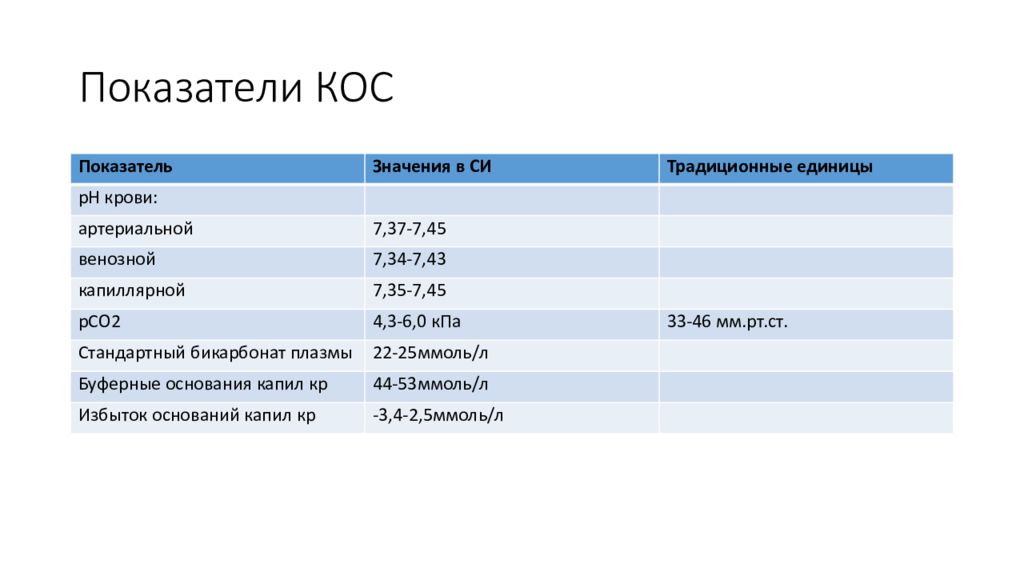
Слайд 31: Показатели КОС
Показатель Значения в СИ Традиционные единицы рН крови: артериальной 7,37-7,45 венозной 7,34-7,43 капиллярной 7,35-7,45 рСО2 4,3-6,0 кПа 33-46 мм.рт.ст. Стандартный бикарбонат плазмы 22-25ммоль/л Буферные основания капил кр 44-53ммоль/л Избыток оснований капил кр -3,4-2,5ммоль/л
Слайд 32: Буферные системы
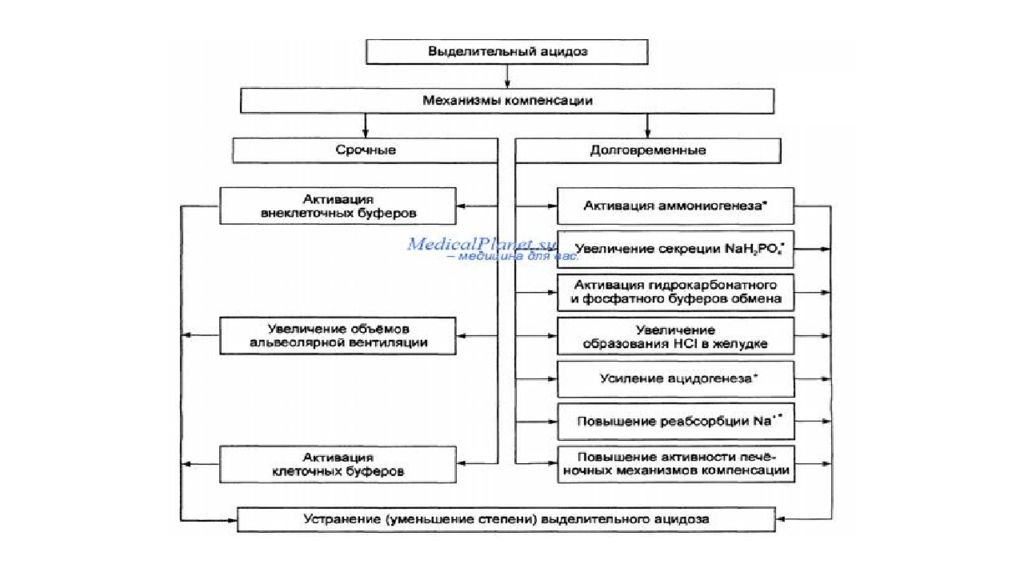
Химические буферные системы : Самой мощной является буферная система гемоглобина. На ее долю приходится 75% буферной емкости крови. Эта система включает восстановленный гемоглобин ( ННb ) и калиевую соль восстановленного гемоглобина ( КНb ). Буферные свойства системы обусловлены тем, что КНb как соль слабой кислоты отдает ион К + и присоединяет при этом ион Н + образуя слабодиссоциированную кислоту: Н+ + KHb = K+ + ННb. Величина рН крови, притекающей к тканям, благодаря восстановленному гемоглобину, способному связывать СО 2 и Н + -ионы, остается постоянной. В этих условиях ННb выполняет функции основания. В легких гемоглобин ведет себя как кислота (оксигемоглобин ННbО 2 является более сильной кислотой, чем СО 2 ), что предотвращает защелачивание крови. Карбонатная буферная система (H 2 CO 3 /NaHCO 3 ) пo своей мощности занимает второе место. Ее функции осуществляются следующим образом: NaHCO 3 диссоциирует на ионы Na + и НСО 3 -. Если в кровь поступает кислота более сильная, чем угольная, то происходит обмен ионами Na + с образованием слабодиссоциированной и легко растворимой угольной кислоты, что предотвращает повышение концентрации ионов Н + в крови. Увеличение же концентрации угольной кислоты приводит к ее распаду (это происходит под влиянием фермента карбоангидразы, находящегося в эритроцитах) на Н 2 O и СО 2. Последний поступает в легкие и выделяется в окружающую среду. Если в кровь поступает основание, то она реагирует с угольной кислотой, образуя натрия гидрокарбонат (NaHCO 3 ) и воду, что опять-таки препятствует сдвигу рН в щелочную сторону.
Слайд 33
Фосфатная буферная система образована натрия дигидрофосфатом (NaH 2 PO 4 ) и натрия гидрофосфатом (Na 2 HPO 4 ). Первое соединение ведет себя как слабая кислота, второе — как соль слабой кислоты. Если в кровь попадает более сильная кислота, то она реагирует с Na 2 HPO 4, образуя нейтральную соль, и увеличивает количество слабодиссоциируемого Na 2 HPO 4 : Н + + NaHPO 4 - = Na + +H 2 P0 4 - Избыточное количество натрия дигидрофосфата при этом будет удаляться с мочой, благодаря чему соотношение NaH 2 PO 4 /Na 2 HPO 4 не изменится. Белки плазмы крови играют роль буфера, так как обладают амфотерными свойствами: в кислой среде ведут себя как основания, а в основной — как кислоты. Карбонаты костной ткани Карбонаты костной ткани функционируют как депо для буферных систем организма. В костях содержится большое количество солей угольной кислоты: карбонаты кальция, натрия, калия и др. При остром увеличении содержания кислот (например, при острой сердечной, дыхательной или почечной недостаточности, шоке, коме и других состояниях) кости могут обеспечивать до 30—40% буферной емкости. Высвобождение карбоната кальция в плазму крови способствует эффективной нейтрализации избытка Н+