Слайд 3
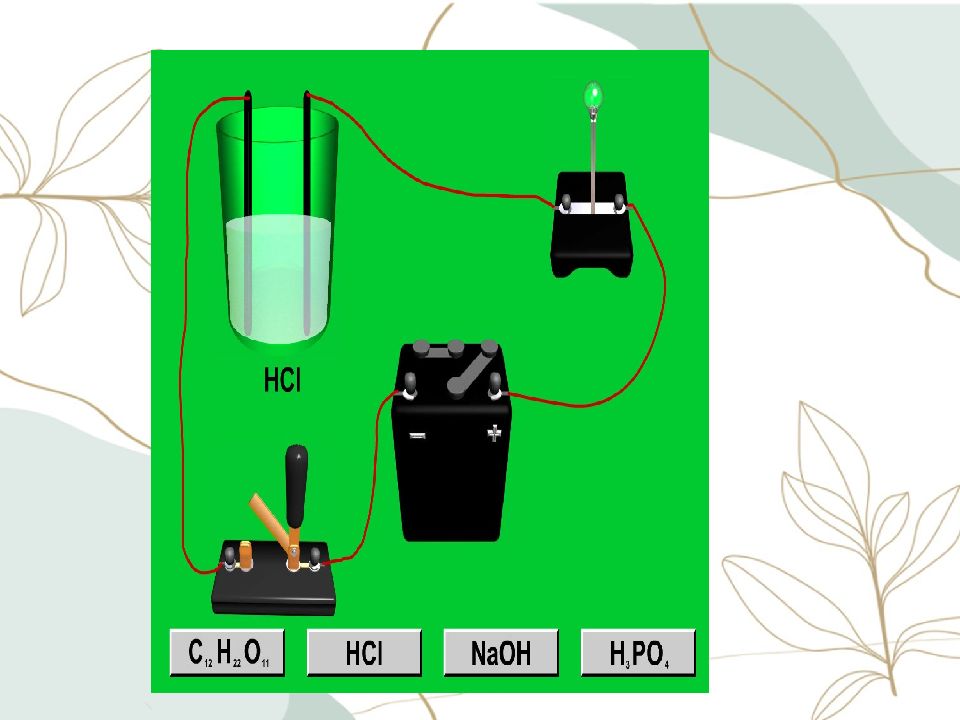
Вещество Вид хим. связи Класс В-в Частицы Свечение лампочки Н 2 О дист. NaCl кр. NaCl р-р C 12 H 22 O 11 кр. сахар C 12 H 2 2 O 11 р- р. NaOH кр. NaOH р- р. H 2 SO 4 р-р. O 2 газ
Слайд 4
Вещество Вид хим. связи Класс В-в Частицы Свечение лампочки Н 2 О дист. NaCl кр. NaCl р-р C 12 H 22 O 11 кр. сахар C 12 H 2 2 O 11 р- р. NaOH кр. NaOH р- р. H 2 SO 4 р-р. O 2 газ
Слайд 7
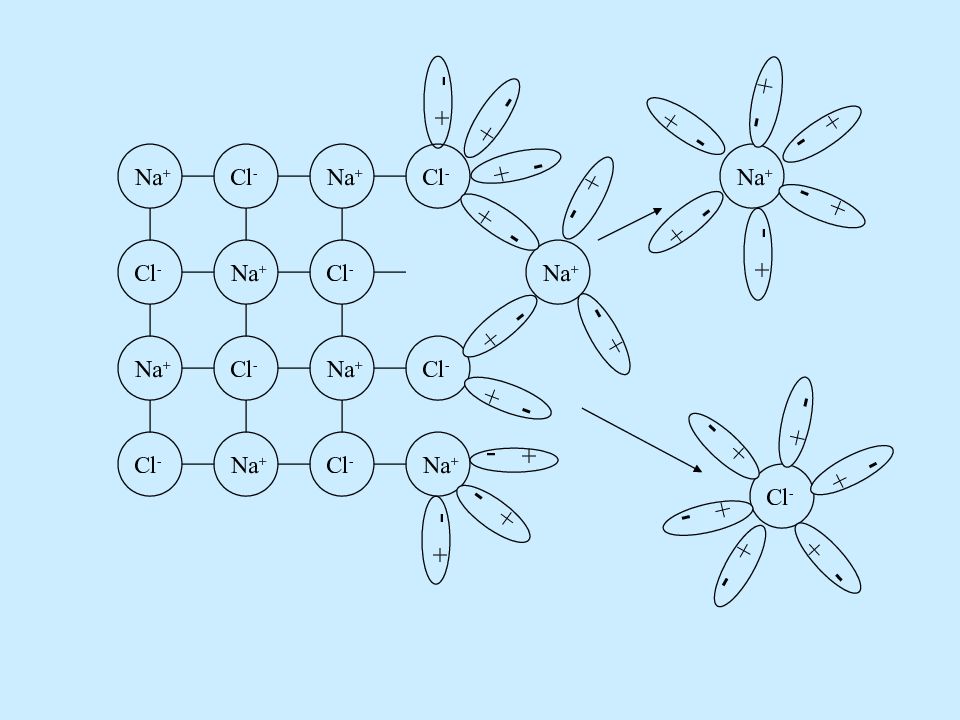
+ - Cl - Na + Na + Na + Na + Na + Na + Na + Cl - Cl - Cl - Cl - Cl - Cl - Cl - Na + + - + - + - + - + - + - + - + - + - + - Cl - + - + - + - + - + - + - Na + + - + - + - + - + - + -
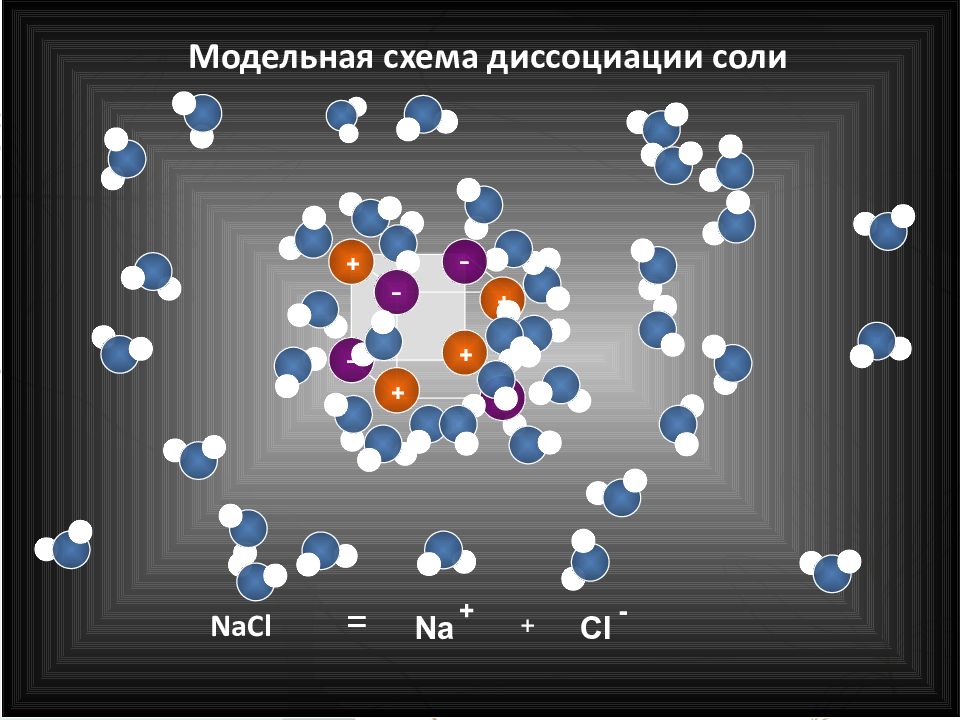
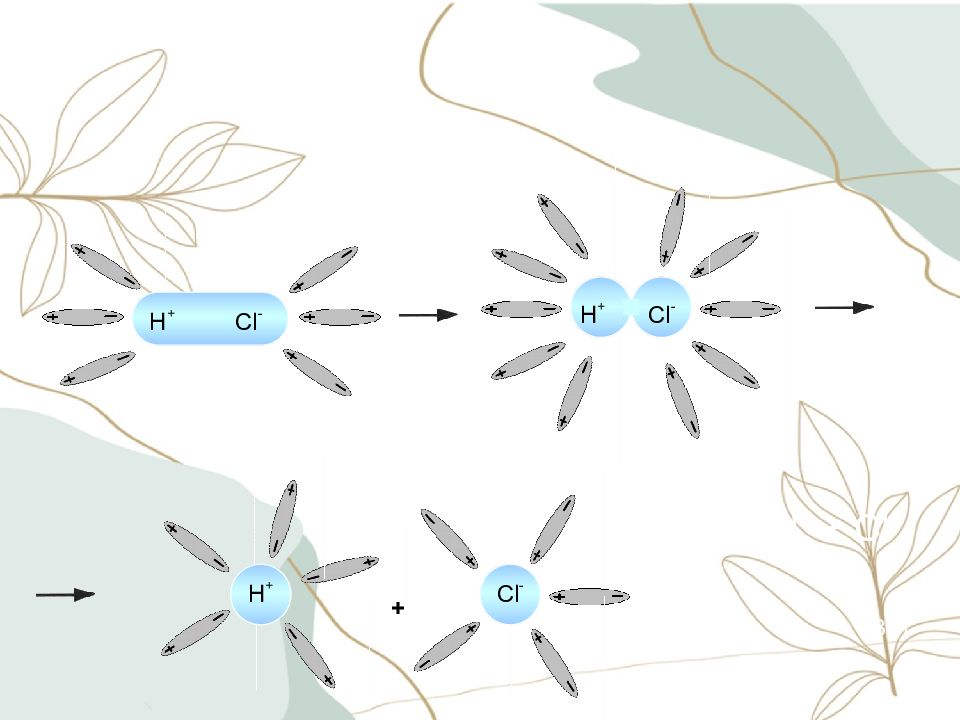
Слайд 9: Последовательность процессов, происходящих при электролитической диссоциации:
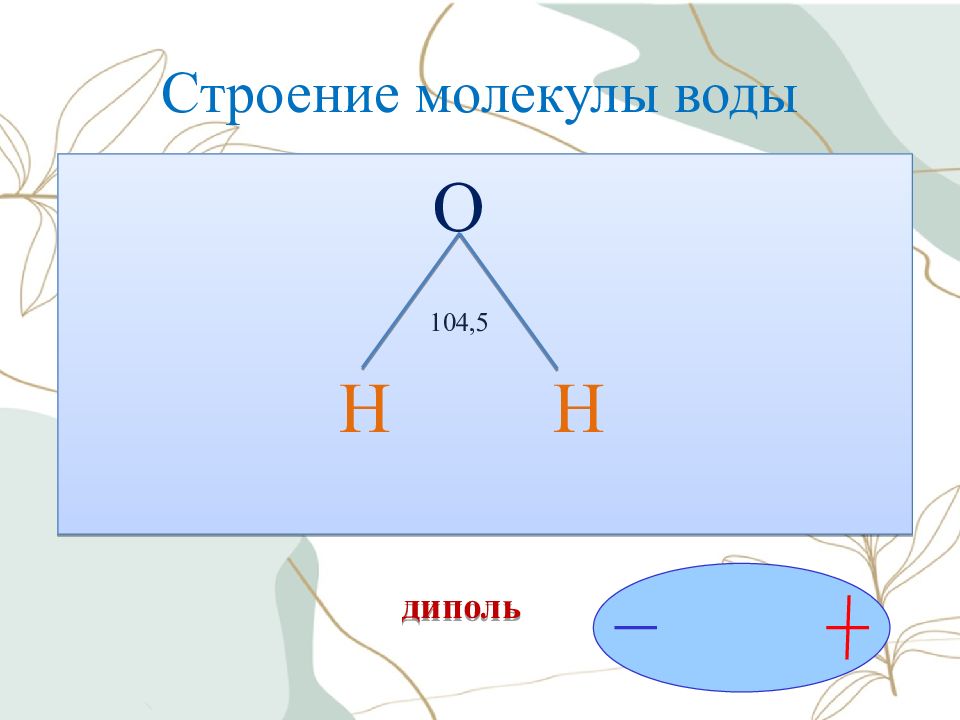
Ориентация молекул – диполей воды около ионов; Гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла; Диссоциация (распад) кристалла электролита на гидратированные ионы
Слайд 12: Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении
Слайд 13
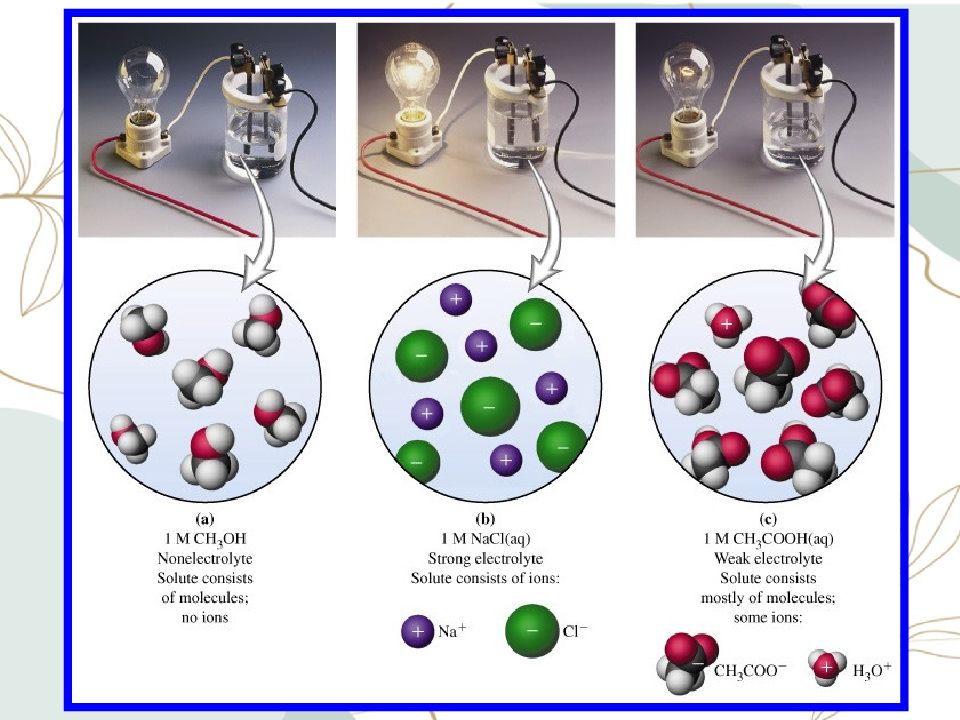
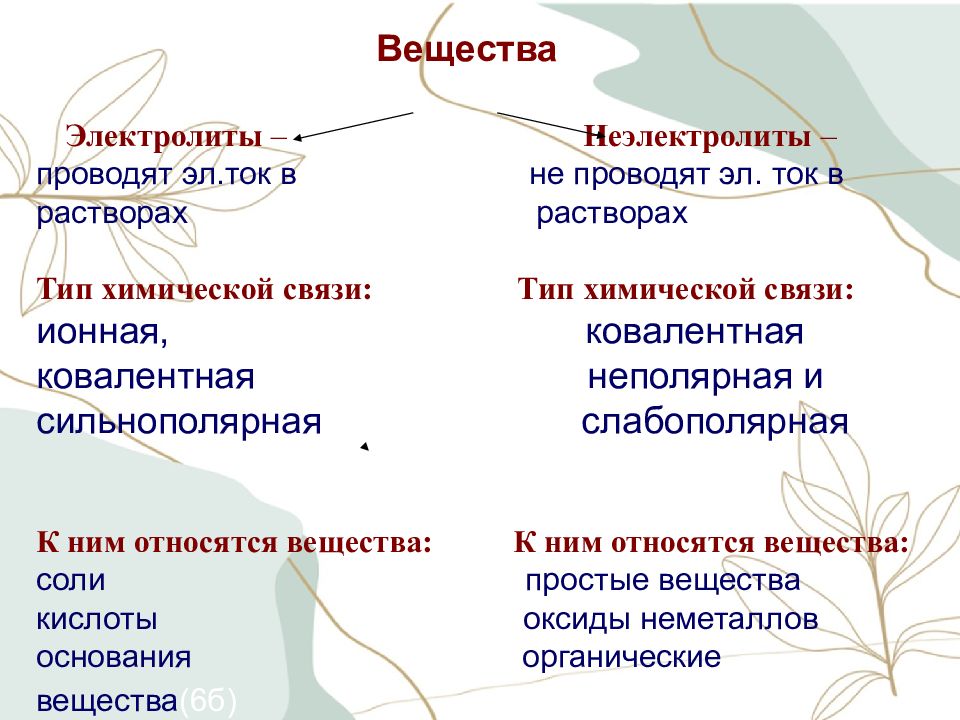
Вещества Электролиты – Неэлектролиты – проводят эл.ток в не проводят эл. ток в растворах растворах (1б) Тип химической связи: Тип химической связи: ионная, ковалентная ковалентная неполярная и сильнополярная слабополярная (4б) К ним относятся вещества: К ним относятся вещества: соли простые вещества кислоты оксиды неметаллов основания органические вещества (6б)
Слайд 14
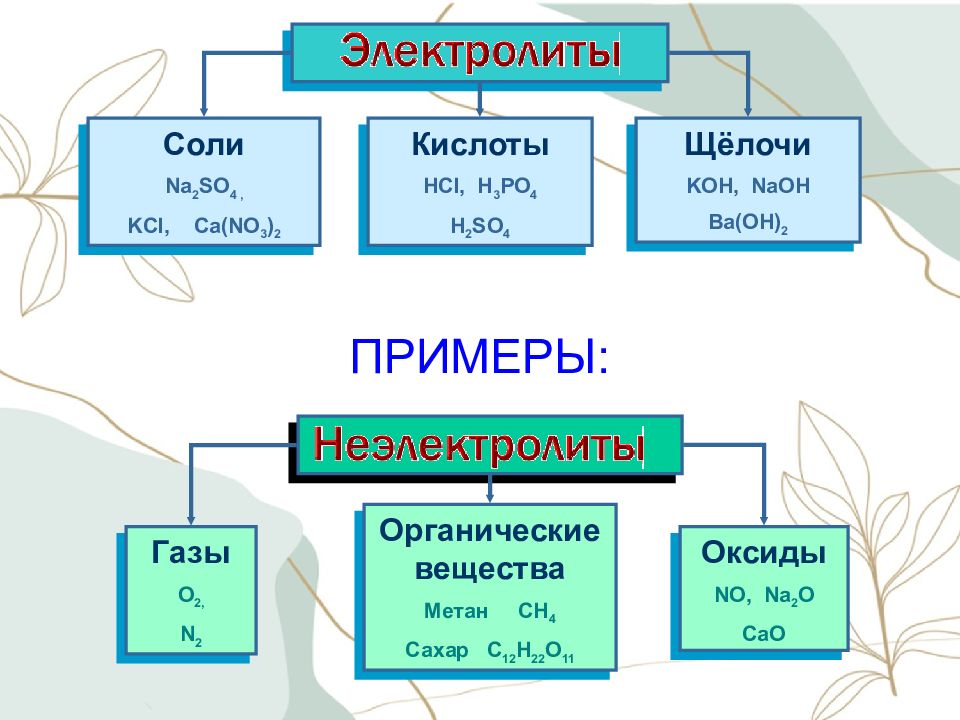
C оли Na 2 SO 4, KCl, Ca(NO 3 ) 2 Кислоты HCl, H 3 PO 4 H 2 SO 4 Щёлочи KOH, NaOH Ba(OH) 2 Газы O 2, N 2 Органические вещества Метан CH 4 Сахар C 12 H 22 O 11 Оксиды NO, Na 2 O CaO ПРИМЕРЫ:
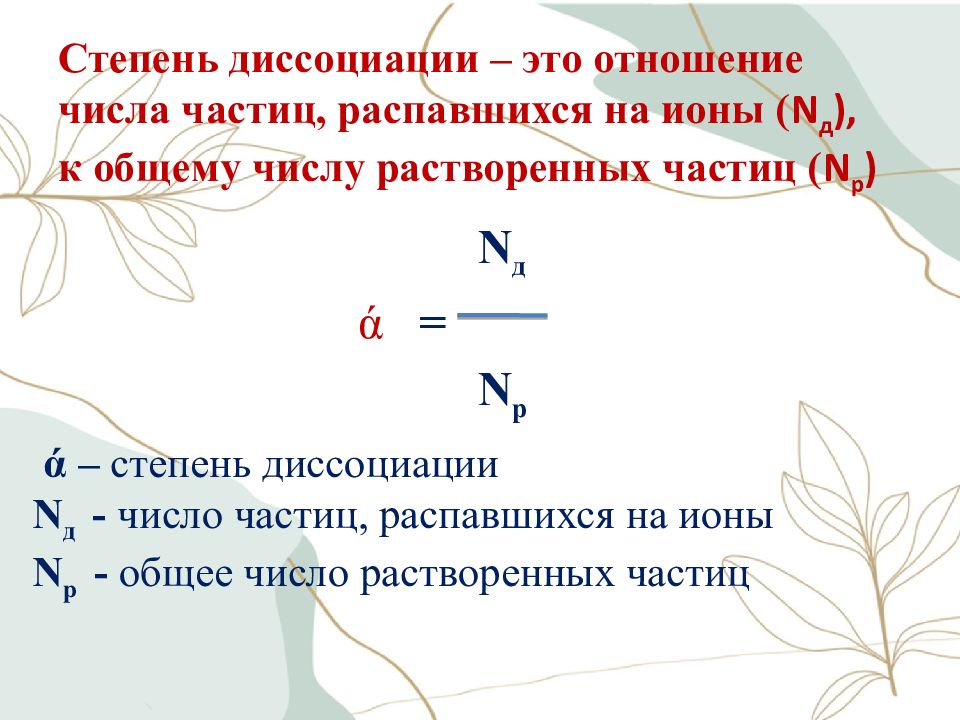
Слайд 15: Степень диссоциации – это отношение числа частиц, распавшихся на ионы ( N д ), к общему числу растворенных частиц ( N р )
N д ά = N р ά – степень диссоциации N д - число частиц, распавшихся на ионы N р - общее число растворенных частиц
Слайд 16
Легче всего диссоциируют вещества с ионной и ковалентной полярной связью: Кислоты : HCl, H 2 SO 4, HF, HNO 3 Основания : NaOH, Ba(OH) 2, KOH Соли : NaCl, CuSO 4, KNO 3
Слайд 17: Степень диссоциации выражают в долях или процентах
При ά = 0 диссоциация отсутствует При ά = 1 или 100% электролит полностью распадается на ионы По степени электролитической диссоциации электролиты делят сильные слабые
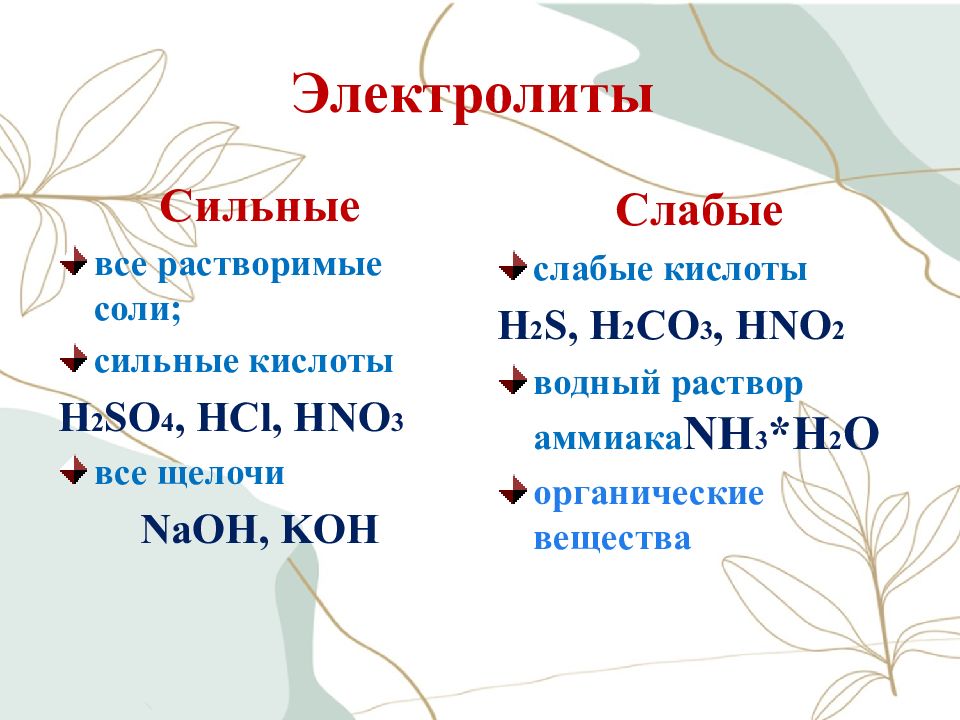
Слайд 18: Электролиты
Сильные все растворимые соли; сильные кислоты H 2 SO 4, HCl, HNO 3 все щелочи NaOH, KOH Слабые слабые кислоты H 2 S, H 2 CO 3, HNO 2 водный раствор аммиака NH 3 *H 2 O органические вещества
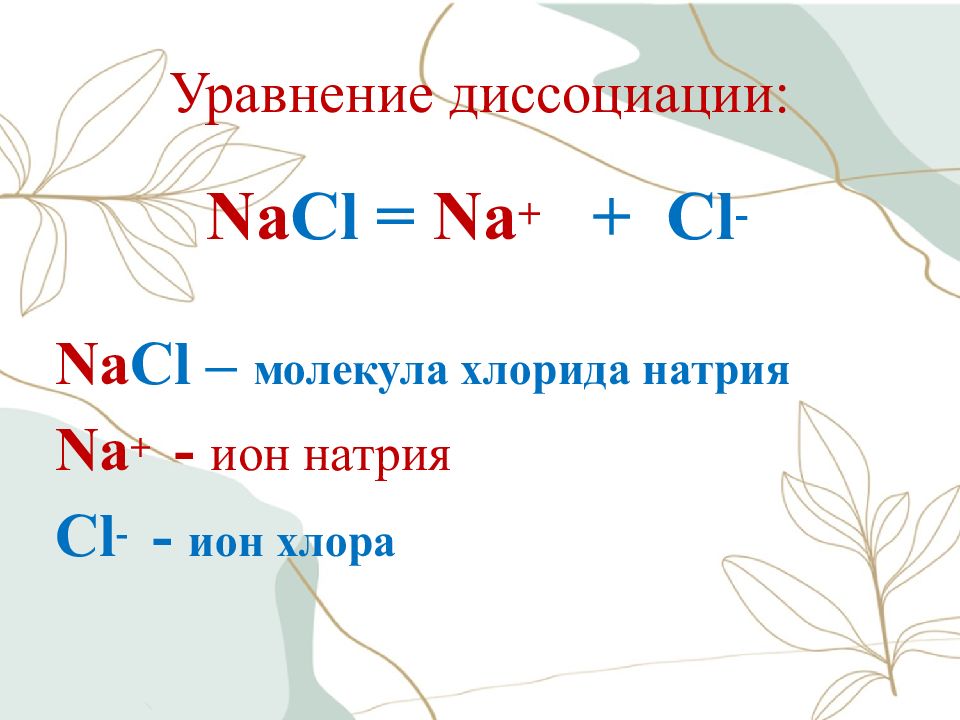
Слайд 19: Уравнение диссоциации:
Na Cl = Na + + Cl - Na Cl – молекула хлорида натрия Na + - ион натрия Cl - - ион хлора
Слайд 20: Почему растворы электролитов проводят электрический ток?
Сванте Аррениус ( 1859-1927 ) Создал теорию электролитической диссоциации. За исследования в области электролитов был удостоен Нобелевской премии в 1903 г.
Слайд 21: Причину диссоциации объяснили
И.А. Каблуков, В.А. Кистяковский ─ при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. В растворах находятся не свободные, а гидратированные ионы (4б)