Слайд 2
Электролиз – это совокупность ОВР, протекающих под действием электрического тока на электродах, погруженных в раствор или расплав электролита.
Слайд 3
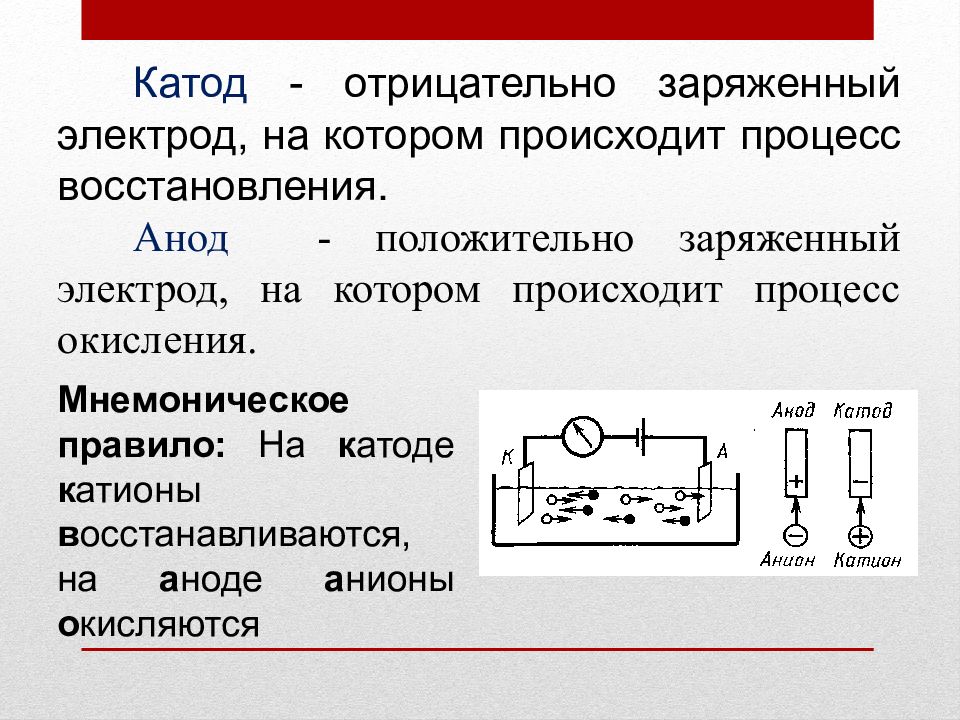
Катод - отрицательно заряженный электрод, на котором происходит процесс восстановления. Анод - положительно заряженный электрод, на котором происходит процесс окисления. Мнемоническое правило: На к атоде к атионы в осстанавливаются, на а ноде а нионы о кисляются
Слайд 4: Виды анодов:
1. Инертные аноды (нерастворимые, пассивные): материал анода не окисляется, окисляются ионы электролита (платина, графит). 2. Активные аноды (растворимые): материал анода легко окисляется (медь, цинк, железо).
Слайд 5: Электролиз расплавов
Пример 1: Электролиз расплава хлорида натрия. NaCl расплав → Na + + Cl − K - : Na + + 1e → Na 0 (восстановление) ∣ 2 A + : 2 Cl − -2 e → Cl 2 0 (окисление) ∣ 1 2 NaCl 2 Na + Cl 2
Слайд 6
Пример 2 : Электролиз расплава гидроксида натрия. Na ОН расплав → Na + + ОН − K - : Na + + 1e → Na 0 (восстановление) ∣ 4 A + : 4ОН − -4 e → О 2 0 + 2H 2 O (окисление) ∣ 1 4 Na ОН Na + О 2 0 + 2H 2 O
Слайд 7: Электролиз растворов
На катоде: От Li + до Al 3+ (включительно) восстанавливаются молекулы воды или катионы H + : 2H 2 O+2e → H 2 ↑+ 2OH − 2H + +2e → H 2 ↑
Слайд 8
Катодные процессы: От Al 3+ до Н 2 восстанавливаются металл и молекулы воды (катионы H + ): Me n + + ne →Me 0 2H 2 O+2e → H 2 ↑+ 2OH − 2H + +2e → H 2 ↑ После Н 2 восстанавливаются металл : Me n + + ne →Me 0
Слайд 9
Анодные процессы: I. Нерастворимый анод (инертный) Р t, C Окисляются: 1. Анионы бескислородных кислот: I -, Br -, S 2-, Cl -, RCOO - : 2 Cl - -2 e → Cl 2 0, 2 RCOO - -2 e → R – R + 2 CO 2 ↑ 2. Кислород воды, если в растворе есть анионы кислородсодержащих кислот ( SO 4 2-, NO 3 - ) или фторид-ион F - : 2 H 2 O – 4 e → O 2 ↑ + 4 H + или гидроксид – ионы (в щелочной среде) по схеме : 4 OH - - 4 e → O 2 ↑ + 2 H 2 O. 3. В растворах не разряжаются анионы кислородсодержащих кислот и фторид – ион : F -, SO 4 2-, NO 3 -, CO 3 2-, PO 4 3- II. Растворимый анод (активный) Cu, Ag, Ni, Zn Окисление металла анода: Me 0 – ne → Me n +
Слайд 10
KI раствор → K + + I − K - : 2H 2 O+2e →H 2 +2OH − (восстановление) ∣ 1 A + : 2 I − -2 e → I 2 0 (окисление) ∣ 1 2KI + 2H 2 O H 2 + I 2 + 2 К OH Пример 3 : Электролиз раствора иодида калия.
Слайд 11
Пример 4 : Электролиз раствора сульфата меди ( II). CuSO 4 раствор → Cu 2 + +SO 4 2− K - : Cu 2 + + 2e → Cu 0 (восстановление) ∣ 2 A + : 2H 2 O - 4e → O 2 + 4 Н + (окисление) ∣ 1 2CuSO 4 + 2H 2 O 2Cu + 2H 2 SO 4 + O 2 ↑
Слайд 12
Пример 5: Электролиз раствора ацетата натрия. СН 3 СОО Na раствор → Na + + СН 3 СОО − K - : 2H 2 O+2e →H 2 +2OH − (в - е) ∣ 1 A + : 2CH 3 COO – –2ē →CH 3 -CH 3 +2CO 2 (о - е) ∣ 1 2 СН 3 СОО Na +2H 2 O H 2 +2NaOH+ CH 3 -CH 3 +2CO 2
Слайд 13: Применение электролиза
1. Для защиты металлических изделий от коррозии на их поверхность наносится тонкий другого металла (хромирование, серебрение, меднение, никелирование и т.д.). Эта отрасль прикладной электрохимии называется гальваностегией.
Слайд 14
2. Гальванопластика - получение точных металлических копий с предметов. С помощью гальванопластики изготавливают клише для печатания денег, печатные схемы в радиотехнике, грампластинки.
Слайд 15
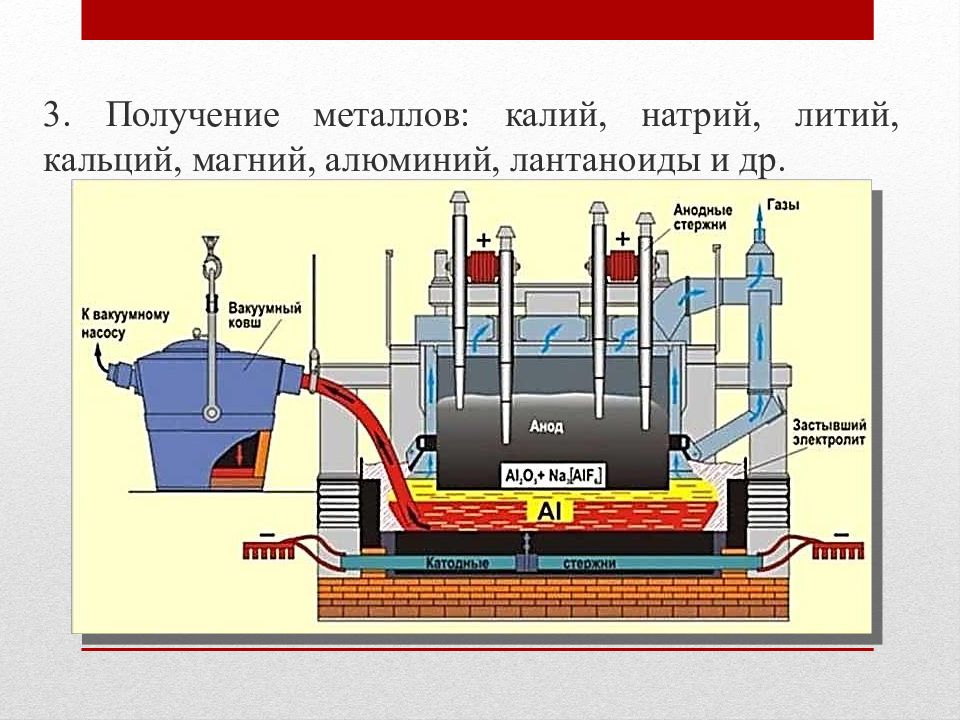
3. Получение металлов: калий, натрий, литий, кальций, магний, алюминий, лантаноиды и др.
Слайд 16
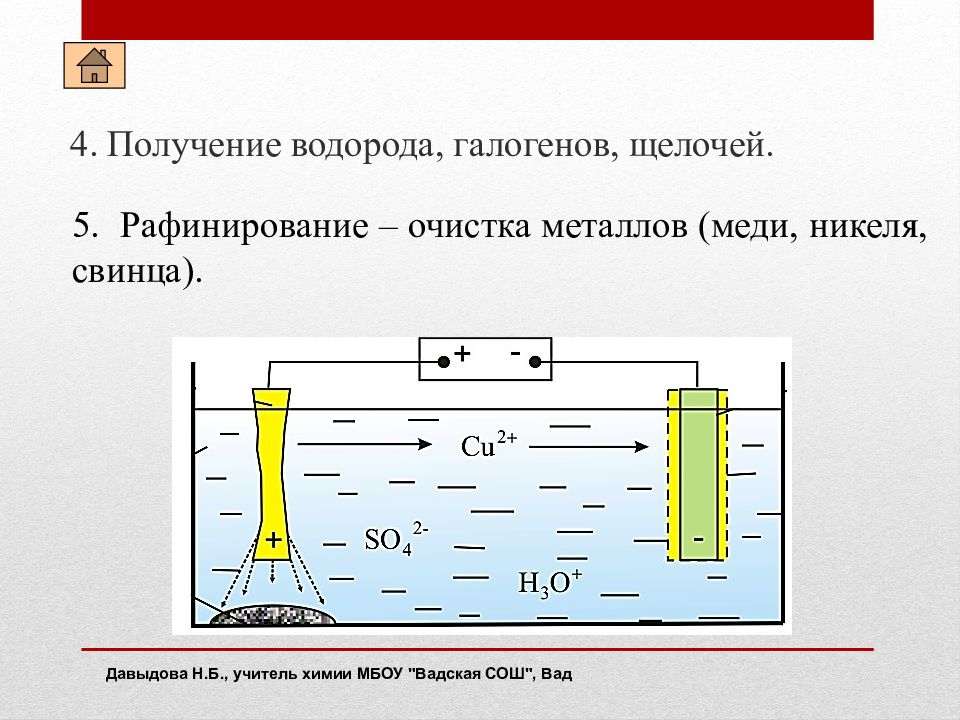
4. Получение водорода, галогенов, щелочей. Давыдова Н.Б., учитель химии МБОУ " Вадская СОШ", Вад 5. Рафинирование – очистка металлов (меди, никеля, свинца).
Слайд 17
Закрепление и применение полученных знаний Базовый уровень сложности 1. При электролизе AgNO 3 на катоде выделяется (- ются ): 1) серебро 2) водород 3) серебро и водород 4) водород и кислород 2. При электролизе водного раствора нитрата калия на аноде выделяется 1) О 2 2 ) NO 2 3) N 2 4) H 2 3. При электролизе водного раствора какой соли на катоде и аноде будут выделятся газообразные вещества 1) AgNO 3 2) К NO 3 3) CuCl 2 4) SnCl 2
Слайд 18
Закрепление и применение полученных знаний Повышенный уровень сложности 4. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах. ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА А) Al 2 (SO 4 ) 3 1) гидроксид металла, кислота Б) CsOH 2) металл, галоген В) Hg(NO 3 ) 2 3) металл, кислород Г) AuBr 3 4) водород, галоген 5) водород, кислород 6) металл, кислота, кислород
Последний слайд презентации: Электролиз растворов и расплавов
Закрепление и применение полученных знаний Повышенный уровень сложности 5. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе его водного раствора ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ А) Na 3 PO 4 1) O 2 Б) NaNO 3 2) H 2 S В) Al 2 (SO 4 ) 3 3) Br 2 Г) AlBr 3 4) HBr 5) NO 2 6) SO 2