Первый слайд презентации
Ежесекундно в организме человека происходят сотни и тысячи всевозможных реакций. В печени человека протекает 20 000 000 химических реакций. Как же химикам удается ориентироваться в огромном количестве химических реакций?
Слайд 3: По каким признакам классифицируют реакции?
Число и состав исходных веществ и продуктов реакции; Тепловой эффект; Обратимость реакции; Участие катализатора; И зменение степени окисления; А грегатное состояние реагирующих веществ;
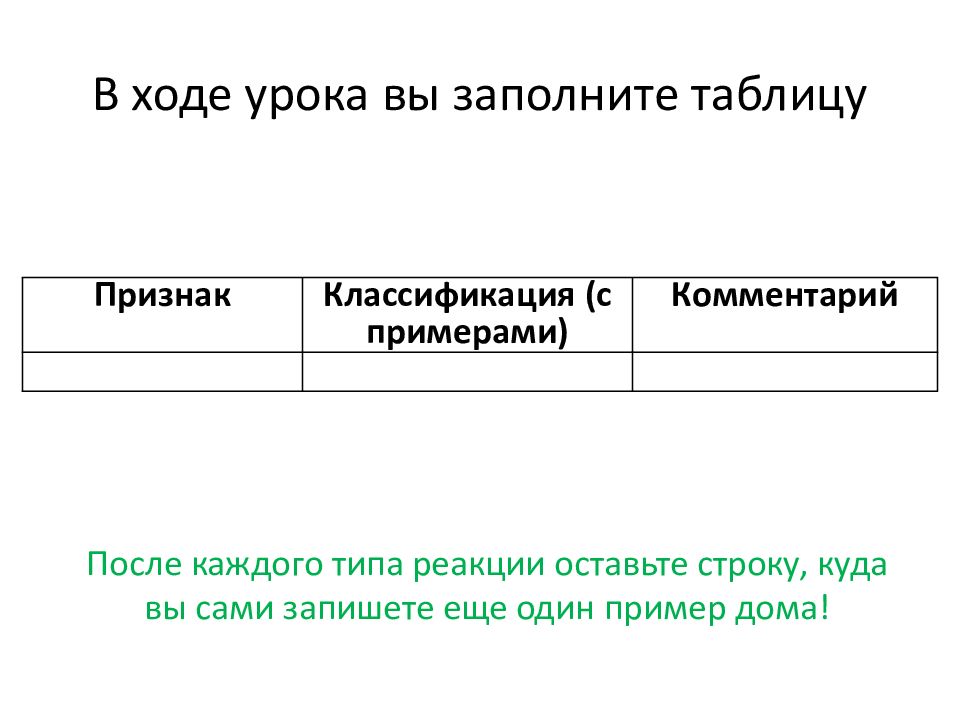
Слайд 4: В ходе урока вы заполните таблицу
Признак Классификация (с примерами) Комментарий После каждого типа реакции оставьте строку, куда вы сами запишете еще один пример дома!
Слайд 5: 1. По числу и составу исходных и образовавшихся веществ
Реакции разложения – из одного сложного вещества образуется несколько более простых СаСО 3 СаО + СО 2 СН 3 – СН 2 – СН 2 – СН 3 СН 3 – СН 2 – СН 2 – СН 3 + 2H 2 Реакции соединения – из нескольких простых или сложных веществ образуется одно сложное 2H 2 + О 2 2H 2 O СН 2 СН 2 + H 2 СН 3 – СН 3 t, Ni t, Ni t
Слайд 6: 1. По числу и составу исходных и образовавшихся веществ
Реакции замещения – атомы простого вещества замещают атомы одного из элементов в сложном веществе : Zn + 2HCl ZnCl 2 + H 2 ↑ CH 4 + Cl 2 CH 3 Cl + HCl Реакции обмена – два сложных вещества обмениваются составными частями : AgNO 3 + HCl AgCl↓ + HNO 3 HCOOH + CH 3 OH HCOOCH 3 + H 2 O H +
Слайд 7: 2. По тепловому эффекту
Экзотермические – протекают с выделением энергии : 4Р + 5О 2 2Р 2 О 5 + Q CH 4 + 2О 2 СО 2 + 2H 2 O + Q Эндотермические – протекают с поглощением энергии : Cu ( OH ) 2 CuO + H 2 O – Q N 2 + O 2 2NO – Q
Слайд 8: 3. По направлению (обратимость реакции )
Необратимые – протекают в данных условиях только в одном направлении : H 2 SO 4 + BaCl 2 BaSO 4 + 2 HCl CH 4 + 2О 2 СО 2 + 2H 2 O Обратимые – протекают в данных условиях одновременно в двух противоположных направлениях : 3H 2 + N 2 2NH 3 C 2 H 4 + H 2 C 2 H 6
Слайд 9: 4. По наличию катализатора
Каталитические: 2H 2 O 2 2H 2 O + О 2 ↑ C 2 H 4 + H 2 C 2 H 4 Некаталитические: S + О 2 SO 2 C 2 H 2 + НCl 2 C 2 H 3 Cl t, Ni MnO 2
Слайд 10: 5. По изменению степени окисления атомов элементов
Окислительно-восстановительные – реакции, идущие с изменением степени окисления: Fe 0 + 2 H +1 Cl -1 Fe 2+ Cl 2 -1 + H 2 0 Не окислительно-восстановительные – реакции, идущие без изменением степени окисления: S +6 O 3 -2 + H 2 O H 2 + S +6 O 4 -2
Слайд 11
* Реакции ионного обмена: 1. FeCl 3 + 3 NaOH = Fe ( OH ) 3 ↓ + 3 NaCl Fe 3+ + 3Cl - + 3Na + + 3OH - = Fe(OH) 3 ↓ + 3Na + + 3Cl - 2. KOH + HCl = KCl + H 2 O 3. K 2 S + 2HCl = 2KCl + H 2 S↑ В каких случаях реакции ионного обмена идут до конца? Запишите полные ионные уравнения для двух оставшихся реакций!
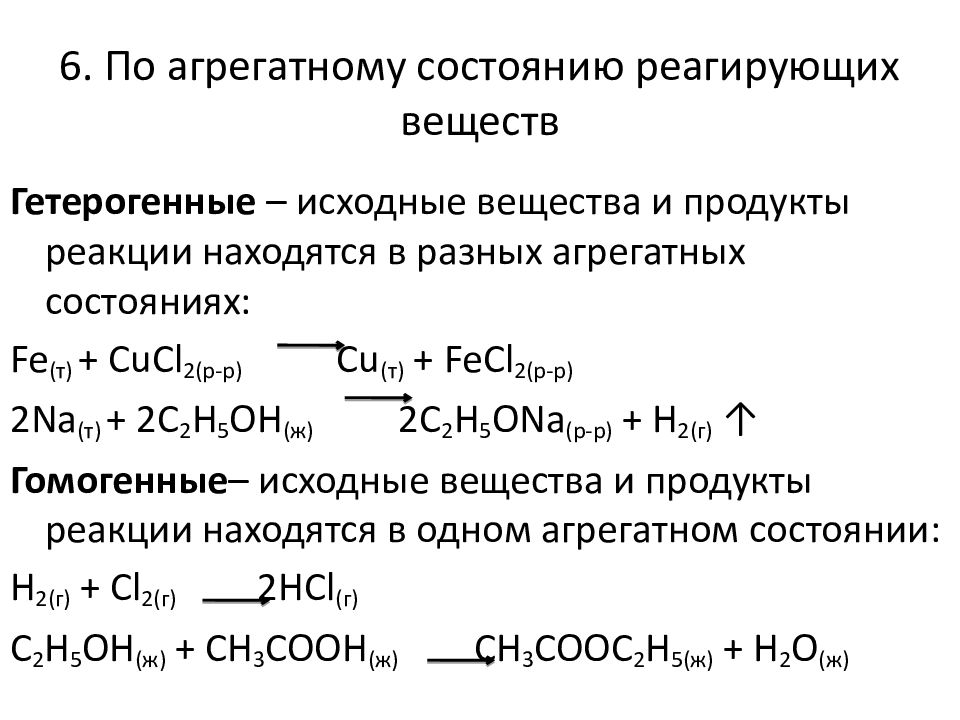
Последний слайд презентации: Ежесекундно в организме человека происходят сотни и тысячи всевозможных: 6. По агрегатному состоянию реагирующих веществ
Гетерогенные – исходные вещества и продукты реакции находятся в разных агрегатных состояниях: Fe (т) + CuCl 2( р-р ) Cu (т) + FeCl 2( р-р ) 2Na (т) + 2C 2 H 5 OH (ж) 2C 2 H 5 ONa ( р-р ) + H 2(г) ↑ Гомогенные – исходные вещества и продукты реакции находятся в одном агрегатном состоянии: H 2(г) + Cl 2(г) 2HCl (г) C 2 H 5 OH ( ж ) + CH 3 COOH ( ж ) CH 3 COOC 2 H 5( ж ) + H 2 O ( ж )