Первый слайд презентации: Фаг энтеробактерий λ
РАБОТУ ВЫПОЛНИЛА: студентка 234М группы Кушниренко Дарья Санкт-Петербургский государственный технологический институт (технический университет) Кафедра молекулярной биотехнологии
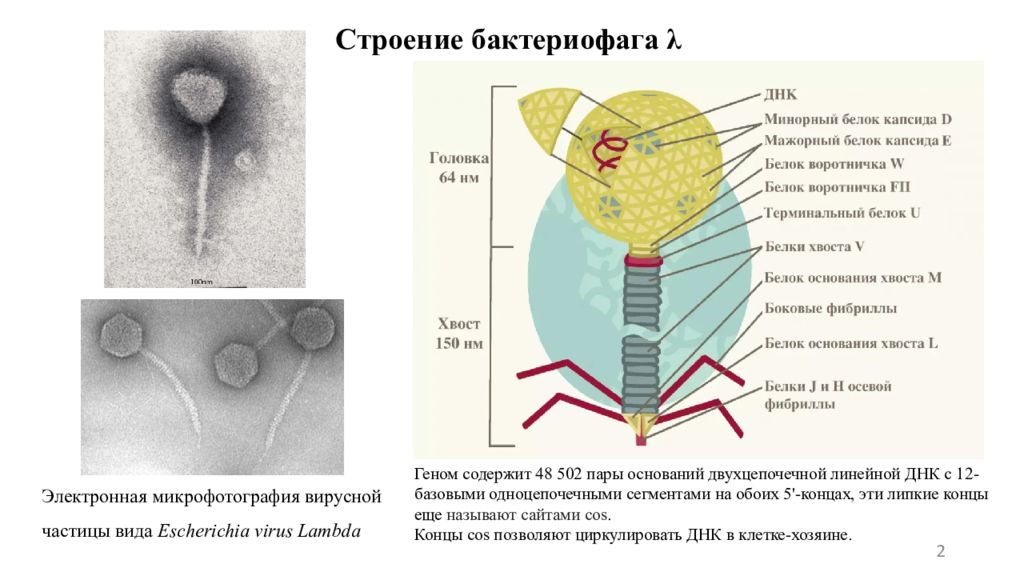
Слайд 2: Строение бактериофага λ
2 Электронная микрофотография вирусной частицы вида Escherichia virus Lambda Геном содержит 48 502 пары оснований двухцепочечной линейной ДНК с 12-базовыми одноцепочечными сегментами на обоих 5'-концах, эти липкие концы еще называют сайтами cos. Концы cos позволяют циркулировать ДНК в клетке-хозяине.
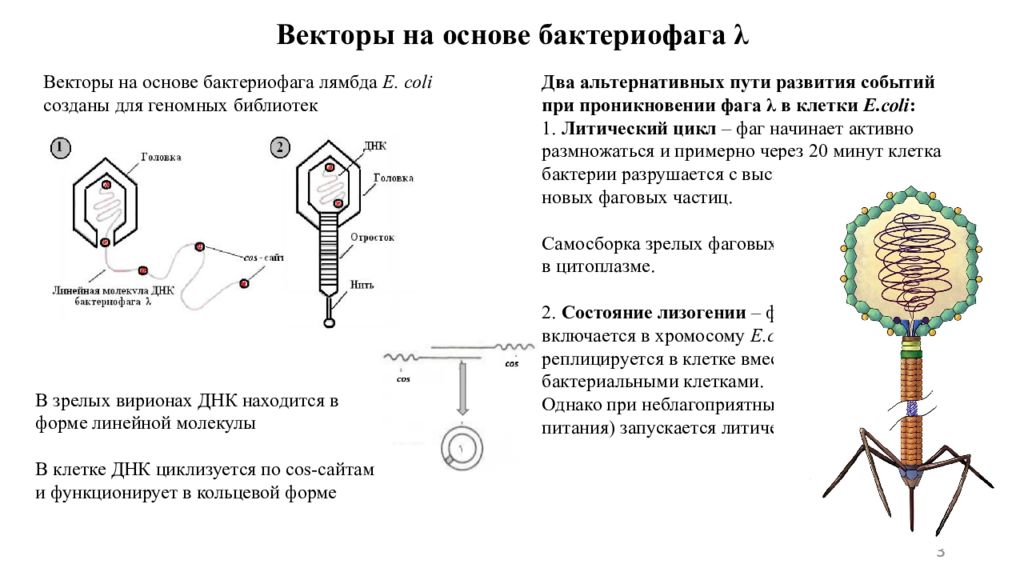
Слайд 3
3 Два альтернативных пути развития событий при проникновении фага λ в клетки E.coli : 1. Литический цикл – фаг начинает активно размножаться и примерно через 20 минут клетка бактерии разрушается с высвобождением до 100 новых фаговых частиц. Самосборка зрелых фаговых вирионов происходит в цитоплазме. 2. Состояние лизогении – фаговая ДНК включается в хромосому E.coli как профаг и реплицируется в клетке вместе с нормальными бактериальными клетками. Однако при неблагоприятных условиях (нехватка питания) запускается литический цикл. Векторы на основе бактериофага λ Векторы на основе бактериофага лямбда Е. соli созданы для геномных библиотек В зрелых вирионах ДНК находится в форме линейной молекулы В клетке ДНК циклизуется по соs -сайтам и функционирует в кольцевой форме
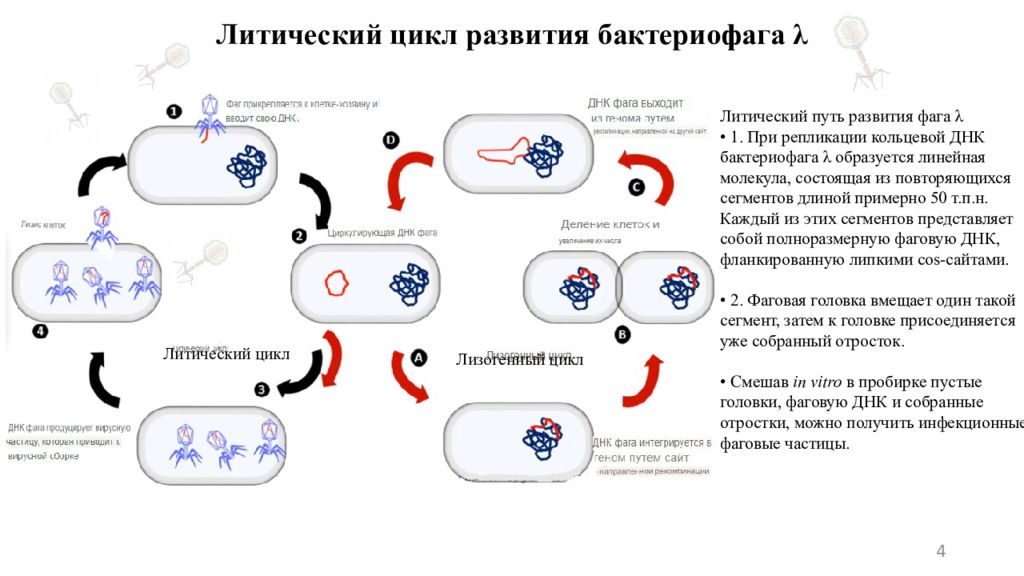
Слайд 4
4 Литический цикл развития бактериофага λ Литический путь развития фага λ • 1. При репликации кольцевой ДНК бактериофага λ образуется линейная молекула, состоящая из повторяющихся сегментов длиной примерно 50 т.п.н. Каждый из этих сегментов представляет собой полноразмерную фаговую ДНК, фланкированную липкими cos -сайтами. • 2. Фаговая головка вмещает один такой сегмент, затем к головке присоединяется уже собранный отросток. • Смешав in vitro в пробирке пустые головки, фаговую ДНК и собранные отростки, можно получить инфекционные фаговые частицы. Литический цикл Лизогенный цикл
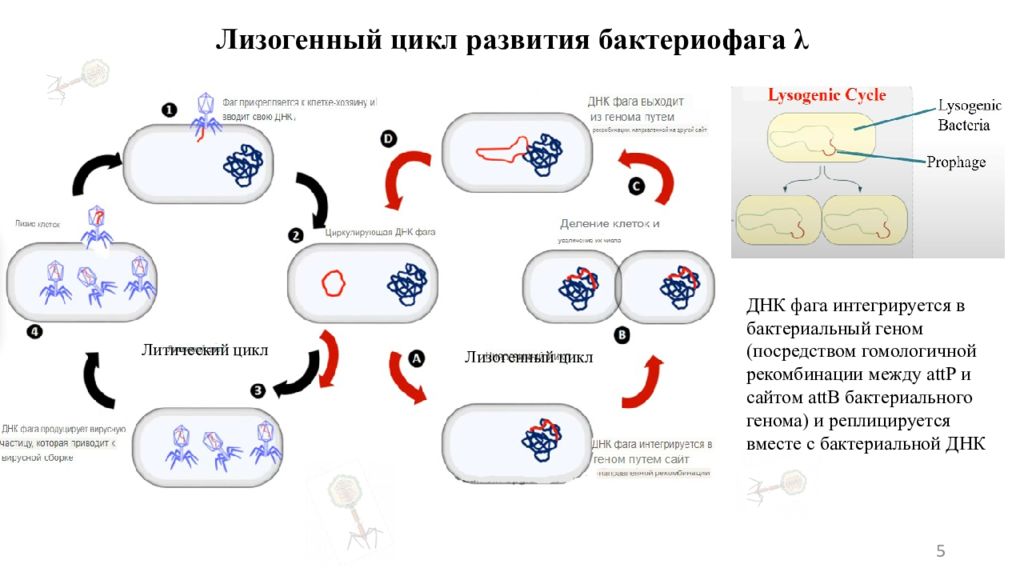
Слайд 5: Лизогенный цикл развития бактериофага λ
5 Литический цикл Лизогенный цикл ДНК фага интегрируется в бактериальный геном (посредством гомологичной рекомбинации между attP и сайтом attB бактериального генома) и реплицируется вместе с бактериальной ДНК
Слайд 6
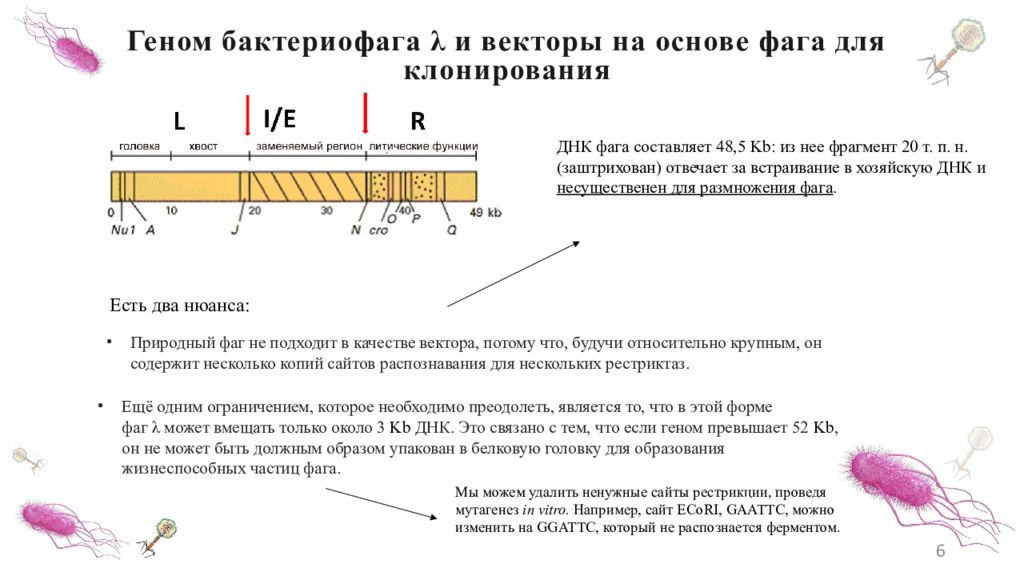
6 Геном бактериофага λ и векторы на основе фага для клонирования ДНК фага составляет 48,5 Kb : из нее фрагмент 20 т. п. н. (заштрихован) отвечает за встраивание в хозяйскую ДНК и несущественен для размножения фага. Природный фаг не подходит в качестве вектора, потому что, будучи относительно крупным, он содержит несколько копий сайтов распознавания для нескольких рестриктаз. Ещё одним ограничением, которое необходимо преодолеть, является то, что в этой форме фаг λ может вмещать только около 3 Kb ДНК. Это связано с тем, что если геном превышает 52 Kb, он не может быть должным образом упакован в белковую головку для образования жизнеспособных частиц фага. Есть два нюанса: Мы можем удалить ненужные сайты рестрикции, проведя мутагенез in vitro. Например, сайт ECoRI, GAATTC, можно изменить на GGATTC, который не распознается ферментом.
Слайд 7
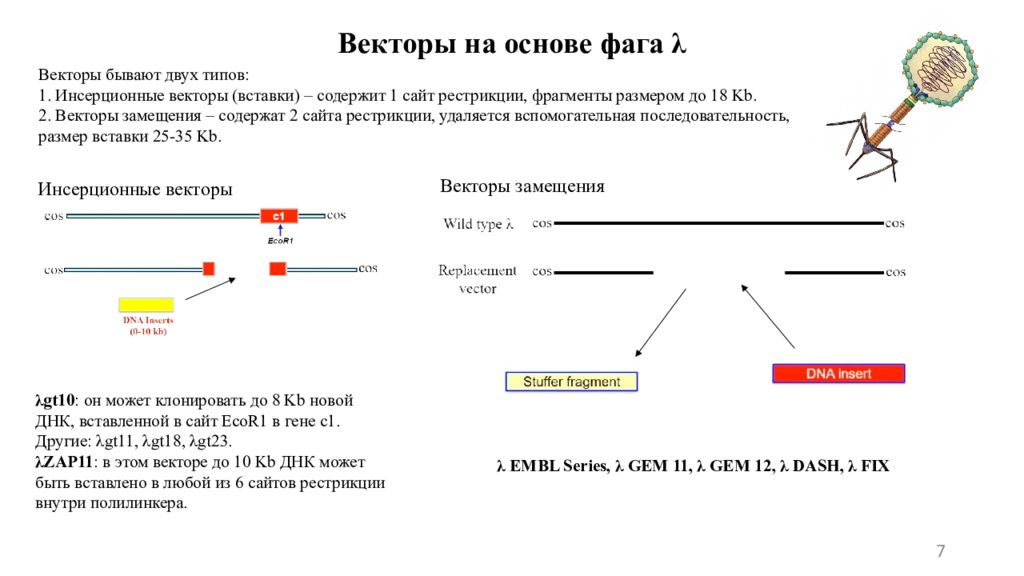
7 Векторы на основе фага λ Векторы бывают двух типов: 1. Инсерционные векторы (вставки) – содержит 1 сайт рестрикции, фрагменты размером до 18 Kb. 2. Векторы замещения – содержат 2 сайта рестрикции, удаляется вспомогательная последовательность, р азмер вставки 25-35 Kb. λ gt10 : он может клонировать до 8 Kb новой ДНК, вставленной в сайт EcoR1 в гене с1. Другие: λ gt1 1, λ gt1 8, λ gt 23. λ ZAP11 : в этом векторе до 10 Kb ДНК может быть вставлено в любой из 6 сайтов рестрикции внутри полилинкера. Инсерционные векторы Векторы замещения λ EMBL Series, λ GEM 11, λ GEM 12, λ DASH, λ FIX
Слайд 8
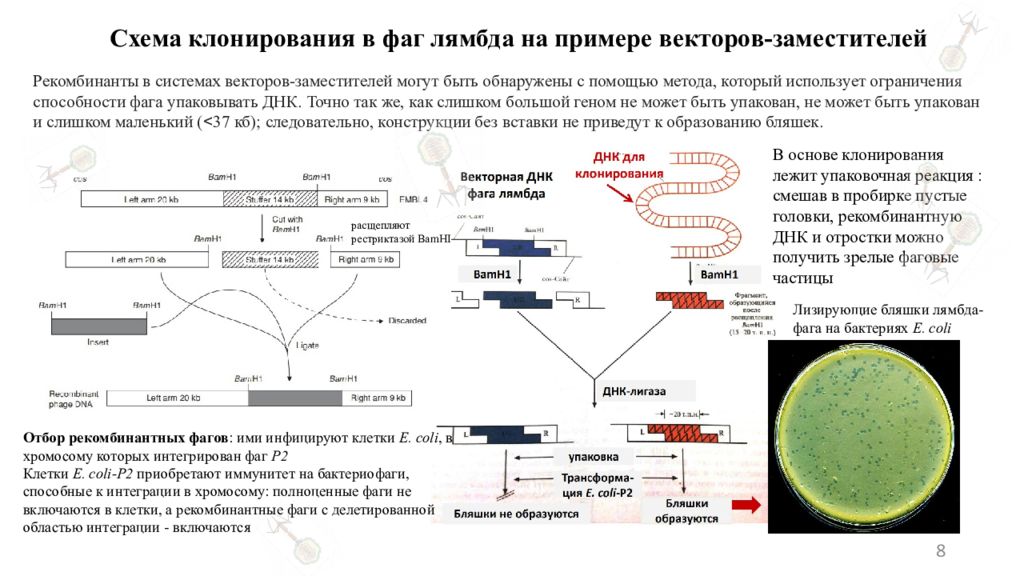
8 Схема клонирования в фаг лямбда на примере векторов-заместителей Рекомбинанты в системах векторов-заместителей могут быть обнаружены с помощью метода, который использует ограничения способности фага упаковывать ДНК. Точно так же, как слишком большой геном не может быть упакован, не может быть упакован и слишком маленький ( < 37 кб); следовательно, конструкции без вставки не приведут к образованию бляшек. В основе клонирования лежит упаковочная реакция : смешав в пробирке пустые головки, рекомбинантную ДНК и отростки можно получить зрелые фаговые частицы Лизирующие бляшки лямбда-фага на бактериях E. coli Отбор рекомбинантных фагов : ими инфицируют клетки E. coli, в хромосому которых интегрирован фаг Р2 Клетки E. coli-Р2 приобретают иммунитет на бактериофаги, способные к интеграции в хромосому: полноценные фаги не включаются в клетки, а рекомбинантные фаги с делетированной областью интеграции - включаются расщепляют рестриктазой BamHI
Слайд 9
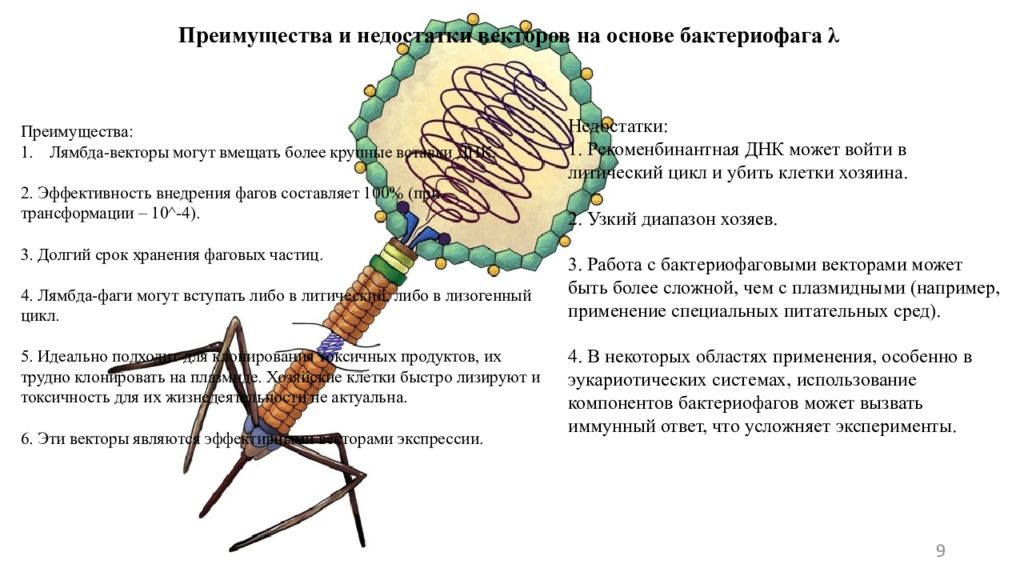
9 Преимущества и недостатки векторов на основе бактериофага λ Преимущества: Лямбда-векторы могут вмещать более крупные вставки ДНК. 2. Эффективность внедрения фагов составляет 100% (при трансформации – 10 ^ -4). 3. Долгий срок хранения фаговых частиц. 4. Лямбда-фаги могут вступать либо в литический, либо в лизогенный цикл. 5. Идеально подходит для клонирования токсичных продуктов, их трудно клонировать на плазмиде. Хозяйские клетки быстро лизируют и токсичность для их жизнедеятельности не актуальна. 6. Эти векторы являются эффективными векторами экспрессии. Недостатки: 1. Рекоменбинантная ДНК может войти в литический цикл и убить клетки хозяина. 2. Узкий диапазон хозяев. 3. Работа с бактериофаговыми векторами может быть более сложной, чем с плазмидными (например, применение специальных питательных сред). 4. В некоторых областях применения, особенно в эукариотических системах, использование компонентов бактериофагов может вызвать иммунный ответ, что усложняет эксперименты.
Слайд 10
10 Геномные библиотеки 1) Образец, содержащий полный геном в растворе, смешивают со многими ферментами рестрикции. Эти ферменты расщепляют большую молекулу ДНК на более мелкие фрагменты генов. 2) При расщеплении образуется набор фрагментов генов, отличающихся по размеру. Фрагменты размером 15 Kb теперь можно разделить с помощью гель-электрофореза. 3) К обоим концам фрагментов гена добавляются когезивные концы, и они встраиваются в молекулы ДНК лямбда-фагов. Эти рекомбинантные фрагменты ДНК затем помещаются в лямбда-фаги. 4) Каждому фагу, содержащему определенный фрагмент, достаточно заразить бактериальные клетки E. Coli, чтобы эти клетки многократно воспроизводили фрагменты ДНК и в конечном итоге лизировали. Мы можем собрать эти фрагменты определенного типа молекулы ДНК для создания геномной библиотеки. 5) Чтобы п роверить геномную библиотеку и найти нужный нам ген, в чашку Петри помещают бактерии и заражаем нужным фагом. Затем в чашку помещают ДНК-зонд с радиоактивной меткой, который комплементарен искомой ДНК, и промывают. Г ибрид с зондом будет только с интересующей нас ДНК.
Слайд 11
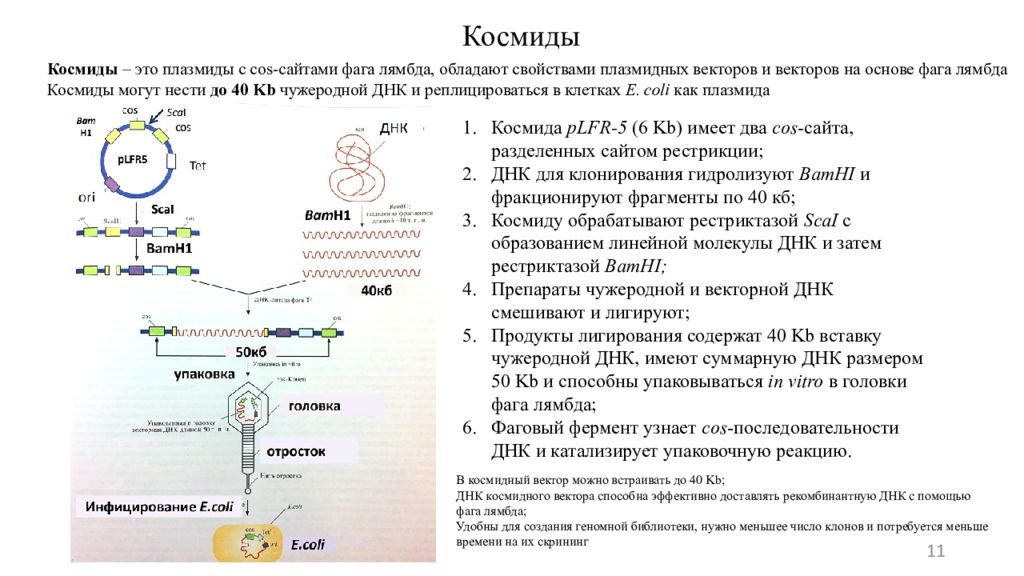
11 Космиды – это плазмиды с cos -сайтами фага лямбда, обладают свойствами плазмидных векторов и векторов на основе фага лямбда Космиды могут нести до 40 Kb чужеродной ДНК и реплицироваться в клетках E. coli как плазмида Космиды Космида pLFR-5 (6 Kb ) имеет два cos -сайта, разделенных сайтом рестрикции; ДНК для клонирования гидролизуют BamHI и фракционируют фрагменты по 40 кб; Космиду обрабатывают рестриктазой ScaI с образованием линейной молекулы ДНК и затем рестриктазой BamHI ; Препараты чужеродной и векторной ДНК смешивают и лигируют ; Продукты лигирования содержат 40 Kb вставку чужеродной ДНК, имеют суммарную ДНК размером 50 Kb и способны упаковываться in vitro в головки фага лямбда; Фаговый фермент узнает cos -последовательности ДНК и катализирует упаковочную реакцию. В космидный вектор можно встраивать до 40 Kb ; ДНК космидного вектора способна эффективно доставлять рекомбинантную ДНК с помощью фага лямбда; Удобны для создания геномной библиотеки, нужно меньшее число клонов и потребуется меньше времени на их скрининг
Слайд 12
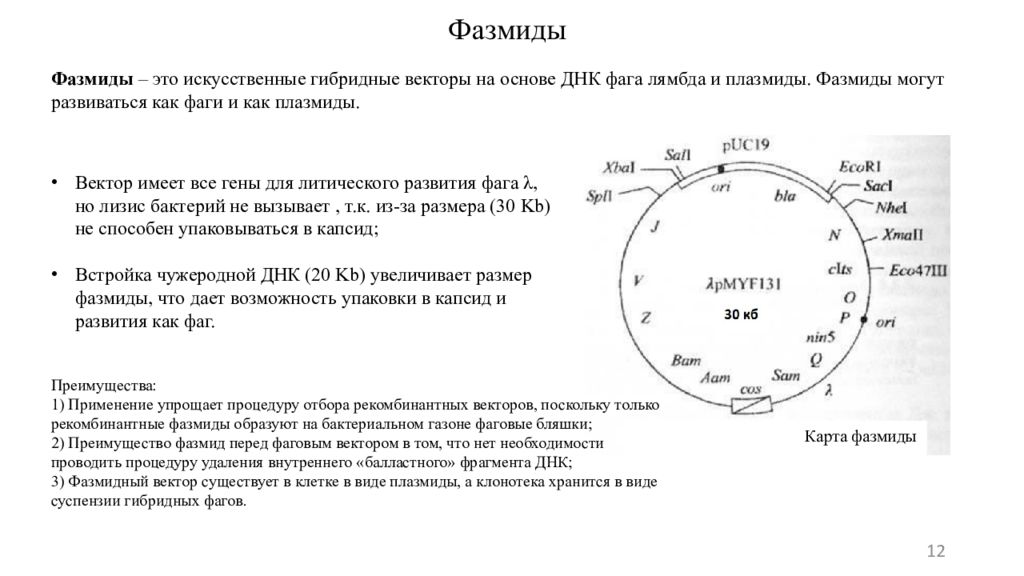
12 Фазмиды Фазмиды – это искусственные гибридные векторы на основе ДНК фага лямбда и плазмиды. Фазмиды могут развиваться как фаги и как плазмиды. Вектор имеет все гены для литического развития фага λ, но лизис бактерий не вызывает, т.к. из-за размера (30 Kb ) не способен упаковываться в капсид ; Встройка чужеродной ДНК (20 Kb ) увеличивает размер фазмиды, что дает возможность упаковки в капсид и развития как фаг. Карта фазмиды Преимущества: 1) Применение упрощает процедуру отбора рекомбинантных векторов, поскольку только рекомбинантные фазмиды образуют на бактериальном газоне фаговые бляшки; 2) Преимущество фазмид перед фаговым вектором в том, что нет необходимости проводить процедуру удаления внутреннего «балластного» фрагмента ДНК; 3) Фазмидный вектор существует в клетке в виде плазмиды, а клонотека хранится в виде суспензии гибридных фагов.