Первый слайд презентации: ФИЗИОЛОГИЯ МЫШЦ
Дальневосточный государственный медицинский университет Кафедра нормальной физиологии Адаптированный перевод текста обучающей программы с иллюстрациями
Слайд 3
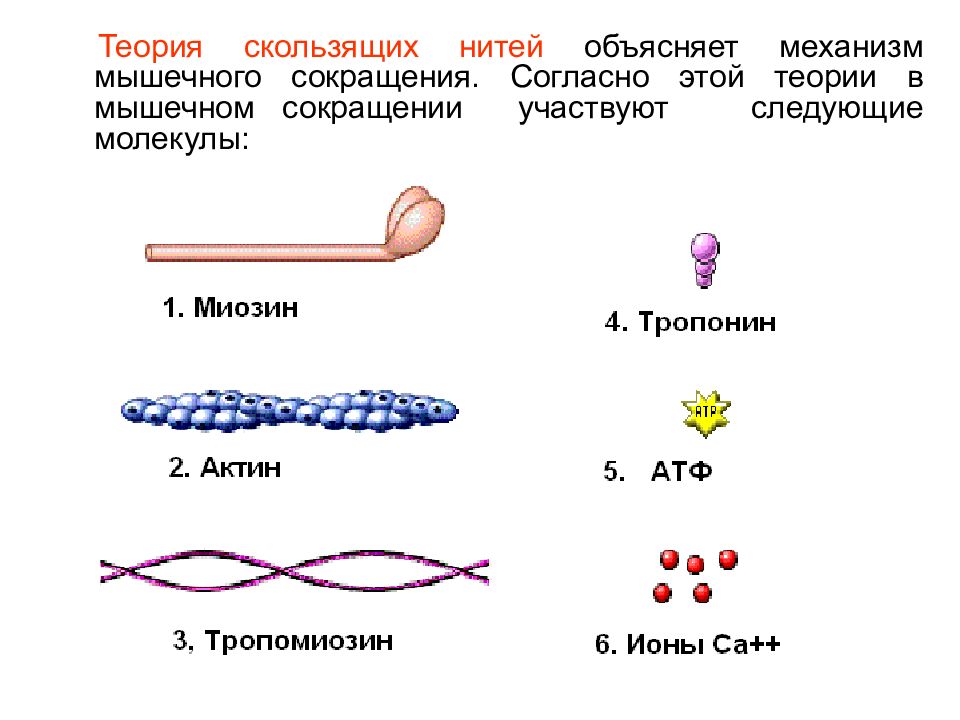
Теория скользящих нитей объясняет механизм мышечного сокращения. Согласно этой теории в мышечном сокращении участвуют следующие молекулы:
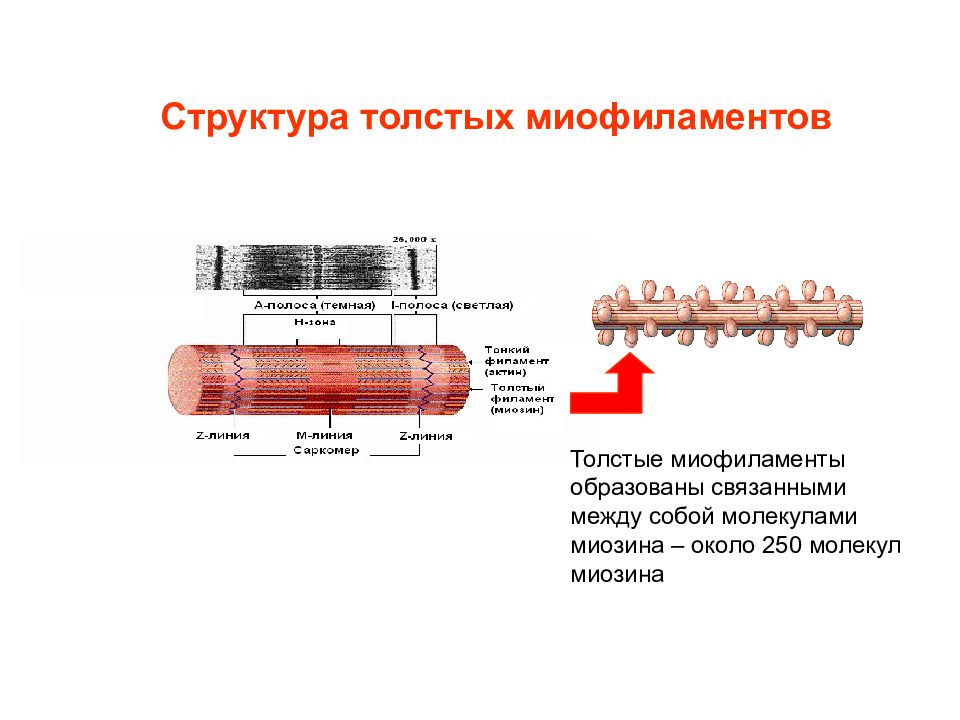
Слайд 4: Структура толстых миофиламентов
Толстые миофиламенты образованы связанными между собой молекулами миозина – около 250 молекул миозина
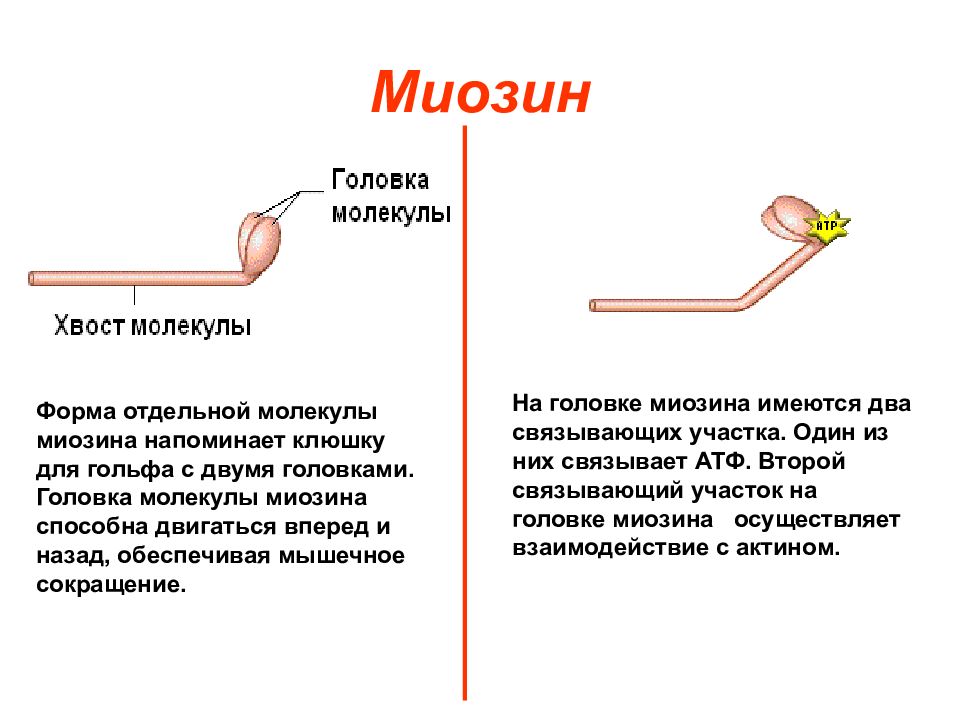
Слайд 5: Миозин
Форма отдельной молекулы миозина напоминает клюшку для гольфа с двумя головками. Головка молекулы миозина способна двигаться вперед и назад, обеспечивая мышечное сокращение. На головке миозина имеются два связывающих участка. Один из них связывает АТФ. Второй связывающий участок на головке миозина осуществляет взаимодействие с актином.
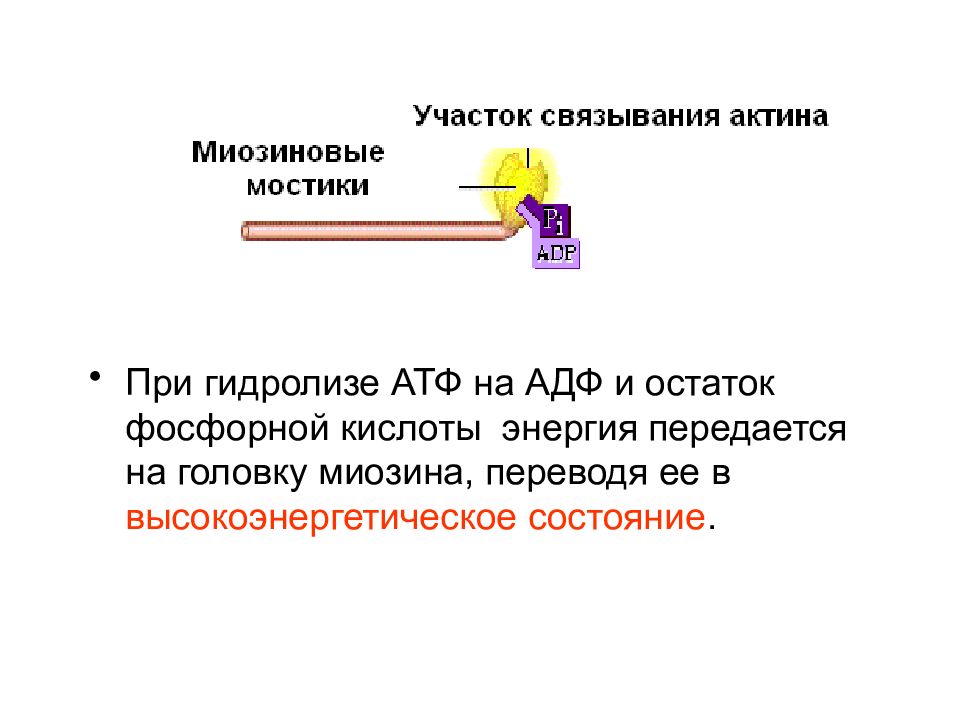
Слайд 6
При гидролизе АТФ на АДФ и остаток фосфорной кислоты энергия передается на головку миозина, переводя ее в высокоэнергетическое состояние.
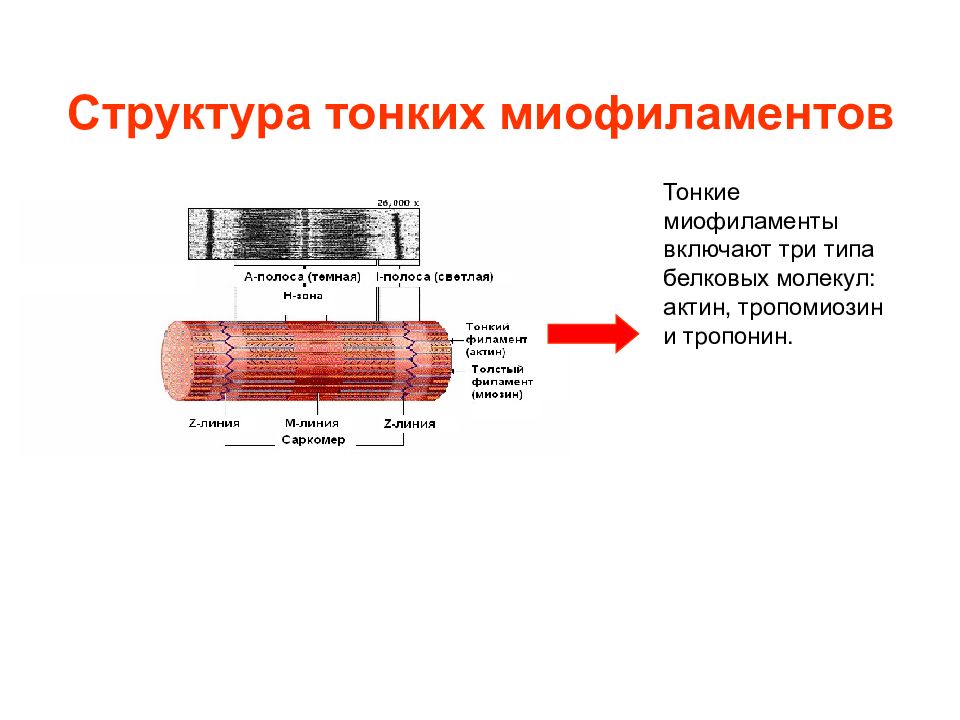
Слайд 7: Структура тонких миофиламентов
Тонкие миофиламенты включают три типа белковых молекул: актин, тропомиозин и тропонин.
Слайд 8: Актин
Актин - основной компонент тонких филаментов. Актиновые субъединицы соединены в виде двух нитей бус, скрученных в двойную винтообразную спираль. Каждая актиновая субъединица имеет участок связывания с головкой миозина.
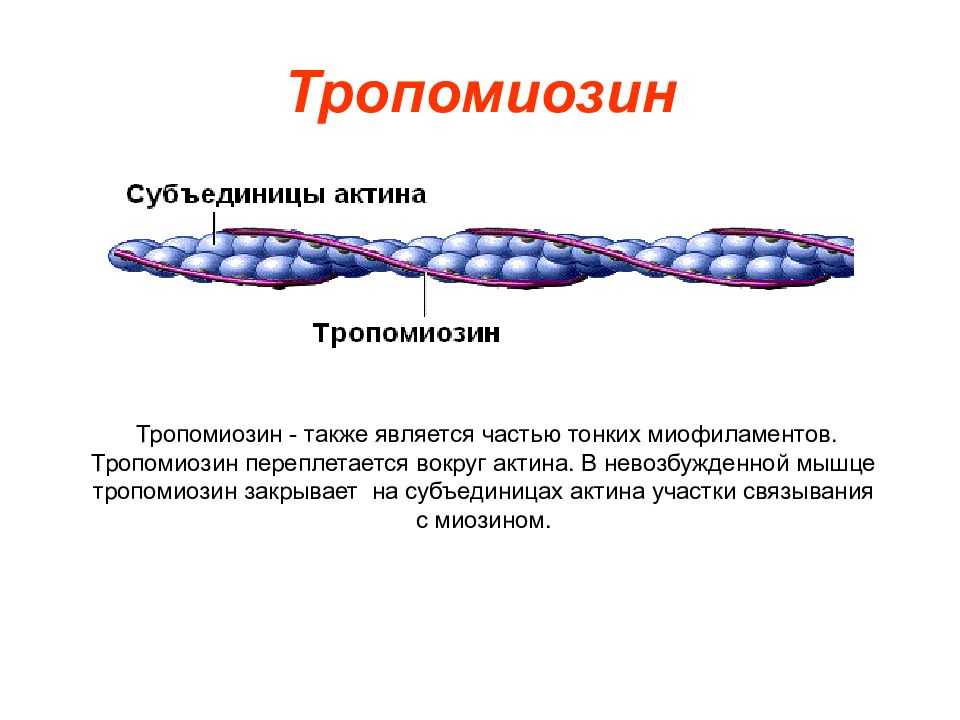
Слайд 9: Тропомиозин
Тропомиозин - также является частью тонких миофиламентов. Тропомиозин переплетается вокруг актина. В невозбужденной мышце тропомиозин закрывает на субъединицах актина участки связывания с миозином.
Слайд 10: Тропонин
Третий белковый компонент тонких миофиламентов тропонин. Молекулы тропонина с определенной периодичностью прилежат к молекулам тропомиозина. Тропонин, связываясь с ионами Са++, изменяет конформацию и сдвигает тропомиозин, освобождая на актиновых субъединицах связующие участки для миозина.
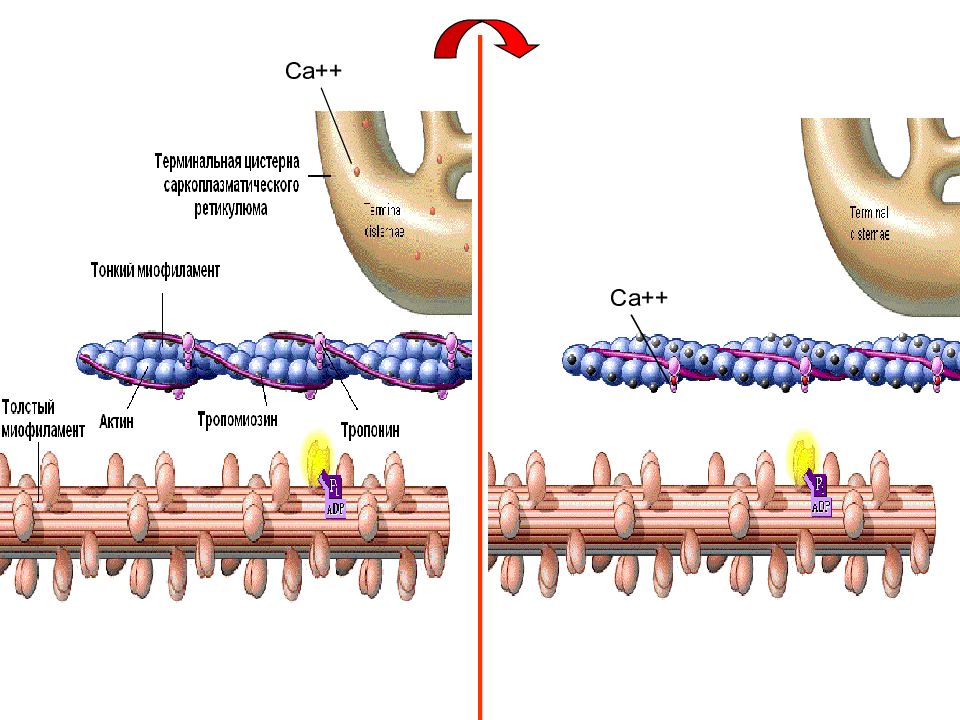
Слайд 11: Первый этап мышечного сокращения – освобождение участков связывания миозина на субъединицах актина
Потенциал действия проходит по мембране мышечного волокна и «заходит» в Т-трубочки. При этом происходит деполяризация мембраны саркоплазматического ретикулума и, вследствие этого, выход ионов Са++ из саркоплазматического ретикулума в цитозоль. Ионы Са++ связываются с тропонином, что приводит к конформационным изменениям в тропонин-тропомиозиновом комплексе и «освобождении» на субъединицах актина участков связывания с миозином.
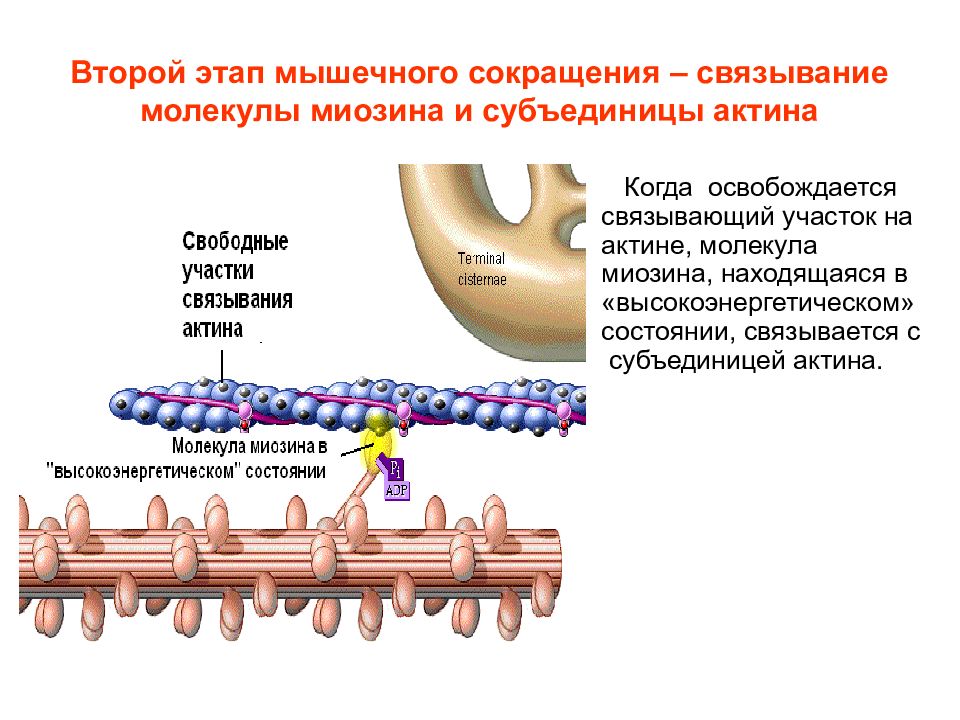
Слайд 13: Второй этап мышечного сокращения – связывание молекулы миозина и субъединицы актина
Когда освобождается связывающий участок на актине, молекула миозина, находящаяся в «высокоэнергетическом» состоянии, связывается с субъединицей актина.
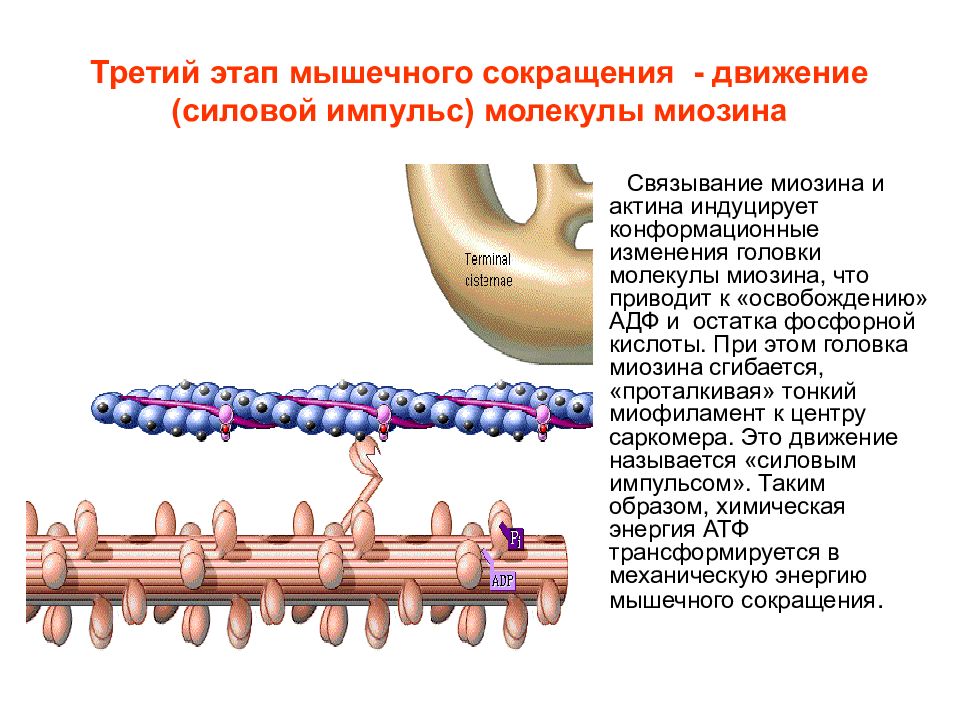
Слайд 14: Третий этап мышечного сокращения - движение (силовой импульс) молекулы миозина
Связывание миозина и актина индуцирует конформационные изменения головки молекулы миозина, что приводит к «освобождению» АДФ и остатка фосфорной кислоты. При этом головка миозина сгибается, «проталкивая» тонкий миофиламент к центру саркомера. Это движение называется «силовым импульсом». Таким образом, химическая энергия АТФ трансформируется в механическую энергию мышечного сокращения.
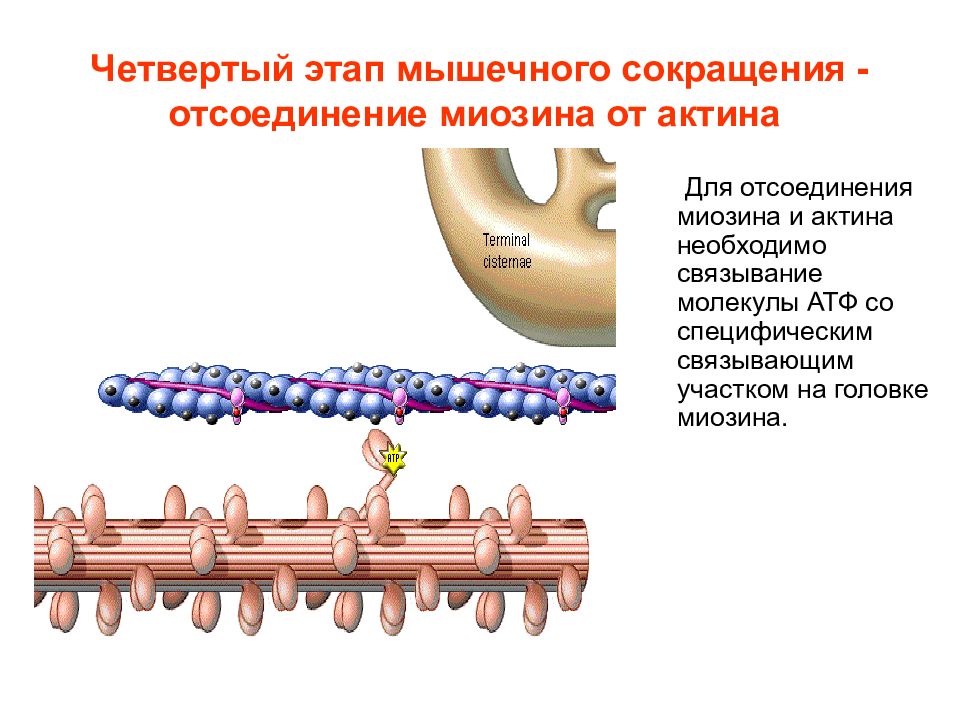
Слайд 15: Четвертый этап мышечного сокращения - отсоединение миозина от актина
Для отсоединения миозина и актина необходимо связывание молекулы АТФ со специфическим связывающим участком на головке миозина.
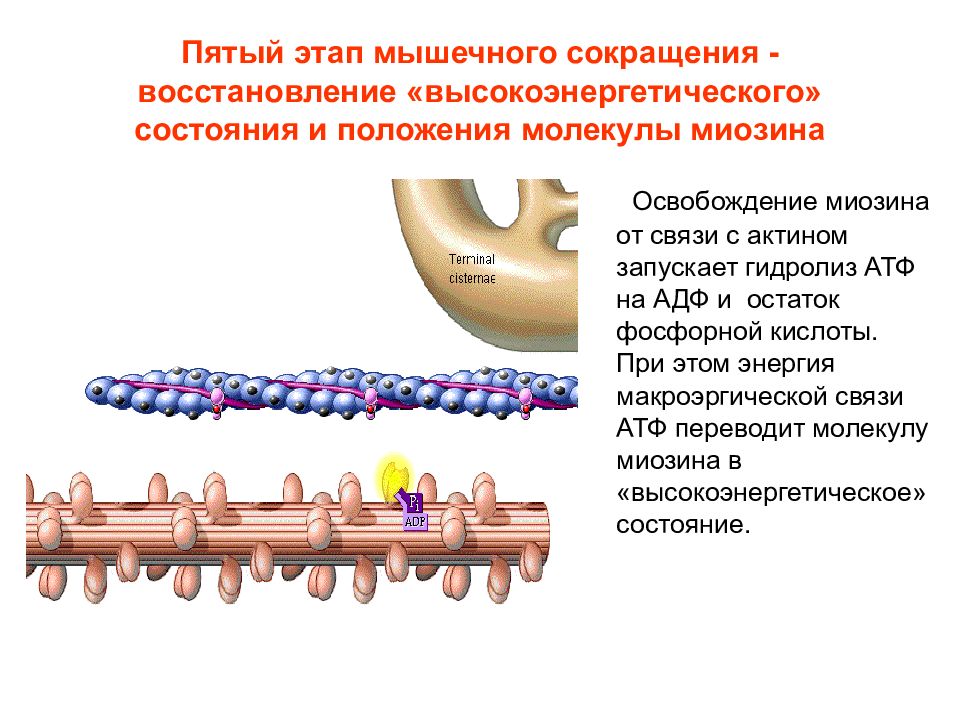
Слайд 16: Пятый этап мышечного сокращения - восстановление «высокоэнергетического» состояния и положения молекулы миозина
Освобождение миозина от связи с актином запускает гидролиз АТФ на АДФ и остаток фосфорной кислоты. При этом энергия макроэргической связи АТФ переводит молекулу миозина в «высокоэнергетическое» состояние.
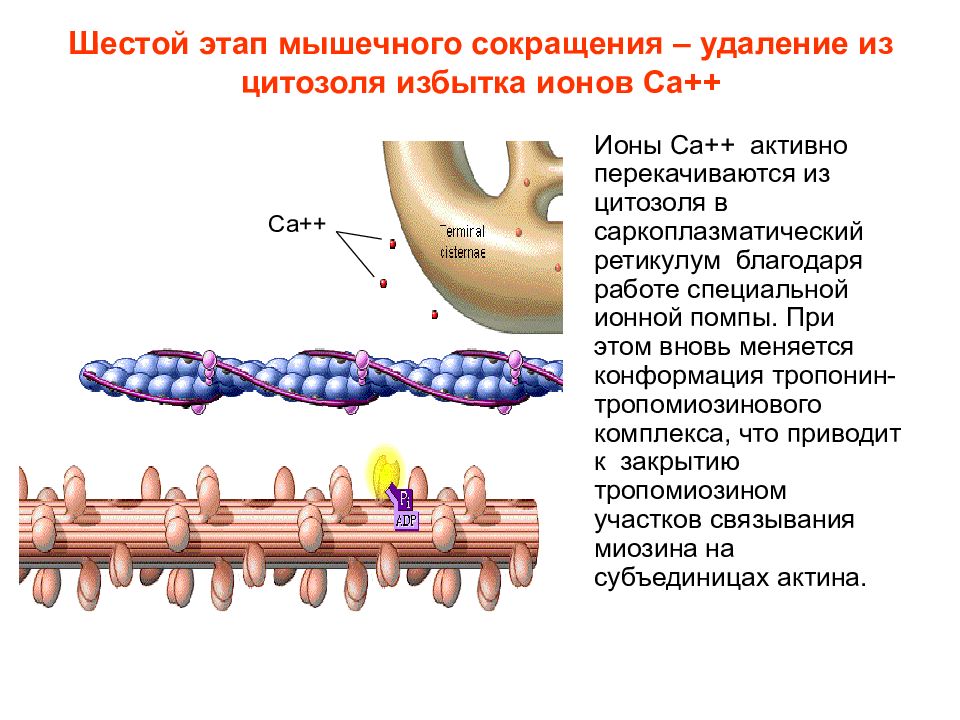
Слайд 17: Шестой этап мышечного сокращения – удаление из цитозоля избытка ионов Са++
Ионы Са++ активно перекачиваются из цитозоля в саркоплазматический ретикулум благодаря работе специальной ионной помпы. При этом вновь меняется конформация тропонин-тропомиозинового комплекса, что приводит к закрытию тропомиозином участков связывания миозина на субъединицах актина. Са++
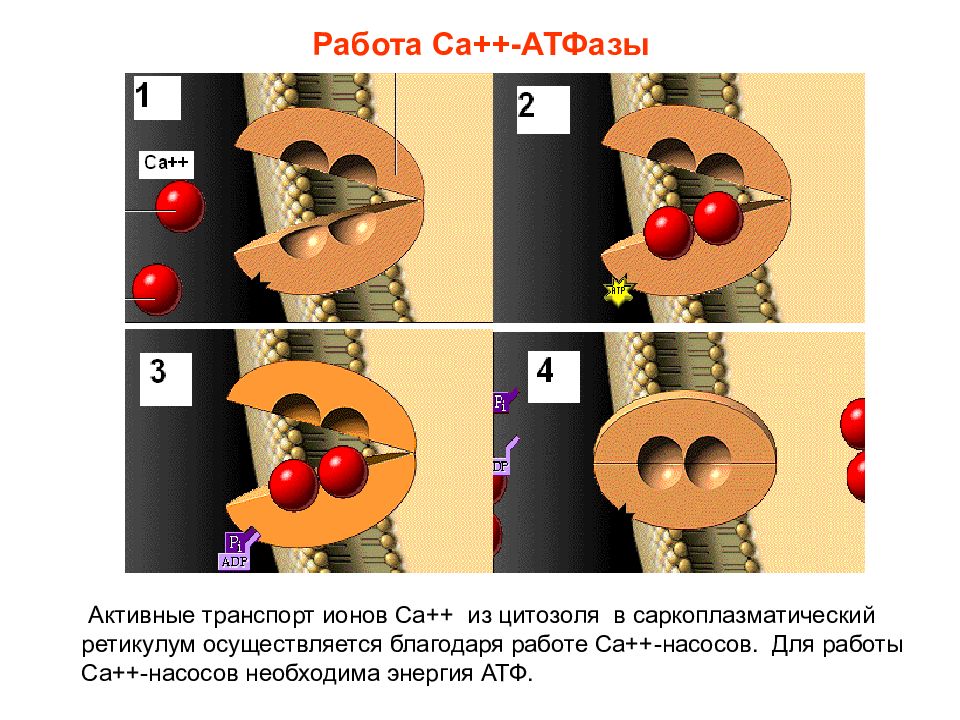
Слайд 18: Работа Са++-АТФазы
Активные транспорт ионов Са++ из цитозоля в саркоплазматический ретикулум осуществляется благодаря работе Са++-насосов. Для работы Са++-насосов необходима энергия АТФ.
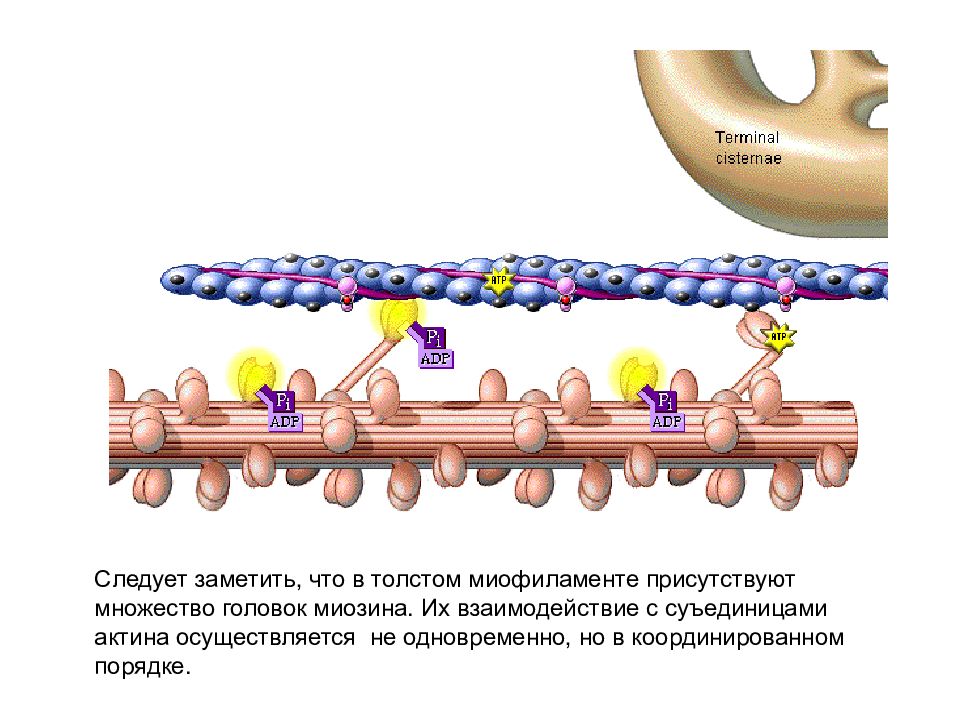
Слайд 19
Следует заметить, что в толстом миофиламенте присутствуют множество головок миозина. Их взаимодействие с суъединицами актина осуществляется не одновременно, но в координированном порядке.
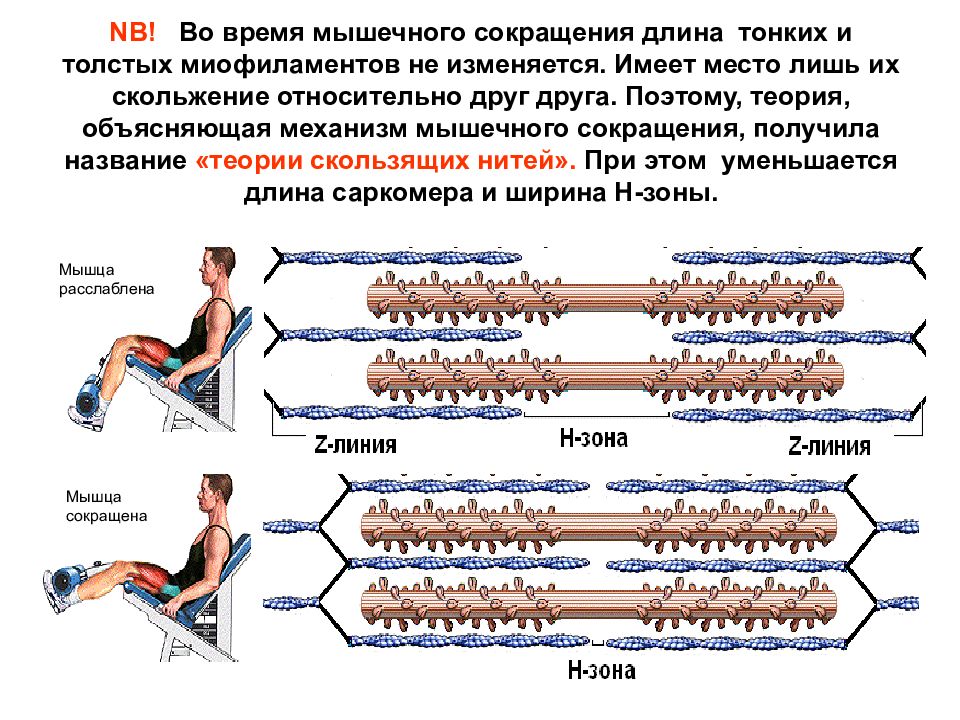
Слайд 20: NB! Во время мышечного сокращения длина тонких и толстых миофиламентов не изменяется. Имеет место лишь их скольжение относительно друг друга. Поэтому, теория, объясняющая механизм мышечного сокращения, получила название «теории скользящих нитей». При этом уменьшается длина саркомера и ширина Н-зоны
Мышца расслаблена Мышца сокращена
Слайд 21: Роль АТФ в мышечном сокращении:
АТФ обеспечивает энергией «силовой импульс» головки молекулы миозина; с помощью АТФ осуществляется разъединение молекул актина и миозина после «силового импульса»; АТФ обеспечивет энергией транспорт ионов Са++ из цитозоля в саркоплазматический ретикулюм после сокращения.