Первый слайд презентации: Gene targeting of HPV18 E6 and E7 synchronously by non-viral transfection of CRISPR/Cas9 system in cervical cancer Синхронное воздействие на гены ВПЧ18 E6 и E7 с помощью невирусной трансфекции системы CRISPR/Cas9 при раке шейки матки
Подготовила: Кушниренко Д., студентка группы 234М СИСТЕМЫ РЕДАКТИРОВАНИЯ ГЕНОМОВ
Слайд 2: система Crispr/cas9
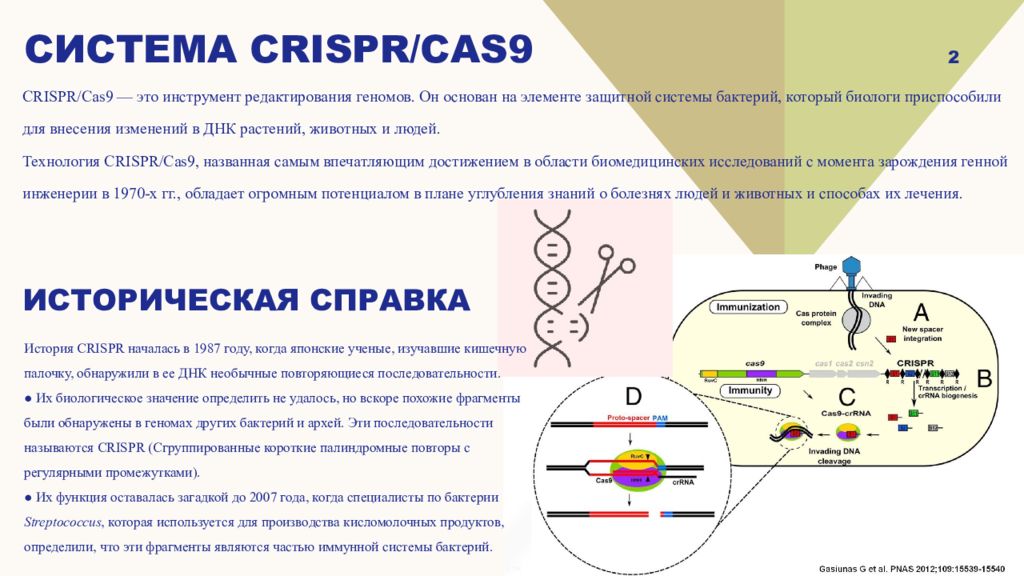
2 История CRISPR началась в 1987 году, когда японские ученые, изучавшие кишечную палочку, обнаружили в ее ДНК необычные повторяющиеся последовательности. ● Их биологическое значение определить не удалось, но вскоре похожие фрагменты были обнаружены в геномах других бактерий и архей. Эти последовательности называются CRISPR (Сгруппированные короткие палиндромные повторы с регулярными промежутками). ● Их функция оставалась загадкой до 2007 года, когда специалисты по бактерии Streptococcus, которая используется для производства кисломолочных продуктов, определили, что эти фрагменты являются частью иммунной системы бактерий. CRISPR/Cas9 — это инструмент редактирования геномов. Он основан на элементе защитной системы бактерий, который биологи приспособили для внесения изменений в ДНК растений, животных и людей. Технология CRISPR/Cas9, названная самым впечатляющим достижением в области биомедицинских исследований с момента зарождения генной инженерии в 1970-х гг., обладает огромным потенциалом в плане углубления знаний о болезнях людей и животных и способах их лечения. Историческая справка
Слайд 3: Историческая справка
В 2011 году биологи Дженнифер Дудна и Эммануэль Шарпантье решили более тщательно изучить механизм CRISPR. Они обнаружили, что белок Cas9 можно обмануть, введя в него искусственную РНК. Белок, несущий такую РНК, будет искать генетические фрагменты, соответствующие тому, что он несет. Дженнифер Дудна (США) и Эммануэль Шарпантье (Франция) получили Нобелевскую премию по химии 2020 года «за развитие метода редактирования генома» (CRISPR/Cas9). Обнаружив совпадение с чужой ДНК, он начнет ее измельчать, независимо от того, кому она принадлежит - вирусу, растению или животному.
Слайд 4: 1
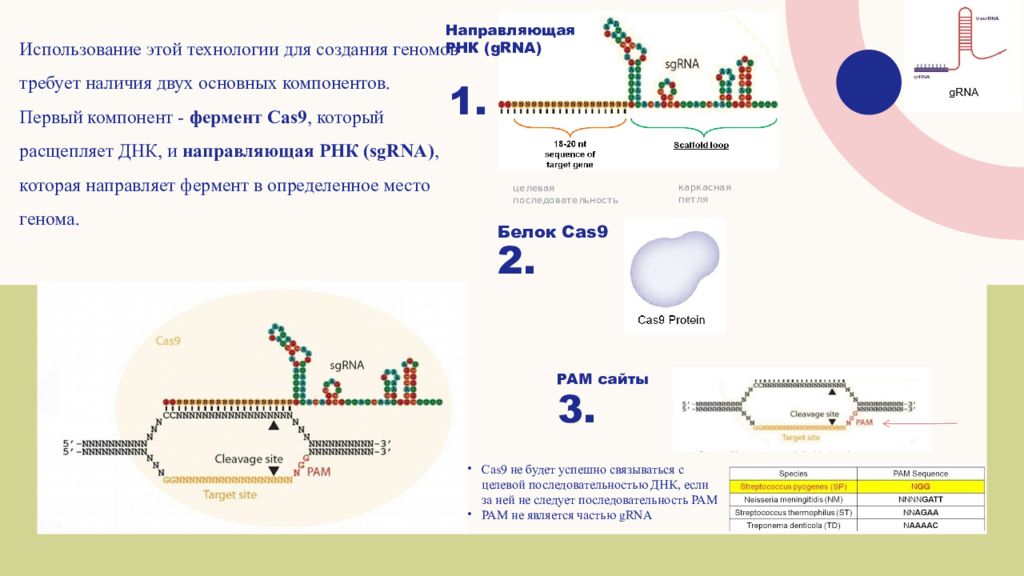
Использование этой технологии для создания геномов требует наличия двух основных компонентов. Первый компонент - фермент Cas9, который расщепляет ДНК, и направляющая РНК ( sgRNA ), которая направляет фермент в определенное место генома. 2. 3. Направляющая РНК ( gRNA ) PAM сайты Белок Cas9 целевая последовательность каркасная петля Cas9 не будет успешно связываться с целевой последовательностью ДНК, если за ней не следует последовательность PAM PAM не является частью gRNA
Слайд 5: механизм действия системы crispr/cas9
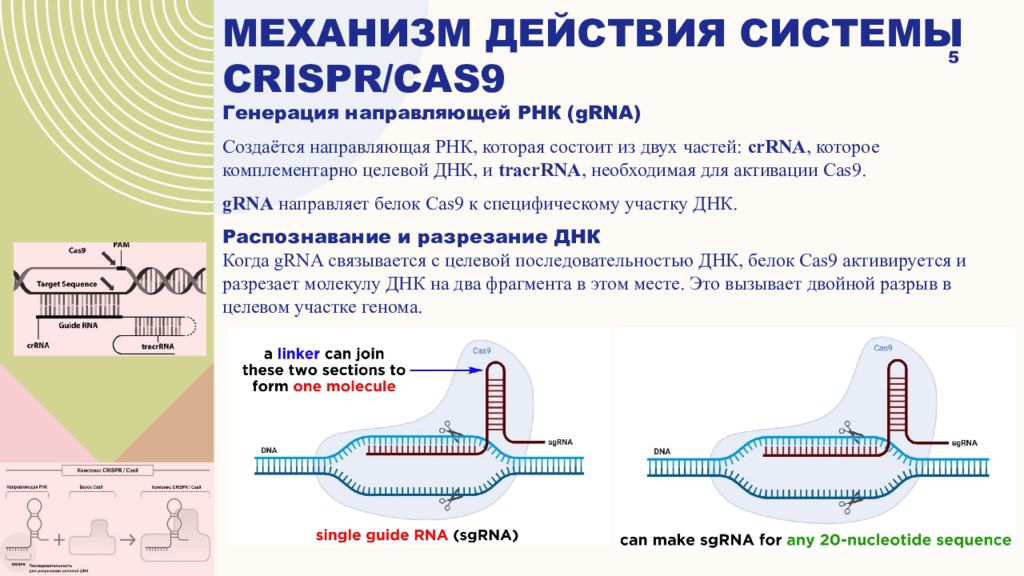
Генерация направляющей РНК (gRNA) Создаётся направляющая РНК, которая состоит из двух частей: crRNA, которое комплементарно целевой ДНК, и tracrRNA, необходимая для активации Cas9. gRNA направляет белок Cas9 к специфическому участку ДНК. Распознавание и разрезание ДНК Когда gRNA связывается с целевой последовательностью ДНК, белок Cas9 активируется и разрезает молекулу ДНК на два фрагмента в этом месте. Это вызывает двойной разрыв в целевом участке генома. 5
Слайд 6: механизм действия системы crispr/cas9
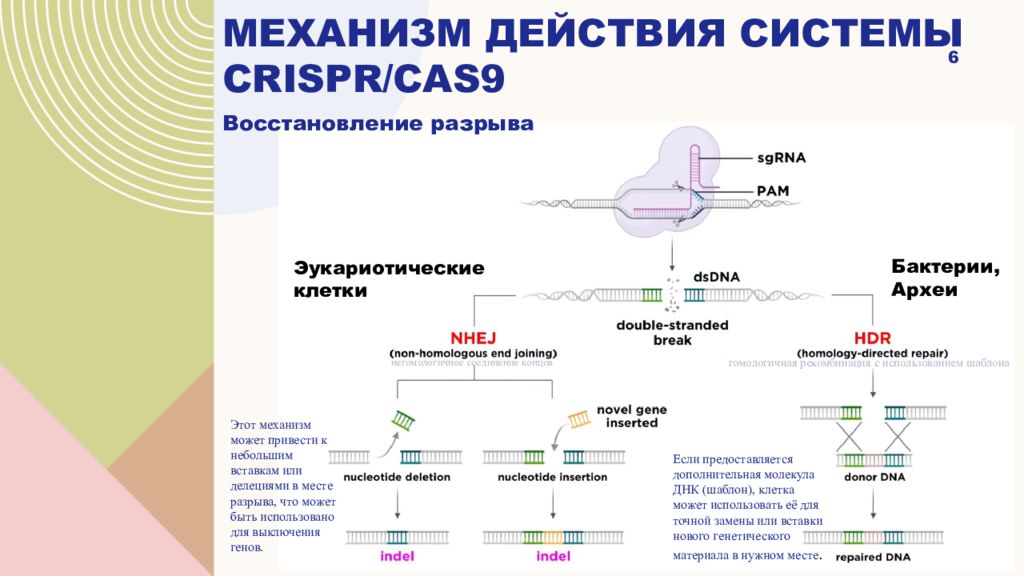
Восстановление разрыва 6 негомологичное соединение концов гомологичная рекомбинация с использованием шаблона Этот механизм может привести к небольшим вставкам или делециями в месте разрыва, что может быть использовано для выключения генов. Если предоставляется дополнительная молекула ДНК (шаблон), клетка может использовать её для точной замены или вставки нового генетического материала в нужном месте. Эукариотические клетки Бактерии, Археи
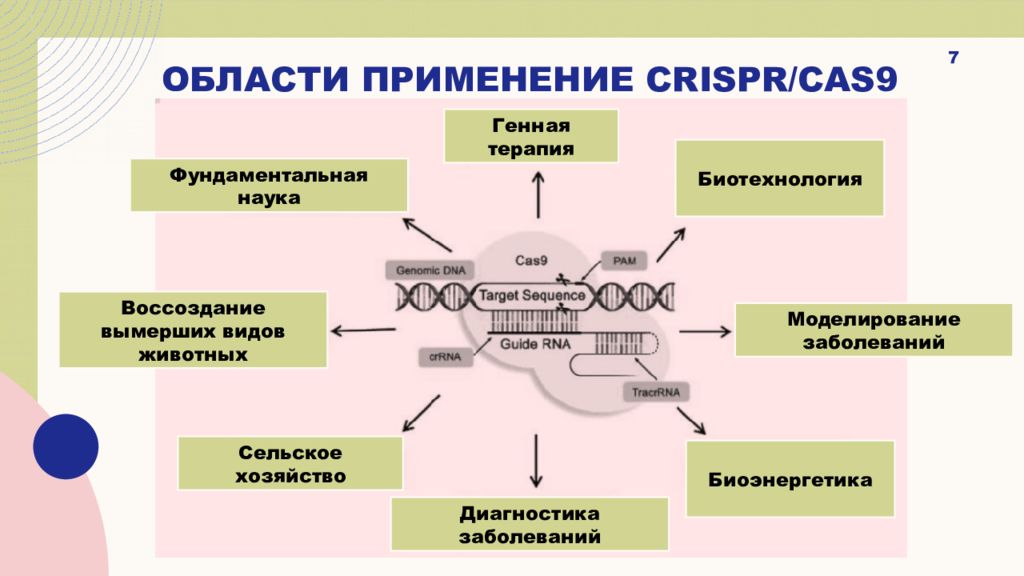
Слайд 7: Области применение crispr/cas9
7 Фундаментальная наука Сельское хозяйство Биотехнология Моделирование заболеваний Генная терапия Диагностика заболеваний Биоэнергетика Воссоздание вымерших видов животных
Слайд 8: введение
Рак шейки матки является одним из наиболее распространенных видов рака среди женщин, и его основным этиологическим фактором является хроническая инфекция высокоонкогенными типами вируса папилломы человека (HPV). Известно, что вирусные онкогены HPV E6 и E7 играют ключевую роль в возникновении и прогрессировании этого заболевания. Эти гены не только способствуют репликации вируса, но и нарушают клеточную пролиферацию и апоптоз, подавляя активность p 53 и ретинобластомного белка ( pRB ). Поэтому их избирательное подавление с помощью новых технологий генетического редактирования, таких как CRISPR/Cas9, представляет собой перспективную стратегию лечения. 8
Слайд 9: введение
Целью данного исследования было разработать систему CRISPR/Cas9 для синхронного нацеливания на гены HPV18 E6 и E7 с использованием немодифицированной трансфекции и оценка эффективности этой терапии как in vitro, так и in vivo. Оценить эффективность одноразового использования CRISPR/Cas9 для одновременной блокировки обоих этих генов и оценить его потенциал как терапевтического метода. 9
Слайд 10: Материалы и методы
10 Для исследования использовались клетки рака шейки матки HeLa и SiHa, содержащие вирус HPV18 и HPV16 соответственно. Система CRISPR/Cas9 была настроена для нацеливания на гены E6 и E7 с использованием однонитевой РНК-направляющей ( sgRNA ) Данный CRISPR/Cas9-вектор был доставлен в клетки с помощью липосом, что является безопасной и эффективной альтернативой вирусной трансфекции. Оценка эффективности проводилась с использованием методов секвенирования, проточной цитометрии, ПЦР, а также анализа пролиферации клеток и их апоптоза. Для эксперимента взяли специальных мышей, называемых голыми мышами. Они не имеют иммунной системы, что позволяет исследователям вводить в них клетки опухолей без риска отторжения. HeLa — линия «бессмертных» клеток, используемая во множестве научных исследований в области биологии и фармакологии. Эта линия раковых клеток, взятых у Генриетты Лакс ( Henrietta Lacks ) — афроамериканки, страдавшей раком шейки матки. SiHa — линия клеток рака шейки матки. Эта линия была изолирована из фрагментов первичной ткани матки 55-летней японской пациентки с плоскоклеточной карциномой.
Слайд 11: ход эксперимента
Конструирование и верификация вектора CRISPR/Cas9 - Разработаны 4 направляющие РНК ( sgRNA ) для нацеливания на гены E6 и E7 HPV18. - Из этих sgRNA были выбраны два наиболее эффективных для создания единого вектора E6E7-KO, который был использован в дальнейшем для трансфекции клеток. - Вектор CRISPR/Cas9, включающий эти sgRNA, был вставлен в плазмиду p330x и верифицирован с использованием с помощью секвенирования. Создание единой плазмиды E6 и E7 CRISPR/Cas9 и эффективность редактирования генов. (а) Сайты-мишени генов E6 и E7 HPV18 в E6E7 и sgRNAs. ( b ) Принципиальная схема векторов E6E7 KO и NC. ( с ) Расщепление ферментом эндонуклеазой. Полосы плазмиды E6E7 KO: ApaLI+XbaI составляли 8250 и 497, 1246 и 1110 п.н. соответственно, в то время как контроль был другим. Это означает, что одна плазмида E6 и E7 CRISPR/Cas9 была успешно сконструирована.
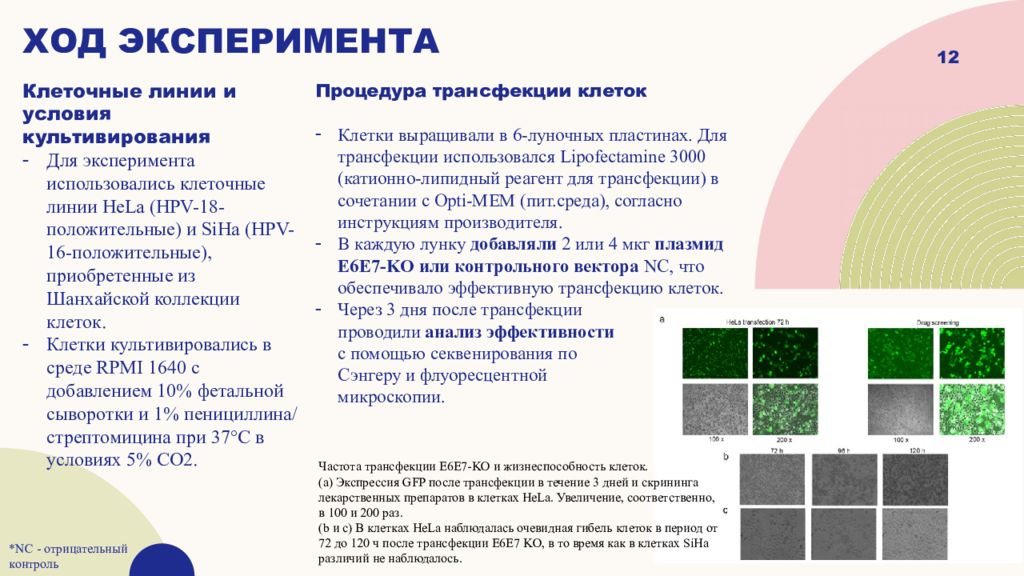
Слайд 12
Клеточные линии и условия культивирования Для эксперимента использовались клеточные линии HeLa (HPV-18-положительные) и SiHa (HPV-16-положительные), приобретенные из Шанхайской коллекции клеток. Клетки культивировались в среде RPMI 1640 с добавлением 10% фетальной сыворотки и 1% пенициллина/стрептомицина при 37°C в условиях 5% CO2. 12 ход эксперимента Процедура трансфекции клеток Клетки выращивали в 6-луночных пластинах. Для трансфекции использовался Lipofectamine 3000 ( катионно -липидный реагент для трансфекции) в сочетании с Opti-MEM ( пит.среда ), согласно инструкциям производителя. В каждую лунку добавляли 2 или 4 мкг плазмид E6E7-KO или контрольного вектора NC, что обеспечивало эффективную трансфекцию клеток. Через 3 дня после трансфекции проводили анализ эффективности с помощью секвенирования по Сэнгеру и флуоресцентной микроскопии. *NC - отрицательный контроль Частота трансфекции E6E7‐KO и жизнеспособность клеток. (а) Экспрессия GFP после трансфекции в течение 3 дней и скрининга лекарственных препаратов в клетках HeLa. Увеличение, соответственно, в 100 и 200 раз. ( b и c ) В клетках HeLa наблюдалась очевидная гибель клеток в период от 72 до 120 ч после трансфекции E6E7 KO, в то время как в клетках SiHa различий не наблюдалось.
Слайд 13
Флуоресцентная активная сортировка клеток или проточная цитометрия (FACS) Этот метод позволил определить количество клеток, в которых происходила экспрессия зеленого флуоресцентного белка (EGFP). Через 3 дня после трансфекции клетки были обработаны с использованием аннексина V (Са2+-зависимый белок, связывающий фосфолипиды, который используется как индикатор апоптоза) и 7-AAD (краситель нуклеиновых кислот) для оценки апоптоза. ПЦР в реальном времени На основе извлеченной мРНК выполняли обратную транскрипцию (RT) и количественную ПЦР (RT- qPCR ) для оценки уровней экспрессии генов E6 и E7 HPV-18. Вестерн-блоттинг После 3-5 дней трансфекции клетки подвергались вестерн-блоттингу для выявления уровня белков E6, E7, p53, p21 и BCL2. Наблюдали повышение уровня белков, регулирующих апоптоз, таких как p53 и p21, в клетках, трансфицированных E6E7-KO, что подтверждает активизацию путей запрограммированной клеточной смерти. 13 ход эксперимента in vitro Оценка пролиферации клеток Пролиферация клеток измерялась с использованием метода CCK-8, который показал замедление роста клеток в E6E7-KO группе. Показала замедление клеточного роста в клетках, трансфицированных E6E7-KO, что подтверждает эффективность подавления опухолевой пролиферации. *CCK-8 (Cell Counting Kit-8) — набор реагентов для определения цитотоксичности и контроля пролиферации клеток Иммуногистохимия Для оценки экспрессии E6 и E7 вирусных белков использовали метод иммуногистохимии. Клетки инкубировали с антителами против E6 и E7 HPV, а затем окрашивали с использованием вторичных антител.
Слайд 14: ход эксперимента in vivo
МОДЕЛИ ОПУХОЛЕЙ У ЖИВОТНЫХ Для in vivo экспериментов использовали пятинедельных мышей. В спинальной области мышей инъецировали 1x10^7 клеток HeLa для создания опухолей. Мыши с подкожными опухолями, индуцированными клетками HeLa, были разделены на 4 группы: контрольная и три экспериментальные с разными дозами E6E7-KO (20, 40, 60 мкг). Вектор CRISPR/Cas9 в опухолевую ткань был введен с помощью липосом, и наблюдалось снижение роста опухоли в экспериментальных группах по сравнению с контрольной. Мышей убивали через 9 дней, после чего проводили иммуногистохимию для анализа состояния опухолей и тканей. Вес мышей и индекс органов не показали значимых изменений, что свидетельствует об отсутствии токсичности от введенных липосомальных наночастиц. Имуногистохимия показала, что в опухолях из экспериментальных групп уровни белков E6 и E7 были снижены, а уровни p53 и p21 увеличились, особенно в группе с высокой дозой. 14 ход эксперимента in vivo
Слайд 15: Промежуточные результаты
15 1. Эффективность трансфекции и генные изменения. После трансфекции в клетки HeLa, CRISPR/Cas9 система успешно снижала уровни экспрессии как E6, так и E7, что приводило к повышению уровней p 53 и p21, ключевых белков, связанных с клеточным апоптозом и ростом. 2. Апоптоз и пролиферация клеток. В клетках HeLa было зафиксировано значительное увеличение апоптоза и снижение клеточной пролиферации после трансфекции CRISPR/Cas9 вектором E6E7-KO. В то же время, в клетках SiHa изменений было меньше, что может указывать на более выраженную эффективность подхода в клетках с HPV18. 3. Оценка in vivo. Эксперименты на мышах показали, что локальная инъекция векторов E6E7-KO с использованием липосомных наночастиц приводит к значительному подавлению роста опухоли. Эффект был дозозависимым : более высокие дозы вектора (60 мкг) давали лучший результат. Важным достижением является то, что терапия не вызывала токсичности, что подтверждается отсутствием изменений в массе тела и органах животных. 4. Механизм действия. Одним из ключевых наблюдений было значительное повышение уровня белка p 53, что указывает на участие пути p53 в антиопухолевом эффекте CRISPR/Cas9 терапии. Кроме того, наблюдалась активация p21, что свидетельствует о влиянии на клеточный цикл и апоптоз.
Слайд 16: Итог
in vitro • В клетках HeLa (рака шейки матки) плазмида CRISPR/Cas9 (E6E7-KO) вызывала гибель клеток (апоптоз) и снижала рост клеток. Было отмечено значительное снижение пролиферации клеток в группе E6E7-KO по сравнению с неконтролируемыми клетками. • Этот эффект не наблюдался в другом типе клеток рака шейки матки (SiHa), что указывает на специфический ответ клеток. in vivo • Иммуногистохимический анализ опухолевых тканей показал пониженное содержание белков E6 и E7 в опухолевых клетках, а также увеличение уровня p53, что подтверждает активное подавление вирусной экспрессии и стимуляцию клеточного ответа. Однако следует отметить, что необходимо было проводить инъекции каждые три дня для повышения эффективности лечения. • Результаты предполагают, что CRISPR/Cas9 может стать многообещающим методом лечения рака шейки матки за счет нацеливания на гены, связанные с ВПЧ (HPV). • Не-вирусные системы доставки, такие как липосомы, эффективны для доставки CRISPR/Cas9 и показывают большой потенциал для клинического использования без вреда для организма. 16