Слайд 2: Темір, вольфрам және сынаптың балқу температуралары сәйкесінше 1538 o C, 3422 o C және -39 o C. Неліктен металдардың балқу температуралары әртүрлі?
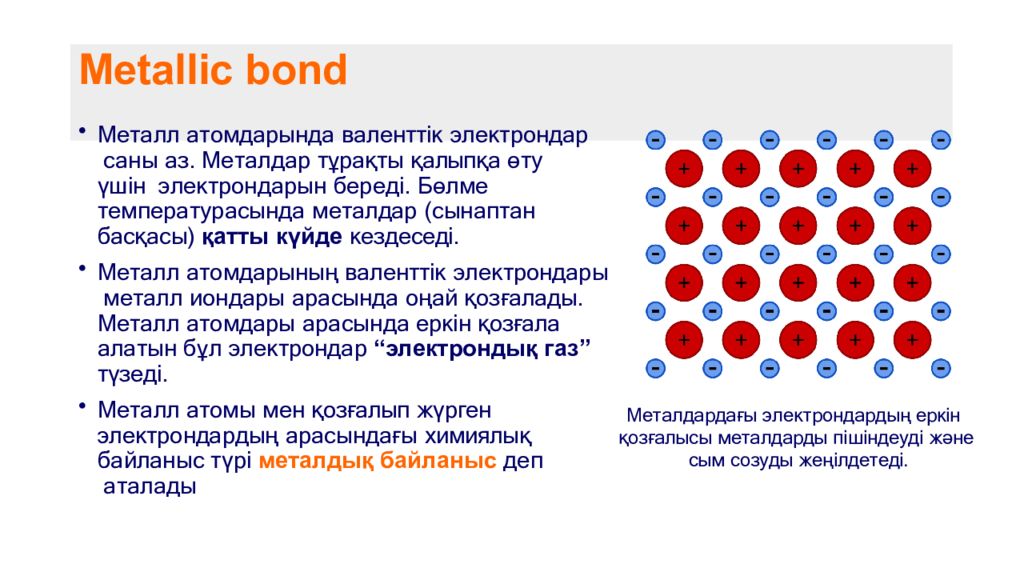
Слайд 3: Metallic bond
Металл атомдарында валенттік электрондар саны аз. Металдар тұрақты қалыпқа өту үшін электрондарын береді. Бөлме температурасында металдар (сынаптан басқасы) қатты күйде кездеседі. Металл атомдарының валенттік электрондары металл иондары арасында оңай қозғалады. Металл атомдары арасында еркін қозғала алатын бұл электрондар “электрондық газ” түзеді. Металл атомы мен қозғалып жүрген электрондардың арасындағы химиялық байланыс түрі металдық байланыс деп аталады Металдардағы электрондардың еркін қ озғалысы металдарды пішіндеуді және сым созуды жеңілдетеді.
Слайд 4: Metallic bond
Металл атомдары арасында еркін қозғалатын электрондар металдардың жылу мен электр энергиясының жақсы өткізуіне с ебеп болып табылады. Еркін электрондар металл бойымен қозғалатындықтан, олар электр тогын өткізе алады. Сондай-ақ, металдарға жылтырау, сымға созылу, тапталу қасиеттері тән. Металдың валенттік электрондары көбейген сайын металдық байланыс та күшті болады. Алюминийдегі металдық байланыс ең күшті, ал Na- да ең әлсіз. Сәйкесінше натрий, магний және алюминийдің балқу температуралары 98°C, 650°C және 660°C –ты құрайды.
Слайд 5: Metallic crystal lattice
Периодтық кестедегі барлық элементтердің 80%-ы металдар болып табылады. Олардың барлығы дерлік қатты күйде кездеседі, және де олардың балқу температуралары, қаттылығы және майысқақтығы әр түрлі. Аталған қасиеттер металдағы кристалдық тор құрылысымен түсіндіріледі. Металдық кристалдық тордың негізгі 3 типі бар: кубтық көлемді орталықтанған, кубтық бүйірлі орталықтанған және гексагональды тығыздалған (алты бұрышты).
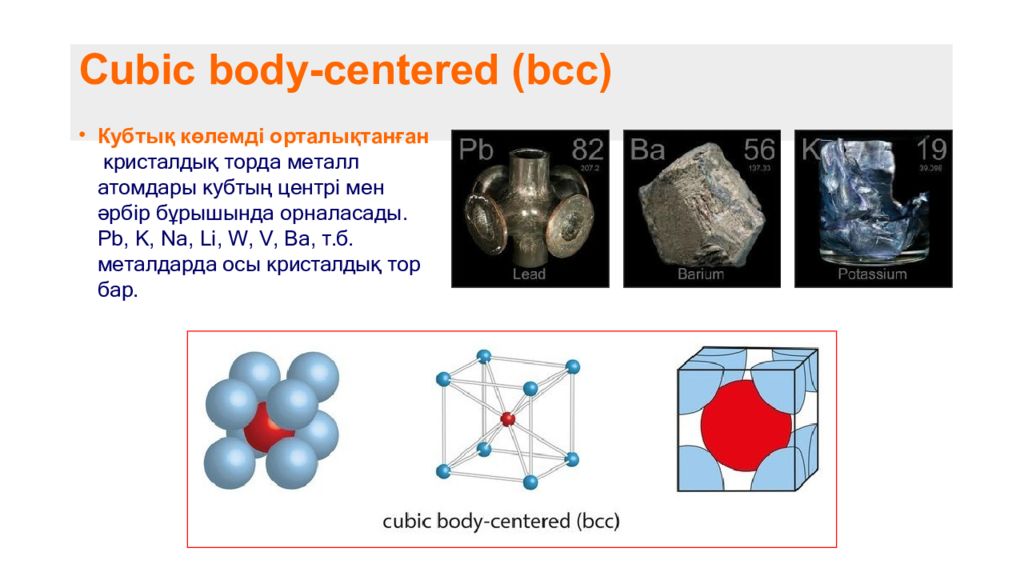
Слайд 6: Cubic body-centered (bcc)
Кубтық көлемді орталықтанған кристалдық торда металл атомдары кубтың центрі мен әрбір бұрышында орналасады. Pb, K, Na, Li, W, V, Ba, т.б. металдарда осы кристалдық тор бар.
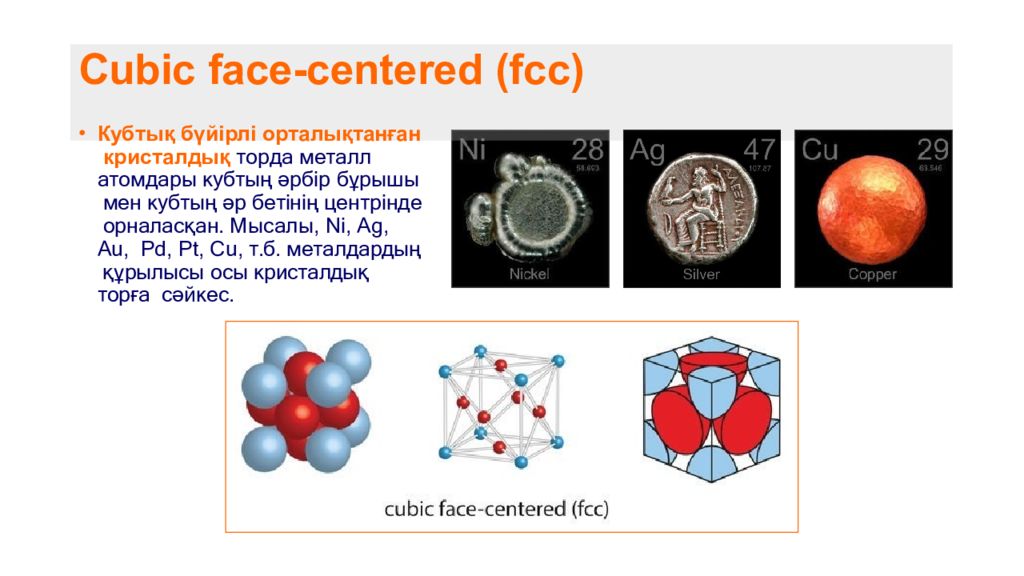
Слайд 7: Cubic face-centered ( fcc )
Кубтық бүйірлі орталықтанған кристалдық торда металл атомдары кубтың әрбір бұрышы мен кубтың әр бетінің центрінде орналасқан. Мысалы, Ni, Ag, Au, Pd, Pt, Cu, т.б. металдардың құрылысы осы кристалдық торға сәйкес.
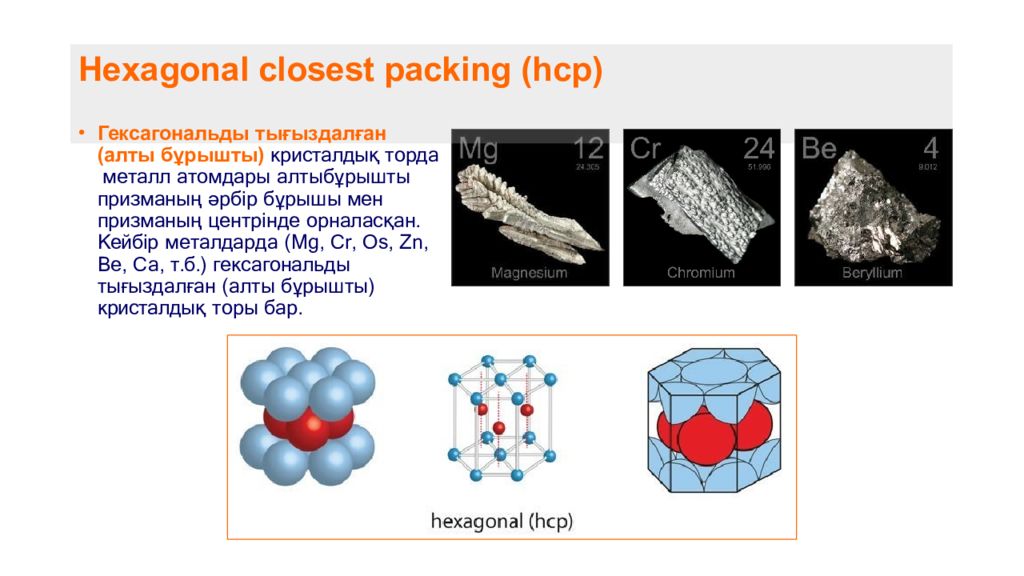
Слайд 8: Hexagonal closest packing ( hcp )
Гексагональды тығыздалған (алты бұрышты) кристалдық торда металл атомдары алтыбұрышты призманың әрбір бұрышы мен призманың центрінде орналасқан. Кейбір металдарда (Mg, Cr, Os, Zn, Be, Ca, т.б.) гексагональды тығыздалған (алты бұрышты) кристалдық торы бар.
Слайд 9: Chemical properties of metals
Көп металдардың валенттік электрондар саны аз болып келеді. Сол себепті, химиялық реакцияларда металдар тотықсыздандырғыш қызметін атқарады және сыртқы электрон қабатын тұрақтандыру үшін басқа элементтерге электрондарын береді (тотығады): Na → Na + + e - Mg → Mg 2+ + 2e - Енді, металдардың кейбір химиялық қасиеттеріне тоқталсақ. Металдар оттегімен реакцияласып оксидтер түзеді: Магний + Оттегі → Магний оксиді 2Mg( s ) + O 2 ( g ) → 2MgO( s ) Белсенді металдар сумен әрекеттесіп сілті мен сутек газын түзеді: Натрий + Су → Натрий гидроксиді + Сутегі 2Na( s ) + 2H 2 O( l ) → 2NaOH( aq.) + H 2 ( g ) Металдар қышқылдарда еріп, тұз бен сутек газын түзеді: Мырыш + Күкірт қышқылы → Мырыш сульфаты + Сутегі Zn( s ) + H 2 SO 4 ( dil.) → ZnSO 4 ( aq.) + H 2 ( g ) Ауада магнийдің жануы
Последний слайд презентации: General properties of metals: Бекіту тапсырмалары:
Хром мен мырыш қайда қолданылады? Металдардың негізгі физикалық қасиеттерін жазыңыз. Құлаққаптар жасауда қандай металдар қолданылады? Келесі металдар үшін кристалдық торлардың түрлерін анықтаңыз: Au, Fe, Ca, Cr. Металдар мен бейметалдардың айырмашылығы неде? Төмендегі металды қасиетіне қарап анықтаңыз: X элементі икемді және электр тогын жақсы өткізгіш болып табылады. Оның қызыл-қызғылт сары металл жылтырлығы бар және сымдар жасауда қолданылады.