Первый слайд презентации: Генетическая связь между основными классами органических соединений
Слайд 2
Алиса (в Стране Чудес Чеширскому коту): – Скажите, а куда мне отсюда идти? Чеширский кот: – Это зависит от того, куда Вы хотите придти? 2
Слайд 4
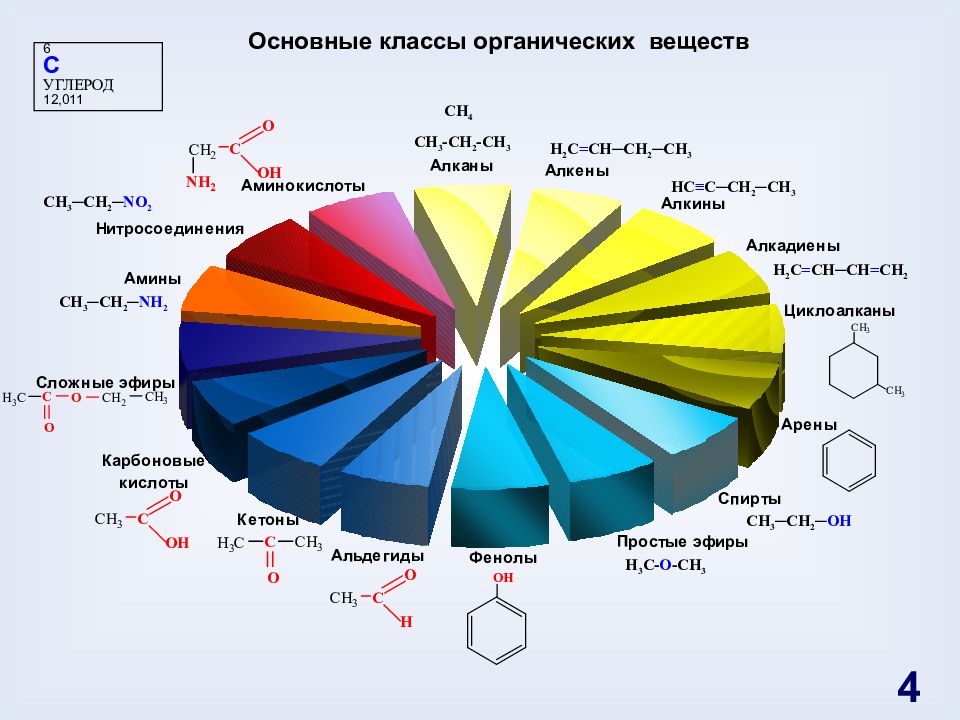
H 3 C- O -CH 3 CH 3 -CH 2 -CH 3 6 C УГЛЕРОД 12,011 Основные классы органических веществ H 2 C = CH─CH 2 ─CH 3 HC ≡ C─CH 2 ─CH 3 H 2 C = CH─CH = CH 2 CH 3 ─CH 2 ─ OH CH 3 ─CH 2 ─ NH 2 CH 3 ─CH 2 ─ NO 2 CH 4 4
Слайд 5
Стратегия синтеза «Я хочу воспеть хвалу сотворению молекул – химическому синтезу… …Я глубоко убежден, что он и есть искусство. И в то же время синтез – это логика». Роальд Хоффман ( Нобелевская премия по химии 1981 г ) Выбор исходного сырья Построение углеродного остова молекулы Введение, удаление или замена функциональной группы Защита группы Стереоселективность 5
Слайд 6
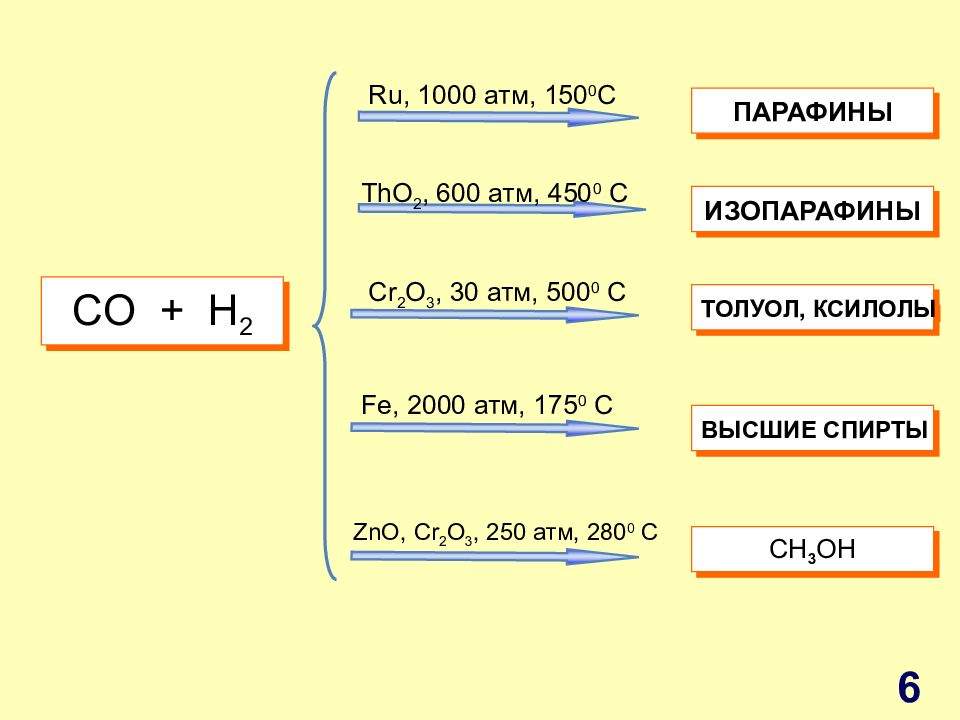
С O + H 2 Ru, 1000 атм, 150 0 C ThO 2, 600 атм, 450 0 C Cr 2 O 3, 30 атм, 500 0 C Fe, 2000 атм, 175 0 C ZnO, Cr 2 O 3, 250 атм, 280 0 C ПАРАФИНЫ ИЗОПАРАФИНЫ ТОЛУОЛ, КСИЛОЛЫ ВЫСШИЕ СПИРТЫ С H 3 OH 6
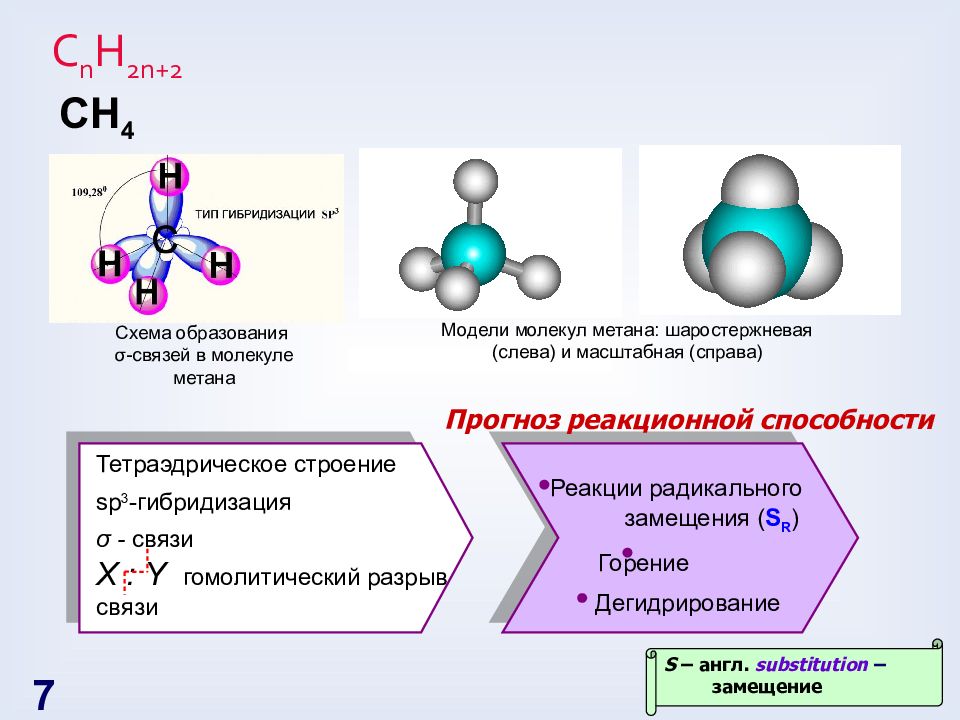
Слайд 7: С n H 2n+2
Схема образования σ -связей в молекуле метана Модели молекул метана: шаростержневая (слева) и масштабная (справа) С H 4 Тетраэдрическое строение sp 3 - гибридизация σ - связи X : Y гомолитический разрыв связи Реакции радикального замещения ( S R ) Горение Дегидрирование S – англ. substitution – замещение Прогноз реакционной способности 7
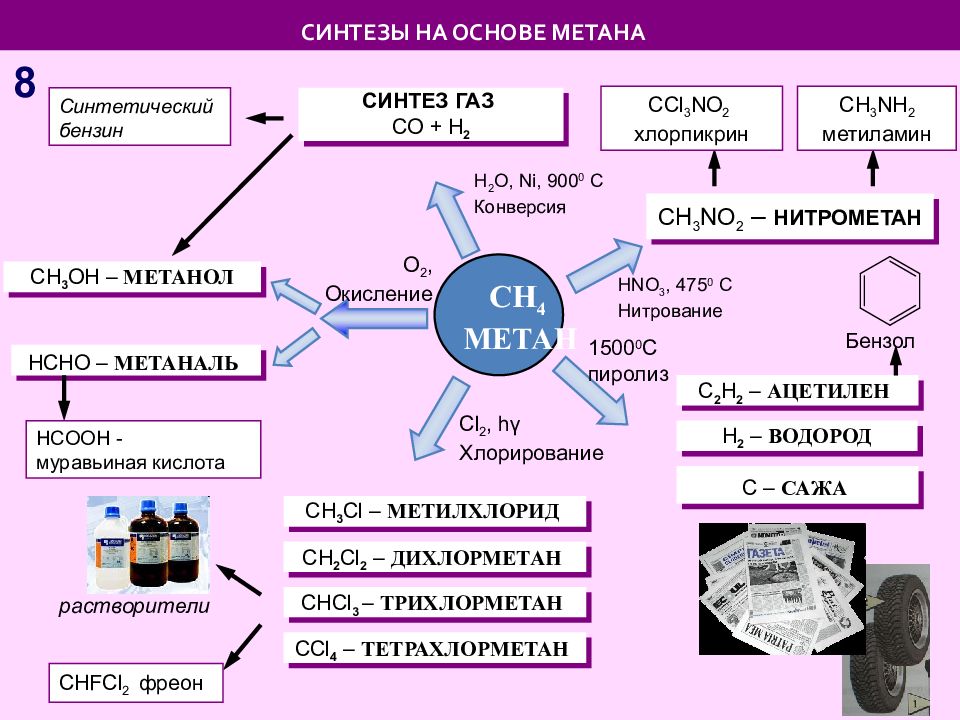
Слайд 8: СИНТЕЗЫ НА ОСНОВЕ МЕТАНА
С H 3 Cl – МЕТИЛХЛОРИД CH 4 МЕТАН С – САЖА С 2 Н 2 – АЦЕТИЛЕН С H 2 Cl 2 – ДИХЛОРМЕТАН С HCl 3 – ТРИХЛОРМЕТАН С Cl 4 – ТЕТРАХЛОРМЕТАН Н 2 – ВОДОРОД СИНТЕЗ ГАЗ С O + H 2 С l 2, h γ Хлорирование 1500 0 С пиролиз Н 2 О, Ni, 900 0 C Конверсия О 2, Окисление С H 3 OH – МЕТАНОЛ HCHO – МЕТАНАЛЬ растворители Бензол С HFCl 2 фреон HCOOH - муравьиная кислота Синтетический бензин СИНТЕЗЫ НА ОСНОВЕ МЕТАНА 8 С H 3 NO 2 – НИТРОМЕТАН С Cl 3 NO 2 хлорпикрин С H 3 NH 2 метиламин HNO 3, 475 0 C Нитрование
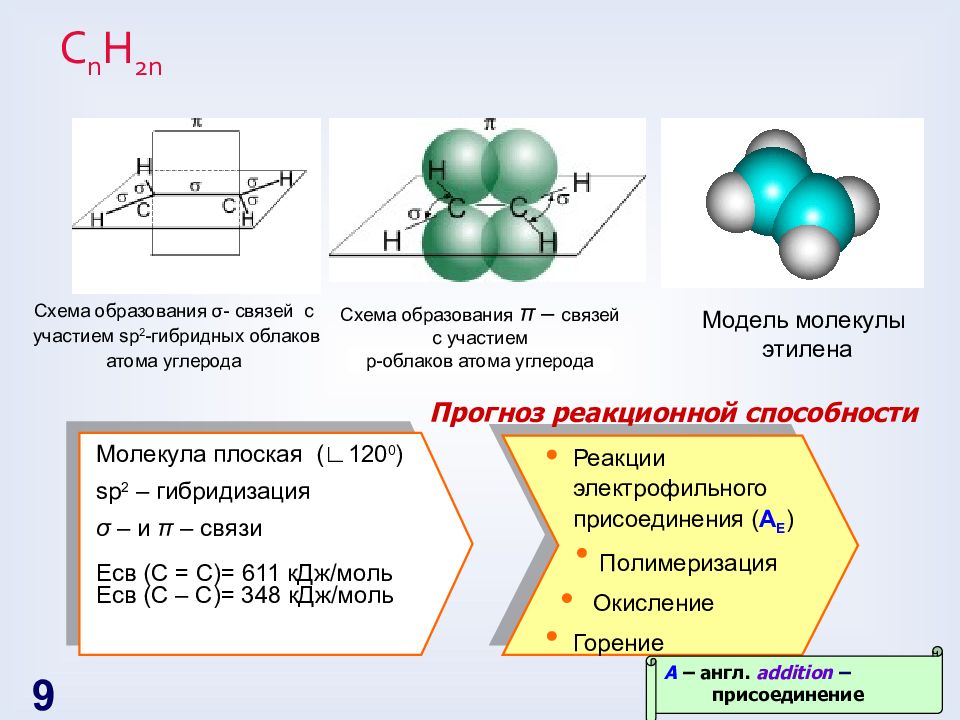
Слайд 9: С n H 2n
Схема образования σ - связей с участием sp 2 -гибридных облаков атома углерода Схема образования π – связей с участием p- облаков атома углерода Модель молекулы этилена Реакции электрофильного присоединения ( A E ) Полимеризация Окисление Горение Молекула плоская ( ∟ 120 0 ) sp 2 – гибридизация σ – и π – связи Есв (С = С)= 611 кДж / моль Есв (С – С)= 348 кДж / моль A – англ. addition – присоединение Прогноз реакционной способности 9
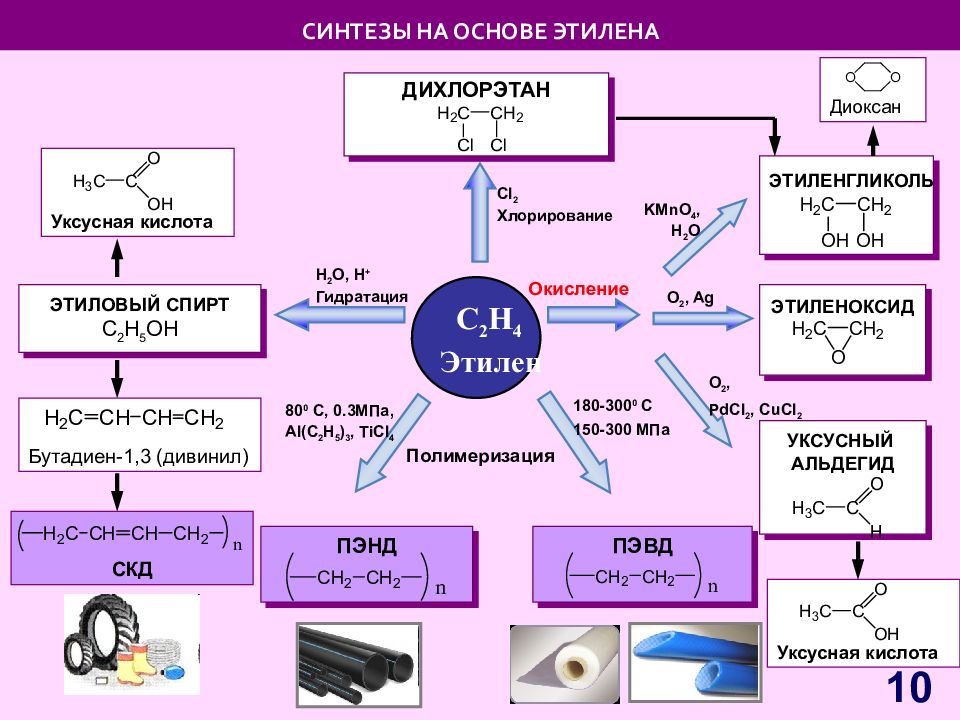
Слайд 10: СИНТЕЗЫ НА ОСНОВЕ ЭТИЛЕНА
C 2 H 4 Этилен Полимеризация H 2 O, H + Гидратация Cl 2 Хлорирование Окисление ЭТИЛОВЫЙ СПИРТ С 2 Н 5 OH СИНТЕЗЫ НА ОСНОВЕ ЭТИЛЕНА ДИХЛОРЭТАН ЭТИЛЕНОКСИД ЭТИЛЕНГЛИКОЛЬ УКСУСНЫЙ АЛЬДЕГИД O 2, Ag KMnO 4, H 2 O O 2, PdCl 2, CuCl 2 ПЭНД 180-300 0 С 150-300 МПа 80 0 С, 0.3МПа, Al(C 2 H 5 ) 3, TiCl 4 СКД ПЭВД Бутадиен-1,3 (дивинил) Уксусная кислота Диоксан Уксусная кислота 10
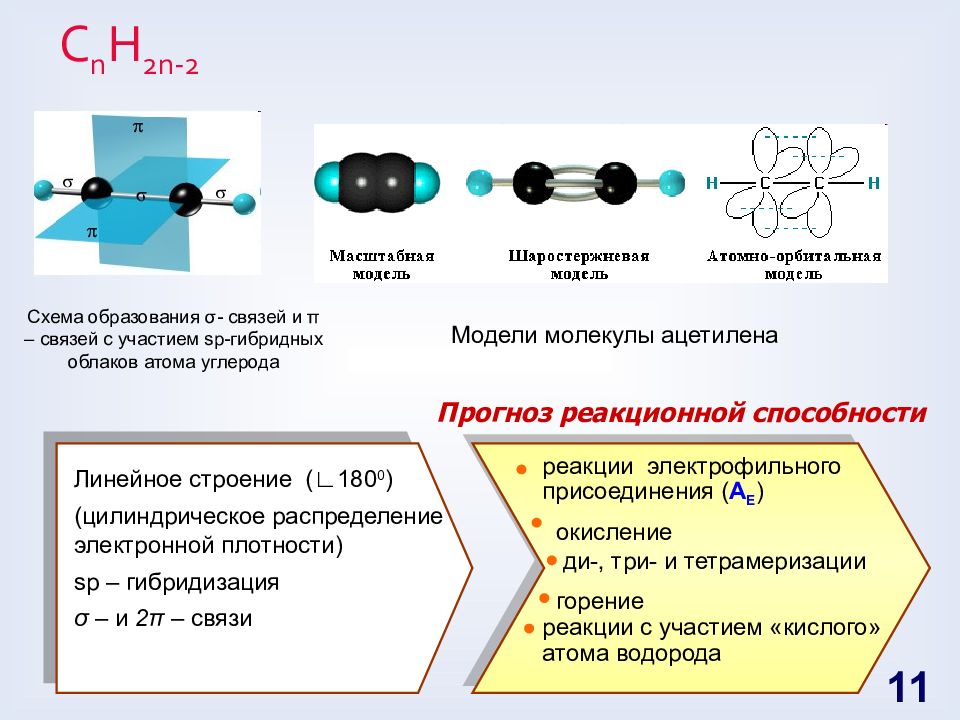
Слайд 11: С n H 2n -2
Схема образования σ - связей и π – связей с участием sp -гибридных облаков атома углерода Модели молекулы ацетилена реакции электрофильного присоединения ( A E ) окисление ди-, три- и тетрамеризации горение реакции с участием «кислого» атома водорода Линейное строение ( ∟ 180 0 ) (цилиндрическое распределение электронной плотности) sp – гибридизация σ – и 2 π – связи Прогноз реакционной способности 11
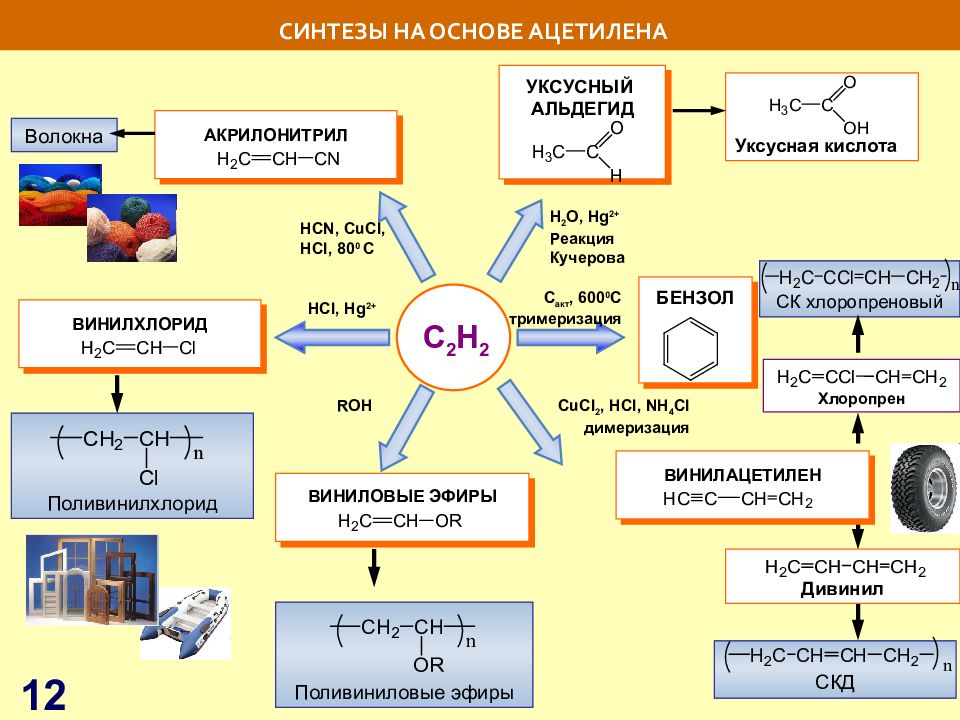
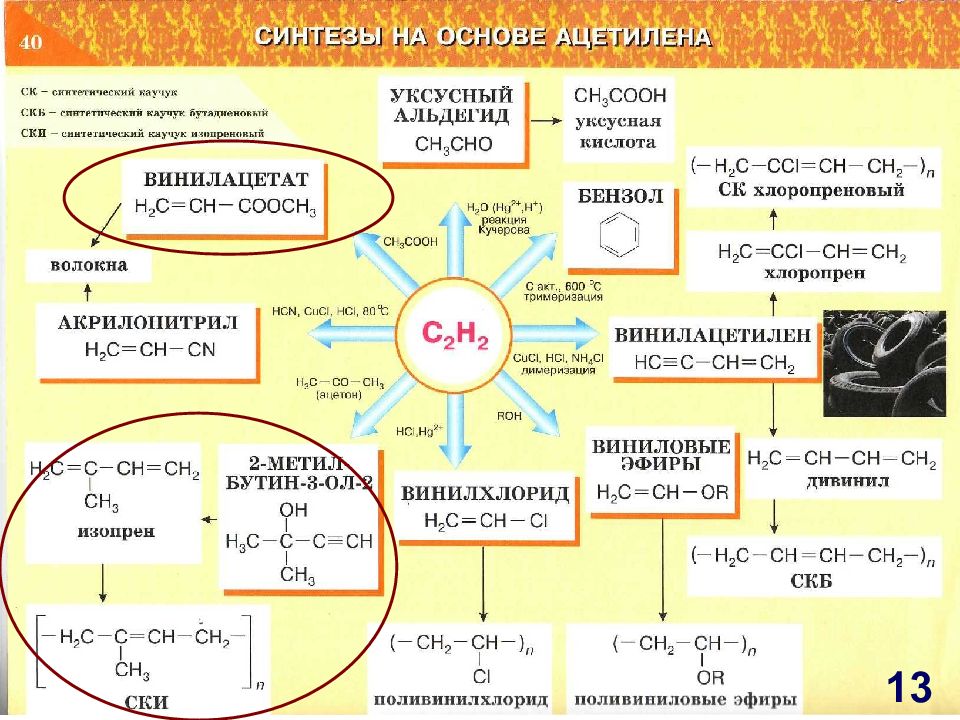
Слайд 12: СИНТЕЗЫ НА ОСНОВЕ АЦЕТИЛЕНА
C 2 H 2 H С l, Hg 2+ H 2 O, Hg 2+ Реакция Кучерова С акт, 600 0 С тримеризация СИНТЕЗЫ НА ОСНОВЕ АЦЕТИЛЕНА УКСУСНЫЙ АЛЬДЕГИД С uCl 2, HCl, NH 4 Cl димеризация ROH Уксусная кислота БЕНЗОЛ СКД Дивинил Хлоропрен СК хлоропреновый ВИНИЛАЦЕТИЛЕН ВИНИЛОВЫЕ ЭФИРЫ Поливиниловые эфиры Поливинилхлорид ВИНИЛХЛОРИД HCN, С uCl, HCl, 80 0 C АКРИЛОНИТРИЛ Волокна 12
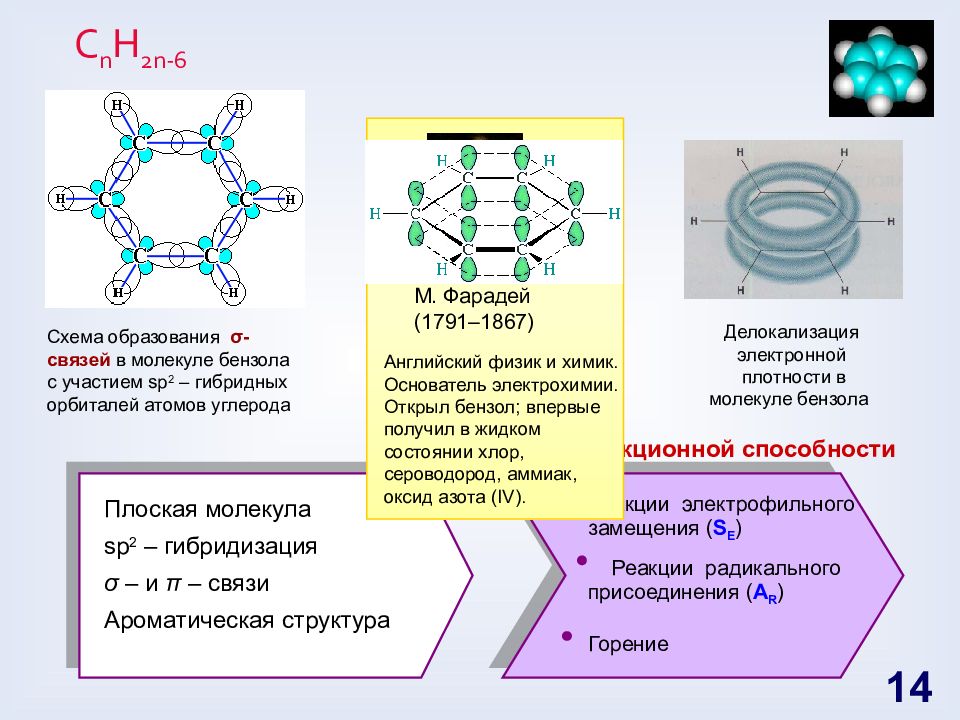
Слайд 14: С n H 2n -6
Схема образования π -связей в молекуле бензола Делокализация электронной плотности в молекуле бензола Схема образования σ -связей в молекуле бензола с участием sp 2 – гибридных орбиталей атомов углерода С n H 2n -6 Прогноз реакционной способности Плоская молекула sp 2 – гибридизация σ – и π – связи Ароматическая структура Реакции электрофильного замещения ( S E ) Реакции радикального присоединения ( А R ) Горение 14 М. Фарадей (1791–1867) Английский физик и химик. Основатель электрохимии. Открыл бензол; впервые получил в жидком состоянии хлор, сероводород, аммиак, оксид азота ( IV).
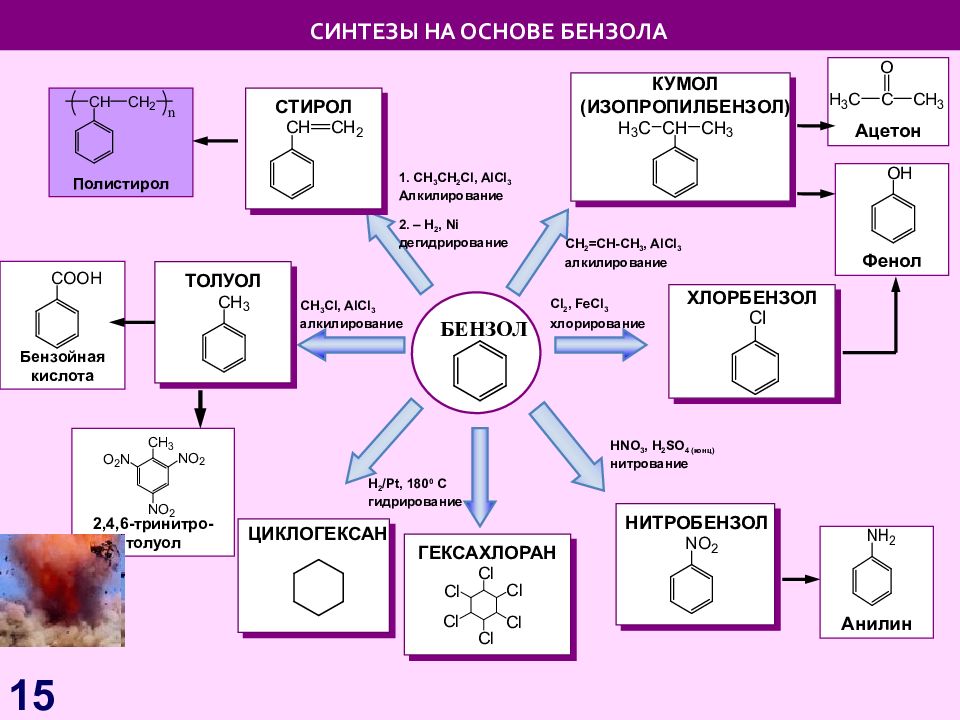
Слайд 15: СИНТЕЗЫ НА ОСНОВЕ БЕНЗОЛА
БЕНЗОЛ H 2 /Pt, 180 0 C гидрирование СИНТЕЗЫ НА ОСНОВЕ БЕНЗОЛА НИТРОБЕНЗОЛ С l 2, FeCl 3 хлорирование HNO 3, H 2 SO 4 ( конц) нитрование CH 3 Cl, AlCl 3 алкилирование ХЛОРБЕНЗОЛ Анилин ТОЛУОЛ Бензойная кислота 2,4,6-тринитро-толуол СТИРОЛ Полистирол 1. С H 3 CH 2 Cl, AlCl 3 Алкилирование 2. – H 2, Ni дегидрирование С H 2 =CH-CH 3, AlCl 3 алкилирование КУМОЛ (ИЗОПРОПИЛБЕНЗОЛ) ЦИКЛОГЕКСАН Фенол Ацетон ГЕКСАХЛОРАН 15
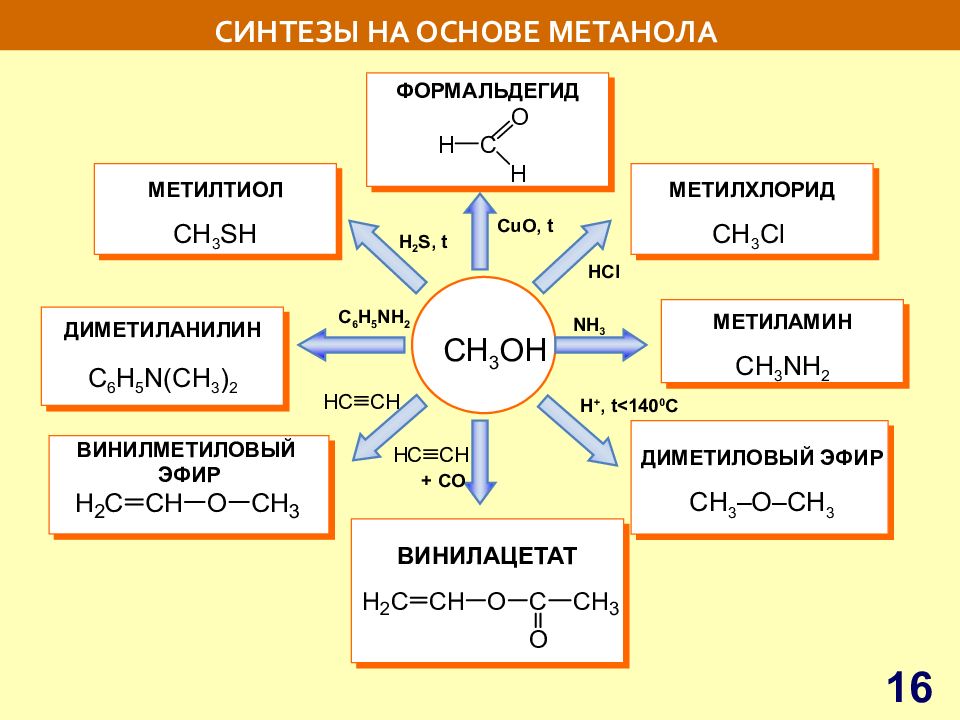
Слайд 16: СИНТЕЗЫ НА ОСНОВЕ МЕТАНОЛА
С H 3 OH ВИНИЛМЕТИЛОВЫЙ ЭФИР ДИМЕТИЛАНИЛИН C 6 H 5 N(CH 3 ) 2 ДИМЕТИЛОВЫЙ ЭФИР CH 3 –O–CH 3 МЕТИЛАМИН СН 3 NH 2 ВИНИЛАЦЕТАТ МЕТИЛХЛОРИД СН 3 С l ФОРМАЛЬДЕГИД С uO, t HCl NH 3 МЕТИЛТИОЛ СН 3 SH H 2 S, t С 6 H 5 NH 2 + CO 16 H +, t<140 0 C
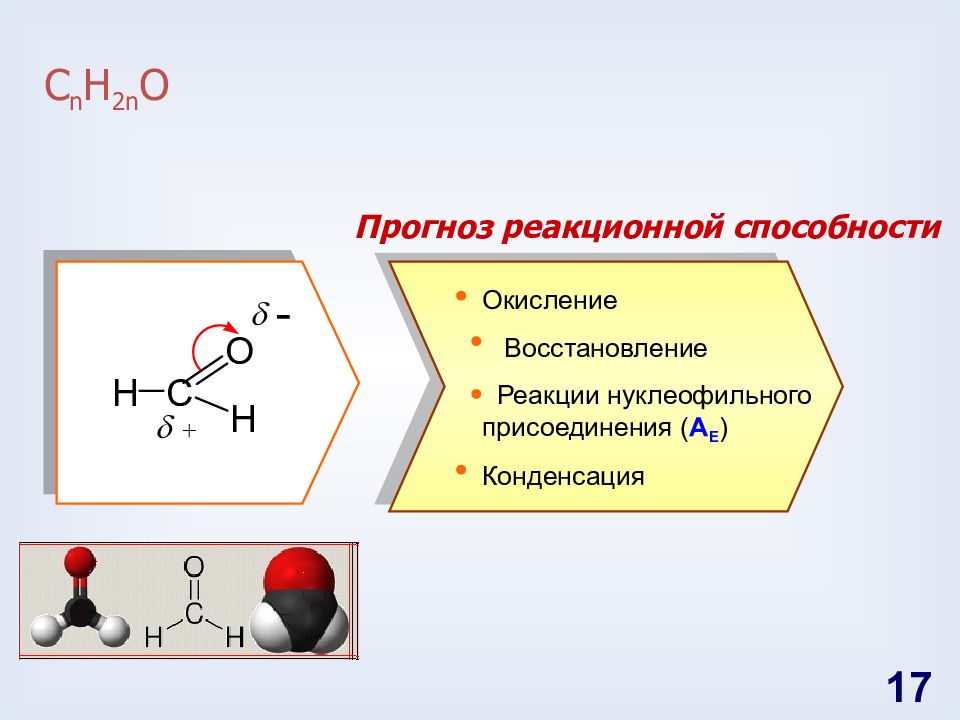
Слайд 17: С n H 2n O
Прогноз реакционной способности Окисление Восстановление Реакции нуклеофильного присоединения ( A E ) Конденсация 17
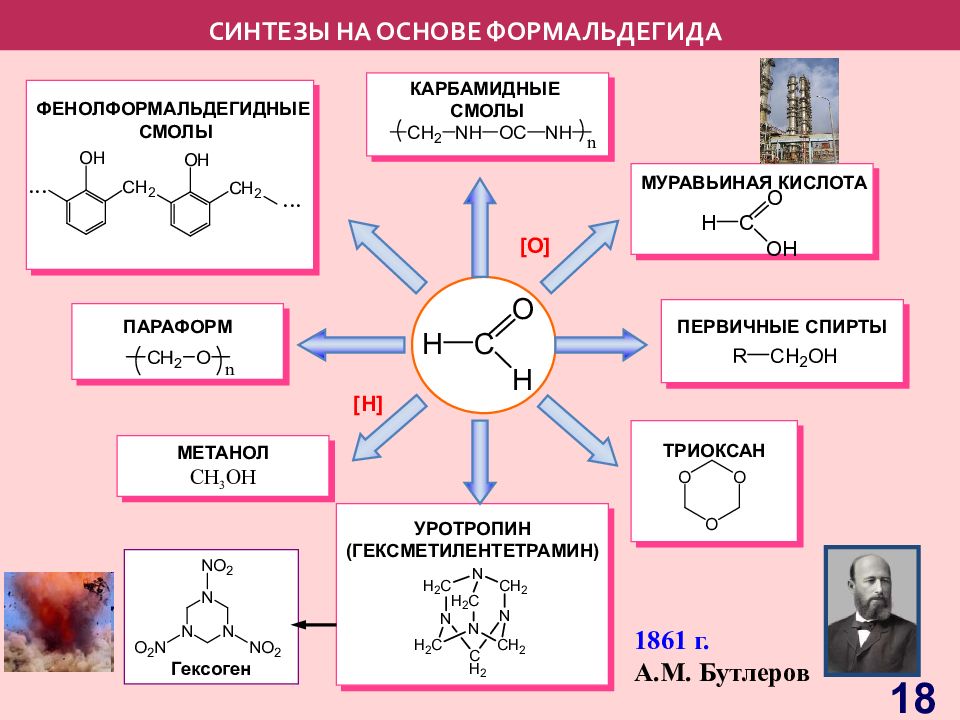
Слайд 18: СИНТЕЗЫ НА ОСНОВЕ ФОРМАЛЬДЕГИДА
МЕТАНОЛ С H 3 OH ПАРАФОРМ ФЕНОЛФОРМАЛЬДЕГИДНЫЕ СМОЛЫ ТРИОКСАН ПЕРВИЧНЫЕ СПИРТЫ КАРБАМИДНЫЕ СМОЛЫ УРОТРОПИН (ГЕКСМЕТИЛЕНТЕТРАМИН) МУРАВЬИНАЯ КИСЛОТА Гексоген [O] [H] 1861 г. А.М. Бутлеров 18
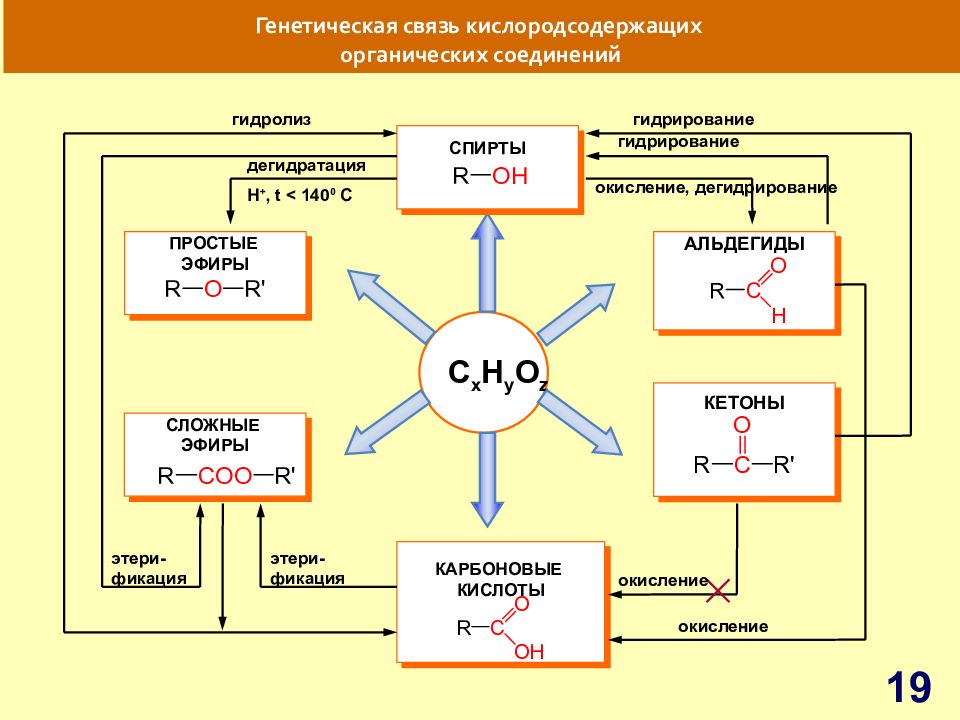
Слайд 19: Генетическая связь кислородсодержащих органических соединений
C x H y O z Генетическая связь кислородсодержащих органических соединений АЛЬДЕГИДЫ КАРБОНОВЫЕ КИСЛОТЫ КЕТОНЫ СЛОЖНЫЕ ЭФИРЫ ПРОСТЫЕ ЭФИРЫ СПИРТЫ гидролиз дегидратация гидрирование гидрирование окисление, дегидрирование этери- фикация этери- фикация окисление окисление H +, t < 140 0 C 19
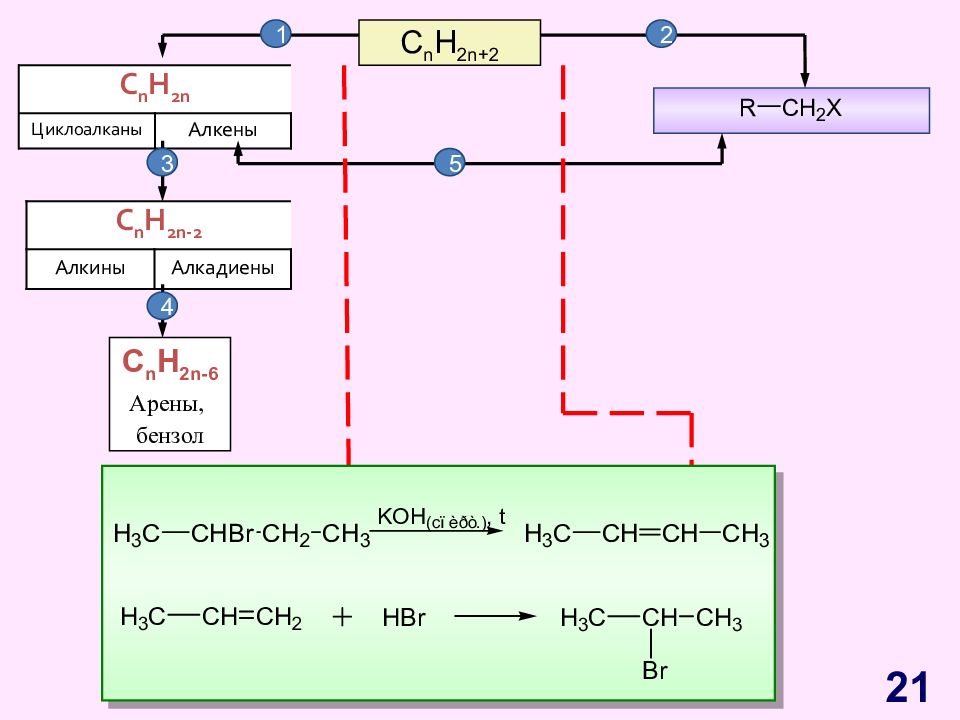
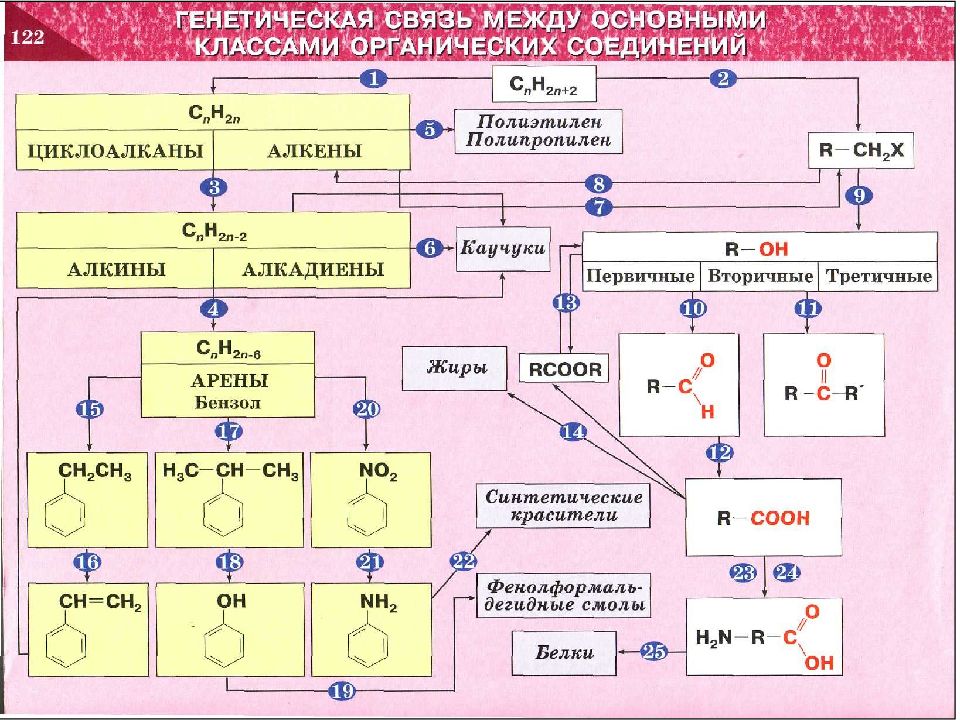
Слайд 21
C n H 2n+2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены C n H 2n -6 Арены, бензол 1 2 3 4 5 21
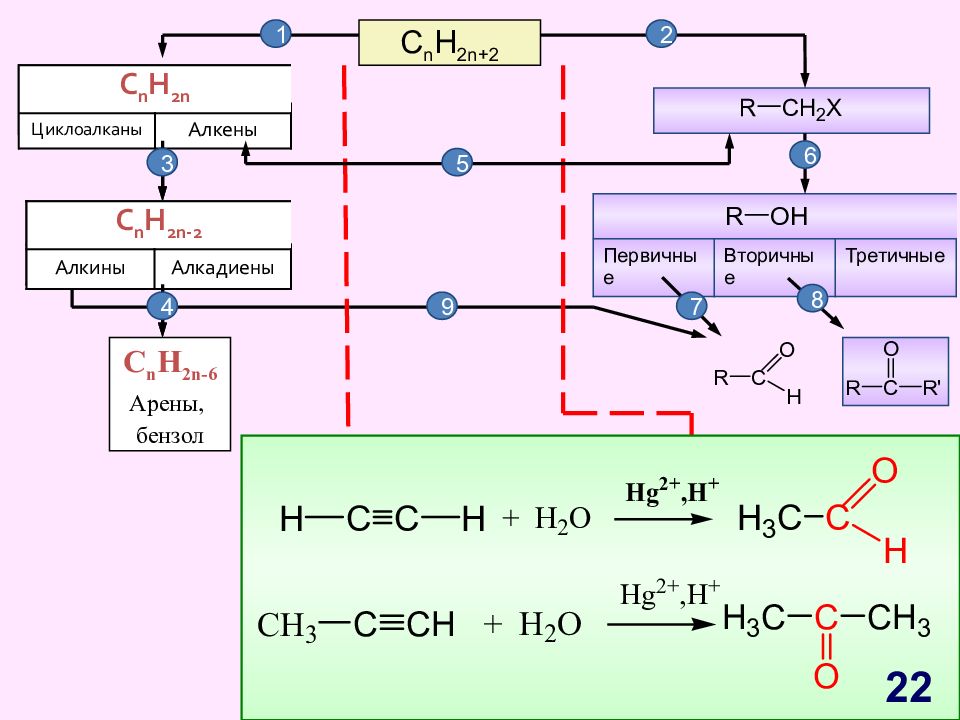
Слайд 22
C n H 2n+2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены Первичные Вторичные Третичные C n H 2n -6 Арены, бензол 1 2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены 3 4 5 6 7 8 9 22
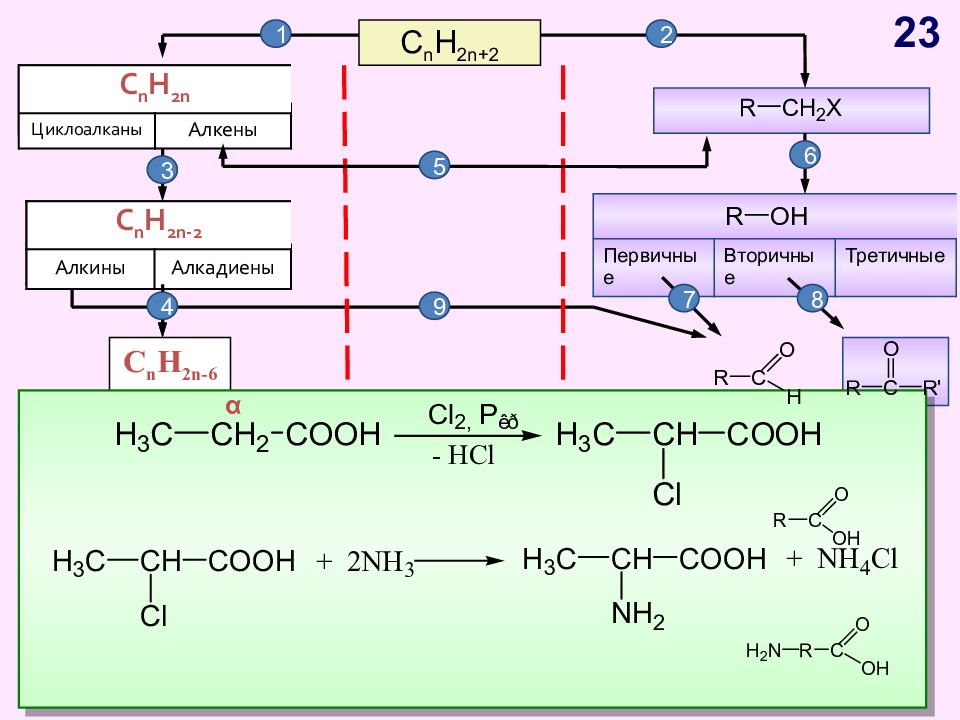
Слайд 23
C n H 2n+2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены Первичные Вторичные Третичные C n H 2n -6 Арены, бензол 1 2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены 4 5 3 6 7 8 9 10 11 α 23
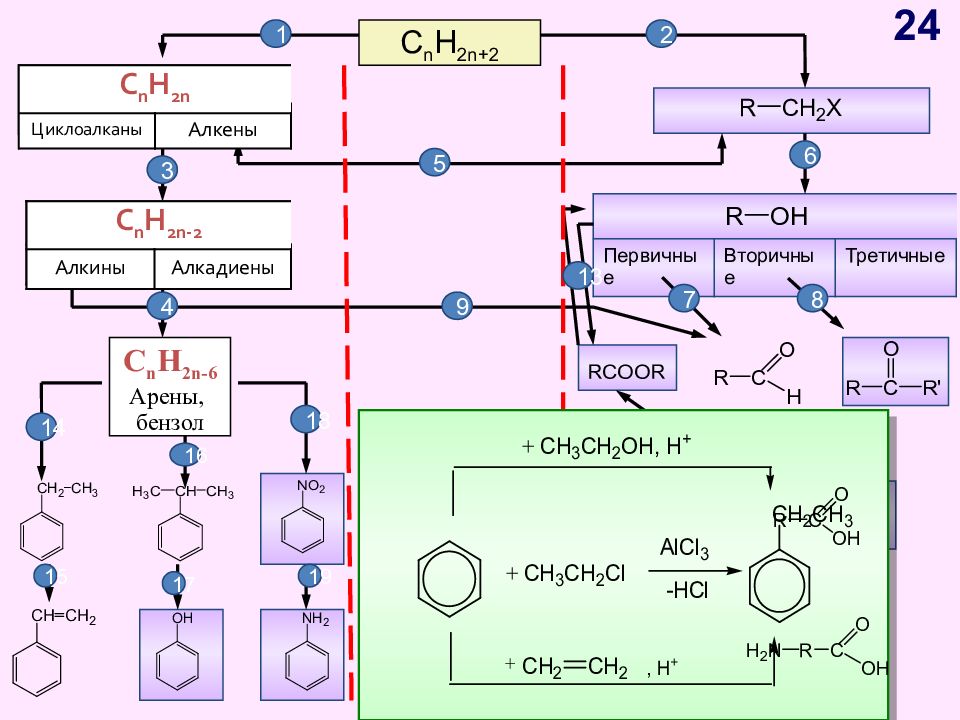
Слайд 24
C n H 2n+2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены Первичные Вторичные Третичные C n H 2n -6 Арены, бензол 1 2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены 3 4 5 6 7 8 9 10 11 12 13 14 15 17 19 16 18 24
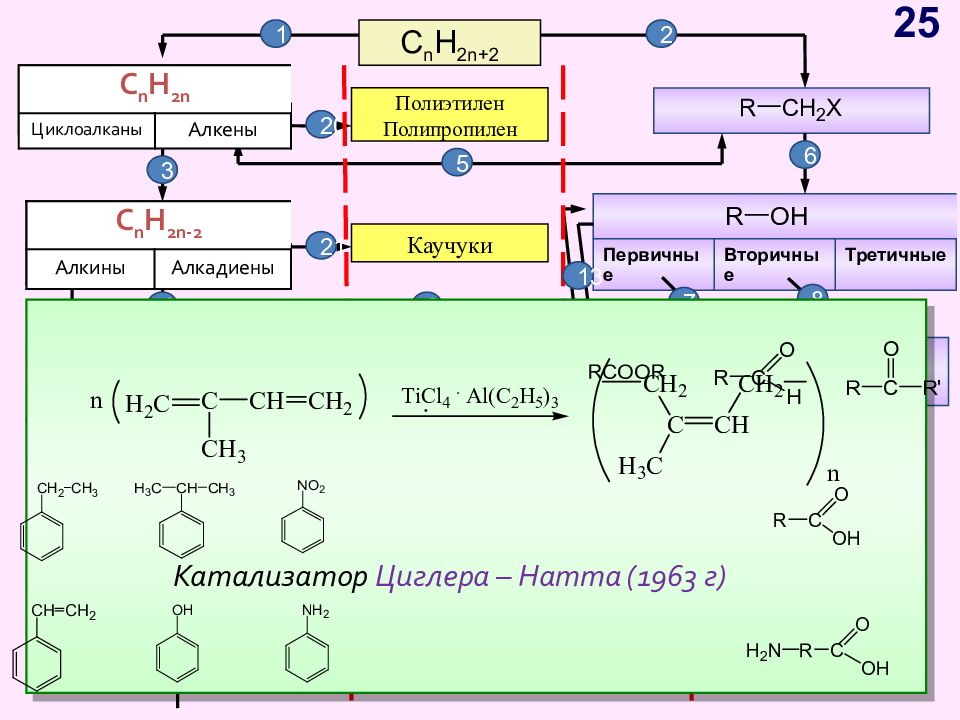
Слайд 25
C n H 2n+2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены Первичные Вторичные Третичные C n H 2n -6 Арены, бензол Полиэтилен Полипропилен 1 2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены Каучуки 3 5 6 7 8 9 10 11 12 13 14 4 18 16 17 19 15 20 21 Катализатор Циглера – Натта (1963 г) 25
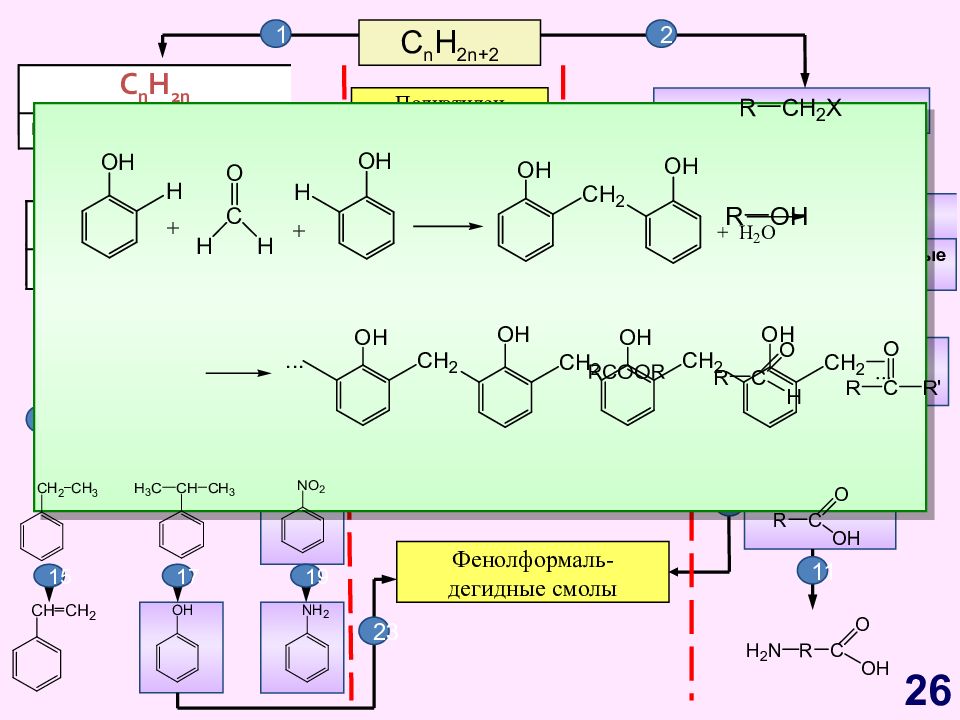
Слайд 26
C n H 2n+2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены Первичные Вторичные Третичные C n H 2n -6 Арены, бензол Полиэтилен Полипропилен Каучуки Жиры Фенолформаль- дегидные смолы 1 2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены 3 4 5 6 9 20 21 12 13 7 8 10 11 18 14 16 17 15 19 22 23 23 26
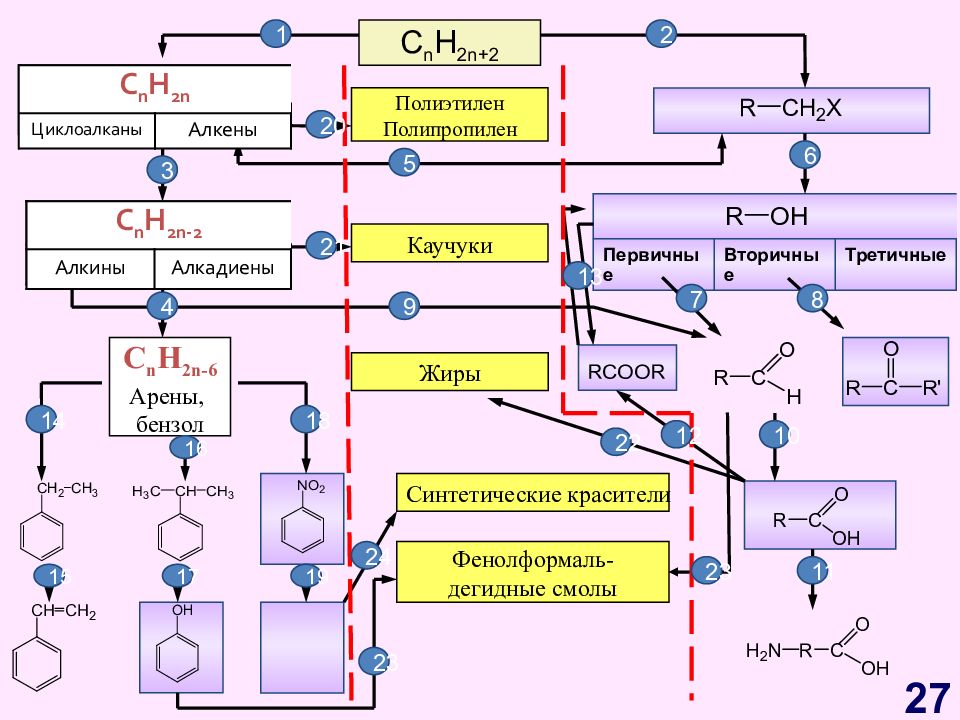
Слайд 27
C n H 2n+2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены Первичные Вторичные Третичные C n H 2n -6 Арены, бензол Полиэтилен Полипропилен Каучуки Жиры Синтетические красители Фенолформаль- дегидные смолы 1 2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены 3 4 5 20 6 9 7 8 13 12 10 11 14 18 21 16 15 17 19 22 23 23 24 27
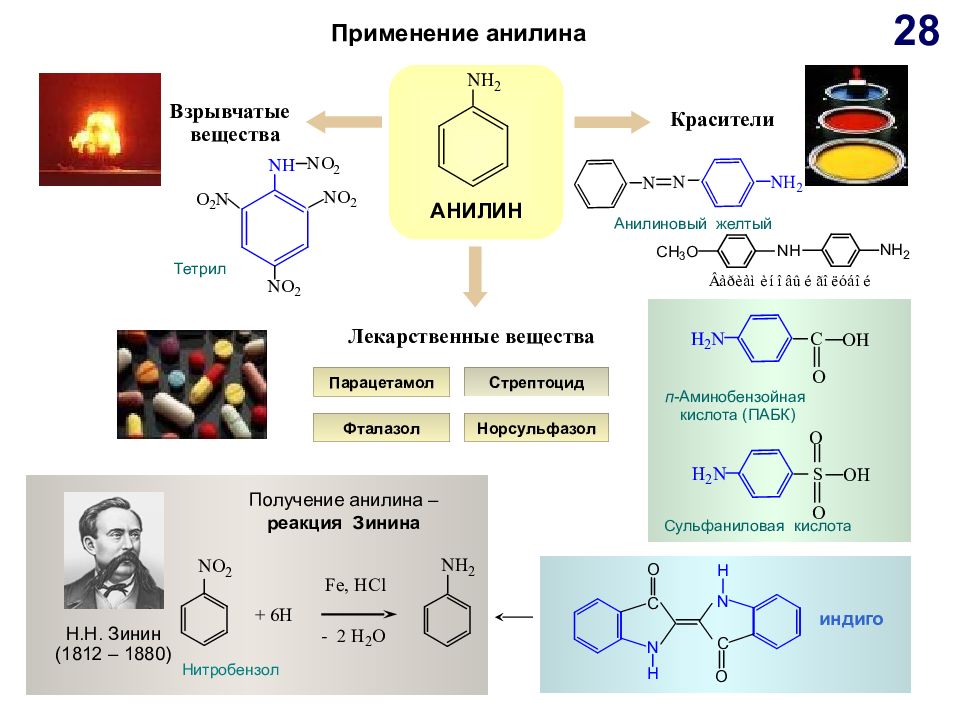
Слайд 28
Применение анилина АНИЛИН Н.Н. Зинин (1812 – 1880) Лекарственные вещества Красители Взрывчатые вещества C трептоцид Норсульфазол Фталазол Получение анилина – реакция Зинина Тетрил Анилиновый желтый Нитробензол п -Аминобензойная кислота (ПАБК) Сульфаниловая кислота индиго Парацетамол 28
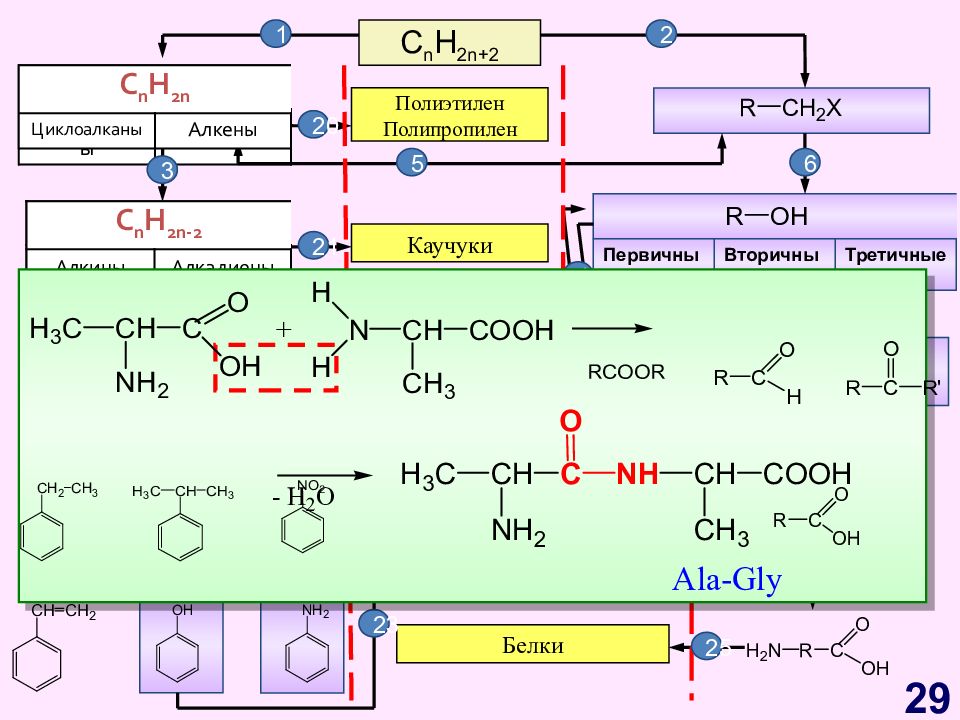
Слайд 29
C n H 2n+2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены Первичные Вторичные Третичные C n H 2n -6 Арены, бензол Полиэтилен Полипропилен Каучуки Жиры Синтетические красители Фенолформаль- дегидные смолы Белки 1 2 C n H 2n Циклоалканы Алкены C n H 2n - 2 Алкины Алкадиены 3 6 5 20 23 25 4 21 13 7 8 14 18 22 12 10 11 23 24 16 17 15 19 9 29