Первый слайд презентации: Институт математики, естественных и компьютерных наук кафедра физики
ТЕОРИЯ: МОЛЕКУЛЯРНАЯ ФИЗИКА ТЕРМОДИНАМИКА ЕГЭ 2023 1 ВОЛОГОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ КОРАБЕЛЫ ПРИОНЕЖЬЯ
Слайд 6
Молекулярно-кинетическая теория (МКТ) исходит из молекулярно-кинетических представлений: 1) все вещества состоят из молекул (атомов); 2) молекулы (атомы) находятся в непрерывном движении; 3) молекулы взаимодействуют между собой. Молекулярная физика изучает строение и свойства вещества Экспериментальные доказательства молекулярно-кинетических представлений: 1) Броуновское движение 2) диффузия
Слайд 7
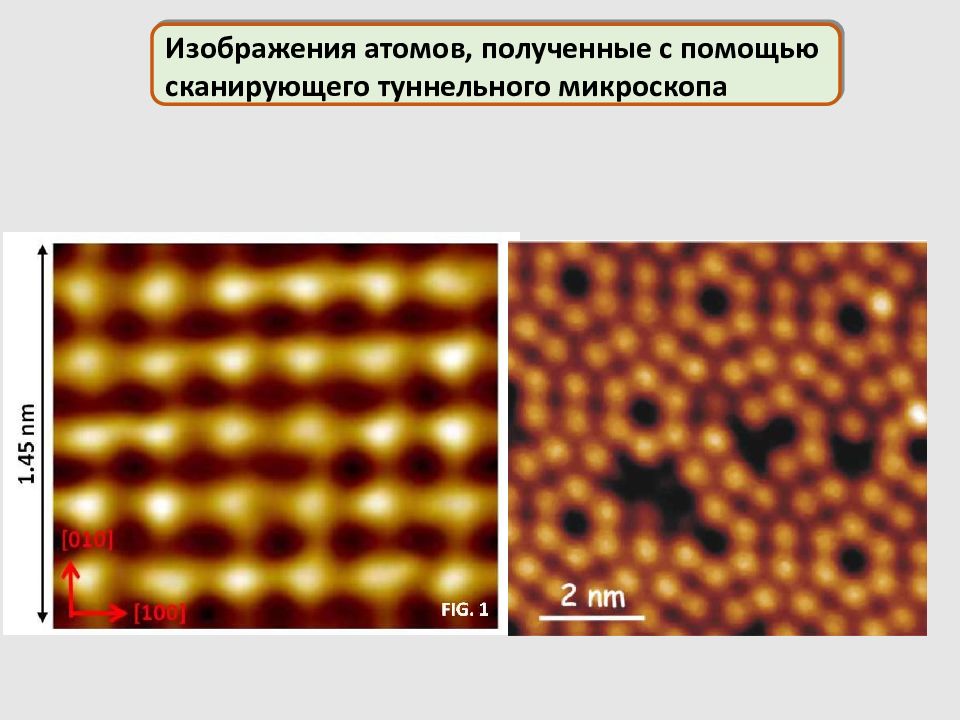
Изображения атомов, полученные с помощью сканирующего туннельного микроскопа
Слайд 8
СТМ-изображение поверхности: а) Si б ) монослоя 1,3-динонадекан-бензена в ) квантового коралла 48 атомов Fe на поверхности Си
Слайд 10
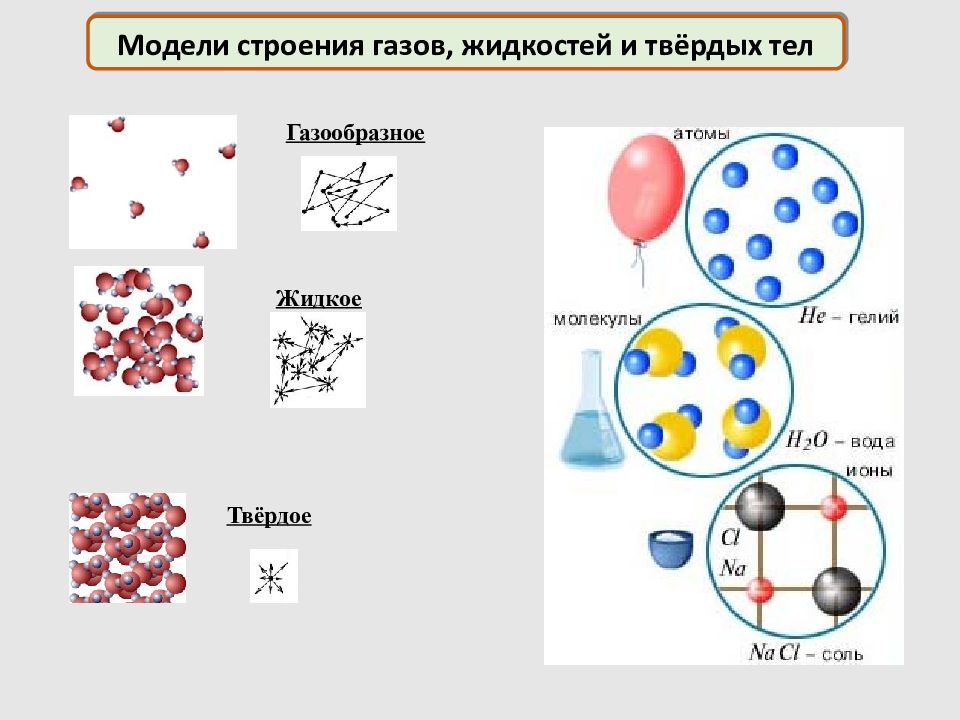
Газообразное Жид к ое Тв ё рдое Модели строения газов, жидкостей и твёрдых тел
Слайд 11
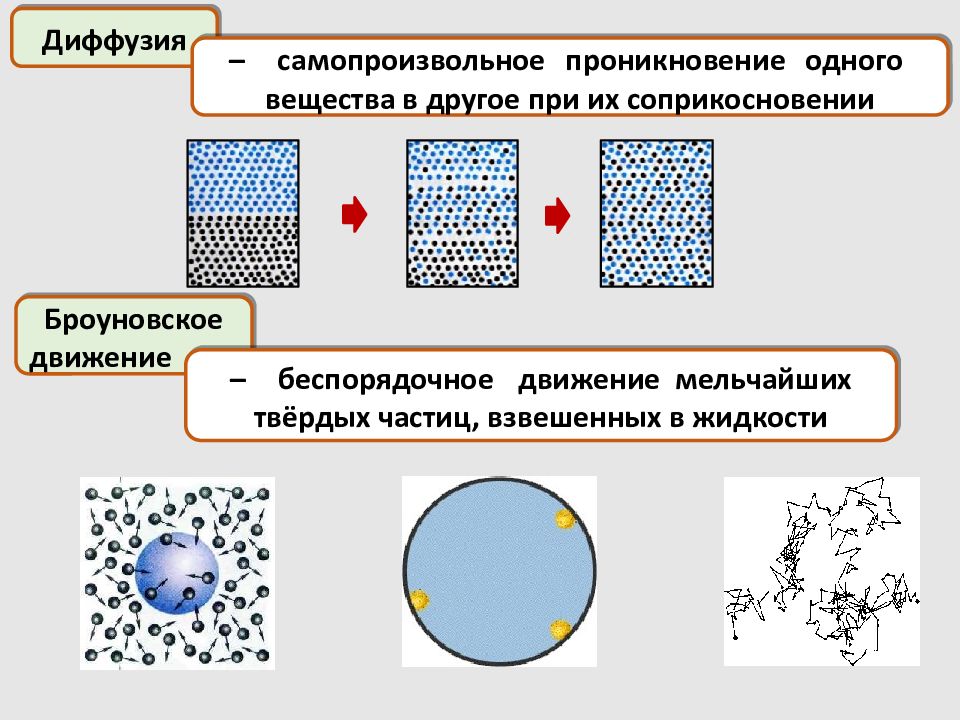
Диффузия – самопроизвольное проникновение одного вещества в другое при их соприкосновении Броуновское движение – беспорядочное движение мельчайших твёрдых частиц, взвешенных в жидкости
Слайд 12
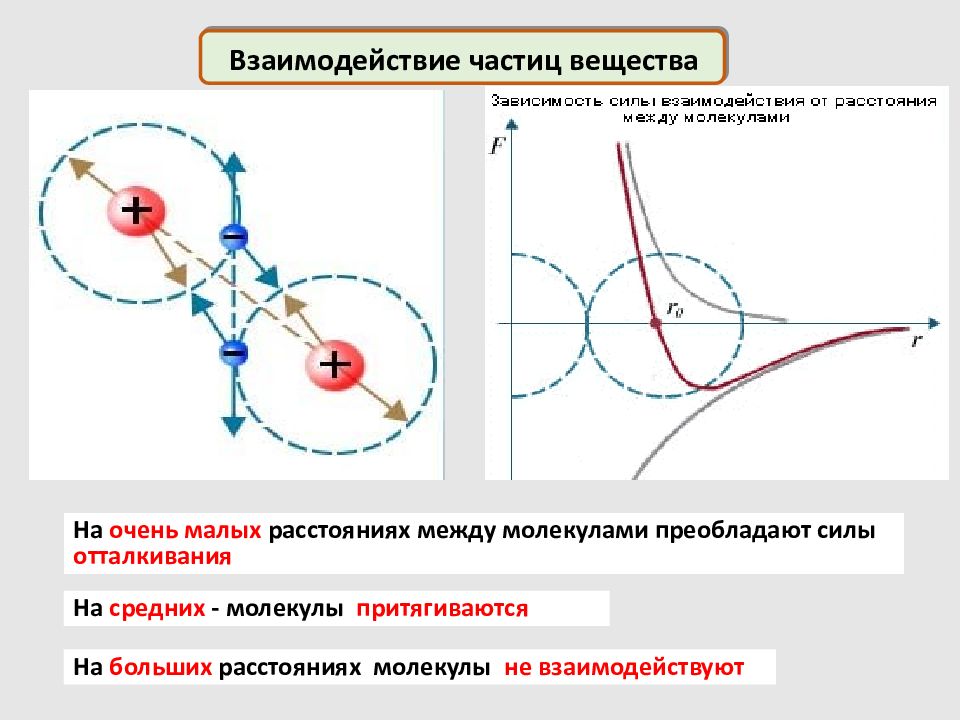
На очень малых расстояниях между молекулами преобладают силы отталкивания На средних - молекулы притягиваются На больших расстояниях молекулы не взаимодействуют Взаимодействие частиц вещества
Слайд 13
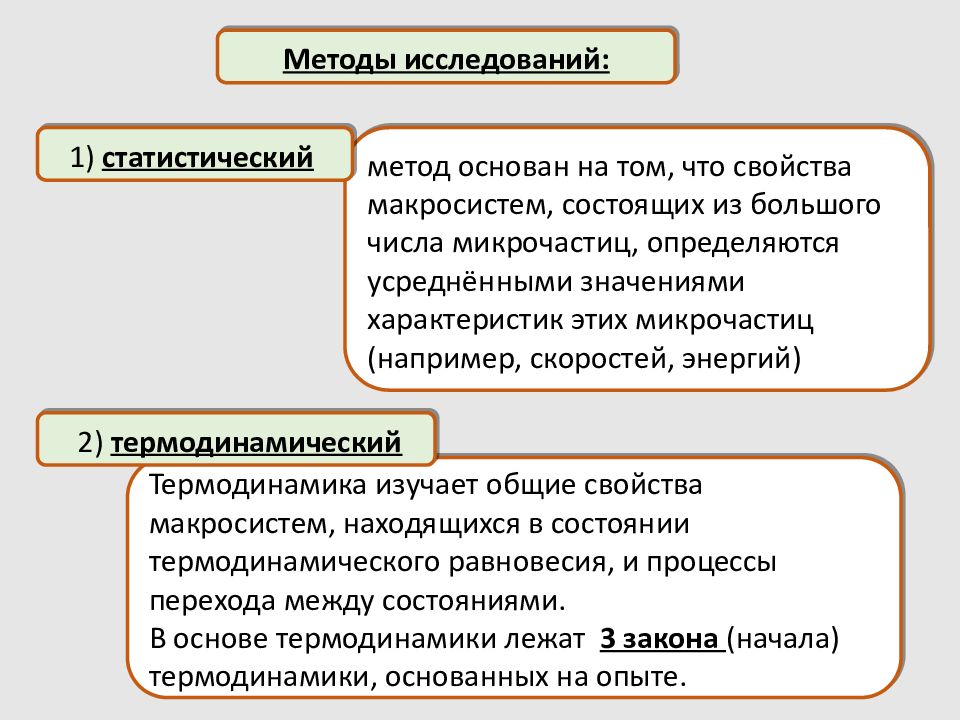
метод основан на том, что свойства макросистем, состоящих из большого числа микрочастиц, определяются усреднёнными значениями характеристик этих микрочастиц (например, скоростей, энергий) Методы исследований: 1) статистический Термодинамика изучает общие свойства макросистем, находящихся в состоянии термодинамического равновесия, и процессы перехода между состояниями. В основе термодинамики лежат 3 закона (начала) термодинамики, основанных на опыте. 2) термодинамический
Слайд 14
При нормальных условиях ( T=273 К, p = 10 5 Па) газ можно считать идеальным Молекулярно-кинетическая теория идеального газа. Уравнение состояния Газ идеальный, если Собственным объёмом молекул можно пренебречь по сравнению с объёмом сосуда. 2) Взаимодействием молекул между собой можно пренебречь. 3) Столкновения молекул между собой и со стенками сосуда – абсолютно упругие.
Слайд 15
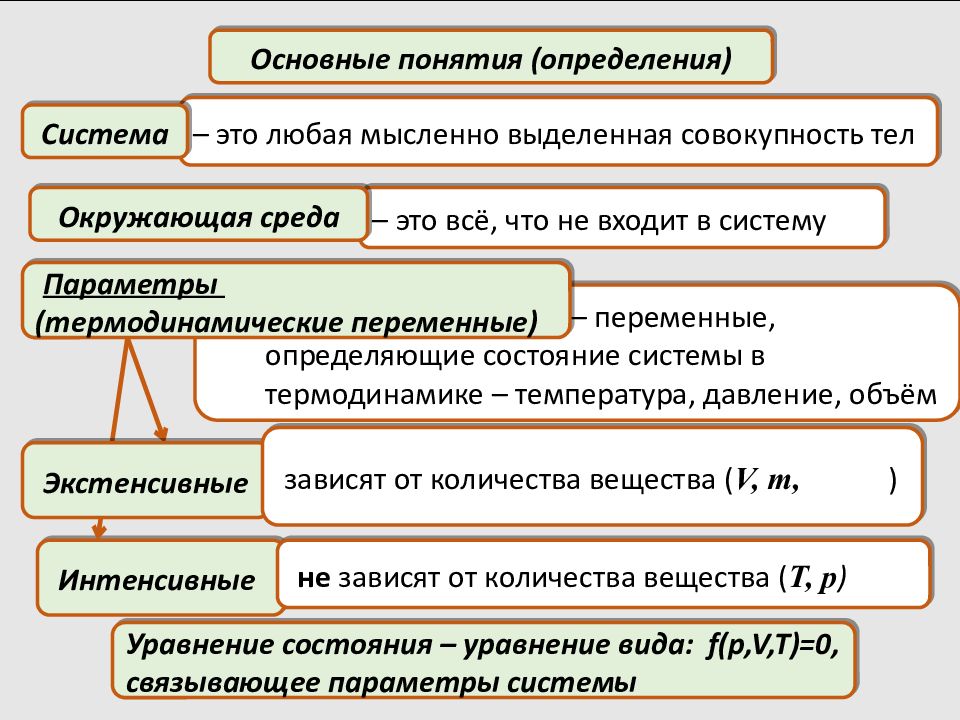
– это любая мысленно выделенная совокупность тел Основные понятия (определения) Система – это всё, что не входит в систему Окружающая среда – переменные, определяющие состояние системы в термодинамике – температура, давление, объём Параметры (термодинамические переменные) Интенсивные Экстенсивные зависят от количества вещества ( V, m, ) не зависят от количества вещества ( T, p ) Уравнение состояния – уравнение вида: f( p,V,T )=0, связывающее параметры системы
Слайд 16
В термодинамике нет моделей, теоретических предположений о строении вещества или о механизме процессов. Свойства вещества определяются из опыта В основе термодинамики лежат основанные на опыте законы (начала) термодинамики Закон теплового равновесия ( нулевое начало термодинамики ) Опыт показывает, что если системы 1 и 2 находятся в тепловом равновесии с системой 3, то системы 1 и 2 будут также в тепловом равновесии друг с другом. Значение этого закона заключается в том, что он приводит к выводу о существовании температуры как характеристики теплового равновесия системы. Температура есть присущая каждому состоянию равновесия интенсивная величина
Слайд 17
T ( t о 273 ) К Температура ( Т ) – характеристика теплового равновесия системы – определяет направление теплообмена между телами Шкала Кельвина: [ T ]= К Шкала Цельсия: [ t ]= град Δ T Δ t
Слайд 18
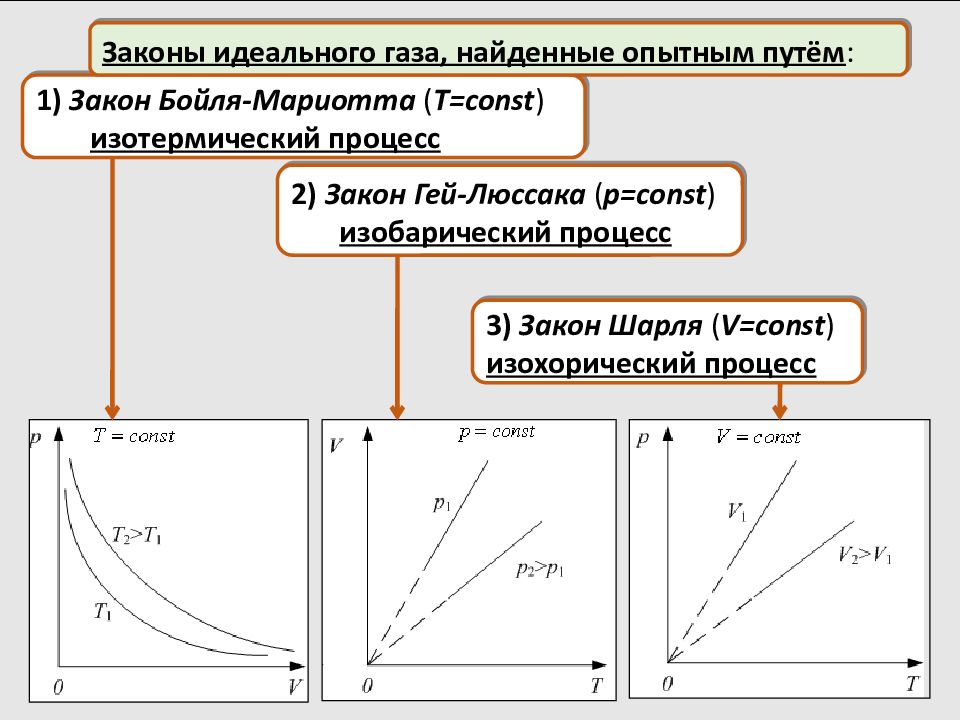
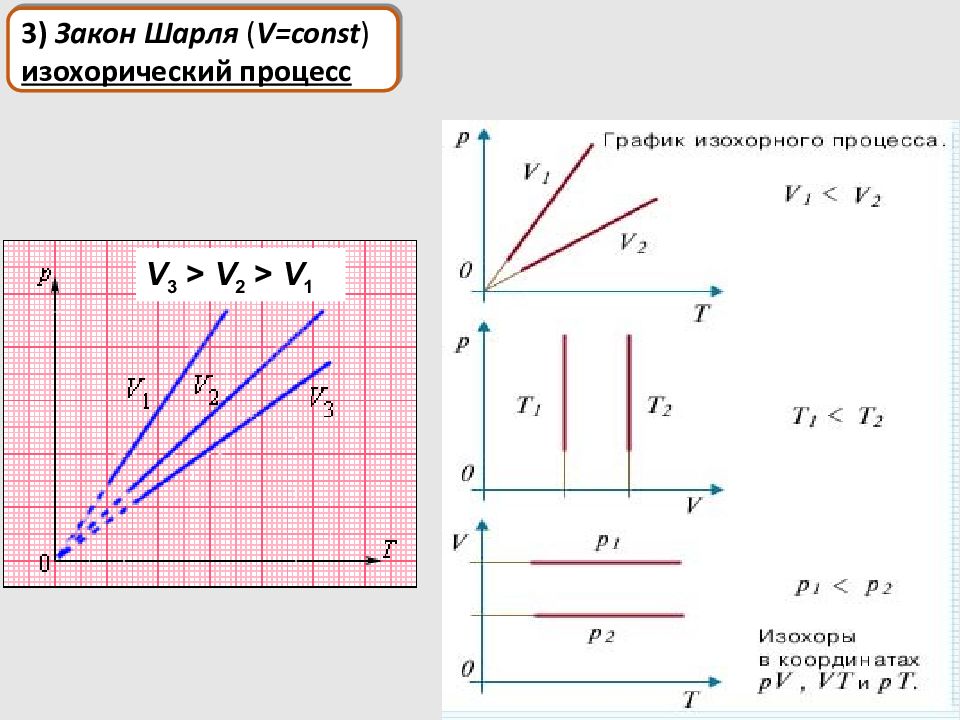
1) Закон Бойля-Мариотта ( T = const ) изотермический процесс Законы идеального газа, найденные опытным путём : 2) Закон Гей-Люссака ( p = const ) изобарический процесс 3) Закон Шарля ( V = const ) изохорический процесс
Слайд 19
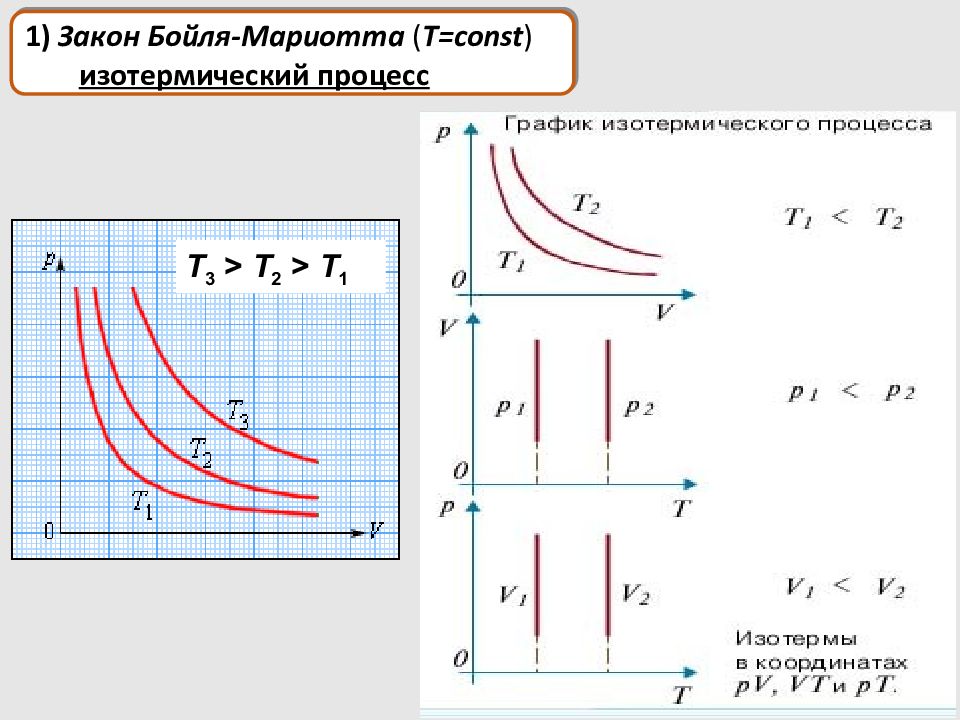
1) Закон Бойля-Мариотта ( T = const ) изотермический процесс T 3 > T 2 > T 1
Слайд 20
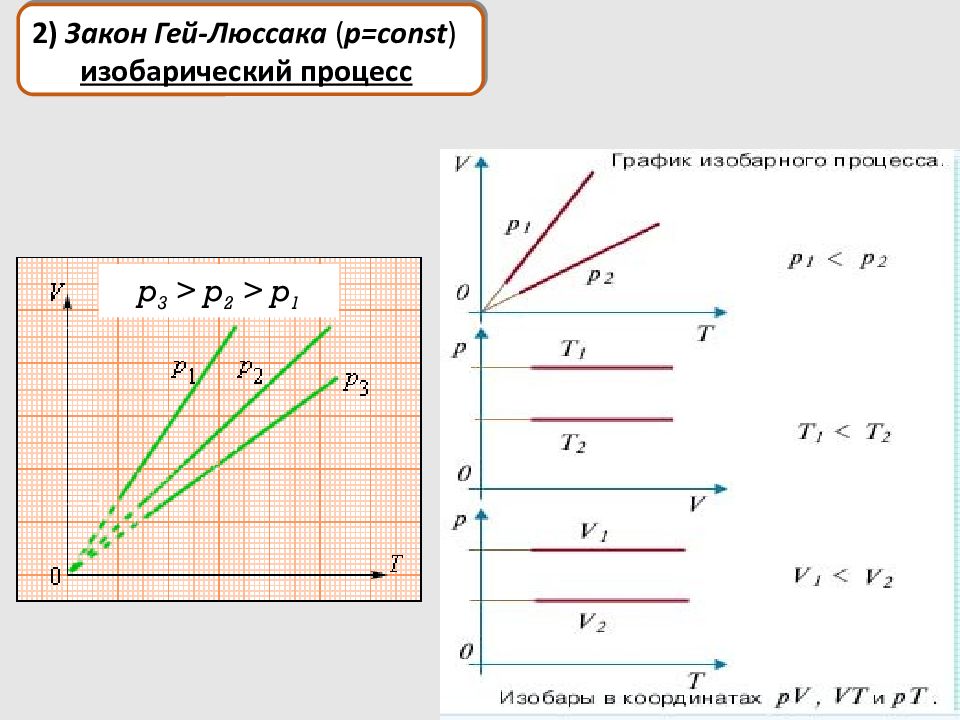
p 3 > p 2 > p 1 2) Закон Гей-Люссака ( p = const ) изобарический процесс
Слайд 22
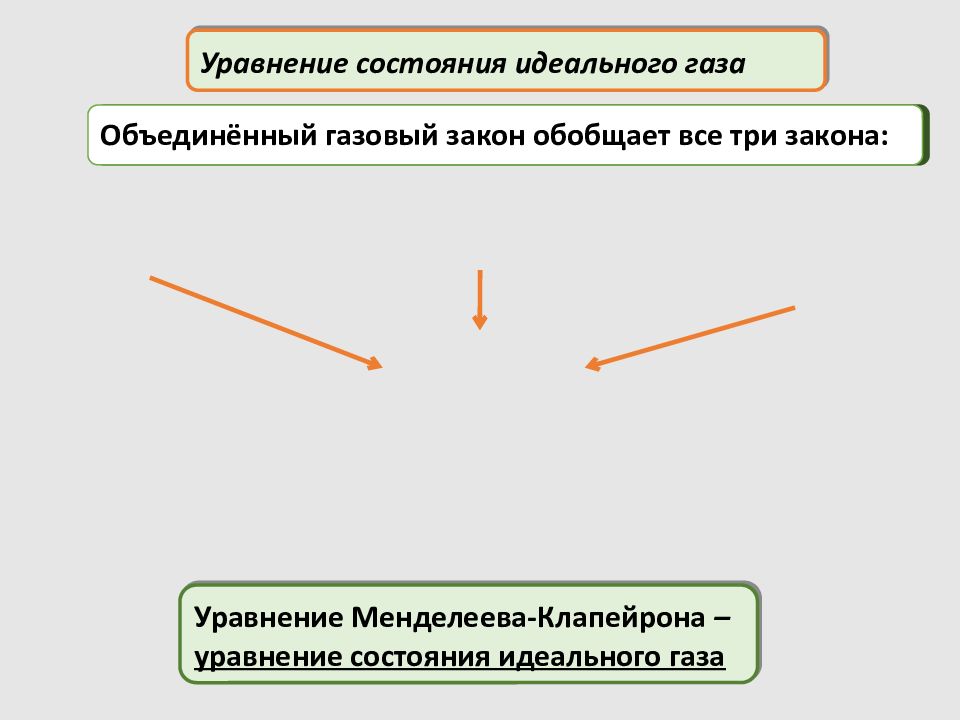
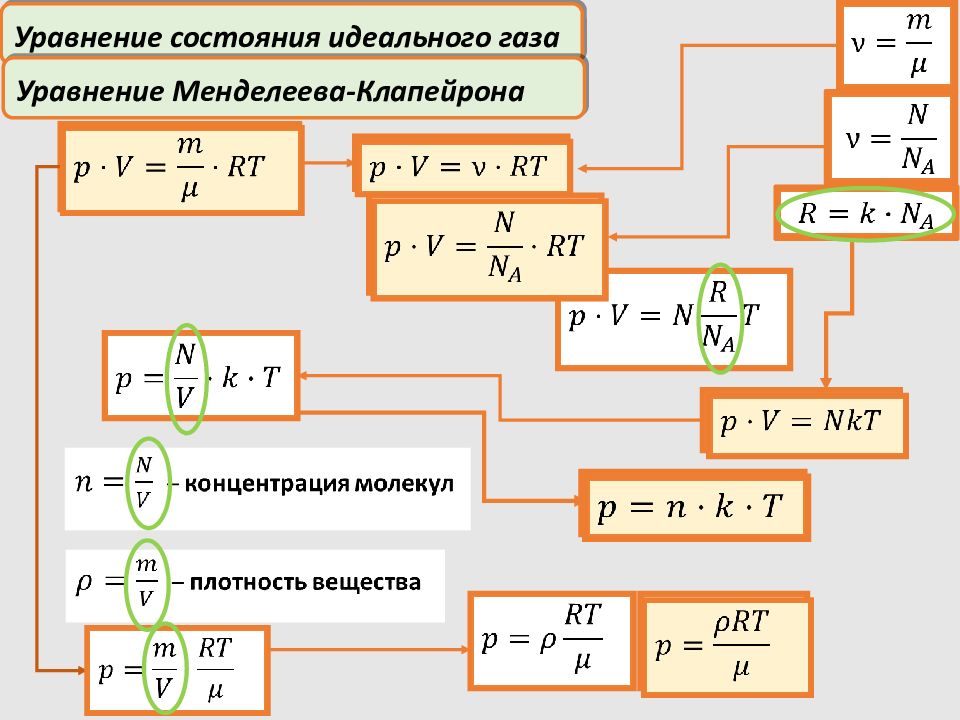
Уравнение состояния идеального газа Уравнение Менделеева-Клапейрона – уравнение состояния идеального газа Объединённый газовый закон обобщает все три закона:
Слайд 23
– масса одной молекулы – число Авогадро – число молекул в одном моле вещества; μ – масса моля (молярная масса); μ k – постоянная Больцмана; R – универсальная газовая постоянная; В одном моле любого вещества содержится одинаковое число молекул (атомов), равное числу Авогадро N А – масса вещества, содержащего молекул; Закон Авогадро Количество вещества (число молей):
Слайд 24
Уравнение состояния идеального газа – концентрация молекул – плотность вещества Уравнение Менделеева-Клапейрона
Слайд 25
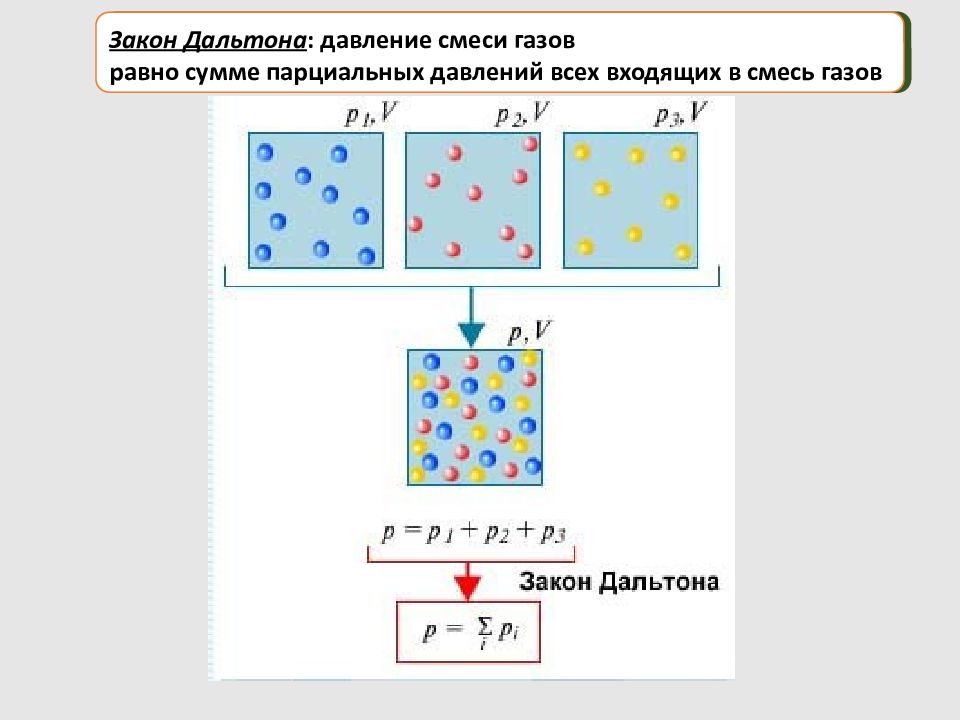
Давление смеси газов Доказательство: Закон Дальтона : давление смеси газов равно сумме парциальных давлений всех входящих в смесь газов: Парциальное давление – это давление, которое оказывал бы данный газ в отсутствие других газов при тех же условиях
Слайд 26
Закон Дальтона : давление смеси газов равно сумме парциальных давлений всех входящих в смесь газов
Слайд 27
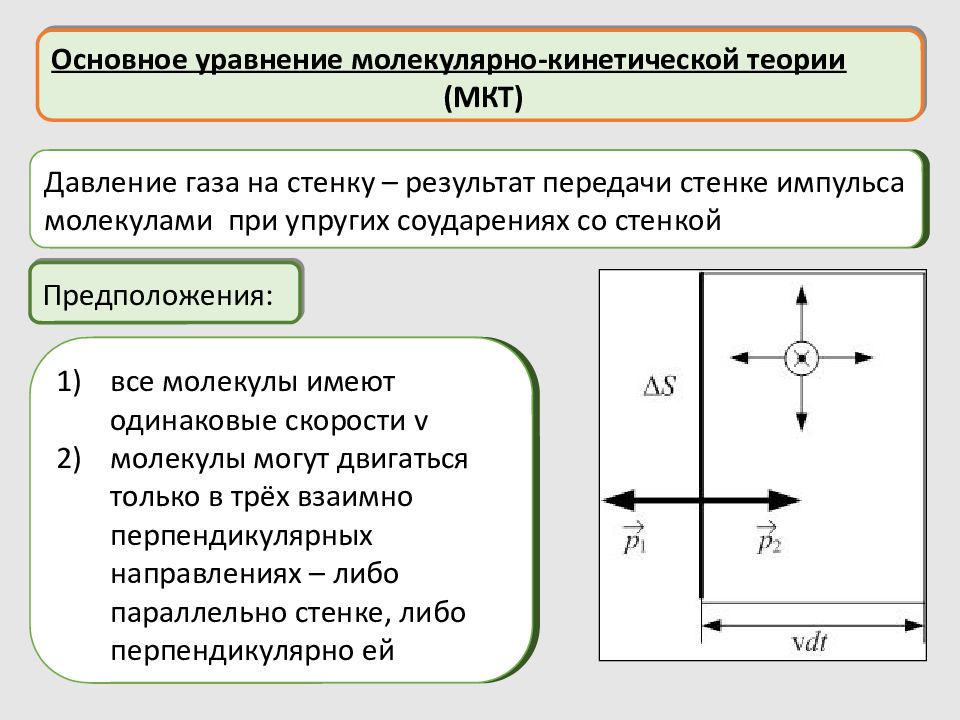
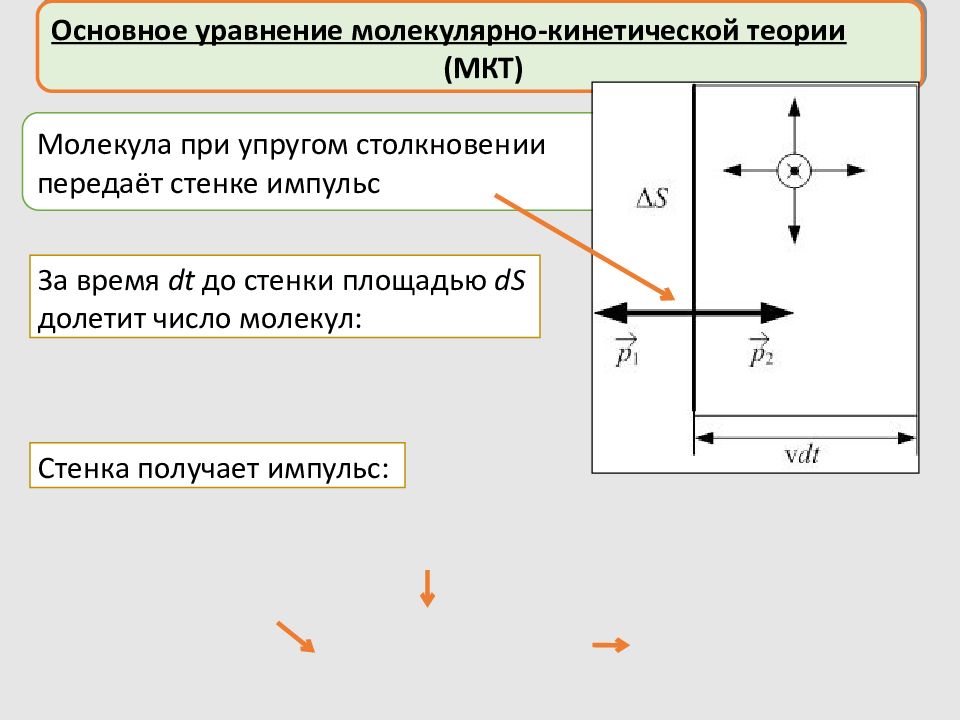
Основное уравнение молекулярно-кинетической теории (МКТ) Предположения: Давление газа на стенку – результат передачи стенке импульса молекулами при упругих соударениях со стенкой все молекулы имеют одинаковые скорости v молекулы могут двигаться только в трёх взаимно перпендикулярных направлениях – либо параллельно стенке, либо перпендикулярно ей
Слайд 28
Основное уравнение молекулярно-кинетической теории (МКТ) Молекула при упругом столкновении передаёт стенке импульс За время dt до стенки площадью dS долетит число молекул: Стенка получает импульс:
Слайд 29
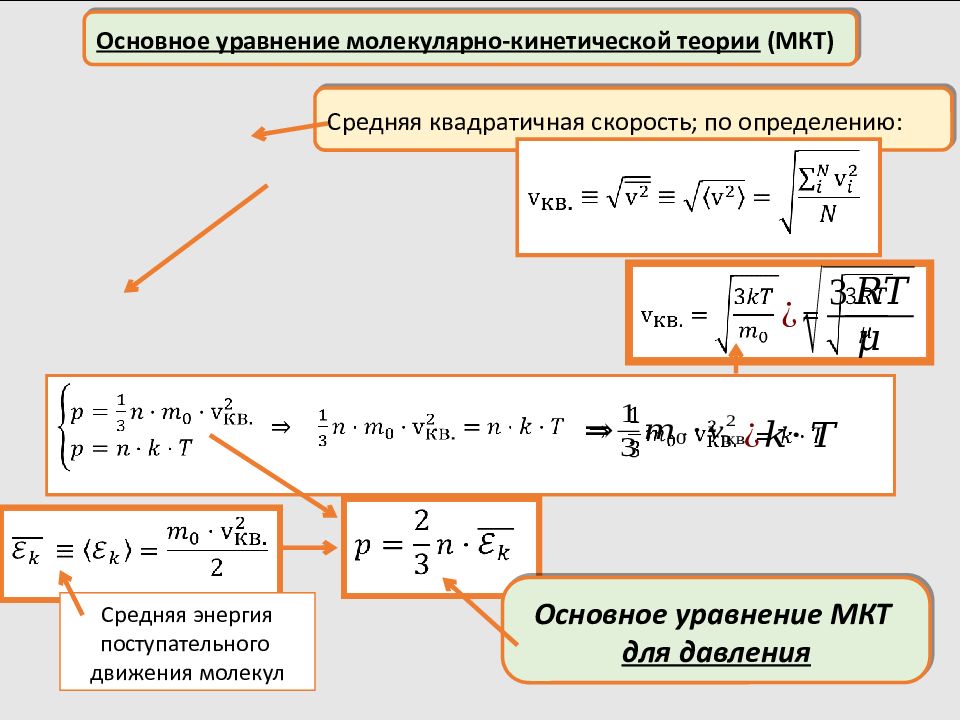
Основное уравнение молекулярно-кинетической теории (МКТ) Средняя квадратичная скорость; по определению: Основное уравнение МКТ для давления Средняя энергия поступательного движения молекул
Слайд 30
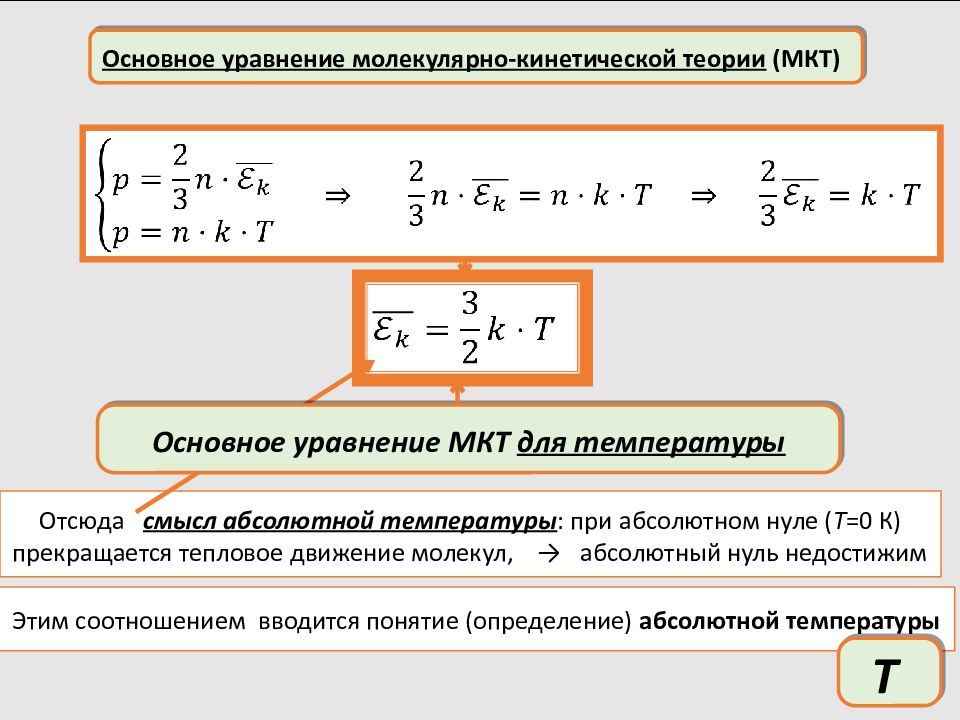
Основное уравнение молекулярно-кинетической теории (МКТ) Отсюда смысл абсолютной температуры : при абсолютном нуле ( T =0 К) прекращается тепловое движение молекул, → абсолютный нуль недостижим Основное уравнение МКТ для температуры Этим соотношением вводится понятие (определение) абсолютной температуры Т
Слайд 31
Т ермодинамика изучает общие свойства макросистем, находящихся в состоянии термодинамического равновесия, и процессы перехода между состояниями. Термодинамика позволяет понять, какие процессы возможны, а какие – нет. Термодинамика Отвлекаясь от движения тела как целого, термодинамика сосредотачивает внимание на изменениях внутреннего состояния тела, состояния термодинамической системы На основе общих принципов механики пытались установить связь между молекулярным движением и тепловыми явлениями Термодинамику пытались свести к механике Это принципиально невозможно Законы Ньютона обратимы во времени Тепловые процессы необратимы: теплота переходит от горячего к холодному, но не наоборот Ньютоновская механика принципиально не может объяснить необратимость процессов Сведение термодинамики к механике оказывается невозможным
Слайд 32
Внутренняя энергия U Внутренняя энергия системы – это функция состояния, то есть однозначно определяется состоянием системы потенциальной энергии тела во внешних полях В реальных процессах важно ИЗМЕНЕНИЕ внутренней энергии системы Изменение внутренней энергии системы в каком-либо процессе не зависит от пути перехода, а только от начального и конечного со c тояния В замкнутом процессе, когда система возвращается в исходное состояние, изменение внутренней энергии равно нулю – это полная энергия тела, за исключением: кинетической энергии движения тела как целого (движения центра масс и вращения тела как целого)
Слайд 33
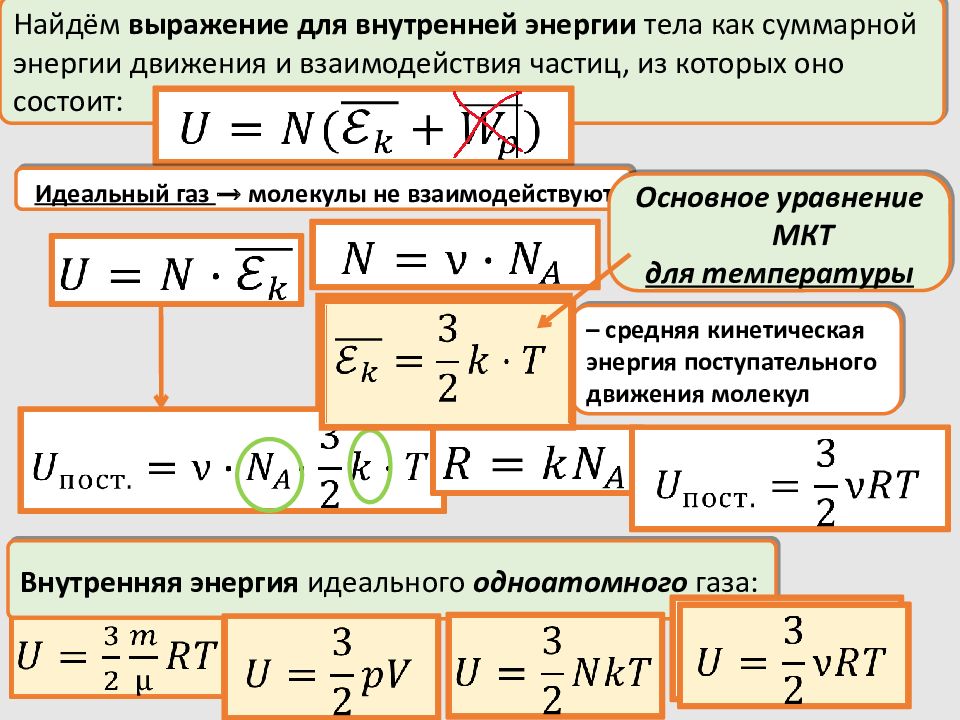
Найдём выражение для внутренней энергии тела как суммарной энергии движения и взаимодействия частиц, из которых оно состоит: Идеальный газ → молекулы не взаимодействуют – средняя кинетическая энергия поступательного движения молекул Внутренняя энергия идеального одноатомного газа: Основное уравнение МКТ для температуры
Слайд 34
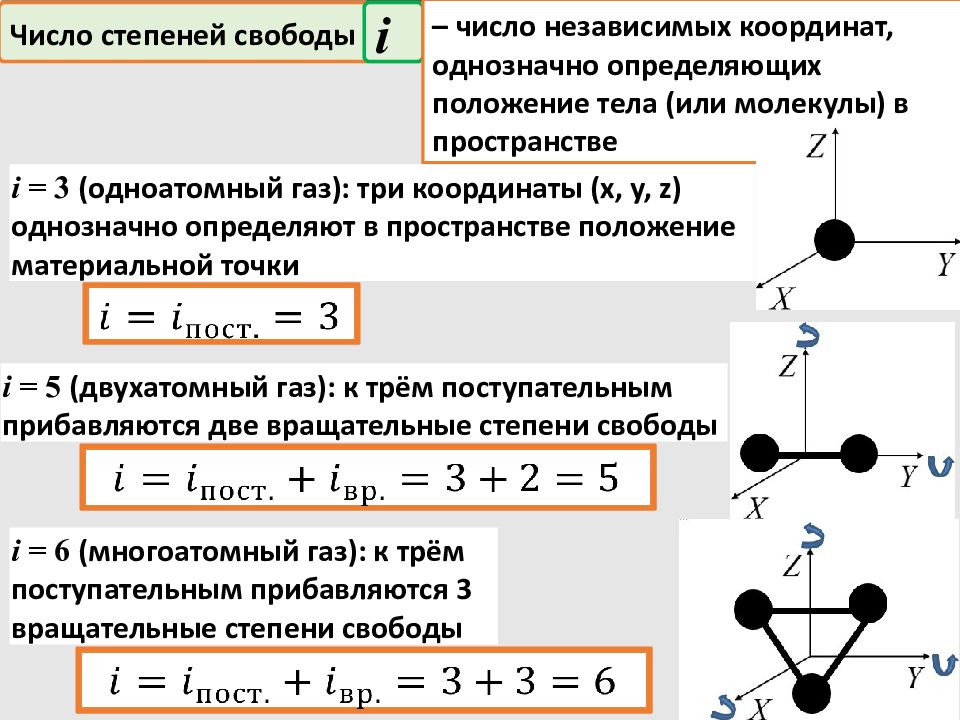
Число степеней свободы i – число независимых координат, однозначно определяющих положение тела (или молекулы) в пространстве i = 3 ( одн оатомный газ ) : три координаты ( x, y, z) однозначно определяют в пространстве положение материальной точки i = 5 ( двух атомный газ ) : к трём поступательным прибавляются две вращательные степени свободы i = 6 ( много атомный газ ) : к трём поступательным прибавляются 3 вращательные степени свободы
Слайд 35
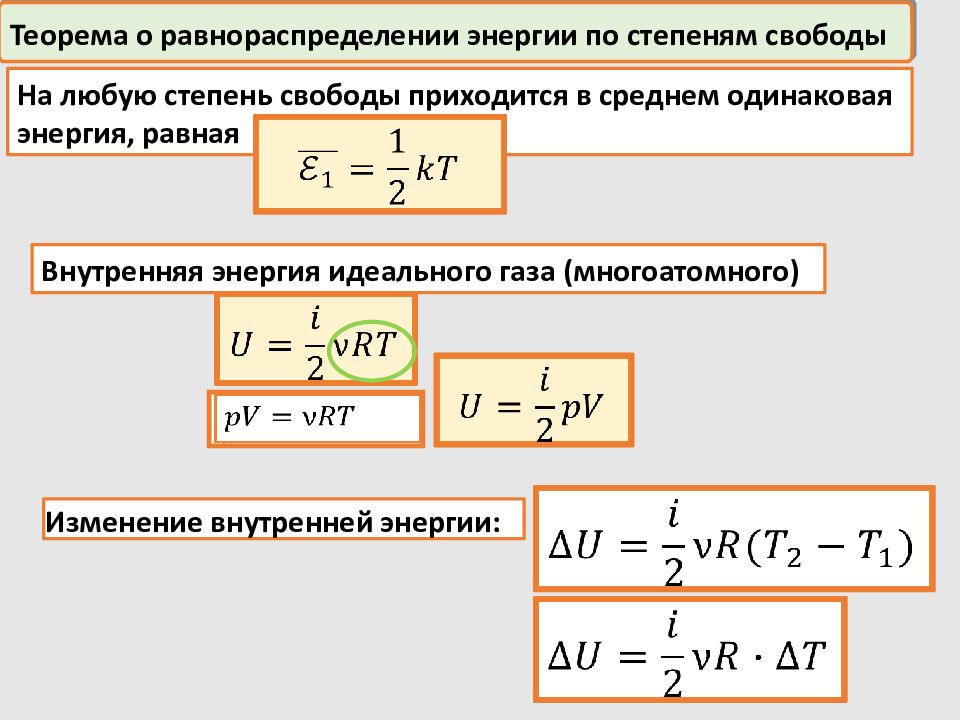
Теорема о равнораспределении энергии по степеням свободы На любую степень свободы приходится в среднем одинаковая энергия, равная Изменение внутренней энергии: Внутренняя энергия идеального газа (многоатомного)
Слайд 36
Количество теплоты – это энергия, которую тело получает или отдает при теплообмене Виды теплообмена: Теплопроводность – передача энергии за счет движения и взаимодействия частиц соприкасающихся тел Конвекция – передача энергии струями жидкости или газа Излучение – передача энергии с помощью электромагнитных волн
Слайд 37
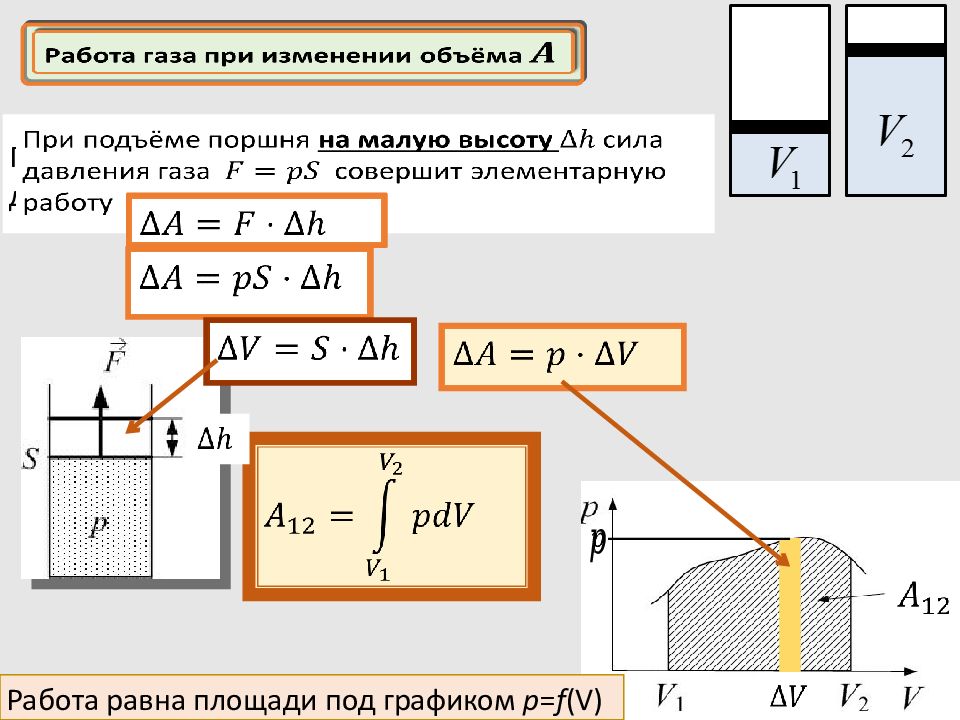
При подъёме поршня на малую высоту сила давления газа совершит элементарную работу Работа равна площади под графиком p = f (V) Работа газа при изменении объёма
Слайд 38
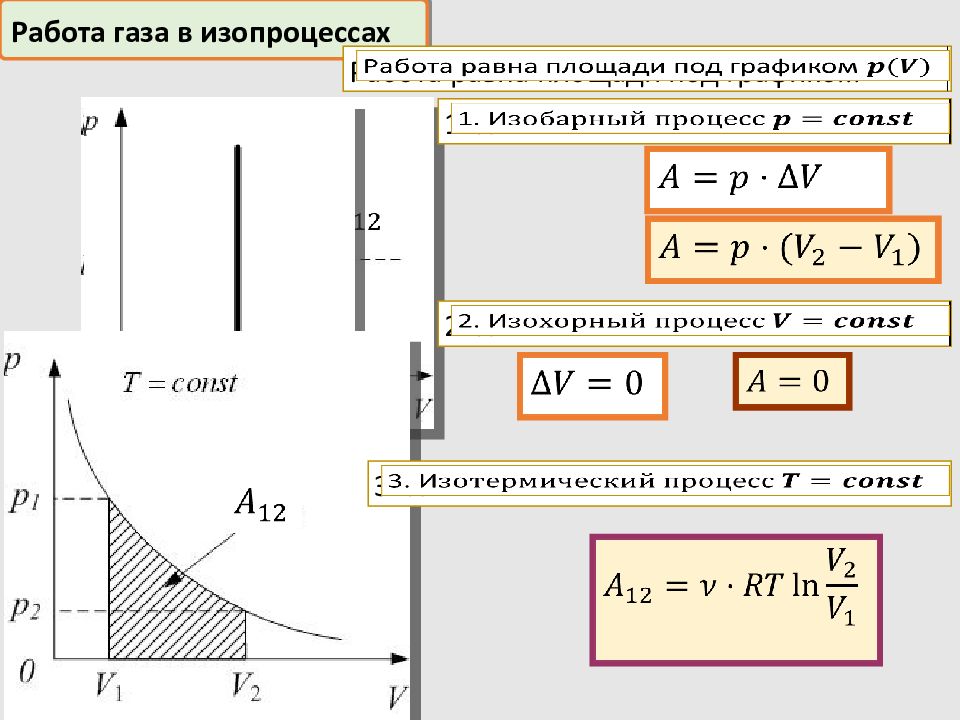
Работа газа в изопроцессах Работа равна площади под графиком 1. И 2. И 3. И
Слайд 39
Первое начало термодинамики Количество теплоты, сообщённое системе, идёт на приращение её внутренней энергии и на работу системы против внешних сил Внутреннюю энергию системы можно изменить за счёт: 1) совершения над системой работы; 2) сообщения системе теплоты: Работа газа
Слайд 40
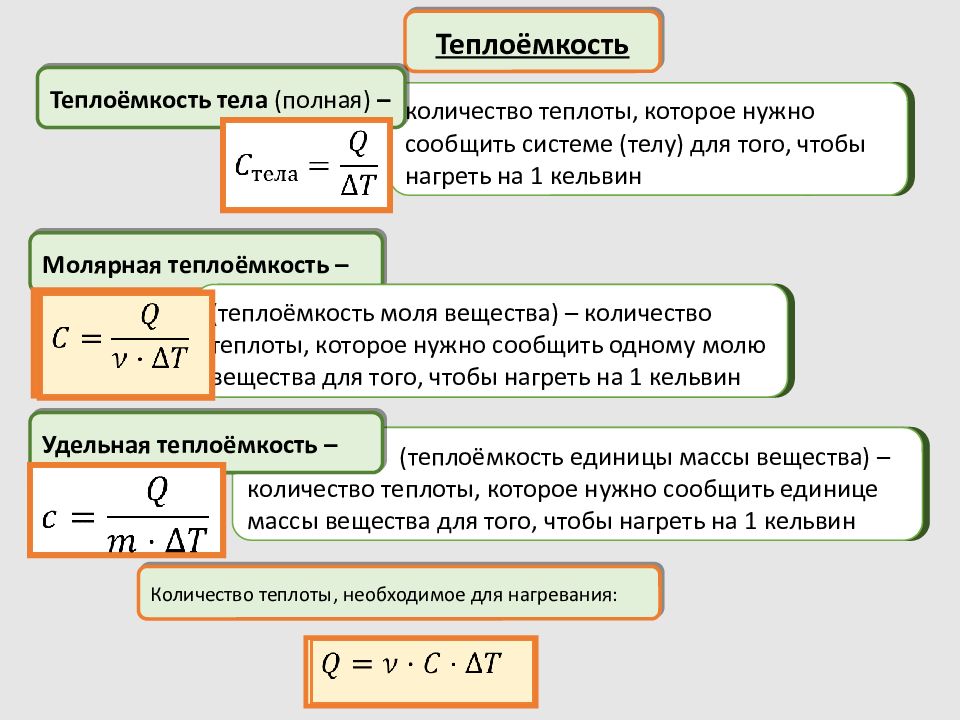
Теплоёмкость Молярная теплоёмкость – количество теплоты, которое нужно сообщить системе (телу) для того, чтобы нагреть на 1 кельвин (теплоёмкость моля вещества) – количество теплоты, которое нужно сообщить одному молю вещества для того, чтобы нагреть на 1 кельвин Теплоёмкость тела (полная) – (теплоёмкость единицы массы вещества) – количество теплоты, которое нужно сообщить единице массы вещества для того, чтобы нагреть на 1 кельвин Удельная теплоёмкость – Количество теплоты, необходимое для нагревания:
Слайд 41
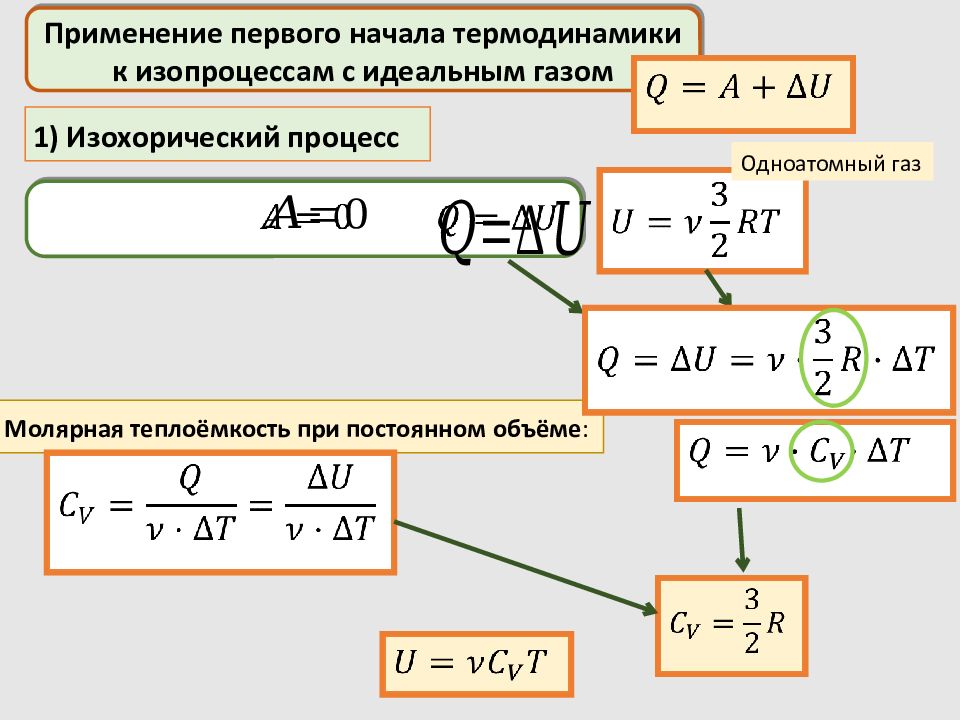
Применение первого начала термодинамики к изопроцессам с идеальным газом Молярная теплоёмкость при постоянном объёме : 1) Изохорический процесс Одноатомный газ
Слайд 42
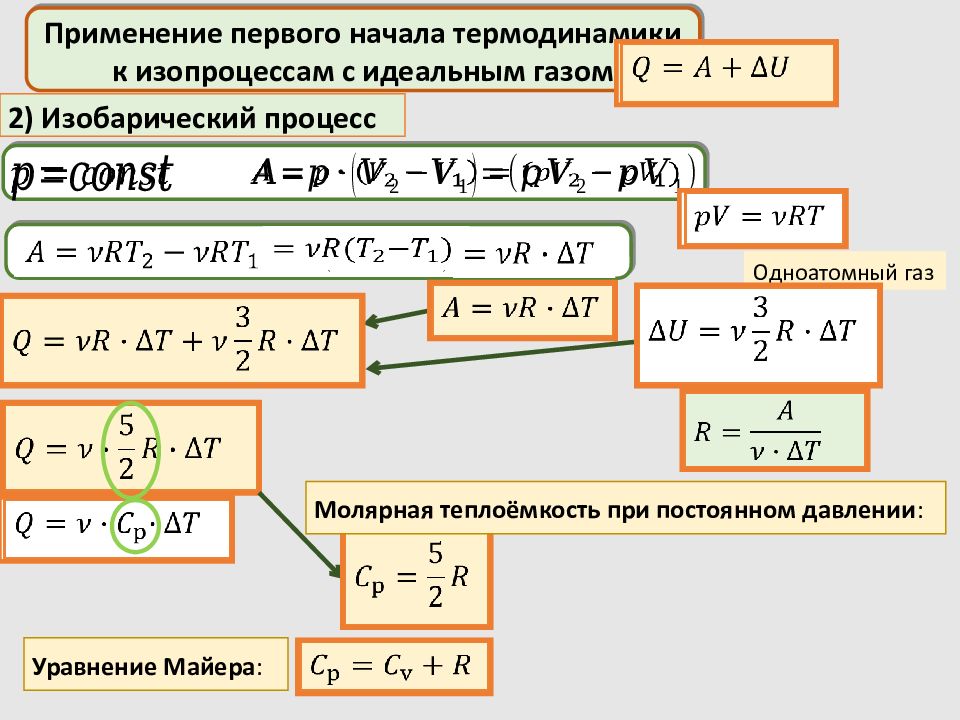
Применение первого начала термодинамики к изопроцессам с идеальным газом 2) Изобарический процесс Одноатомный газ Молярная теплоёмкость при постоянном давлении : Уравнение Майера :
Слайд 43
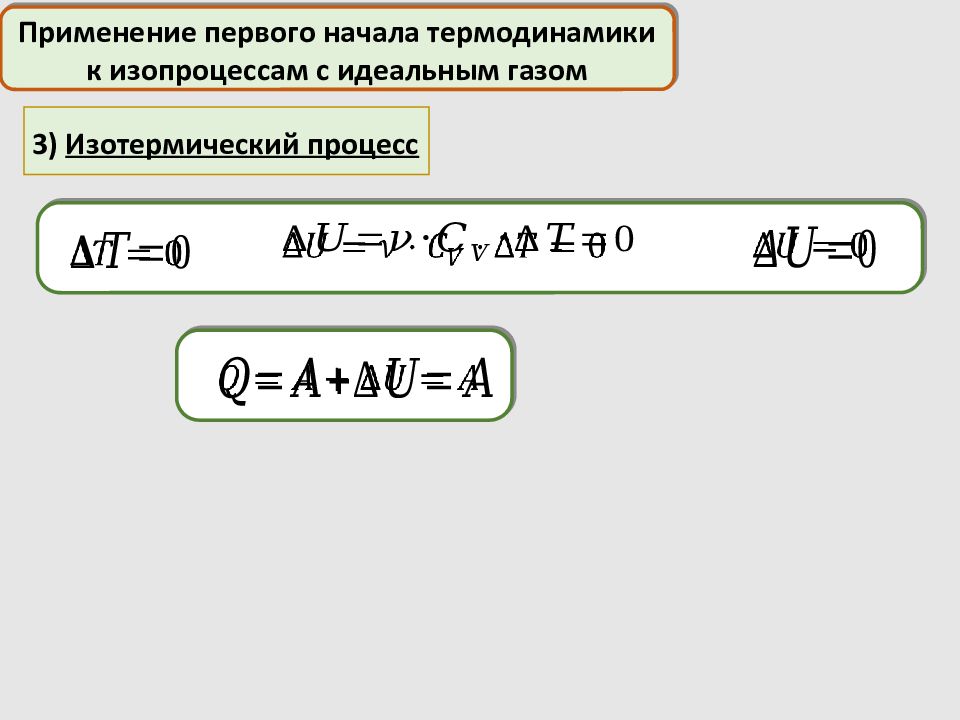
3) Изотермический процесс Применение первого начала термодинамики к изопроцессам с идеальным газом
Слайд 44
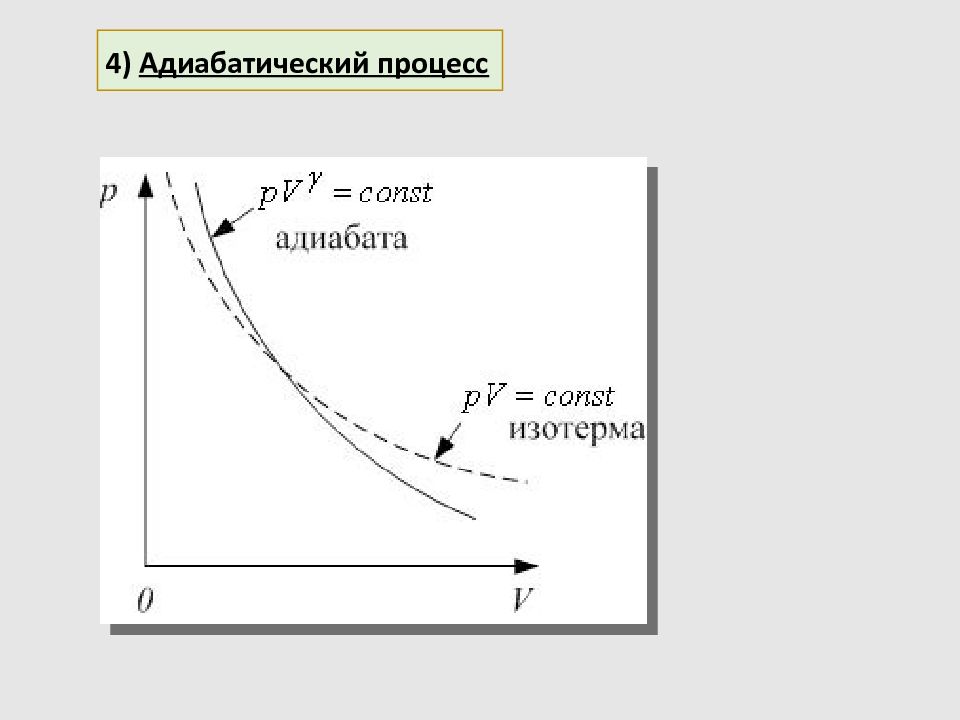
протекает без теплообмена с окружающей средой: система не получает и не отдаёт теплоты 4) Адиабатический процесс По первому началу термодинамики: Адиабатными процессами будут процессы, протекающие 1) в системе с хорошей теплоизоляцией; 2) очень быстрые процессы, – система не успевает обменяться теплотой с окружающей средой за время протекания процесса
Слайд 46
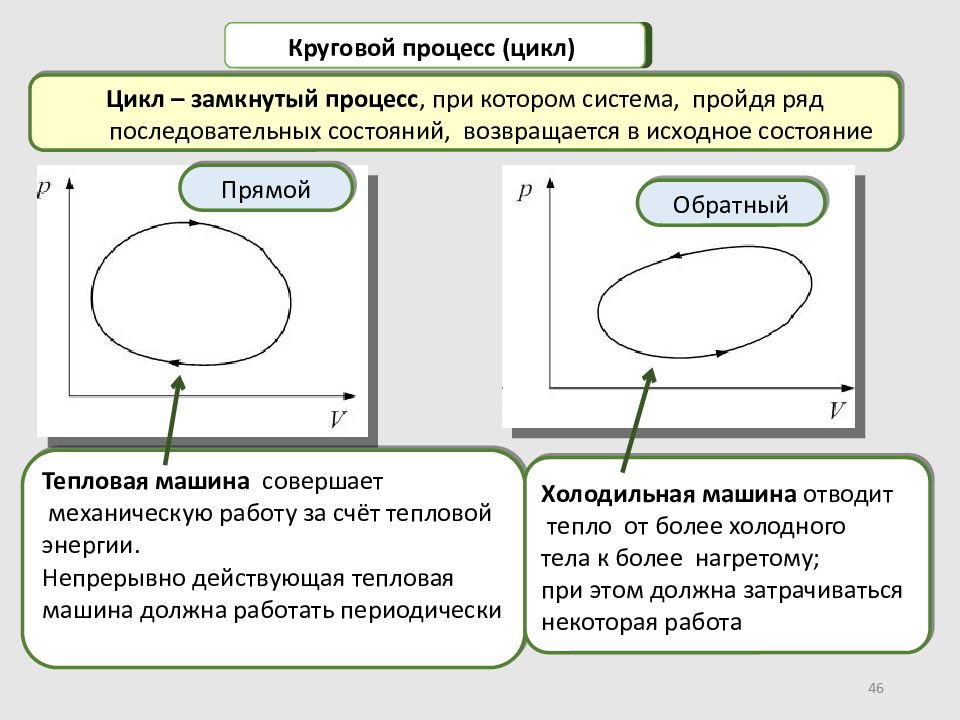
46 Цикл – замкнутый процесс, при котором система, пройдя ряд последовательных состояний, возвращается в исходное состояние Круговой процесс (цикл) Прямой Обратный Тепловая машина совершает механическую работу за счёт тепловой энергии. Непрерывно действующая тепловая машина должна работать периодически Холодильная машина отводит тепло от более холодного тела к более нагретому; при этом должна затрачиваться некоторая работа
Слайд 47
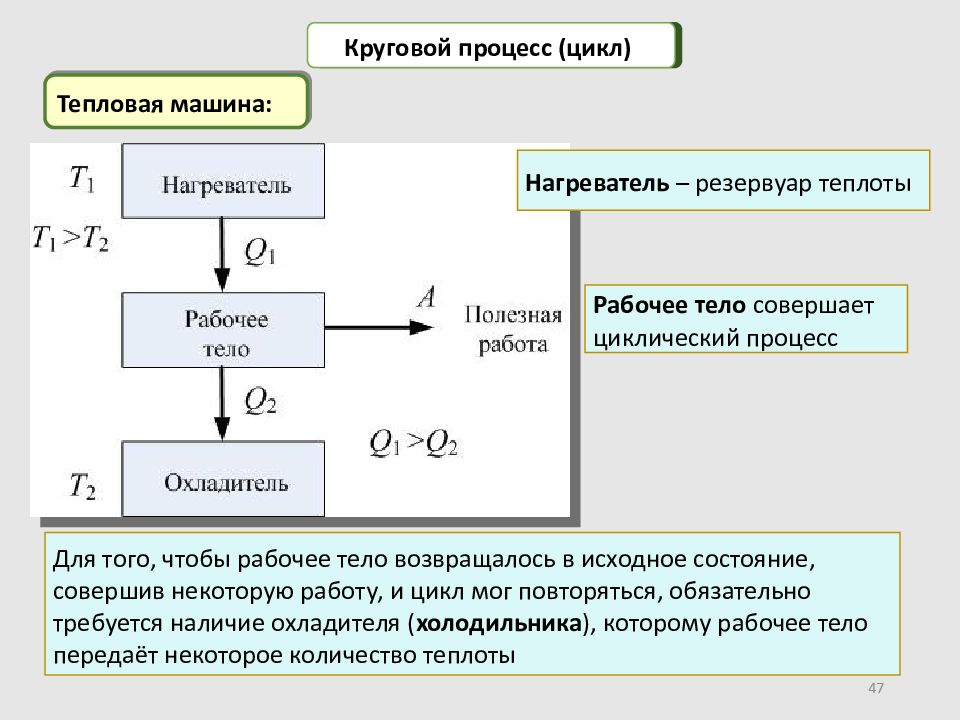
47 Тепловая машина: Круговой процесс (цикл) Рабочее тело совершает циклический процесс Нагреватель – резервуар теплоты Для того, чтобы рабочее тело возвращалось в исходное состояние, совершив некоторую работу, и цикл мог повторяться, обязательно требуется наличие охладителя ( холодильника ), которому рабочее тело передаёт некоторое количество теплоты
Слайд 48
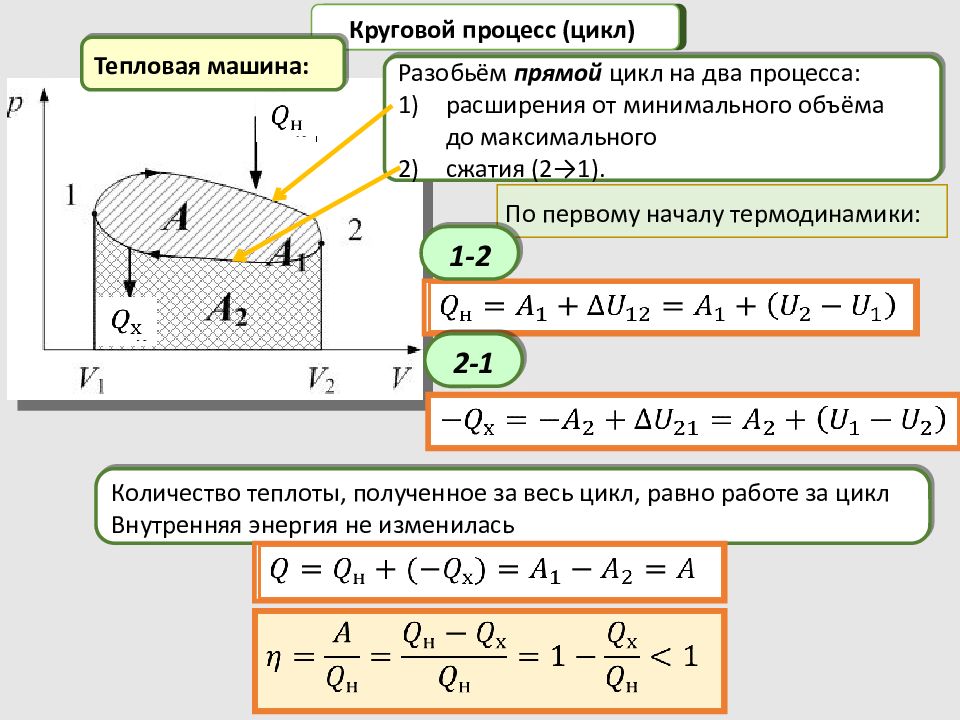
Круговой процесс (цикл) Разобьём прямой цикл на два процесса: расширения от минимального объёма до максимального сжатия (2→1). По первому началу термодинамики: Тепловая машина: Количество теплоты, полученное за весь цикл, равно работе за цикл Внутренняя энергия не изменилась 1-2 2-1
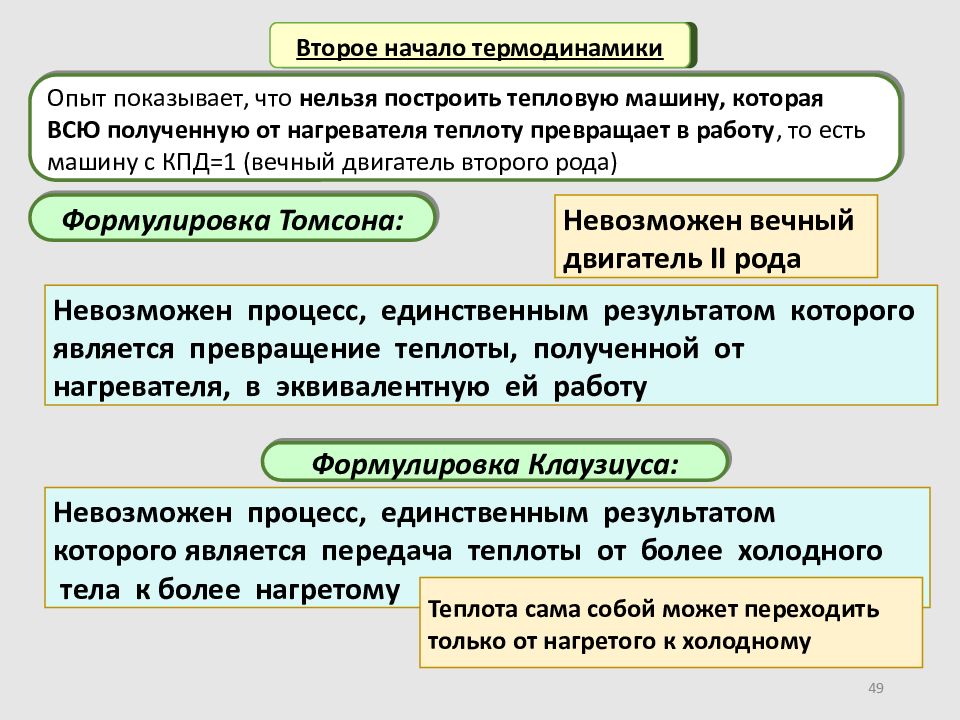
Слайд 49
49 Второе начало термодинамики Формулировка Томсона: Опыт показывает, что нельзя построить тепловую машину, которая ВСЮ полученную от нагревателя теплоту превращает в работу, то есть машину с КПД=1 (вечный двигатель второго рода) Невозможен процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу Формулировка Клаузиуса: Невозможен вечный двигатель II рода Невозможен процесс, единственным результатом которого является передача теплоты от более холодного тела к более нагретому Теплота сама собой может переходить только от нагретого к холодному
Слайд 50
50 Второе начало термодинамики Формулировки Томсона и Кельвина эквивалентны Если бы теплота Q х сама собой, без дополнительной работы перешла от холодильника к нагревателю тепловой машины, то её можно было бы в конце концов превратить в работу, то есть построить тепловую машину с КПД=1 Невозможен двигатель с КПД=1 Теплота сама собой может переходить только от нагретого к холодному Доказательство: Формулировка Томсона: Формулировка Клаузиуса :
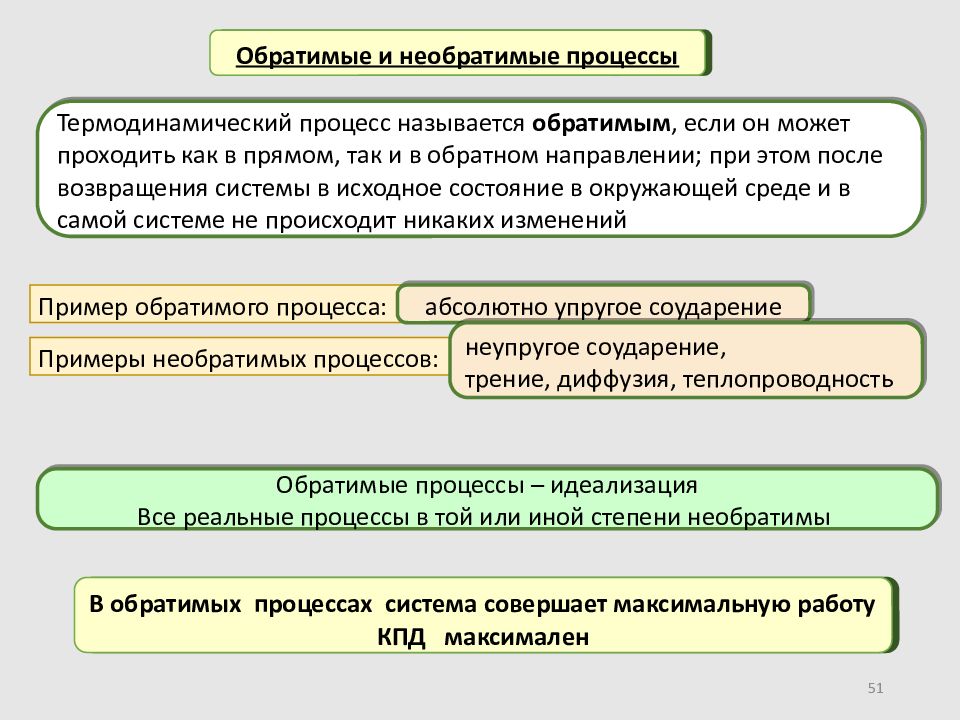
Слайд 51
51 Обратимые и необратимые процессы Термодинамический процесс называется обратимым, если он может проходить как в прямом, так и в обратном направлении; при этом после возвращения системы в исходное состояние в окружающей среде и в самой системе не происходит никаких изменений Пример обратимого процесса: Обратимые процессы – идеализация Все реальные процессы в той или иной степени необратимы абсолютно упругое соударение Примеры необратимых процессов: неупругое соударение, трение, диффузия, теплопроводность В обратимых процессах система совершает максимальную работу КПД максимален
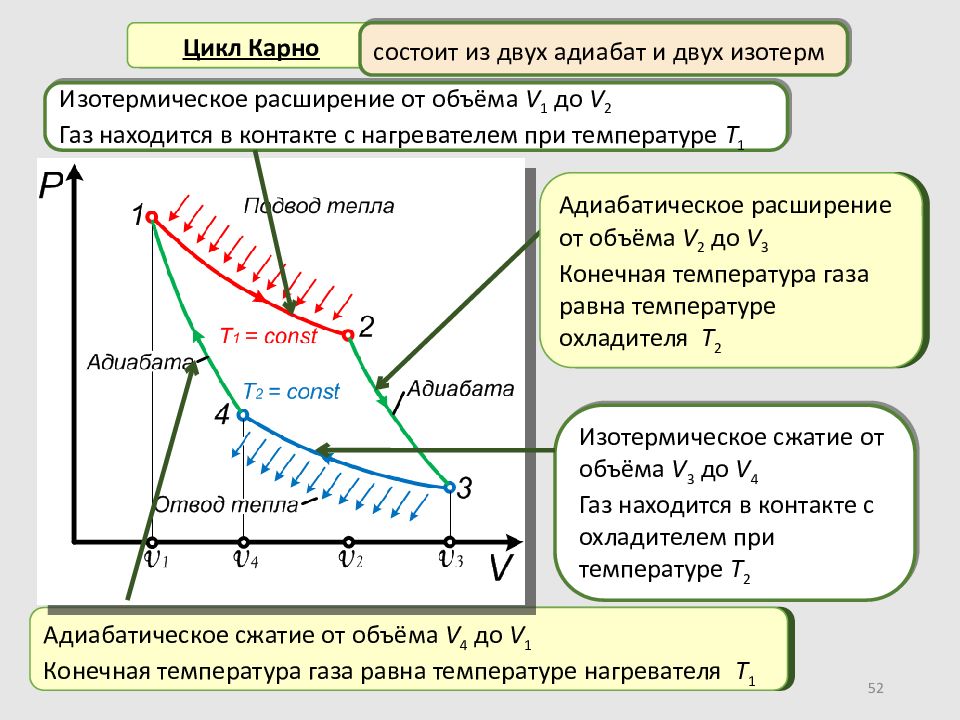
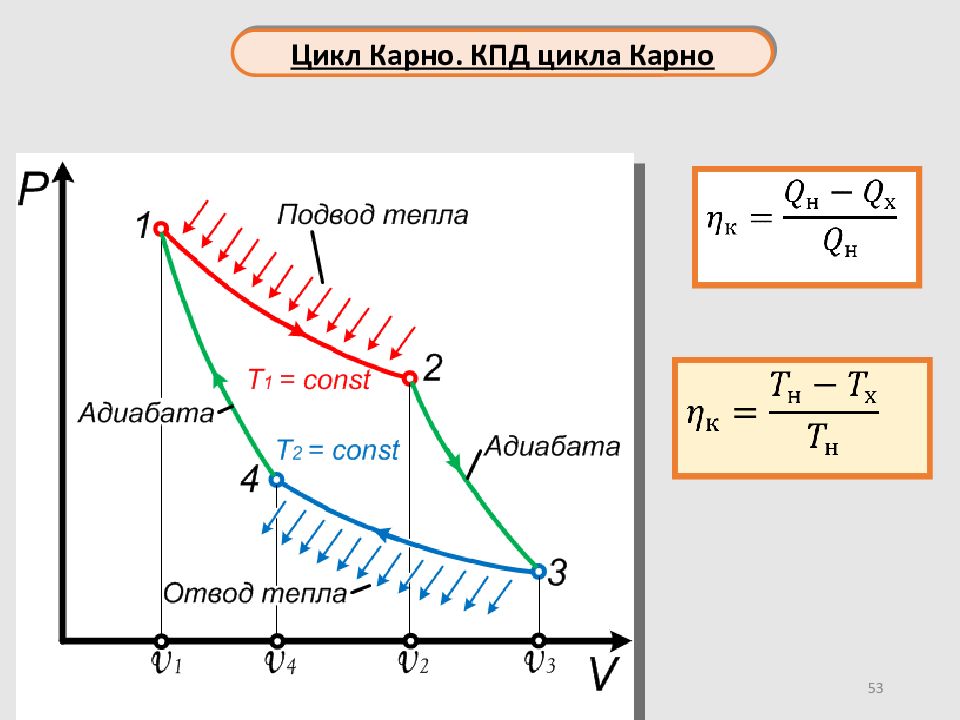
Слайд 52
52 Цикл Карно Изотермическое расширение от объёма V 1 до V 2 Газ находится в контакте с нагревателем при температуре T 1 состоит из двух адиабат и двух изотерм Адиабатическое сжатие от объёма V 4 до V 1 Конечная температура газа равна температуре нагревателя T 1 Изотермическое сжатие от объёма V 3 до V 4 Газ находится в контакте с охладителем при температуре T 2 Адиабатическое расширение от объёма V 2 до V 3 Конечная температура газа равна температуре охладителя T 2
Слайд 54
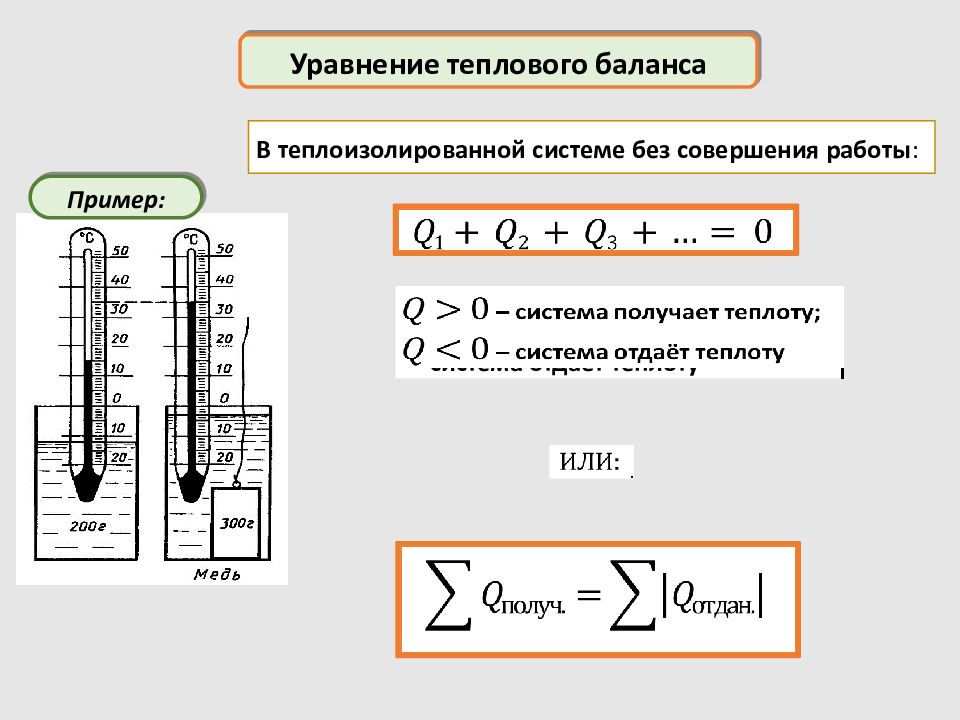
Уравнение теплового баланса Пример: В теплоизолированной системе без совершения работы : – система получает теплоту; – система отдаёт теплоту
Слайд 55
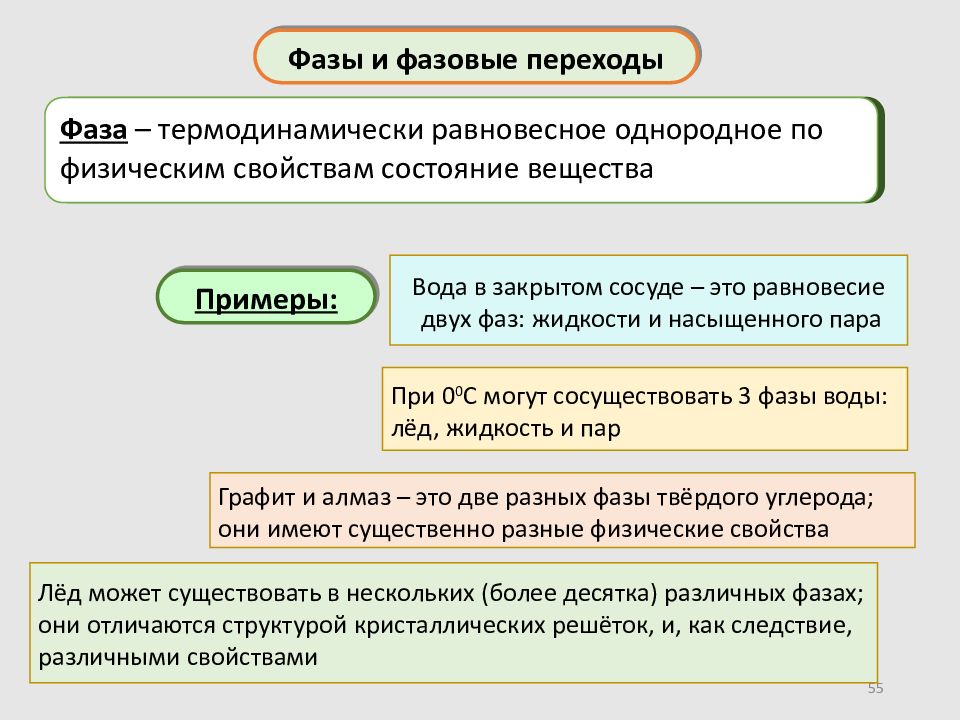
55 Фазы и фазовые переходы Фаза – термодинамически равновесное однородное по физическим свойствам состояние вещества Графит и алмаз – это две разных фазы твёрдого углерода; они имеют существенно разные физические свойства При 0 0 С могут сосуществовать 3 фазы воды: лёд, жидкость и пар Лёд может существовать в нескольких (более десятка) различных фазах; они отличаются структурой кристаллических решёток, и, как следствие, различными свойствами Примеры: Вода в закрытом сосуде – это равновесие двух фаз: жидкости и насыщенного пара
Слайд 56
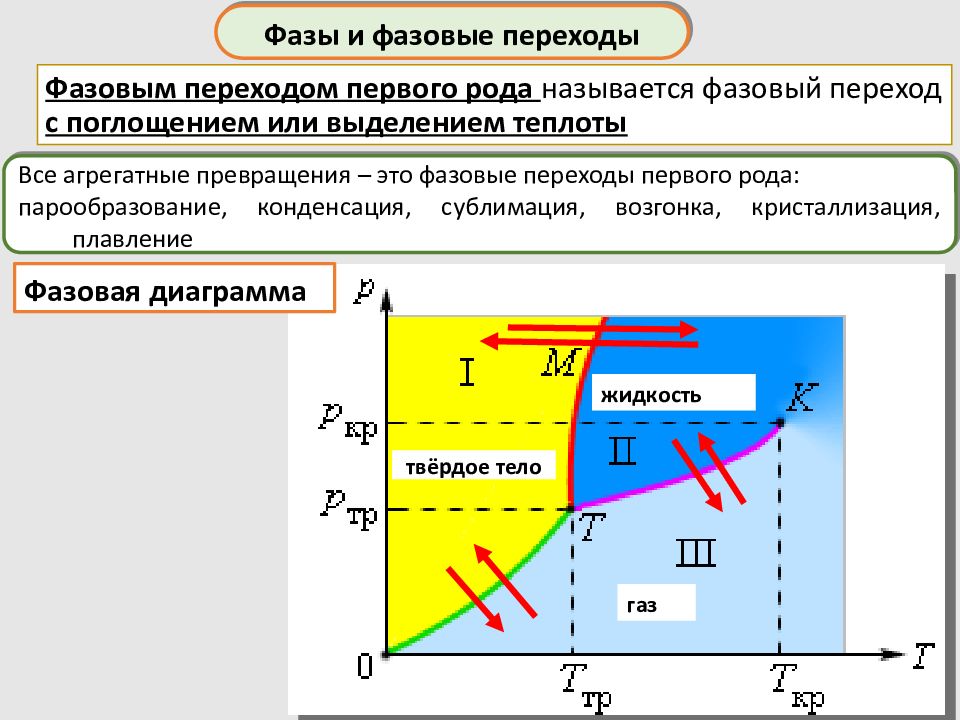
Фазы и фазовые переходы Все агрегатные превращения – это фазовые переходы первого рода: парообразование, конденсация, сублимация, возгонка, кристаллизация, плавление Фазовым переходом первого рода называется фазовый переход с поглощением или выделением теплоты жидкость газ твёрдое тело Фазовая диаграмма
Слайд 57
57 Фазы и фазовые переходы При фазовых переходах второго рода скачкообразно меняются свойства вещества Фазовый переход второго рода не сопровождается поглощением или выделением теплоты переход в сверхпроводящее состояние при сверхнизких температурах переход жидкого гелия в сверхтекучее состояние при сверхнизких температурах переход кристалла из одной модификации в другую (металлы, графит-алмаз, лёд и т.д.) Примеры фазовых переходов второго рода:
Слайд 58
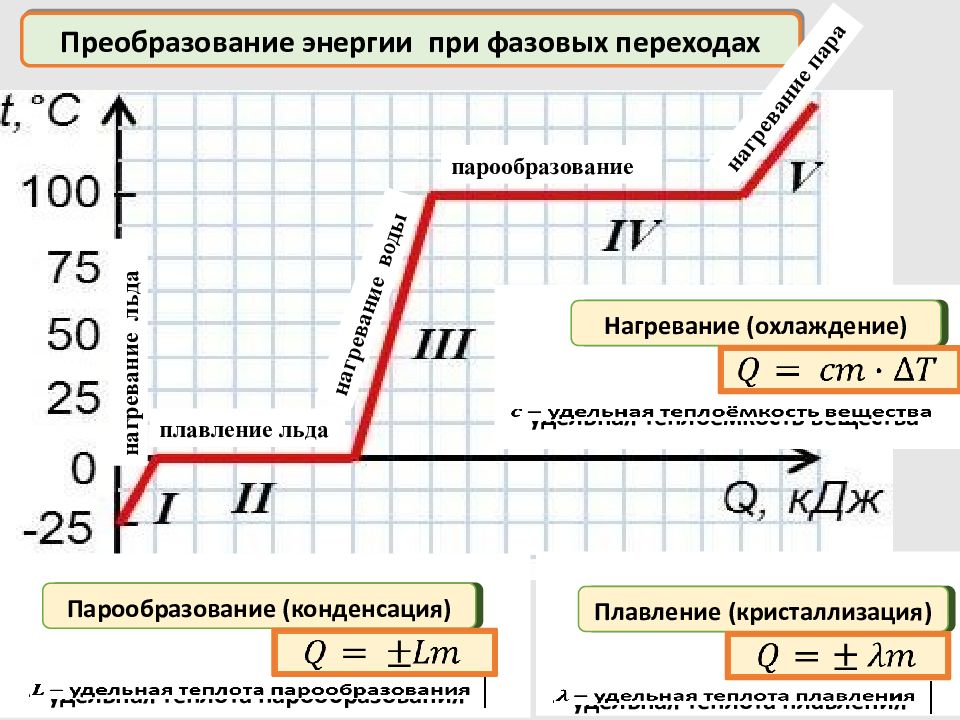
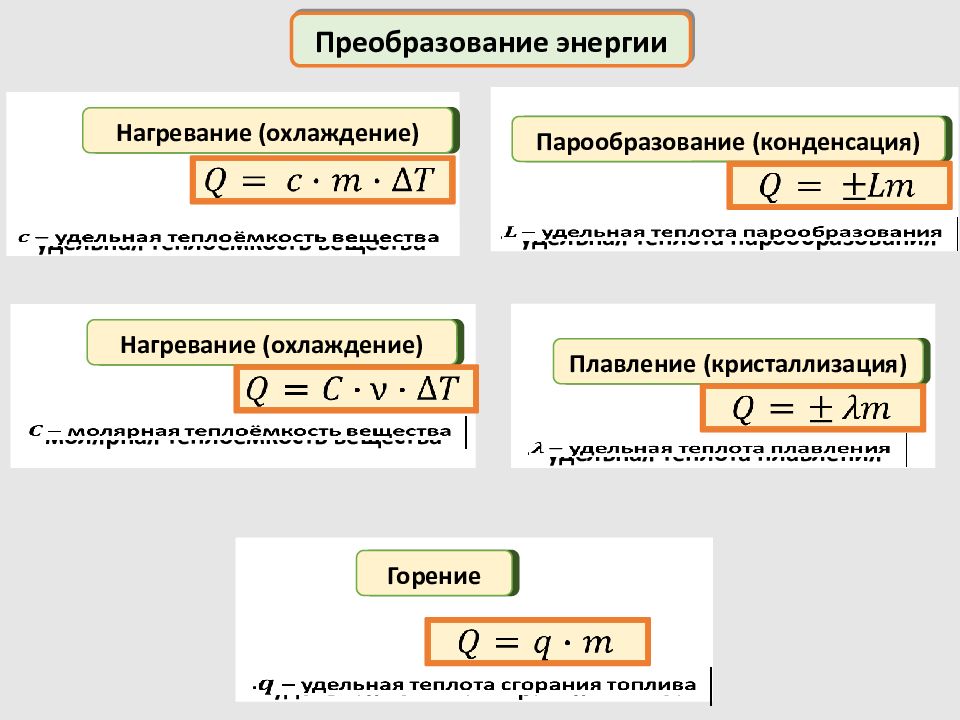
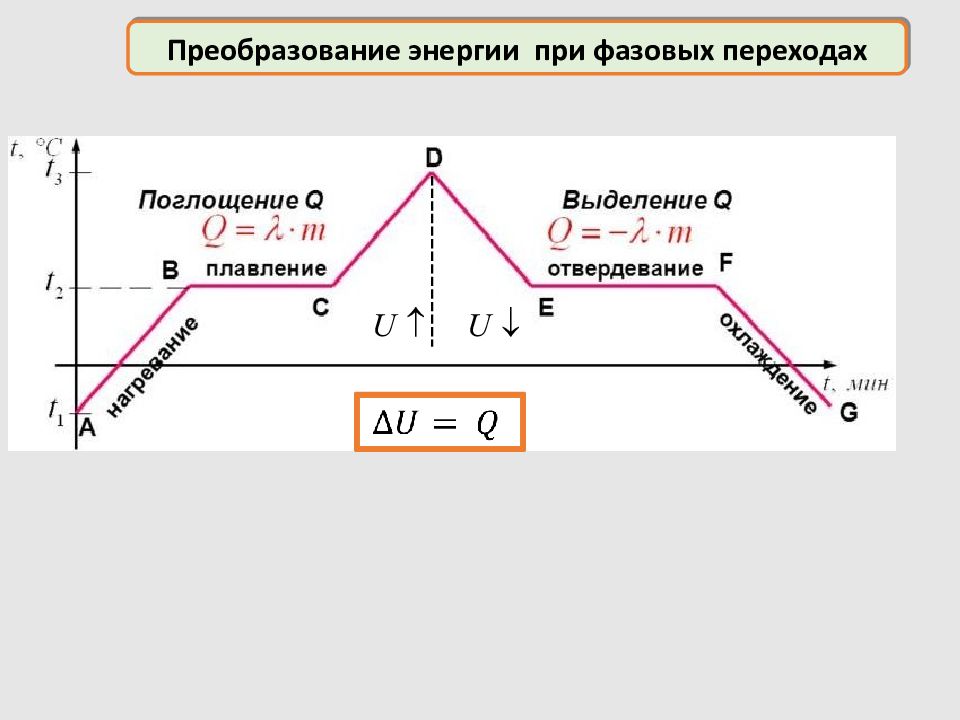
– удельная теплота парообразования Преобразование энергии при фазовых переходах нагревание льда плавление льда нагревание воды парообразование нагревание пара Нагревание (охлаждение) Плавление (кристаллизация) Парообразование (конденсация) – удельная теплота плавления – удельная теплоёмкость вещества
Слайд 59
– удельная теплота парообразования Преобразование энергии Нагревание (охлаждение) Плавление (кристаллизация) Парообразование (конденсация) – удельная теплота плавления – удельная теплоёмкость вещества Нагревание (охлаждение) – молярная теплоёмкость вещества Горение – удельная теплота сгорания топлива
Слайд 61
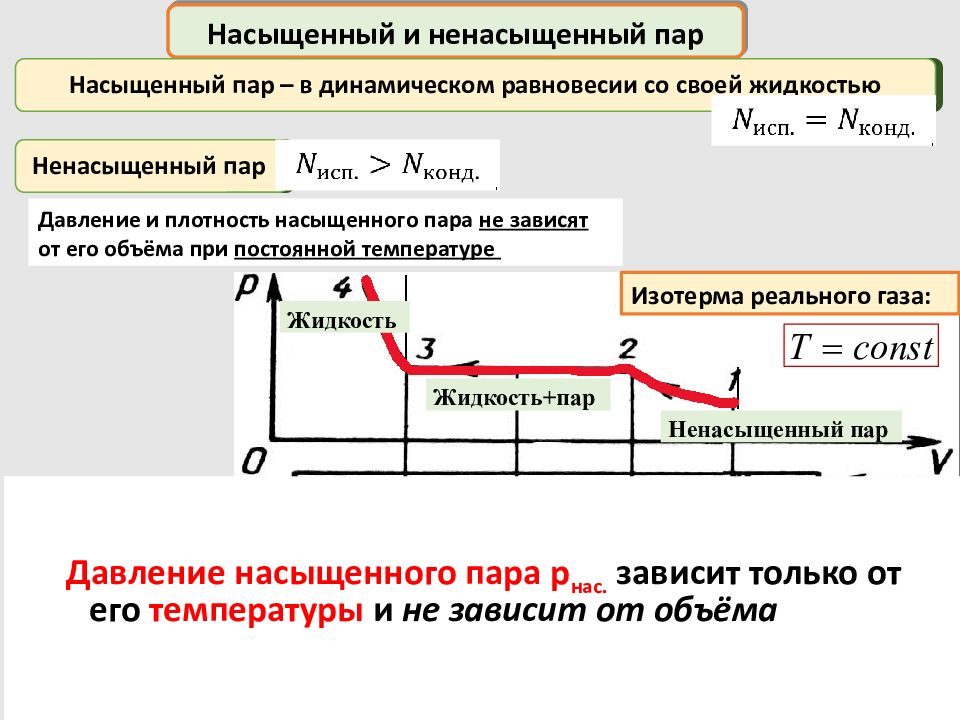
Насыщенный и ненасыщенный пар Насыщенный пар – в динамическом равновесии со своей жидкостью Давление и плотность насыщенного пара не зависят от его объёма при постоянной температуре Т c on s t Изотерма реального газа: Ненасыщенный п ар Жидкость +пар Ненасыщенный пар Жидкость Давление насыщенного пара p нас. зависит только от его температуры и не зависит от объёма
Слайд 62
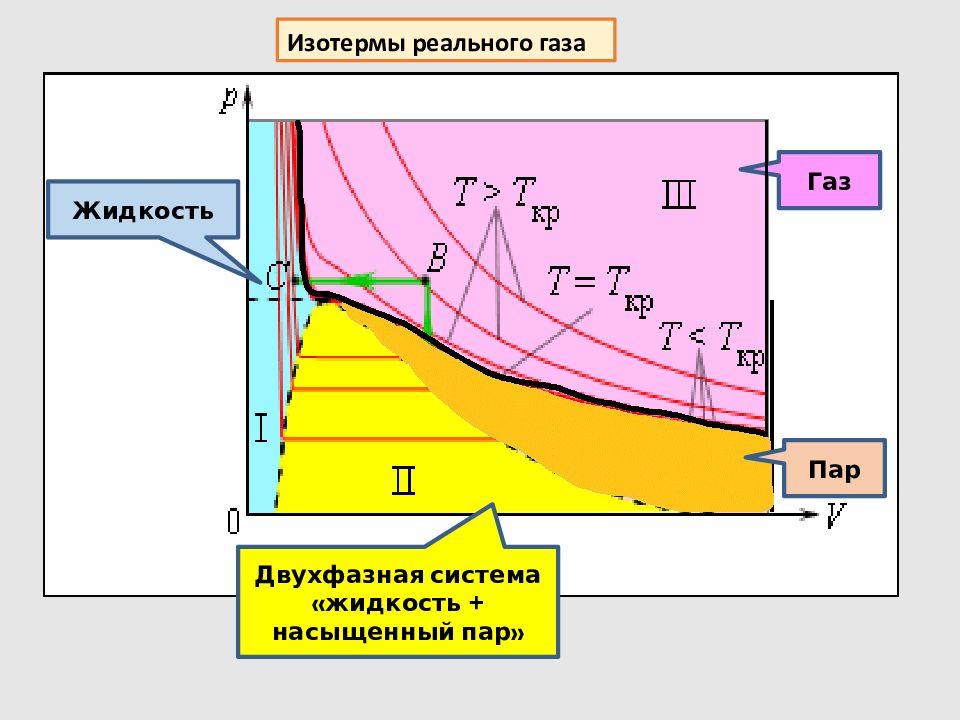
Жидкость Двухфазная система «жидкость + насыщенный пар» Газ Изотермы реального газа Пар
Слайд 63
Идеальный газ ( n = const ) Насыщенный пар ( n ≠ const ) Насыщенный пар Концентрация насыщенного пара (плотность) увеличивается с ростом температуры: Зависимость нелинейная
Слайд 64
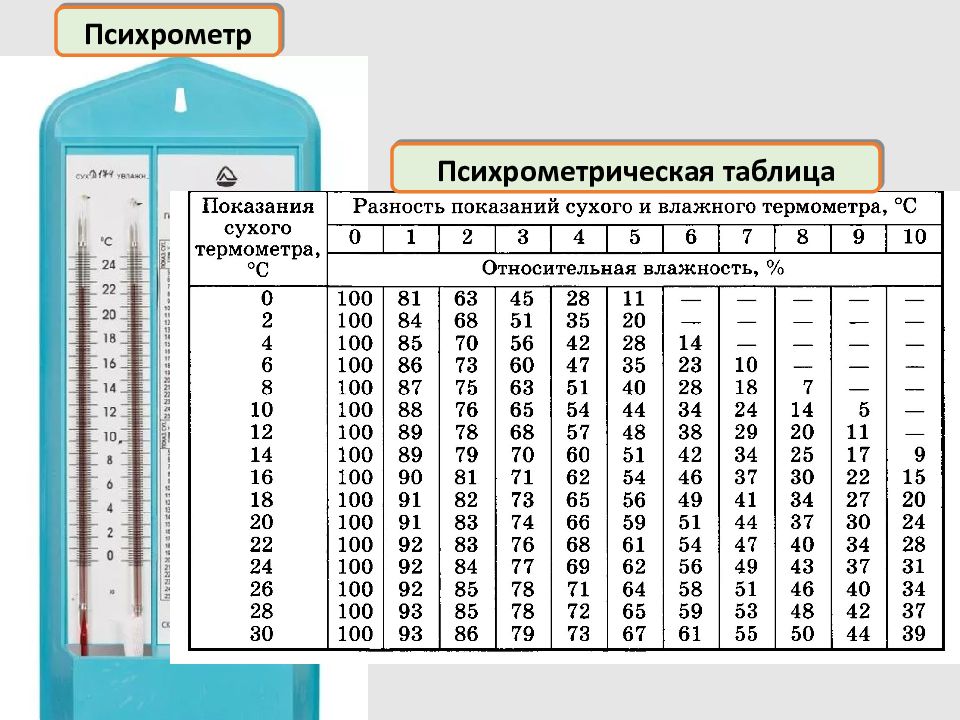
Влажность воздуха Абсолютная влажность – это масса водяного пара в 1 м³ воздуха ( плотность водяных паров ) Относительная влажность – это отношение парциального давления водяного пара при данной температуре к давлению насыщенного водяного пара при этой же температуре парциальное давление водяного пара
Слайд 65
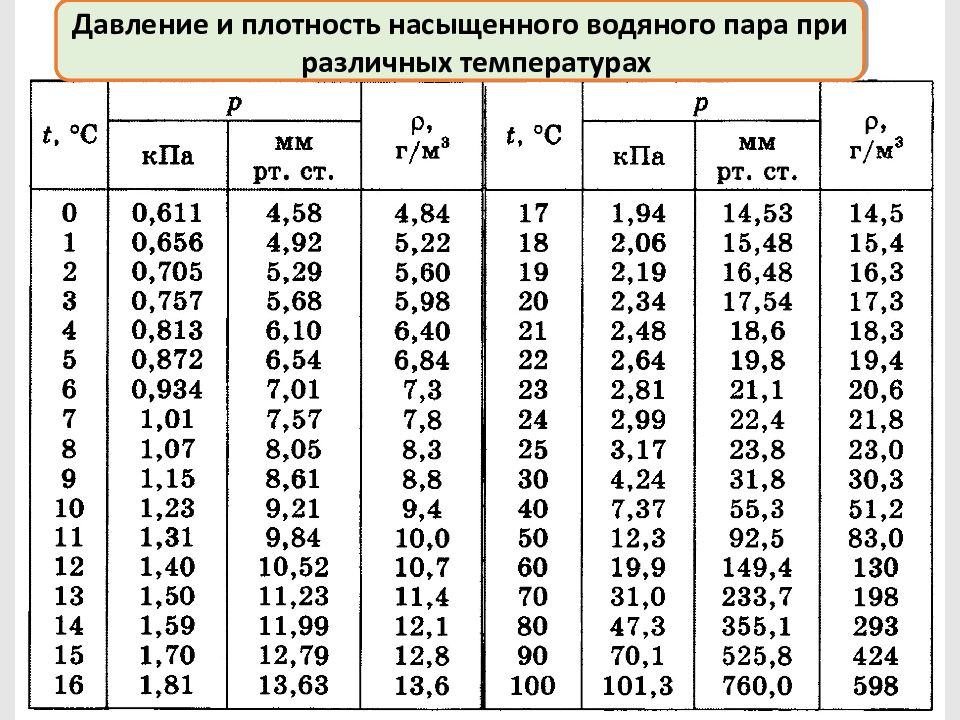
Давление и плотность насыщенного водяного пара при различных температурах