Первый слайд презентации: ИРИДИЙ мультимедийный лонгрид
Выполнила: команда «ПЛЮМБАУРУМ» ЧОУ «Медико-биологический лицей», г. Симферополь
Слайд 2: Положение в периодической системе химических элементов Д.И. Менделеева
Иридий ( Ir ) - благородный металл, находящийся в 6 (большом) периоде, в VIII группе, побочной подгруппе, в d семействе. Атомный номер 77.
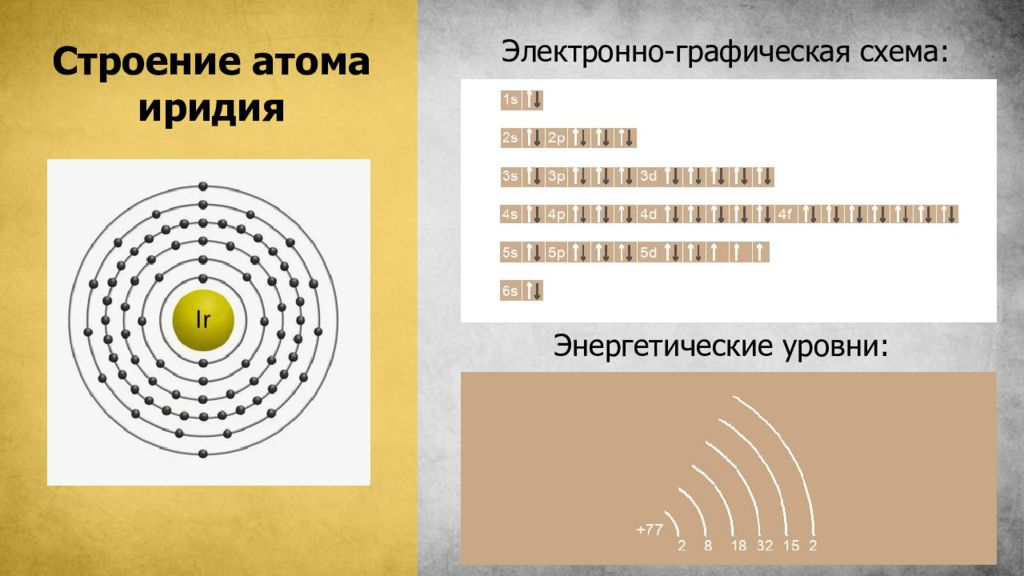
Слайд 3: Строение атома иридия
Электронно-графическая схема: иридия: Энергетические уровни:
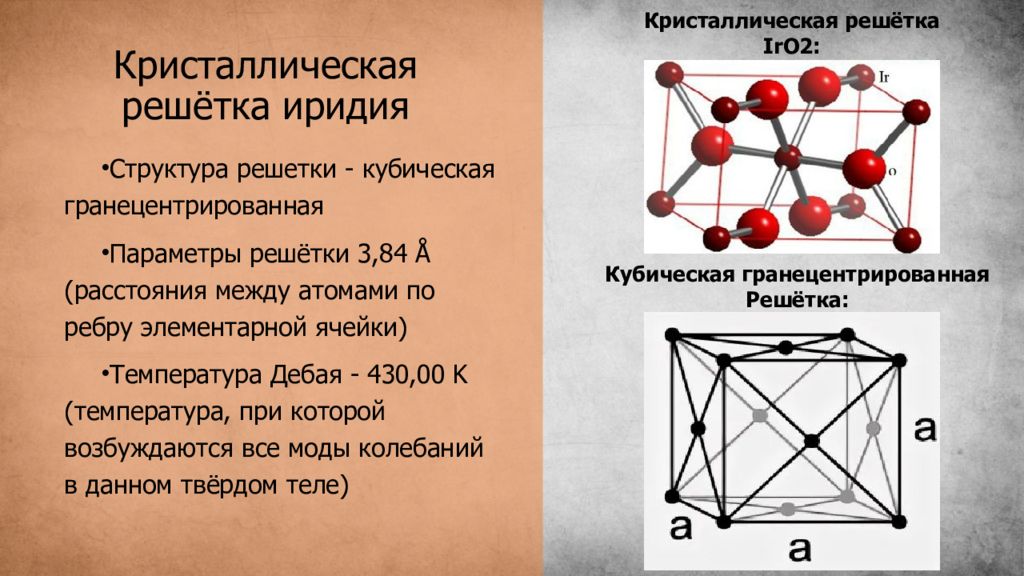
Слайд 4: Кристаллическая решётка иридия
Структура решетки - кубическая гранецентрированная Параметры решётки 3,84 Å (расстояния между атомами по ребру элементарной ячейки ) Температура Дебая - 430,00 K ( температура, при которой возбуждаются все моды колебаний в данном твёрдом теле) Кристаллическая решётка IrO2 : Кубическая гранецентрированная Решётка:
Слайд 5: Изотопы иридия
Природный иридий является смесью двух стабильных изотопов: 191 Ir (37,3 %) 193 Ir (62,7 %) Также существует искусственный изотоп: Изотоп 192 Ir используется для генерации гамма-излучения. Его применяют в технике для контроля сварных швов и в высокодозной брахитерапии для лечения рака.
Слайд 6: Степени окисления и валентность
Степень окисления - это условный заряд на атоме в соединениях. Атомы иридия в соединениях имеют степени окисления 0, +1, +2, +3, +4, +5, +6. Валентность иридия характеризует способность атомов Ir к образованию химических связей. Атомы иридия в соединениях проявляют валентность I, II, III, IV, V, VI. Взаимодействие фторида иридия( VI ) с водой: Ir +2 ē ⭢ Ir ⋅2 +6 + 4 2 O -4 ē ⭢ O 2 ⋅1 -2 0 4 Ox Red
Слайд 7: История открытия иридия
Изначально исследователи не могли понять природу иридия. Они пытались растворить его в кислотах, но безуспешно, что и стало ключом к его уникальным свойствам. Открытие иридия стало настоящим прорывом в химии.
Слайд 8: Предпосылки открытия: платина и её спутники
История открытия иридия тесно связана с изучением платины. В XVIII веке ученые обнаружили, что платина не является чистым элементом и содержит примеси других металлов. Попытки выделить и идентифицировать эти примеси привели к открытию новых элементов, включая иридий.
Слайд 9: Смитсон Теннант: человек, открывший иридий
Смитсон Теннант, английский химик, стал тем учёным, который смог выделить и определить иридий. В 1803 году он провёл ряд опытов с нерастворимым осадком, который остался после растворения платины в царской водке. В результате этих опытов были открыты два новых элемента — иридий и осмий.
Слайд 10: Эксперименты и анализ : Как был выделен иридий
Теннант открыл в нерастворимом остатке два новых элемента. Обработка остатка щелочью позволила выделить два вещества: осмий с резким запахом хлора и иридий, образующий соли разных цветов. Для выделения иридия Теннант использовал различные химические реакции, включая осаждение, фильтрование и прокаливание.
Слайд 11: Происхождение названия : Ирис, Богиня Радуги
Иридий назван в честь греческого слова « iris », что означает « радуга ». Это связано с многообразием цветов его солей: красный, желтый, зеленый и синий, напоминающие цвета радуги. Смитсон Теннант назвал иридий, чтобы подчеркнуть его способность образовывать соединения разных цветов. Это название стало символом красоты и разнообразия химических элементов.
Слайд 12
Содержание иридия в земной коре ничтожно мало ( 10 −7 % по массе ). Иридий содержится в таких минералах, как невьянскит, сысертскит и ауросмирид. Иридий, наряду с другими драгоценными металлами, получают из анодных шламов медно-никелевого производства. ИРИДИЙ: НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ
Слайд 13: ИРИДИЙ: ФИЗИЧЕСКИЕ СВОЙСТВА
• Плотность иридия: 22,65 г/см³ при 20 °C • В чистом виде иридий имеет серебристо-белый цвет с легким желтоватым оттенком. • Нелинейная зависимость плотности от температуры • Температура плавления : + 24 66 °C • Температура кипения : + 4 428 °C • Высокая прочность и химическая стойкость ИРИДИЙ: ФИЗИЧЕСКИЕ СВОЙСТВА Прочность Пластичность Твердость Высокая твердость (6.5 по Моосу). - Значения по Виккерсу: 200-250 HV. - Слабо снижается с температурой Высокая прочность на разрыв. - Плотная кристаллическая структура. - Ценный материал для износостойких приложений Низкая пластичность. - Трудно деформируется холодной обработкой. - Ограниченная обработка горячими методами 3 2 1
Слайд 14: ИРИДИЙ: ИНТЕРЕСНЫЕ ФАКТЫ
Иридий – один из самых тяжёлых металлов на Земле, плотность которого составляет около 22,56 г/см³. Это значение чуть-чуть меньше, чем у осмия, который традиционно считается самым тяжёлым элементом! Невероятная плотность иридия – следствие структуры его атомов и сильного взаимодействия между ними. Эта плотность почти вдвое превышает плотность свинца и примерно в 23 раза тяжелее воды. Иридий обладает высокой устойчивостью к коррозии и практически не подвержен воздействию кислот, солей и высоких температур. ИРИДИЙ: ИНТЕРЕСНЫЕ ФАКТЫ
Слайд 15: ИРИДИЙ: ХИМИЧЕСКИЕ СВОЙСТВА
1. Иридий - благородный металл с высокой химической инертностью. 2. Взаимодействие с кислотами: - Не реагирует с обычными кислотами. - В р еакци и с царской водкой образуется гексахлороиридат(IV). 3. Взаимодействие со щелочами: - Не реагирует при обычных условиях. 4. Взаимодействие с галогенами: - В р еакци и с фтором образуется гексафторид иридия(VI). - Р еакции с хлором, бромом, иодом требуют высоких температур, при этом образуются разные соединения. ИРИДИЙ: ХИМИЧЕСКИЕ СВОЙСТВА ИРИДИЙ: ХИМИЧЕСКИЕ СВОЙСТВА
Слайд 16: ИРИДИЙ: ХИМИЧЕСКИЕ СВОЙСТВА
• Иридий: важный элемент координационной химии. • Способен образовывать устойчивые комплексы в степенях окисления + 1, +2, +3, +4, +5, +6. • Наиболее распространены комплексы Ir(III) и Ir(IV) с октаэдрической геометрией. • Кинетическая инертность из-за сильных металл-лигандных связей. • Примеры: - K 2 [IrCl 6 ] - сильный окислитель. - [IrCl(CO)( PPh 3 ) 2 ] - квадратный планарный комплекс, используется в гомогенном катализе. • Применение: медицина, материаловедение, катализ. ИРИДИЙ: ХИМИЧЕСКИЕ СВОЙСТВА
Слайд 17
Мировое потребление иридия составило 10,4 тонн в 2022 году. Основное применение — оборудование для выращивания монокристаллов, где иридий используют в качестве материала тиглей. Иридий, наряду с медью и платиной, применяется в свечах зажигания двигателей внутреннего сгорания (ДВС) в качестве материала для изготовления электродов, делая такие свечи наиболее долговечными
Слайд 18
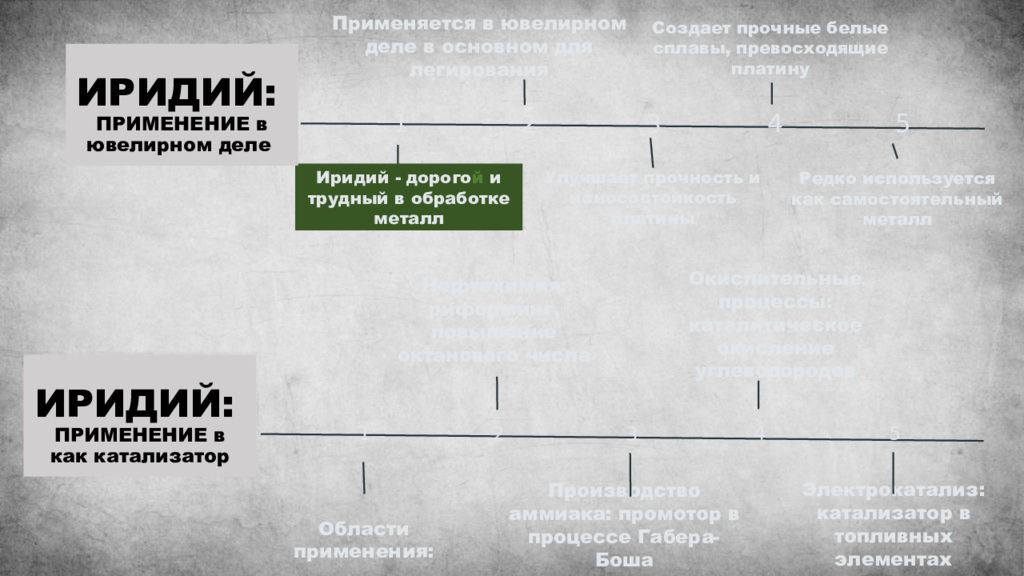
1 2 3 4 5 Применяется в ювелирном деле в основном для легирования Улучшает прочность и износостойкость платины Создает прочные белые сплавы, превосходящие платину Редко используется как самостоятельный металл Иридий - дорого й и трудный в обработке металл ИРИДИЙ: ПРИМЕНЕНИЕ в ювелирном деле 1 2 3 4 5 Нефтехимия: риформинг, повышение октанового числа Производство аммиака: промотор в процессе Габера-Боша Окислительные процессы: каталитическое окисление углеводородов Электрокатализ: катализатор в топливных элементах Области применения: ИРИДИЙ: ПРИМЕНЕНИЕ в как катализатор
Слайд 19
• Исключительная химическая инертность • Высокая температура плавления • Превосходная электропроводность Области применения: 1. Высокотемпературные электроды 2. Сверхпроводниковые материалы 3. Контактные материалы 4. Изготовление резисторов Преимущества: • Долговечность • Высокая надежность • Стабильность в экстремальных условиях ИРИДИЙ: ПРИМЕНЕНИЕ В ЭЛЕКТРОТЕХНИКЕ
Слайд 20
В 2013 году иридий впервые в мире был применён в изготовлении официальных монет Национальным банком Руанды, который выпустил монету из чистого металла 999-й пробы. Иридиевая монета была выпущена номиналом 10 руандийских франков Сплавы с вольфрамом (W) и торием ( Th ) — материалы термоэлектрических генераторов Из-за своей редкости и сложности извлечения, иридий является одним из самых дорогих металлов.
Слайд 21
Одним из самых известных фактов об иридии является его связь с вымиранием динозавров. В слое глины, датируемом концом мелового периода (границей между мезозойской и кайнозойской эрами), было обнаружено аномально высокое содержание иридия, примерно в 30 раз больше, чем в среднем в земной коре. Это привело к гипотезе о падении крупного астероида или кометы, богатой иридием, на Землю около 66 миллионов лет назад. Падение произошло в районе современного полуострова Юкатан в Мексике. Образовался кратер Чиксулуб, диаметром около 180 километров. «ИРИДИЕВАЯ АНОМАЛИЯ»
Последний слайд презентации: ИРИДИЙ мультимедийный лонгрид
Иридий был обнаружен в метеоритах, что подтверждает его внеземное происхождение. Считается, что иридий, как и другие платиновые металлы, был доставлен на Землю в ходе поздней тяжелой бомбардировки, когда наша планета подверглась интенсивным ударам астероидов и комет. Иридий обладает потенциалом для использования в новых технологиях, например, в качестве катализатора для более эффективных и экологичных химических процессов. Несмотря на свою редкость, иридий продолжает удивлять и вдохновлять исследователей по всему миру. ЗАГАДКА ИРИДИЯ: ВЗГЛЯД В БУДУЩЕЕ