Слайд 2: Изотопы водорода
Про́тий — название самого лёгкого изотопа водорода, обозначается символом 1 H. Ядро протия состоит из одного протона, отсюда и название изотопа. Протий составляет 99,9885 ± 0,0070 % от общего числа атомов водорода во Вселенной и является наиболее распространённым нуклидом в природе среди изотопов всех химических элементов. Дейте́рий (лат. deuterium, от др.-греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2 H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона. Три́тий ( др.-греч. τρίτος «третий»), сверхтяжёлый водород, обозначается символами T и 3 H — радиоактивный изотоп водорода. Ядро трития состоит из протона и двух нейтронов, его называют тритоном и обозначают t. Водород-4 является нестабильным изотопом водорода. Синтезирован в лаборатории посредством атаки трития ядрами дейтерия. В этом эксперименте ядра трития захватили нейтроны от стремительных ядер дейтерия. Присутствие водорода-4 было выведено при обнаружении испускаемых протонов. Водород-5 — нестабильный изотоп водорода. Синтезирован в лаборатории посредством атаки трития ядрами трития. В этом эксперименте ядра трития захватили по 2 нейтрона от стремительных ядер. Водород-6 — нестабильный нуклид химического элемента водорода с массовым числом 6. Водород-7 — нестабильный нуклид химического элемента водорода с массовым числом 7.
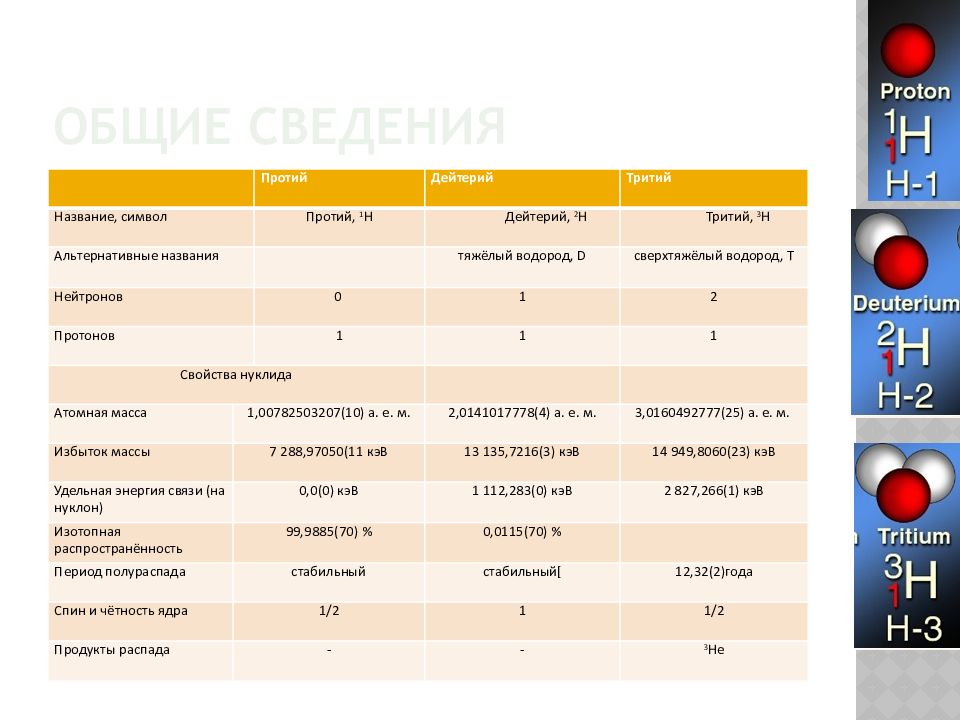
Слайд 3: Общие сведения
Протий Дейтерий Тритий Название, символ Протий, 1 H Дейтерий, 2 H Тритий, 3 H Альтернативные названия тяжёлый водород, D сверхтяжёлый водород, T Нейтронов 0 1 2 Протонов 1 1 1 Свойства нуклида Атомная масса 1,00782503207(10) а. е. м. 2,0141017778(4) а. е. м. 3,0160492777(25) а. е. м. Избыток массы 7 288,97050(11 кэВ 13 135,7216(3) кэВ 14 949,8060(23) кэВ Удельная энергия связи (на нуклон) 0,0(0) кэВ 1 112,283(0) кэВ 2 827,266(1) кэВ Изотопная распространённость 99,9885(70) % 0,0115(70) % Период полураспада стабильный стабильный[ 12,32(2)года Спин и чётность ядра 1/2 1 1/2 Продукты распада - - 3 He
Слайд 4: Распространение в природе
Изотопы распространены в природе неодинаково: один атом дейтерия приходится примерно на 7000, а один атом бета радиоактивного трития – на миллиард миллиардов атомов протия.
Слайд 5: Изотопная плотность
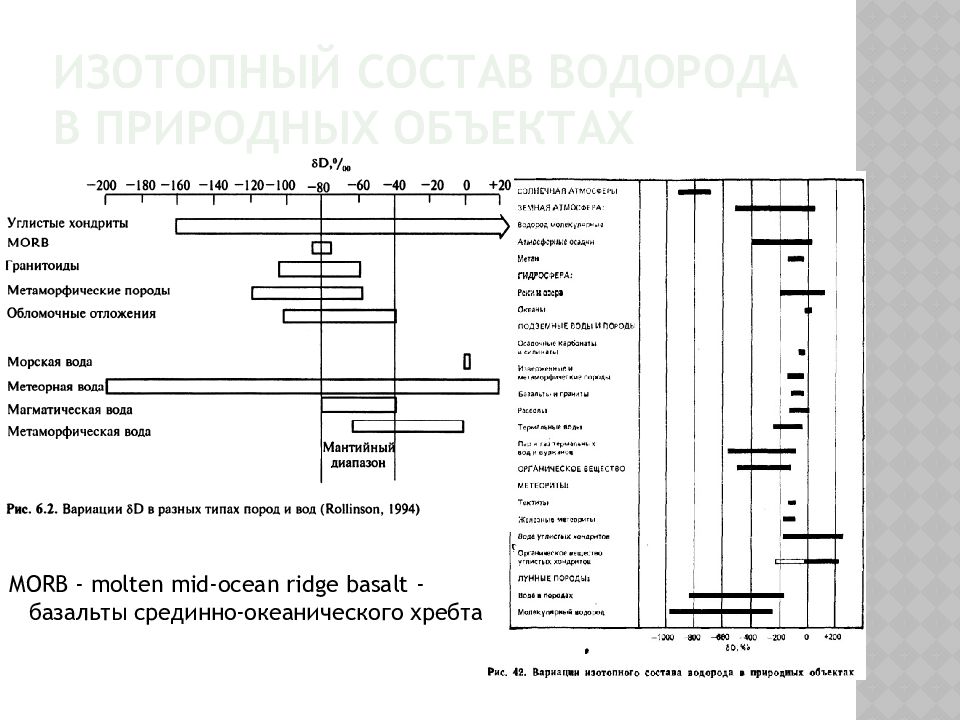
Изотопные виды HD 16 O и D 16 2 O представляют собой тяжелую воду. По характеристике изотопного состава водорода применяют изотопную плотность, которая равна: где (D/H) пр - изотопное отношение в пробе, (D/H) ст - изотопное отношение в стандарте. По предложению Г.Крейга (1961) в качестве международного стандарта принята средняя океаническая вода. Изотопная плотность выражается в промилле. Для стандартной океанической воды ( Standart mean oceanic water - SMOW) она равна нулю. Положительные значения δ D означают увеличение содержания тяжелого изотопа водорода, а отрицательные - уменьшение по сравнению с содержанием океанической воды. Колебания изотопного состава водорода довольно существенны и превышают аналогичные изменения изотопных соотношений других химических элементов. Самые незначительные колебания δ D отмечаются в земных горных породах. В то же время наибольшие колебания характерны для летучих веществ преимущественно в природных водах и органическом веществе.
Слайд 6: Изотопный состав водорода в природных объектах
MORB - molten mid-ocean ridge basalt - базальты срединно-океанического хребта
Слайд 7: Дейтерий
Твердый дейтерий имеет конфигурацию тетрагона, объемноцентрированную решетку, а = 0,338 нм, с = 0,560 нм. Водород и дейтерий не изоморфны, обнаружена их ограниченная взаимная растворимость в твердом состоянии. При 4,2 К предельная растворимость дейтерия в водороде 10% по объему, а растворимость водорода в дейтерии 21%. По химическим свойствам дейтерий аналогичен водороду, однако скорость реакций при замещении водорода на дейтерий заметно уменьшается, например, при окислении органических соединений водорода с хлором - в 5-10 раз. При электролизе воды дейтерий выделяется медленнее, чем водород. С другими изотопами водорода дейтерий образует молекулы протодейтерия HD (мол. м. 3,02205) и дейтеротрития DT (мол. м. 5,03034).
Слайд 8: Дейтерий в общей массе изотопов водорода
Химический элемент Стабильные изотопы Распространённость в природе, ат. % Водород Протий H 99,9853 Дейтерий D 0,0147 Дейтерий накапливается в древних минералах и водах
Слайд 9: Тритий
Изотоп 3 H называют тритием (T). Массовое число в углеродных единицах — 3,0170. В атмосфере его содержится ~1*10 -7 % (т. е. один атом трития приходится на объем воздуха —10 см 3 ). Трития на Земле очень мало и содержится он в основном в водах мирового океана. Раньше его было меньше. Его количество в водах Земли, так же как количество дейтерия, непрерывно возрастает, так как они образуются при бомбардировке ядер азота и кислорода атмосферы космическими лучами. В результате этого содержание трития и дейтерия в первоначальных ( ювенильных ) водах непрерывно увеличивается.
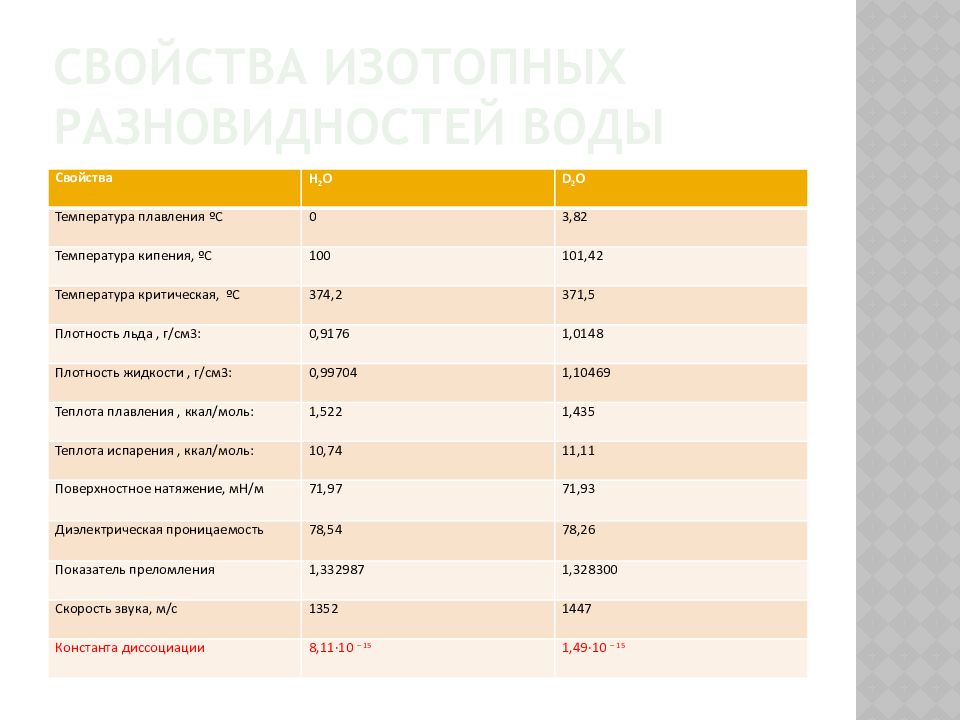
Слайд 10: свойства изотопных разновидностей воды
Свойства H 2 O D 2 O Температура плавления ºС 0 3,82 Температура кипения, ºС 100 101,42 Температура критическая, ºС 374,2 371,5 Плотность льда, г/см3: 0,9176 1,0148 Плотность жидкости, г/см3: 0,99704 1,10469 Теплота плавления, ккал/моль: 1,522 1,435 Теплота испарения, ккал/моль: 10,74 11,11 Поверхностное натяжение, мН/м 71,97 71,93 Диэлектрическая проницаемость 78,54 78,26 Показатель преломления 1,332987 1,328300 Скорость звука, м/с 1352 1447 Константа диссоциации 8,11·10 – 15 1,49·10 – 15
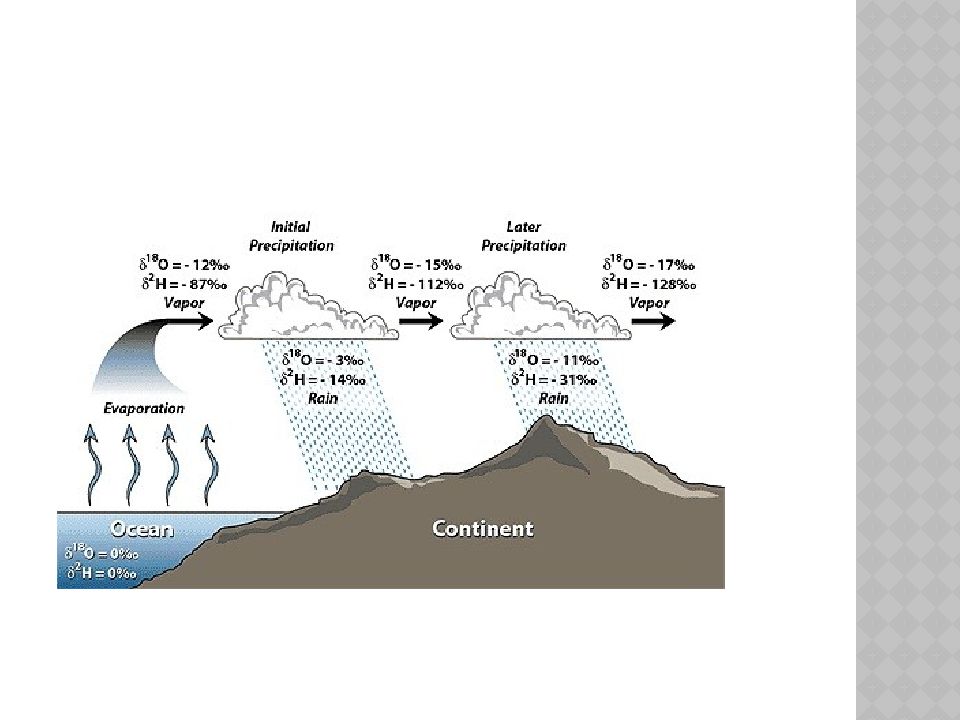
Слайд 11: Распространение тяжелой воды
В замкнутых водоемах тяжелой воды больше, так как по сравнению с обычной водой она испаряется менее интенсивно. Поэтому тяжелой воды больше в местностях с жарким климатом. Обогащается дейтерием и поверхность океана на экваторе и в тропиках, тем более что свою лепту вносят частые атмосферные осадки, при образовании которых идут процессы конденсации воды из паровой фазы, а тяжелая вода конденсируется быстрее, чем легкая, следовательно, осадки обогащены тяжелой водой. Однако для океанской поверхности повышенное содержание тяжелой воды характерно лишь на низких широтах. Вблизи полюсов свои особенности. В высоких южных широтах (в Антарктике) океанские воды заметно «легче». В этом сказывается влияние талых вод антарктических айсбергов, которые отличаются наиболее низким содержанием дейтерия на планете. Невелика доля дейтерия и во льдах Гренландии, тем не менее, океанические воды высоких северных широт обогащены тяжелой водой. Тут сказывается таяние «тяжелых» арктических льдов.
Слайд 13: Сверхтяжелая вода
В небольших количествах сверхтяжелая (тритиевая) вода попадает на Землю в составе осадков. Тритиевая вода распределена неравномерно: в материковых водоемах ее больше, чем в океанах; в полярных океанских водах ее больше, чем в экваториальных. По своим свойствам сверхтяжелая вода еще заметнее отличается от обычной: кипит при 104°С, замерзает при 4...9°С, имеет плотность 1,33 г/см3.
Слайд 14: Образование водорода
В свободной (молекулярной) форме, а также в составе химических соединений водород активно дегазируется из мантии. Значительные количества Н 2 поступают на поверхность Земли при вулканических извержениях, выделяются в результате жизнедеятельности водородных бактерий, участвующих в трансформации органического вещества в анаэробных условиях. В больших количествах водород образуется также при разложении воды в ходе электрохимических реакций и под воздействием продуктов распада радиоактивных элементов. Водород благодаря ничтожной массе ядра может покидать поле тяготения Земли, т.е. диссипировать. Транзит водорода проходит через биосферу. Однако в отличие от химически инертного гелия водород под влиянием жизнедеятельности организмов вступает в соединения и вследствие этого задерживается в биосфере.
Слайд 15: Образование дейтерия
Весь дейтерий, сохранившийся в природе, — это тот, который остался в межзвездном пространстве, причем остался почти со времен Большого Взрыва, с момента своего образования
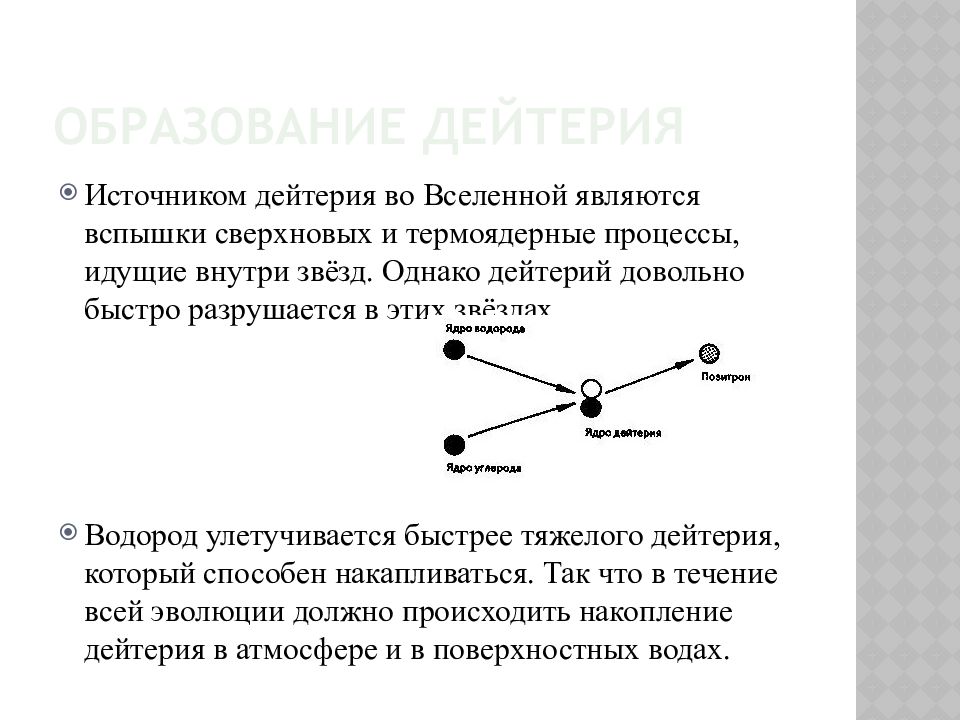
Слайд 16: Образование дейтерия
Источником дейтерия во Вселенной являются вспышки сверхновых и термоядерные процессы, идущие внутри звёзд. Однако дейтерий довольно быстро разрушается в этих звёздах. Водород улетучивается быстрее тяжелого дейтерия, который способен накапливаться. Так что в течение всей эволюции должно происходить накопление дейтерия в атмосфере и в поверхностных водах.
Слайд 17: Образование трития
Тритий образуется в верхних слоях атмосферы в результате взаимодействия космического излучения с ядрами N и O: Образующиеся таким образом атомы трития в результате реакций радиационного окисления и изотопного обмена переходят в молекулы воды, затем тритий в составе дождевой воды выпадает на поверхность Земли. Считают, что ок. 90% природного трития содержится в гидросфере (в виде НТО – оксид трития), 10% в стратосфере (НТО) и 0,1% и тропосфере (из них 50% в виде HT- газ). Большое количество трития образуется при ядерных и термоядерных взрывах. Взрыв водородной бомбы с тротиловым эквивалентом 1 MT приводит к выделению (2,6-7,4)*10 8 ГБк трития. С начала испытания термоядерного оружия (1954) содержание трития в дождевой воде возросло с 0,5-5,0 до 500 Т.E. При подземных ядерных взрывах тритий также превращается в оксид и частично выходит на поверхноcть. При b-распаде трития образуется легкий изотоп гелия:
Слайд 18: Распределение трития в природе
По оценкам (1970), общее содержание трития в биосфере: в мировом океане 250 кг, в континентальных водах 45 кг, в воздухе 3 кг.
Слайд 19
Тритий имеет важнейшее значение при осуществлении реакций, термоядерного синтеза. Он, в частности, используется в водородной бомбе. Главная реакция, протекающая при термоядерном взрыве имеет вид
Последний слайд презентации: Изотопы водорода: Влияние тяжелой воды на организмы
Различные исследователи независимо друг от друга установили, что тяжелая вода действует отрицательно на жизненные функции организмов; это происходит даже при использовании обычной природной воды с повышенным содержанием тяжелой воды. Подопытных животных поили водой, 1/3 часть которой была заменена водой состава HDO. Через недолгое время начиналось расстройство обмена веществ животных, разрушались почки. При увеличении доли тяжелой воды животные погибали. На развитие высших растений тяжелая вода также действует угнетающе; если их поливать водой, на половину состоящей из тяжелой воды, рост прекращается (рис. 1.4). Пониженное содержание дейтерия в воде стимулирует жизненные процессы. Такие данные получили Б.И. Родимов и И.П. Торо-пов. Они долгое время наблюдали за растениями и животными, потреблявшими воду, в которой содержалось дейтерия на 25% ниже нормы. Оказалось, что, потребляя такую воду, свиньи, крысы и мыши дали потомство, гораздо многочисленнее и крупнее обычного, яйценоскость кур поднялась вдвое, пшеница созрела раньше и дала более высокий урожай.