Первый слайд презентации: Б а ха р е в а С в е т л а н а В л а д и м и ро в н а Доцент кафедры химии и методики преподавания химии, к а н дид а т х и м и ч е с к и х н а у к, д о ц е н т
З а д а ч и н а в ы вод фор м ул ы о р г а ни ч е с кого вещ е ства ( 1 0 - 1 1 к л. )
Слайд 2: Задачи на вывод формулы органического вещества (10-11 кл.)
К л а сс, в о з ра с т о б у ч а ю щ и х с я : 10 - 1 1 к л а сс ы Место темы в образовательной программе: подготовка и сдача Е Г Э п о х имии Актуальность темы: умение решать задачи такого типа н е о б х о д и м о ш к о л ьни ка м д л я у с п е шн о й с да ч и Е Г Э Результат для педагога: ознакомление с основными типами и приемами решения задач на вывод молекулярной формулы, а л го ри т м о м ре ш ения . 2
Слайд 3: Спецификация ЕГЭ по химии 2024 г. (сайт ФИПИ)
Включенные в КИМ ЕГЭ задания выявляют достижение предметных и . метапредметных результатов освоения основной образовательной программы среднего общего образования. При выполнении заданий, помимо предметных знаний, умений, навыков и способов познавательной деятельности востребованы также универсальные учебные познавательные, коммуникативные и регулятивные (самоорганизация и самоконтроль) действия. Расчетные задачи относятся к заданиям с развернутым ответом и предусматривают комплексную проверку усвоения на высоком уровне нескольких (двух и более) различных содержательных блоков. Они ориентированы на проверку умений проводить расчеты указанных физических величин по представленным в условии задания данным, а также комбинированные расчеты по уравнениям химических реакций 3
Слайд 4: Спецификация ЕГЭ по химии 2024 г. (сайт ФИПИ)
Задачи на вывод формулы органического вещества относятся к части 2 КИМа ( №33 ), . и м е ю т в ы сок и й у ро в е н ь с л о жн о с т и. М а к с и м а ль на я о ц е н к а с о с т а вл я е т 3 ба лл а. На в ы п о л н е н и е з а да ни я о т в од ит с я 1 0 - 1 5 м и н у т. П р о в е р я е м ы е э ле м ен т ы с о дер ж а н и я : - Нахождение молекулярной формулы органического вещества по его плотности и массовым долям элементов, входящих в его состав, или по продуктам сгорания; установление структурной формулы органического вещества на основе его х и м и ч е ск и х с в ой с т в и л и с п о с о б о в п о л у ч е н ия 4
Слайд 5: Ко дифика т о р Е Г Э по х и ми и 2 0 2 4 г. ( с ай т ФИ П И )
п ро г н о з и ро в а т ь и зм е н ени е в н о в ы х ходе решения задачи результаты, критически оценивать их достоверность, условиях, владеть навыками получения информации, осуществлять анализ, систематизацию и интерпретацию информации ( п о з н а в а т е ль н ы е УУД, ба з о в ы е и с с ле д о в ат е ль с к и е де й с т в и я ) ; 2. Предметные результаты – сформированность умения проводить расчеты по химическим формулам и химическим уравнениям с использованием физических величин, критически анализировать химическую информацию, перерабатывать ее и использовать в соответствии с поставленной учебной задачей. Уровень предметных требований ФГОС – углубленный Расчетные задачи на нахождение химической формулы вещества проверяют: . 1.Метапредметные результаты освоения ООП СОО - анализировать полученные в 5
Слайд 6: Де м о н с т р а ционн ы й в а ри ан т Е Г Э п о х и м ии 20 2 4 г. ( са й т Ф ИП И )
П р а ви ль н ы й и п о л н ы й о т в е т с оде р ж и т в с е п ере ч и с л е нн ы е э л е м е н т ы, о ц ен ив ает с я в 3 балла ( максимальный балл ); Правильно записаны 2 элемента ответа – 2 балла ; П р а ви ль н о з а п и с а н 1 э л е м ен т о т в е т а – 1 б а л л ; Все элементы ответа записаны неверно – 0 баллов. У к а з а ни я п о оц е ни в а н и ю от в е т а . 1. Правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, записана молекулярная формула вещества. Записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в с о о т в ет с т ви и с у с лови е м з а да н и я. Записано уравнение реакции, на которую дается указание в условии задания, с и с п о ль з о в ани е м с т р у к т у р н ой ф о р м ул ы о р г а н и ч е с к о г о в е щ е с т в а. 6
Слайд 7: Ти п ы задач н а в ы во д фор м ул ы орга ни че с ког о ве щ е с т ва
. 4 т и п а з а д а ч Определение формулы по известному элементному составу О п реде л ени е ф ор м у л ы в е щ е с тв а п о п ро д у к т а м с го рания Определение формулы вещества по известной общей формуле и м а сс о в ой д о л е о д н о г о и з э л е м е н т о в Определение формулы вещества по его реакционной способности 7
Слайд 8: 1. О п р е д е л е ни е ф о р м у л ы по из в е ст н о м у э л ем е н т но м у с о с т а в у
. А лгорит м р е ш е ния Если в условии дан элементный состав соединения и дополнительная информация, чаще всего относительная плотность по воздуху или другому газу, то задача решается в два этапа: Нахождение простейшей формулы вещества, включающее определение к о л и ч е с т в ен н о г о с о с т а в а и п р о с т е й ши х и н де к с о в Нахождение истинной формулы с учетом дополнительных условий 8
Слайд 9: П риме р зада ч и
Найдите формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого в ещес т в а п о в о з д у х у ра в н а 1, 4 48 . 9
Слайд 10: Решение
10 Необходимо убедиться, что искомое вещество не содержит других элементов, кроме углерода и водорода. Такой вывод можно сделать, сложив их массовые доли и увидев, что сумма равна 1 00 %. Та ки м о б р а з о м, и с к о м о е сое д и не н и е о т н ос и т с я к к л а сс у у г л е в о д о ро д о в. Для удобства рекомендуется принять массу вещества за 100 г и вычислить массы элементов, исходя из их процентного содержания. Соответственно, m (C) = 85,71 г, m(H) = 14,29 г. Находим количество вещества обоих элементов, разделив массу каждого на их молярные массы. В результате получается, что ν(C) = 7,1425 моль и ν(H) = 14,29 моль. Находим соотношение количества молей углерода и водорода и получаем простейшие индексы, из чего следует, что простейшая формула соединения - СН 2. Используем дополнительные данные, позволяющие уточнить молекулярную массу и установить истинную формулу углеводорода. Через относительную плотность по воздуху находим, что молекулярная масса углеводорода равна 42 г/моль. Отсюда следует, что она в 3 раза превышает простейшую ( 14 г/моль ). Таким образом, необходимо умножить индексы на 3 для получения истинной формулы соединения - С 3 Н 6.
Слайд 11: П риме р зада ч и
Органическое вещество А содержит 13,59% азота, 8,74% водорода и 31,07% кислорода по массе и образуется при взаимодействии органического вещества Б с метанолом в молекулярном соотношении 1:1. Известно, что вещество Б имеет природное происхождение и с п о с о б н о ре а ги р о в а т ь к а к с к и с л о т а м и, т а к и с о щ е л о ч а м и. На основании данных условия задачи: Произведите вычисления, необходимые для установления молекулярной формулы органического вещества и запишите молекулярную формулу органического вещества Составьте структурную формулу исходного вещества А, которая однозначно отражает п ор я до к св я з и ат о м о в в е г о м о ле к у ле Н а п и шит е у ра в нен и е р еа к ц и и п о л у ч ен и я э т о г о в е щ е с т в а п р и в з а и м о де й с т в ии п ри р о д н о г о в е щ е с т в а Б с м ет а н о ло м 11
Слайд 12: Решение
1. Складываем процентное содержание элементов из условия задачи и получаем сумму, которая меньше 100%: 13,59 + 8,74 + 31,07 = 56,4%. Таким образом, в состав соединения 12 в х од и т е щ е од и н э ле м ен т, в ер оя т но, у гл е ро д, п о с к о ль к у о н п р и с у т с т ву е т в о вс е х органических веществах, и на его долю приходится 46,6%. Принимаем массу соединения за 100 г и рассчитываем массы элементов: m(N) = 13,59 г, m(H) = 8,74 г, m(O) = 31,07 г, m(C) = 46,6 г. Находим количество вещества элементов: ν(N) = 13,59/14 = 0,97 моль, ν(H) = 8,74/1 = 8,74 моль, ν(O) = 31,07/16 =1,94 моль, ν(С) = 46,6/12 = 3,88 моль. О п р еде л я е м с о о т н о ш е ни е к о личе с т в а в е щ е с т в э л е м е н т о в и н а х од и м, ч т о он о р а в н о 3,88:8,74:0,97:1,97, или 4:9:1:2. Таким образом, простейшая формула соединения - С 4 Н 9 NO 2.
Слайд 13: Решение
аминокислота с тремя атомами углерода, и этому условию соответствует аланин: 5. Для составления структурной формулы необходимо определить, какому классу соединений с. оответствует данная молекулярная формула, поскольку такой состав имеют нитроалканы, аминокислоты и их эфиры. Поскольку в условии указано, что искомое вещество образуется при взаимодействии вещества Б с метанолом в соотношении 1:1, мы делаем вывод, что вещество А - сложный эфир аминокислоты, а вещество Б - аминокислота. В метаноле один атом углерода, из чего следует, что в веществе Б содержится 3 атома углерода. Таким образом, Б - Таким образом, структурная формула вещества Б - CH 3 Уравнение реакции взаимодействия вещества Б с метанолом выглядит так: 13 CH C NH 2 O O H CH 3 CH C NH 2 O O H + CH 3 OH CH 3 CH C N H 2 O O CH 3 + H 2 O H 2 SO 4
Слайд 14: 2. Определение формулы вещества по продуктам сгорания
Алго р и тм р е ш е н и я Нахождение количественного состава сгоревшего вещества; С о с та в л ени е м о л е к у л я р н о й ф ор м у л ы в е щ е с тв а н а о с н о в а нии дополнительной информации; С о с та в л ени е с тр у к тур н о й ф ор м у л ы в е щ е с т в а ; 4.Запись уравнения реакции с участием использованием структурных формул исходных п ро д у к т о в реа к ц и и. в е щ е с тв а с с ое д ине ни й и . 2. Определение формулы вещества по продуктам сгорания 14
Слайд 15: П риме р зада ч и
При сгорании органического вещества массой 7,2 г образовались углекислый газ массой 9,9 г и вода массой 8,1 г. Плотность паров этого вещества по водороду равна 16. При исследовании химических свойств этого вещества установлено, что при его взаимодействии с уксусной кислотой образуется нерастворимое в воде вещество с приятным запахом. На основании данных условия задачи: П р о из в ед и т е в ыч и с л е ни я, н еоб х од и м ы е дл я у с т а н о влен и я м о л е к у л я рной ф о р м у лы органического вещества и запишите молекулярную формулу органического вещества Составьте структурную формулу исходного органического вещества Напишите уравнение реакции этого вещества с уксусной кислотой . 15
Слайд 16: Решение
Определяем количественный состав вещества. Для этого находим количество вещества . продуктов сгорания. Если в их составе присутствует углекислый газ, то вещество содержит углерод. Таким образом, ν(СО 2 )= 9,9 г/44 г/моль = 0,225 моль. Наличие воды в продуктах сгорания говорит о том, что исходное вещество содержит водород и, возможно, кислород. Соответственно, ν (Н 2 О) = 8,1 г/18 г/моль = 0,45 моль Затем необходимо рассчитать количество вещества углерода и водорода, а также их массы, чтобы проверить предположение о наличии кислорода в искомом веществе. Используя стехиометрические соотношения, получаем, что ν(C) = v(CO 2 ), а v(H) = 2*ν(H 2 O). Таким образом, ν(C) = 0,225 моль, а ν(H) = 0,9 моль. Далее рассчитаем массы углерода и водорода: m( С ) = 0, 22 5 м о л ь * 12 г/ м ол ь = 2, 7 г m ( Н ) = 0, 9 м оль * 1 г/ м ол ь = 0, 9 г 16
Слайд 17: Решение
17 Складывая массу углерода и массу водорода, получаем 3,6 г, что не совпадает с массой . сгоревшего вещества. Таким образом, оно содержит кислород массой 3,6 г. Рассчитаем его количество вещества: ν ( О ) = 3, 6 г/ 1 6 г / м ол ь = 0,2 2 5 м оль Составляем соотношение количества веществ углерода, водорода и кислорода и определяем простейшие индексы: 0,225 : 0,9 : 0,225 = 1:4:1. Таким образом, простейшая формула вещества: СН 4 О. Затем воспользуемся дополнительной информацией о плотности вещества по водороду и находим его молекулярную массу: M ( X ) = D H 2 * M ( H 2 ) = 16 * 2 г/ м о л ь = 3 2 г/ м оль Вычислив молекулярную массу простейшей формулы и сравнив ее с истинной молекулярной массой, находим, что они совпадают. Таким образом, рассчитанная нами м о ле к у л я рн а я ф о р м у л а я в л яет с я и с т и нной
Слайд 18: Решение
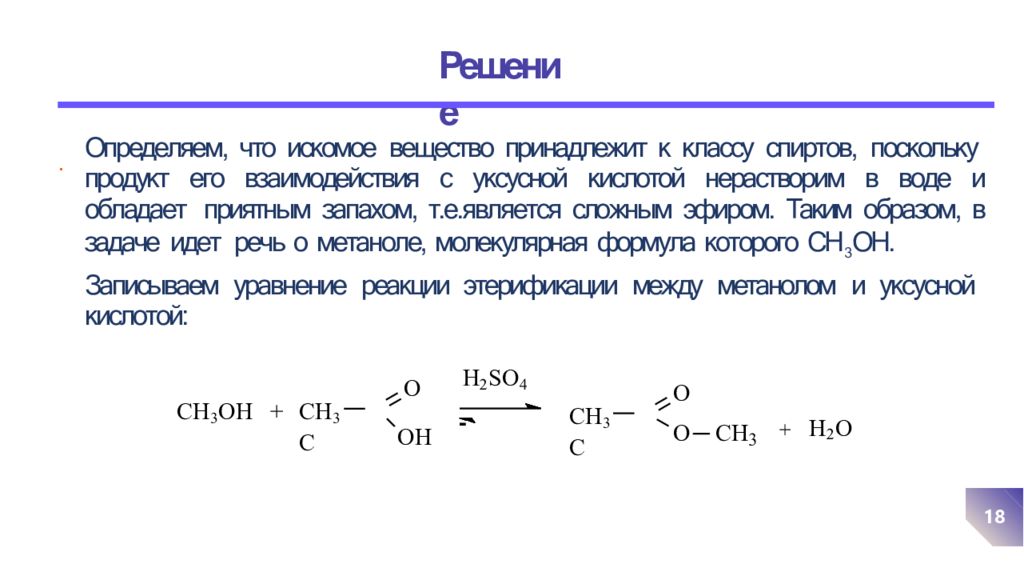
Определяем, что искомое вещество принадлежит к классу спиртов, поскольку продукт его взаимодействия с уксусной кислотой нерастворим в воде и обладает приятным запахом, т.е.является сложным эфиром. Таким образом, в задаче идет речь о метаноле, молекулярная формула которого СН 3 ОН. Записываем уравнение реакции этерификации между метанолом и уксусной кислотой: . CH 3 OH + CH 3 C O O H H 2 SO 4 CH 3 C O O CH 3 + H 2 O 18
Слайд 19: П рим ер зад а ч и
При сжигании 9,675 г органического вещества выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды и 5,475 г хлороводорода. Плотность паров вещества равна 2,879 г/л. Вещество реагирует со спиртовым раствором гидроксида натрия; продукт последней реакции обесцвечивает бромную воду. На основании данных условия задачи: П р о и з в ед и т е в ы ч и с л ени я, н еоб х од и м ы е д л я у с т а н о вл е ни я м о л е к у л я рной ф о р м у лы органического вещества и запишите молекулярную формулу органического вещества С о с т а в ь т е с т р у к т у р н у ю ф о р м ул у и с х одно г о в е щ е с т в а, к от о р а я о д н о з н а ч н о о т р а ж ае т п ор я до к св я з и ат о м о в в е г о м о ле к у ле Напишите уравнение реакции взаимодействия этого вещества со спиртовым раствором гидроксида натрия . 19
Слайд 20: Реш е ни е
Определяем, что искомое вещество содержит углерод, водород, хлор и, вероятно, кислород. Находим, что ν(CO 2 ) = V(CO 2 )/V m = 6,72 л/22,4 л/моль = 0,3 моль. Соответственно, ν(H 2 O) = m(H 2 O)/M(H 2 O) =5,4 г/18 г/моль = 0,3 моль, а ν(HCl) = m(HCl)/M(HCl) =5,475 г/36,5 г/моль = 0,15 моль Р а с с ч ит а е м к о личе с т в о в е щ е с т в а у гл е рода, в одо р од а и х ло р а : ν ( С ) = ν ( СО 2 ) = 0,3 моль, ν 1 (Н) = 2*ν (Н 2 О) = 2*0,3 моль = 0,6 моль, ν 2 (Н) = ν(HCl) = 0,15 моль, ν(Cl) = ν(HCl) = 0,15 моль. Таким образом, ν (Н) = ν 1 (Н) + ν 2 (Н) = 0,6 + 0,15 = 0,75 моль . 20
Слайд 21: Реш е ни е
Вычисляем массы элементов и проверяем, есть ли в веществе кислород: . m( С ) = 0, 3 м оль * 1 2 г /м о л ь = 3, 6 г ; m( Н ) = 0, 7 5 м оль * 1 г /м о л ь = 0, 7 5 г ; m ( Cl ) = 0,1 5 м ол ь * 35, 5 г / м о л ь = 5,3 2 5 г. Сумма масс углерода, водорода и хлора совпадает с массой сгоревшего вещества, что г о в о ри т о б от с у т с т ви и в не м к и с л орода. Рассчитываем простейшие индексы и определяем простейшую молекулярную формулу: ν(С):ν(Н):ν(Cl) = 0,3:0,75:0,15 = 2:5:1. Таким образом, простейшая формула вещества - C 2 H 5 Cl. Определим, является ли она истинной, воспользовавшись данными о плотности его паров: M ( X ) = ρ ( X ) * V m = 2,8 7 9 г/л * 22, 4 л/ м ол ь = 64, 5 г/ м ол ь. В ы ч и с ля е м п р о с т е й ш у ю молекулярную массу и делаем вывод об их совпадении - - полученная формула является истинной 21
Слайд 22: Решение
5. Таким образом, структурная формула искомого вещества: CH 3 Уравнение реакции взаимодействия со спиртовым раствором щелочи: В ре зу л ь т а т е п о л у ч а е т с я э т и л е н, обе с ц в е ч и ва ю щ ий б р о м н у ю в о д у. Т а к и м образом, искомое вещество - хлорэтан. . CH 2 Cl CH 3 CH 2 CH 2 C 2 H 5 OH Cl + NaOH CH 2 + NaCl + H 2 O 22
Слайд 23: 3. Определение формулы вещества по известной общей форм у л е и ма с со в о й д о л е о д н ог о и з эл е м е н т ов
А л горит м р е ш е ния С о с т а вл е ни е об щ ей ф о р м у л ы в е щ е с т в а данно г о к л а сс а ; Нахождение индекса через выражение для расчета массовой доли. П р и м е р з а д а ч и О д и н и з м он о б р о м а лк а но в с одер ж и т 65, 04 % бро м а. У с т а н о в и т е м о л е к у л яр н у ю ф ор м у лу этого вещества. . 23
Слайд 24: Реш е ни е
n 2 n+ 1 1. С о с т а в л я е м об щ у ю ф о р м у л у м онобр о м а л к а н а - C H Br, и с х од я и з об щ е й ф о р м у л ы а л к ано в и з а м е н яя о ди н и з а т о м о в в одород а н а бро м. 2. Применим выражение для вычисления массовой доли одного из элементов: ω(Br) = 0,6504 = 80*1/14n+81. Решая уравнение, получаем, что n = 3. Таким образом, м о ле к у л я рна я ф о р м у л а б р о м а л к а н а - C 3 H 7 B r. . 24
Слайд 25: П рим ер зад а ч и
Установите молекулярную формулу предельной одноосновной карбоновой кислоты, имеющей ту же плотность паров по кислороду, как и сложный эфир, содержащий 43,24% кислорода. Решение Составляем общую формулу предельных одноосновных карбоновых кислот и сложных эфиров, которые являются межклассовыми изомерами - C n H 2n O 2. Они имеют одинаковую молекулярную массу, что следует из информации об относительной п ло т н о с т и об о и х в е щ е с т в п о ки с ло р о ду. Применяем выражение для нахождения массовой доли кислорода: ω(О) = 0,4324 = 16*2/14n+32. В результате находим, что n = 3, и искомая кислота имеет молекулярную формулу С 3 Н 6 О 2. . 25
Слайд 26: 4. О п ре д е л е н и е фор м ул ы ве щ е с т в а п о е г о р е акцио нн ой способности
Применяется алгоритм расчета по уравнению реакции с использованием стехиометрических соотношений между реагентами и продуктами их взаимодействия. Ф ор м у л а и с к о м о г о в е щ е с т в а п р е дст а в л яет с я в об щ е м в иде . 26
Слайд 27: П рим ер зад а ч и
В результате сплавления органического вещества с гидроксидом натрия был получен . углеводород, 660 мг паров которого занимают объем 336 мл (н.у.). Известно, что исходное вещество относится к классу солей. В этом соединении число атомов углерода в 1,25 раза больше числа атомов кислорода. Н а о с н о в а н и и да нн ы х у с л о в и я з а да ч и: П р о из в едит е в ы ч и с ле н и я, н е об х од и м ы е д л я у с т а н о влен и я м о ле к у л я р н ой ф о р м у лы у г ле в одород а и з а п и ши т е м о ле к у л я рн у ю ф ор м ул у у гл е в од о рода С о с т а в ь т е с т р у к т у рн у ю ф о р м ул у и с х одно г о в е щ е с т в а, к от о р а я о д н о з н а ч н о о т р а ж ае т п ор я до к св я з и ат о м о в в е г о м о ле к у ле Н а п и ш ит е у ра вн ен и е реа к ц и и с п л а в л ени я и сх о д н о г о о р г а н и ч е с к о г о в е щ е с т в а с гидроксидом натрия 27
Слайд 28: Реш е ни е
Решение задачи можно начать с определения молекулярной массы углеводорода, который относится к классу алканов, что следует из сведений об отношении солей карбоновых кислот к нагреванию с твердыми щелочами. Таким образом, ν (C n H 2n+2 ) = V(C n H 2n+2 )/Vm = 0,336 л/22,4 л/моль = 0,015 моль. В итоге, получаем, что M(C n H 2n+2 ) = m(C n H 2n+2 )/ν (C n H 2n+2 ) = 0,66 г/0,015 моль = 44 г/моль, и n=3. Значит, при сплавлении с о л и с о щ е л о ч ь ю обра з о в а лс я п р о п а н С 3 Н 8. Соль бутановой кислоты не подходит, т.к. в ней соотношение числа атомов С и О не соответствует условию задачи. Соли двухосновных кислот также способны разлагаться при нагревании со щелочами до алканов. Если представить, что искомая соль образована пентандиовой кислотой, то в ней как раз число атомов углерода относится к числу атомов кислорода как 5:4, или 1,25:1. Таким образом, молекулярная формула вещества - С 5 Н 4 О 4 Na 2, что соответствует динатриевой соли пентандиовой кислоты . 28
Слайд 29: Решение
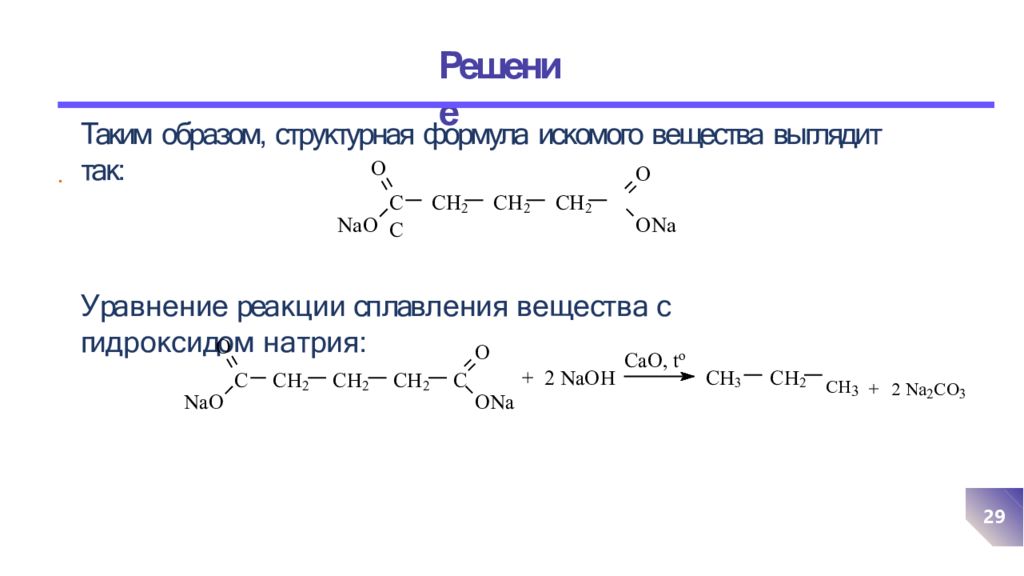
Таким образом, структурная формула искомого вещества выглядит так: У ра в н е н и е реа к ц и и сп лав л е н и я в е щ е ст в а с ги д р о к с и до м н а т р и я : . O NaO C CH 2 CH 2 CH 2 C O O N a O N aO C CH 2 CH 2 CH 2 C O ON a + 2 NaOH CaO, t o CH 3 CH 2 CH 3 + 2 Na 2 CO 3 29
Слайд 30: П рим ер зад а ч и
Органическое вещество А массой 2,15 г сожгли и получили 2,24 л углекислого газа и 1,35 г воды. Известно, что вещество А можно получить гидратацией вещества Б. Вещество Б реагирует с аммиачным раствором оксида серебра в отношении 1:2. О п ред е лит е м о л е к у л я рн у ю ф о р м ул у в е щ е с т в а А Запишите структурную формулу вещества А, однозначно отражающую порядок связей Запишите уравнение реакции гидратации вещества Б . 30
Слайд 31: Реш е ни е
Найдем количества вещества углерода и водорода: . ν (СО 2 ) = 2,24/22,4 = 0,1 моль; ν (С) = ν (СО 2 ) = 0,1 моль. ν (Н 2 О) = 1,35/18 = 0,075 моль; ν (Н) = 0,075* 2 = 0,15 моль. Рассчитаем массу кислорода и его количество вещества: m(O) = 2,15 - 0,1*12 - 0,15*1 = 0,8 г; ν (О) = 0,8/16 = 0,05 моль. Н ай де м с оо т но ш е н и е ат о м о в у гл е р о да, в одор о д а и к и с ло р ода : ν (С) : ν (Н) : ν (О) = 0,1:0,15:0,05 = 2:3:1 или 4:6:2 31
Последний слайд презентации: Б а ха р е в а С в е т л а н а В л а д и м и ро в н а Доцент кафедры химии и: Решение
5. С о ст а в и м у р а в н е н и е р е а к ц и и ги д р а т а ц ии Б : 4. У ст а н о ви м с т р у к ту р н у ю ф ор му л у в е щ е с т в а А . Исходя из условия задачи, вещество Б является алкином, но так как оно реагирует с аммиачным раствором оксида серебра в соотношении 1:2, то оно содержит 2 тройные связи. Таким образом, при гидратации может быть получен не альдегид или кетон, а диальдегид либо дикетон: CH 3 C C CH 3 В е щ е с т в о А - б ут а н д и о н - 1, 3 ; в е щ е ст в о Б - б ут ад и и н - 1, 3. O O C H 3 C C C H 3 O O HC C C CH + 2 H 2 O 32