Слайд 2: Химическая связь
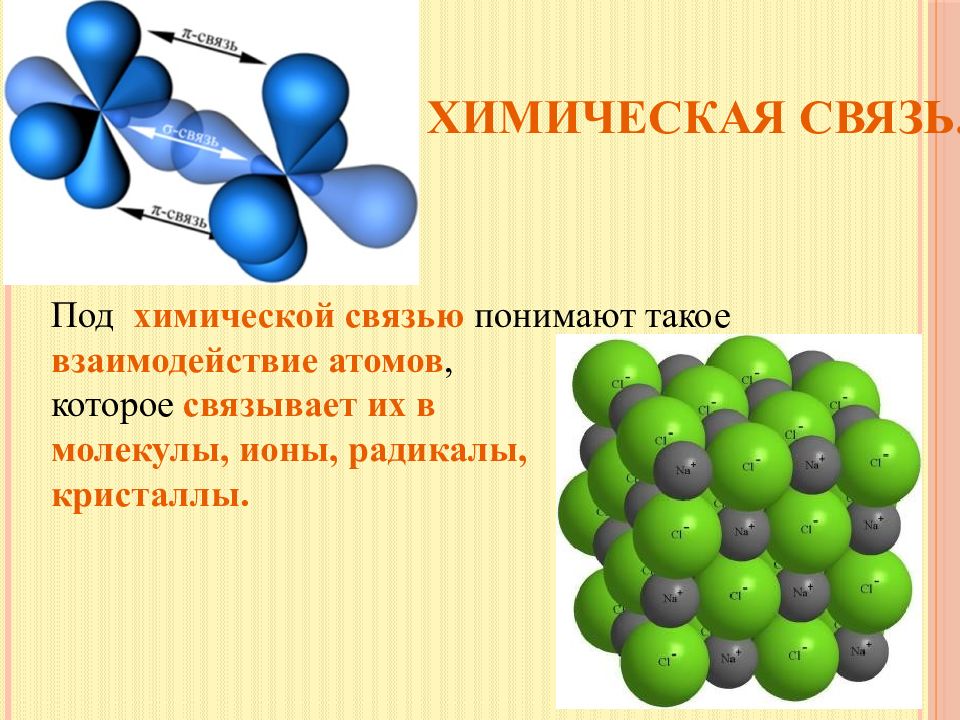
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
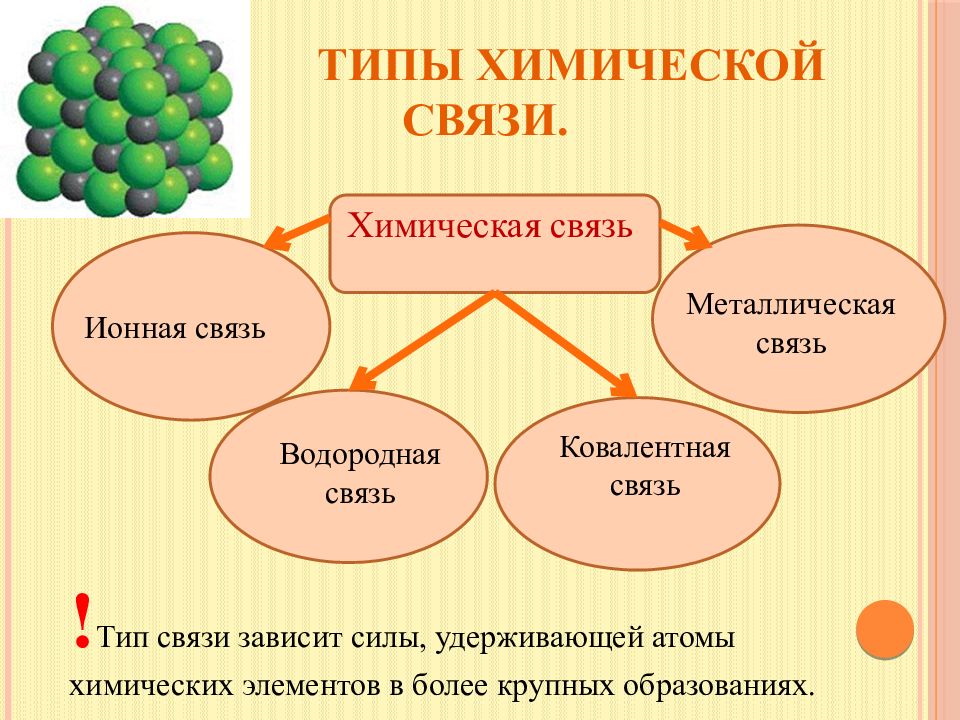
Слайд 3: Типы химической связи
Химическая связь Ионная связь Металлическая связь Водородная связь Ковалентная связь ! Тип связи зависит силы, удерживающей атомы химических элементов в более крупных образованиях.
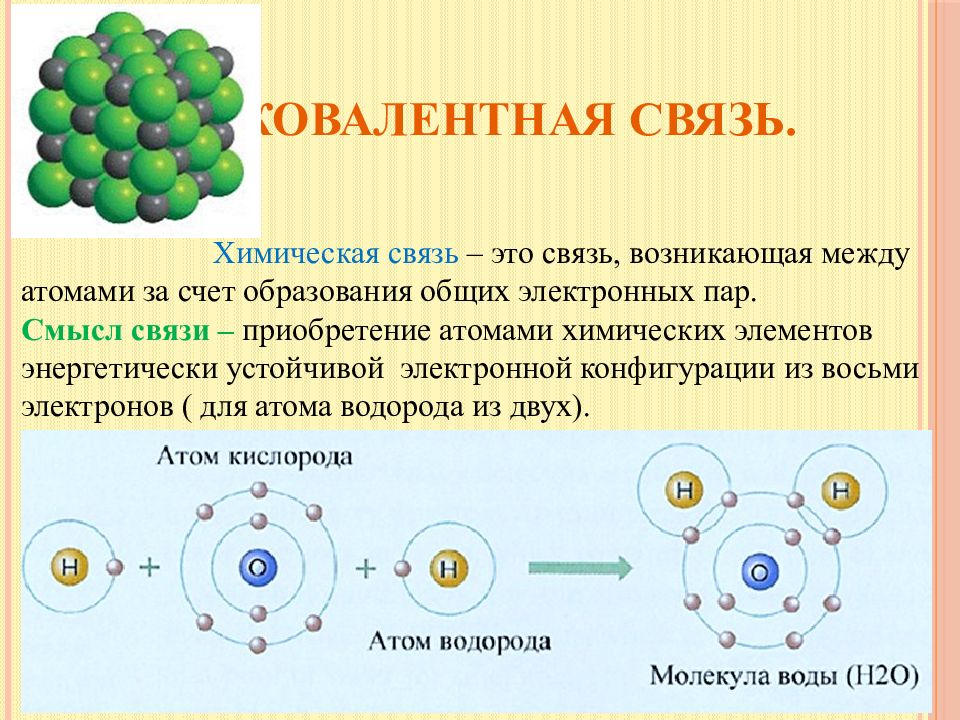
Слайд 4: Ковалентная связь
Химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар. Смысл связи – приобретение атомами химических элементов энергетически устойчивой электронной конфигурации из восьми электронов ( для атома водорода из двух).
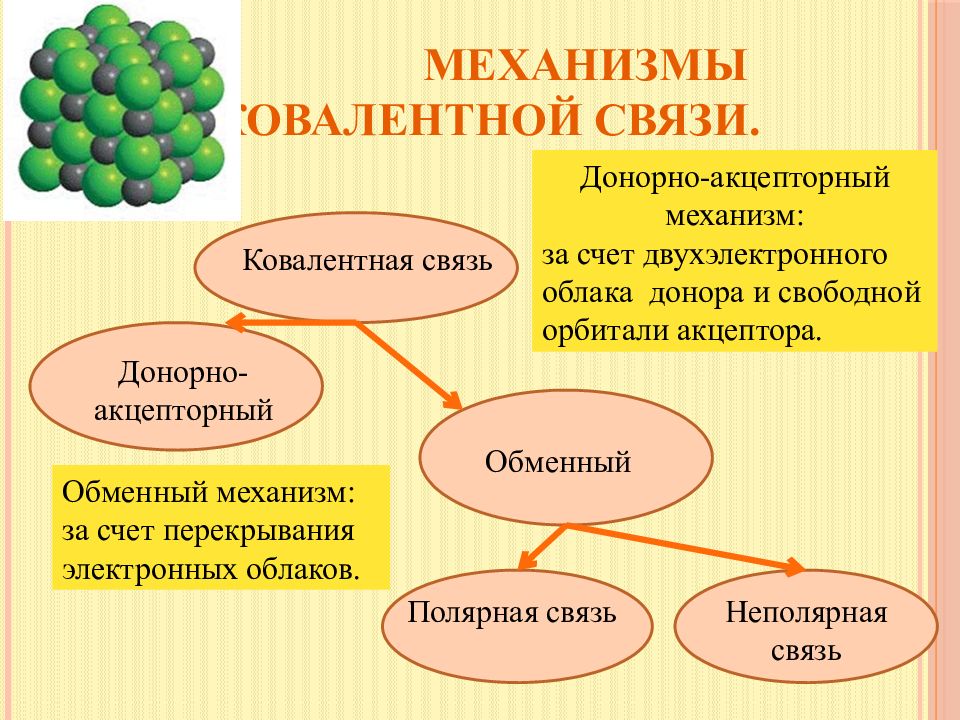
Слайд 5: Механизмы ковалентной связи
Ковалентная связь Донорно-акцепторный Обменный Полярная связь Неполярная связь Обменный механизм: з а счет перекрывания электронных облаков. Донорно-акцепторный механизм: з а счет двухэлектронного облака донора и свободной орбитали акцептора.
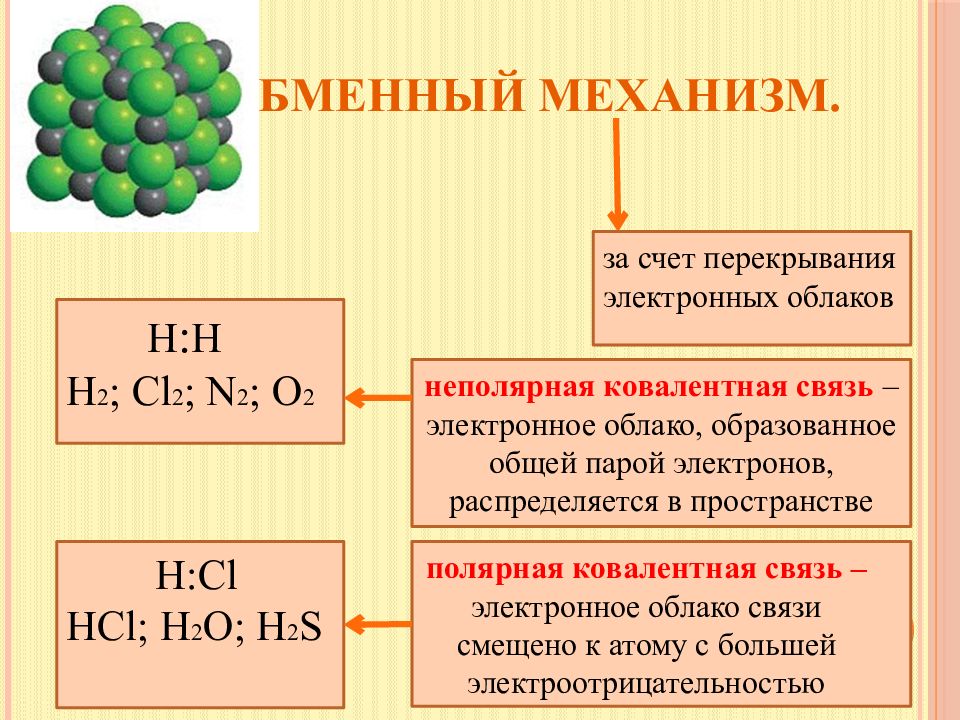
Слайд 6: Обменный механизм
з а счет перекрывания электронных облаков Н : Н Н 2 ; Cl 2 ; N 2 ; O 2 н еполярная ковалентная связь – электронное облако, образованное общей парой электронов, распределяется в пространстве Н: Cl HCl ; H 2 O ; H 2 S п олярная ковалентная связь – электронное облако связи смещено к атому с большей электроотрицательностью
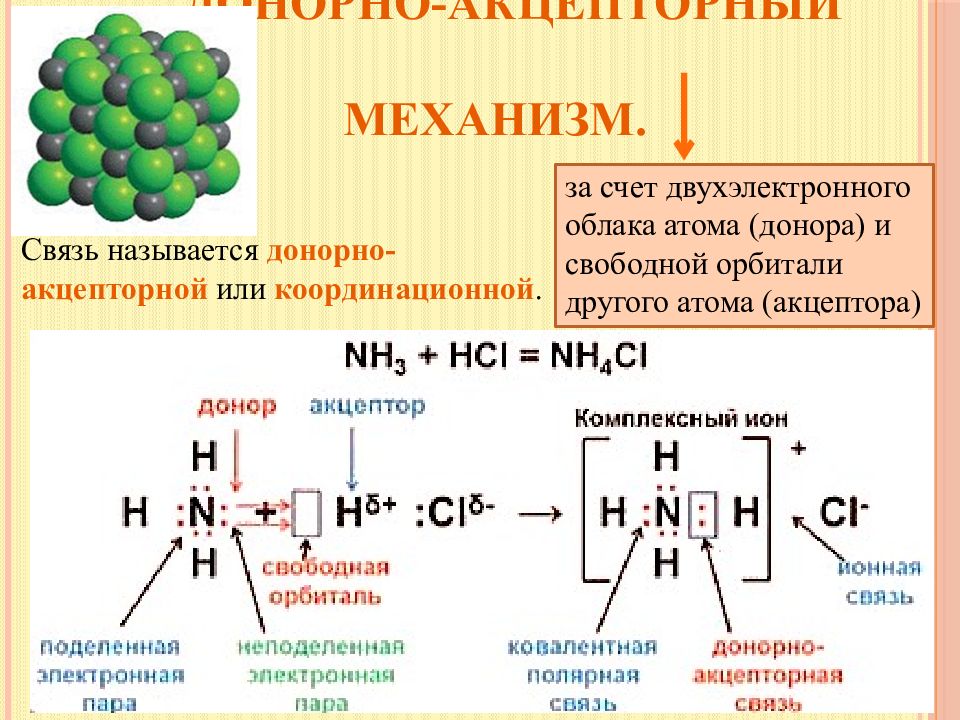
Слайд 7: Донорно-акцепторный механизм
з а счет двухэлектронного облака атома (донора) и свободной орбитали другого атома (акцептора) Связь называется донорно-акцепторной или координационной.
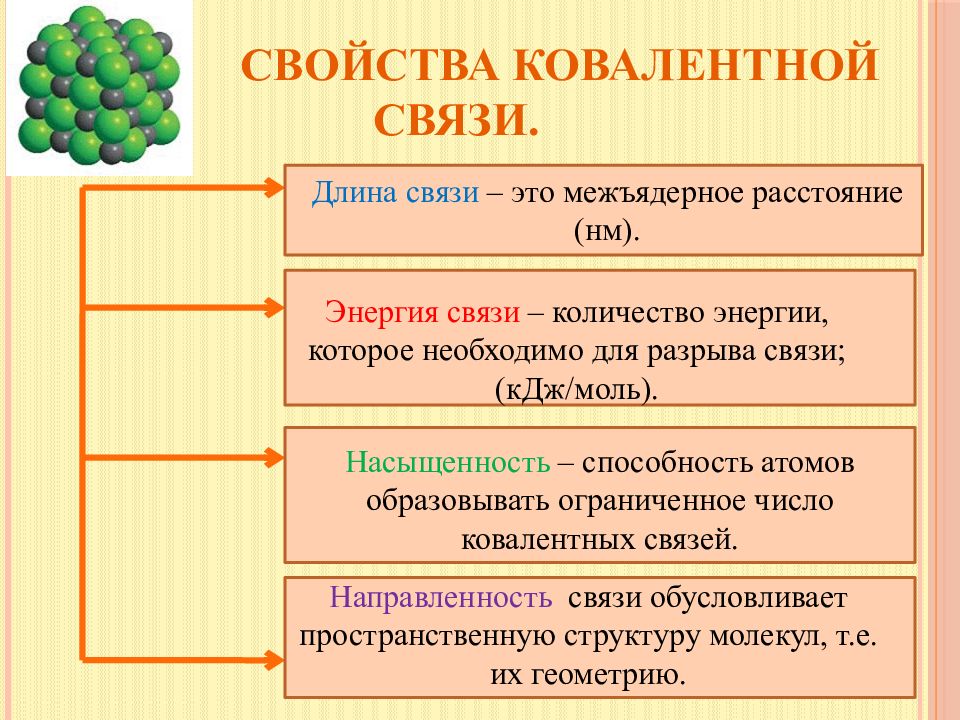
Слайд 8: Свойства ковалентной связи
Длина связи – это межъядерное расстояние (нм). Энергия связи – количество энергии, которое необходимо для разрыва связи; (кДж/моль). Насыщенность – способность атомов образовывать ограниченное число ковалентных связей. Направленность связи обусловливает пространственную структуру молекул, т.е. их геометрию.
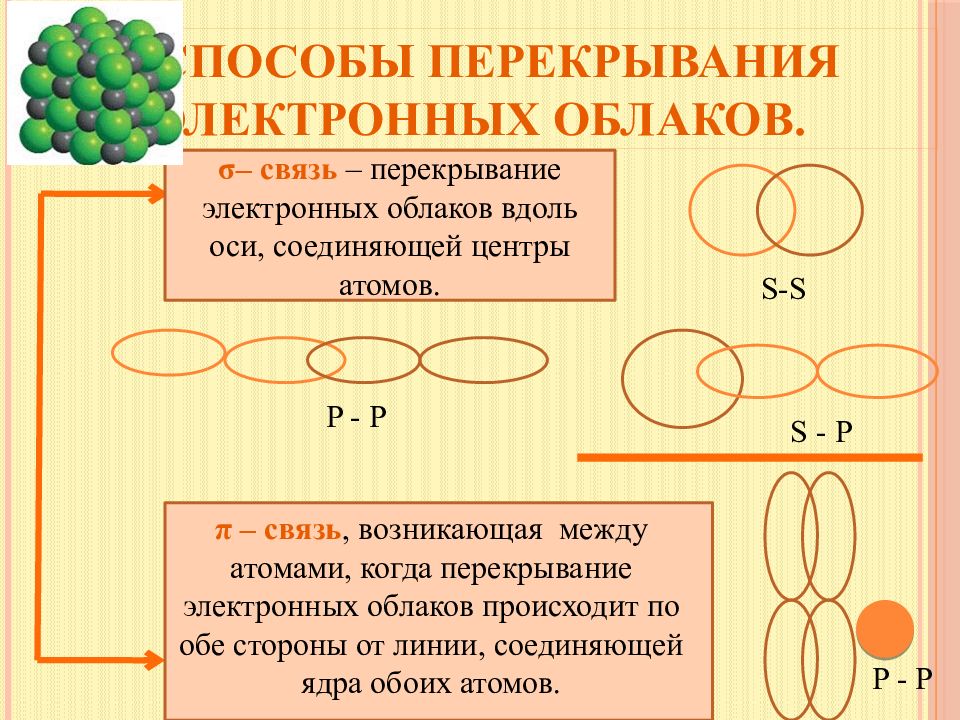
Слайд 9: Способы перекрывания электронных облаков
σ – связь – перекрывание электронных облаков вдоль оси, соединяющей центры атомов. π – с вязь, возникающая между атомами, когда перекрывание электронных облаков происходит по обе стороны от линии, соединяющей ядра обоих атомов. S-S S - P P - P P - P
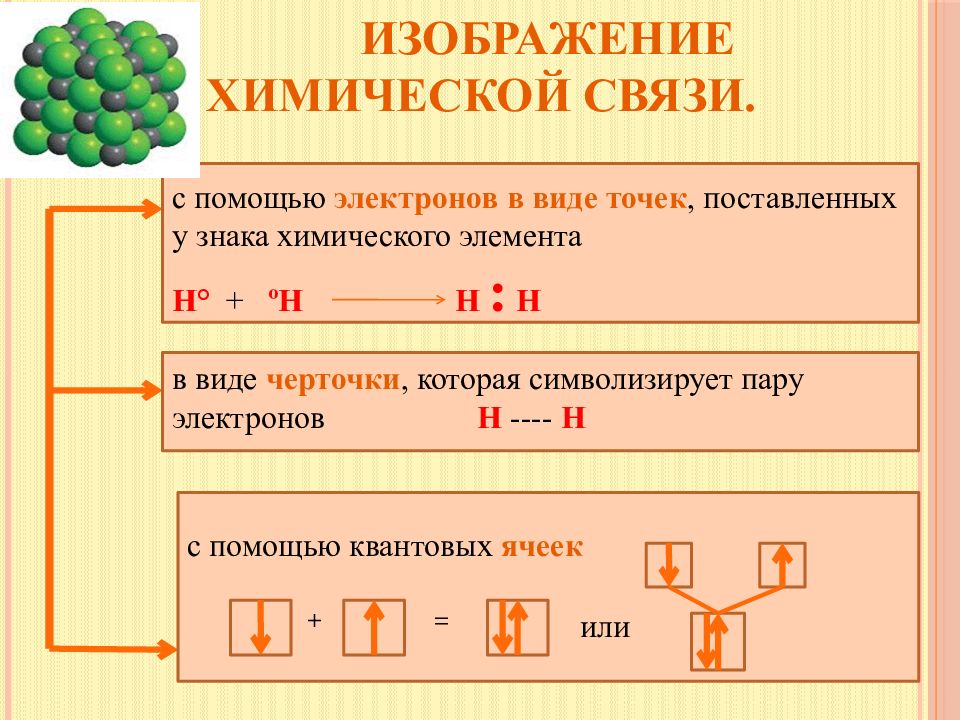
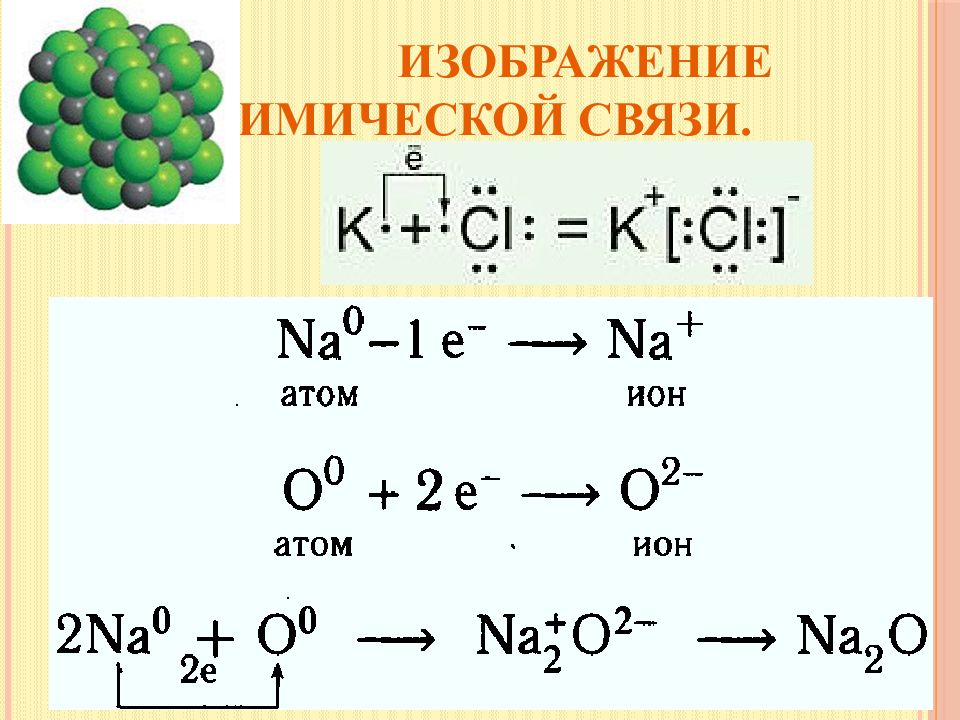
Слайд 10: Изображение химической связи
с помощью электронов в виде точек, поставленных у знака химического элемента Н° + º Н Н : Н в виде черточки, которая символизирует пару электронов Н ---- Н с помощью квантовых ячеек + = или
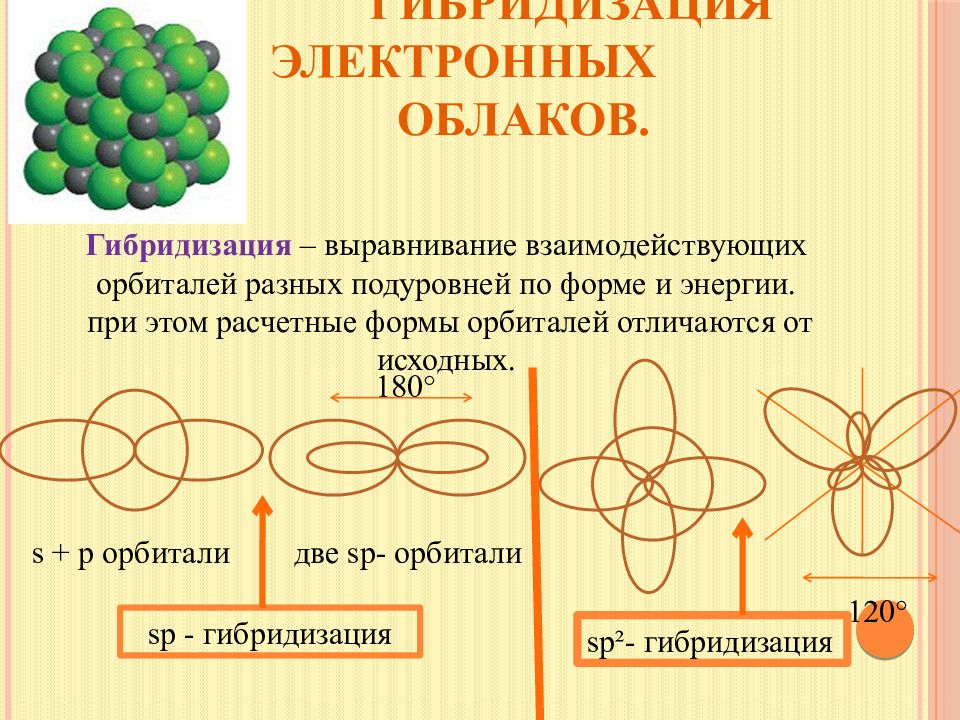
Слайд 11: Гибридизация электронных облаков
Гибридизация – выравнивание взаимодействующих орбиталей разных подуровней по форме и энергии. при этом расчетные формы орбиталей отличаются от исходных. s + p орбитали две sp- орбитали s p - гибридизация 180° 120° sp²- гибридизация
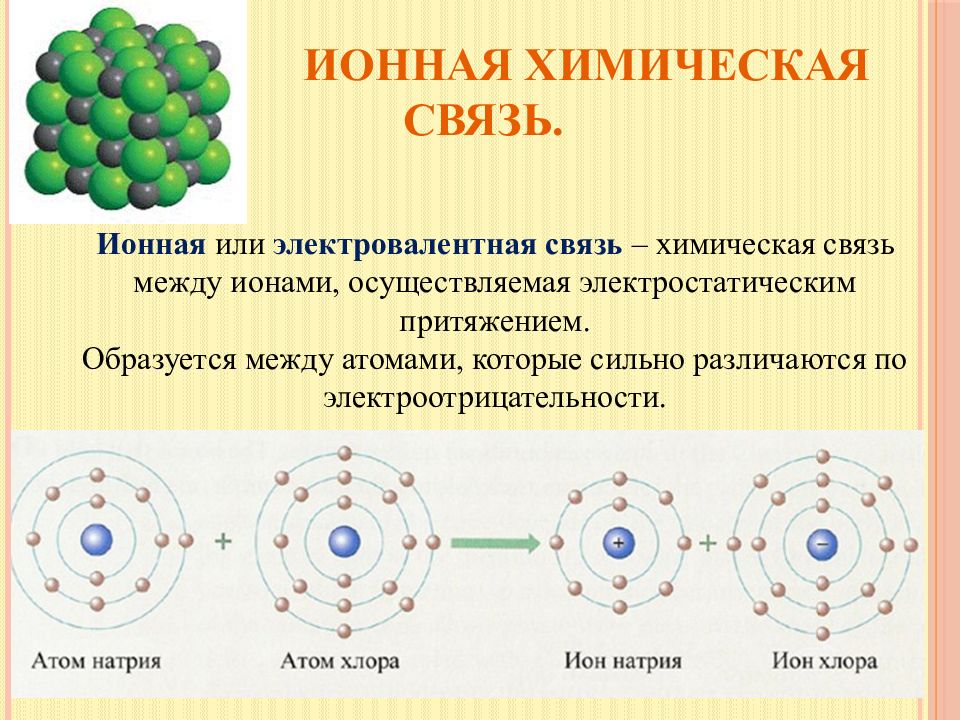
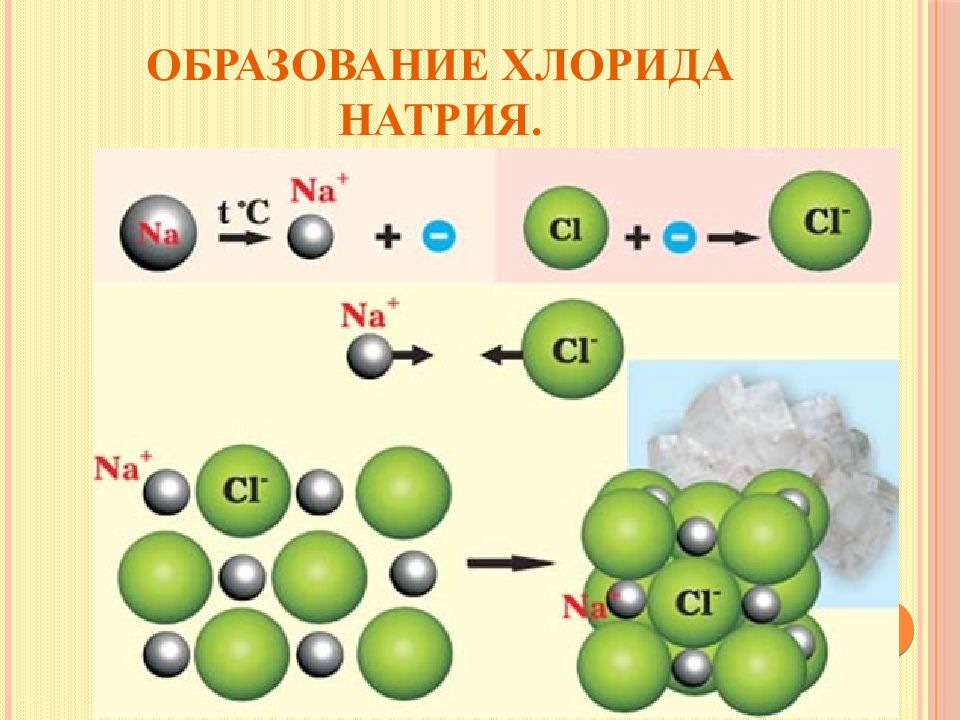
Слайд 12: Ионная химическая связь
Ионная или электровалентная связь – химическая связь между ионами, осуществляемая электростатическим притяжением. Образуется между атомами, которые сильно различаются по электроотрицательности.
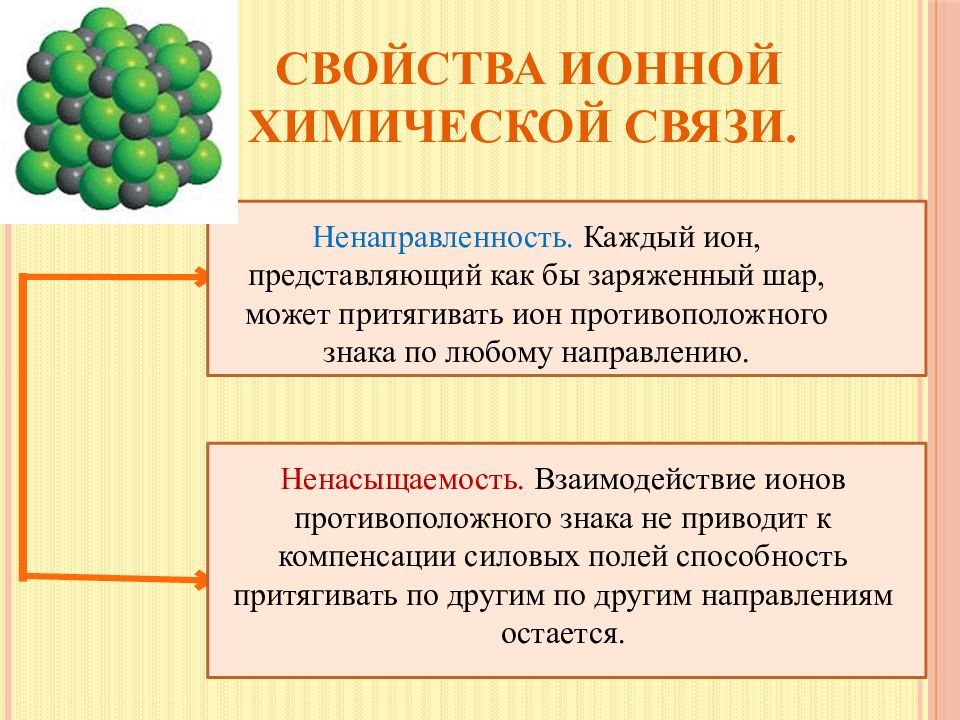
Слайд 14: Свойства ионной химической связи
Ненаправленность. Каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного знака по любому направлению. Ненасыщаемость. Взаимодействие ионов противоположного знака не приводит к компенсации силовых полей способность притягивать по другим по другим направлениям остается.
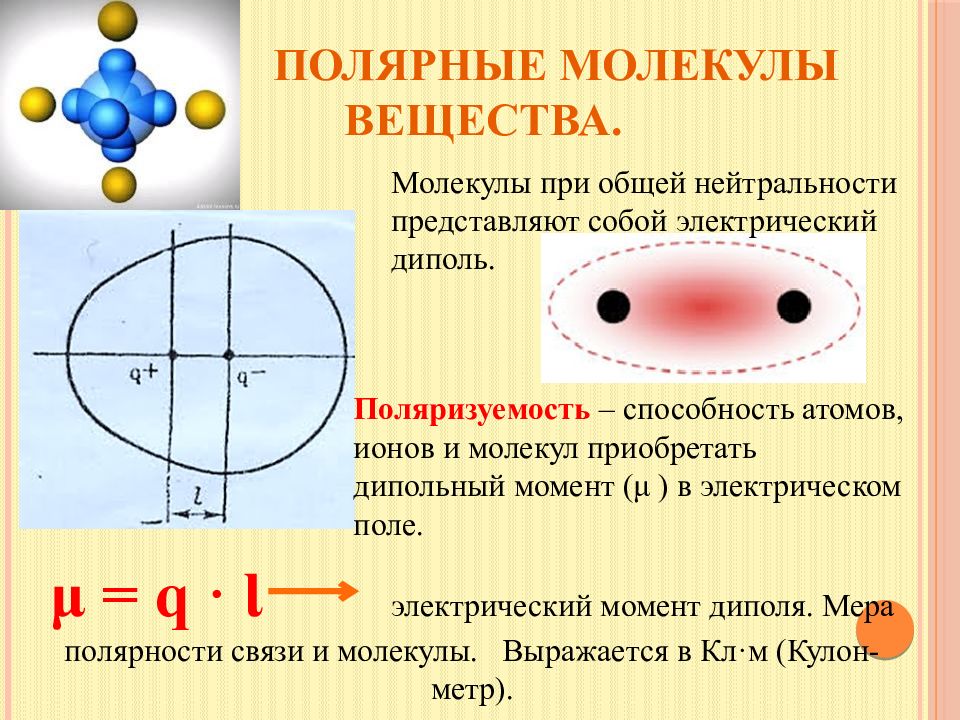
Слайд 16: Полярные молекулы вещества
Молекулы при общей нейтральности представляют собой электрический диполь. Поляризуемость – способность атомов, ионов и молекул приобретать дипольный момент ( μ ) в электрическом поле. μ = q · Ɩ электрический момент диполя. Мера полярности связи и молекулы. Выражается в Кл·м (Кулон-метр).
Слайд 17: Неполярные молекулы
μ = 0 Молекулы, содержащие неполярную ковалентную связь – электронное облако симметрично по отношению к ядрам обоих атомов. Например: Н 2 ; О 2 ; F 2 ; Cl 2 и др.
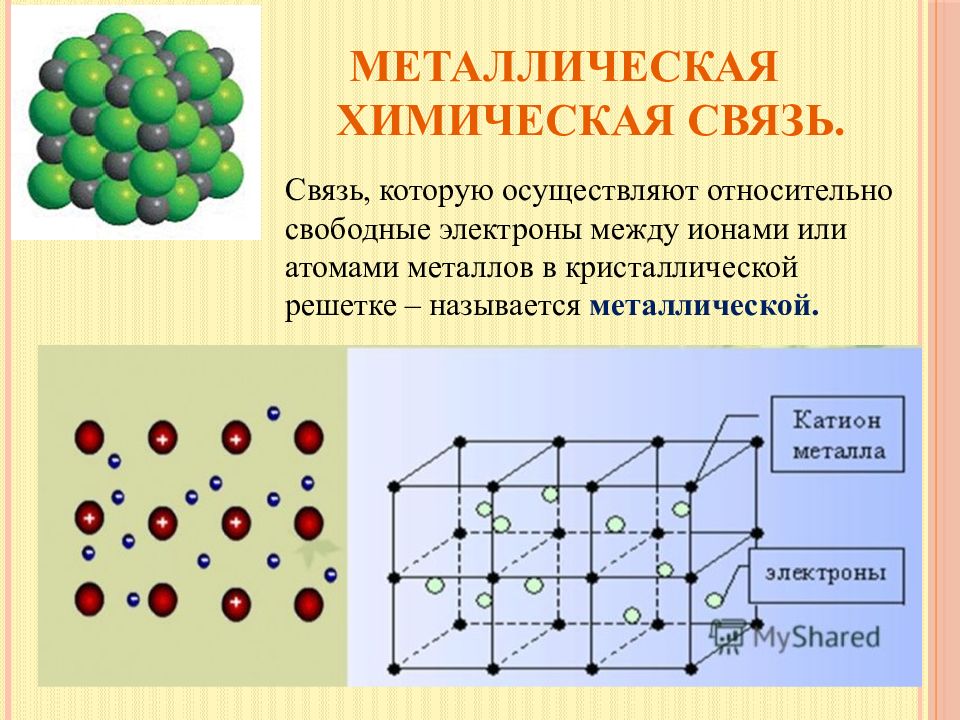
Слайд 18: Металлическая химическая связь
Связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической решетке – называется металлической.
Слайд 19: Особенности металлической связи
1. Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей. Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального. Металлическая связь характерна для металлов твердом и жидком состоянии.
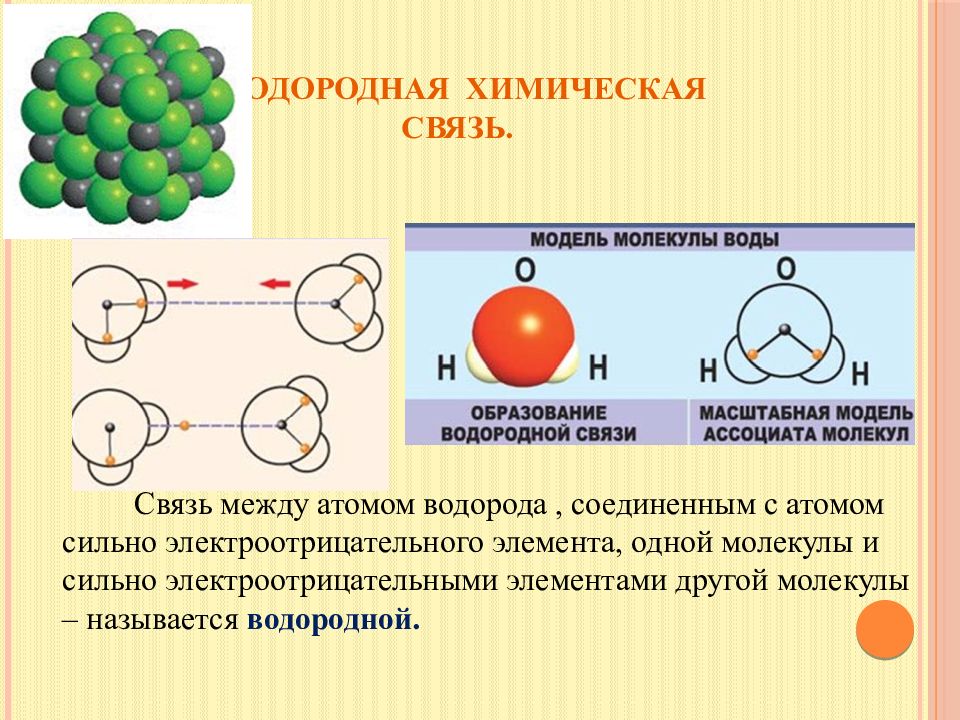
Слайд 20: Водородная химическая связь
Связь между атомом водорода, соединенным с атомом сильно электроотрицательного элемента, одной молекулы и сильно электроотрицательными элементами другой молекулы – называется водородной.
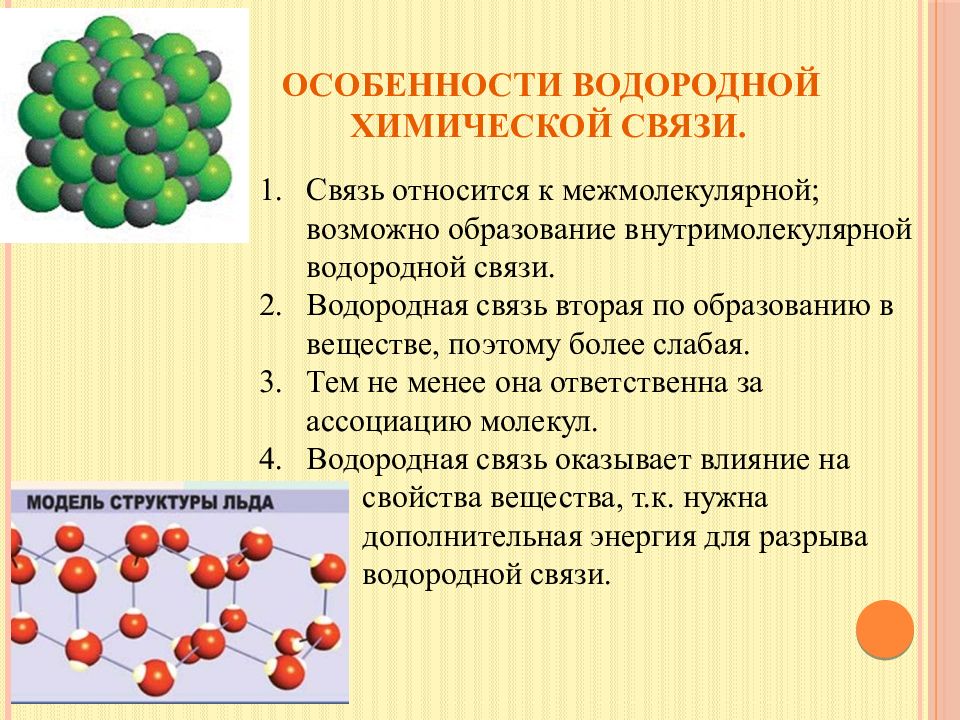
Слайд 21: Особенности водородной химической связи
Связь относится к межмолекулярной; возможно образование внутримолекулярной водородной связи. Водородная связь вторая по образованию в веществе, поэтому более слабая. Тем не менее она ответственна за ассоциацию молекул. Водородная связь оказывает влияние на свойства вещества, т.к. нужна дополнительная энергия для разрыва водородной связи.
Последний слайд презентации: Химическая связь: Материалы, используемые для оформления
http:// elementy.ru/images/eltbook/chemical_bonds_rus1_720.jpg http:// www.varson.ru/images/Himia_jpeg_big/2-10.jpg http:// www.varson.ru/images/Himia_jpeg_big/2-11.jpg http:// konspekta.net/studopediaorg/baza4/733777796720.files/image774.jpg http:// images.myshared.ru/277791/slide_4.jpg https:// upload.wikimedia.org/wikipedia/commons/thumb/0/06/Sigma_bond.svg/250px-Sigma_bond.svg.png http:// arhe.msk.ru/wp-content/uploads/2014/03/17882_html_670f366a-335x230.png http:// estnauki.ru/images/stories/water_molekula.jpg https:// encrypted-tbn3.gstatic.com/images?q=tbn:ANd9GcTxFRG_40yv33-EqH9Ue_BtfBz5GQided0BtUHE_wRtFWVvD1Zc http:// distant-lessons.ru/wp-content/uploads/2013/12/donorno-akceptornaja-kovalentnaja-svyaz.jpg