Первый слайд презентации: Химические методы
Синтез в неводных средах Осаждение Гидротермальный синтез
Слайд 2
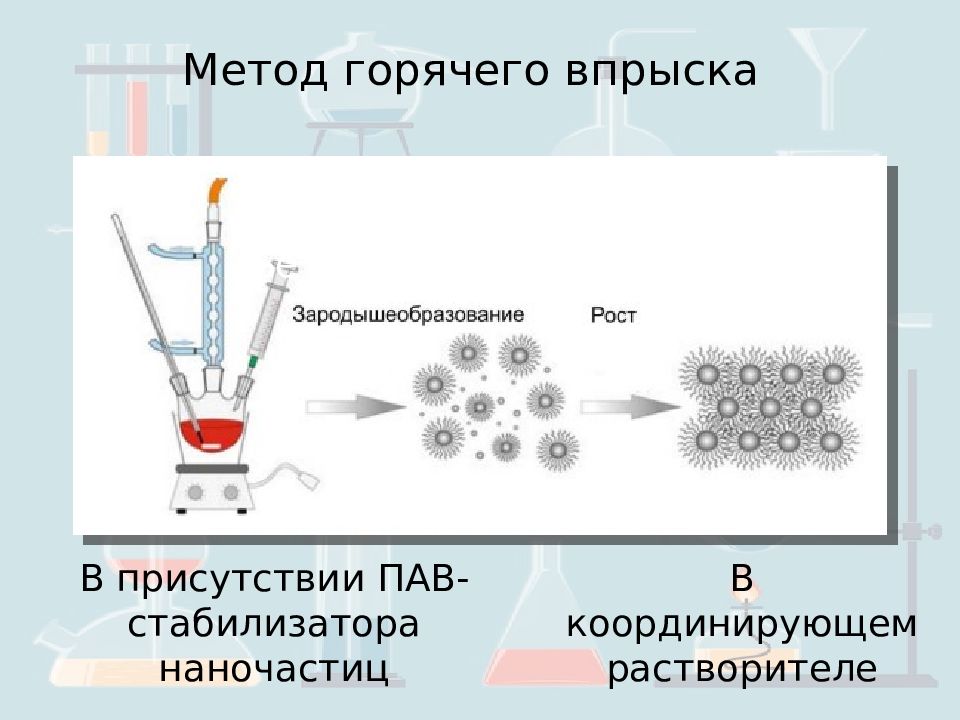
Метод горячего впрыска В присутствии ПАВ-стабилизатора наночастиц В координирующем растворителе Se : Cd(CH3)2 : ТБФ = 2 : 5 : 100 T 300- 400 о С
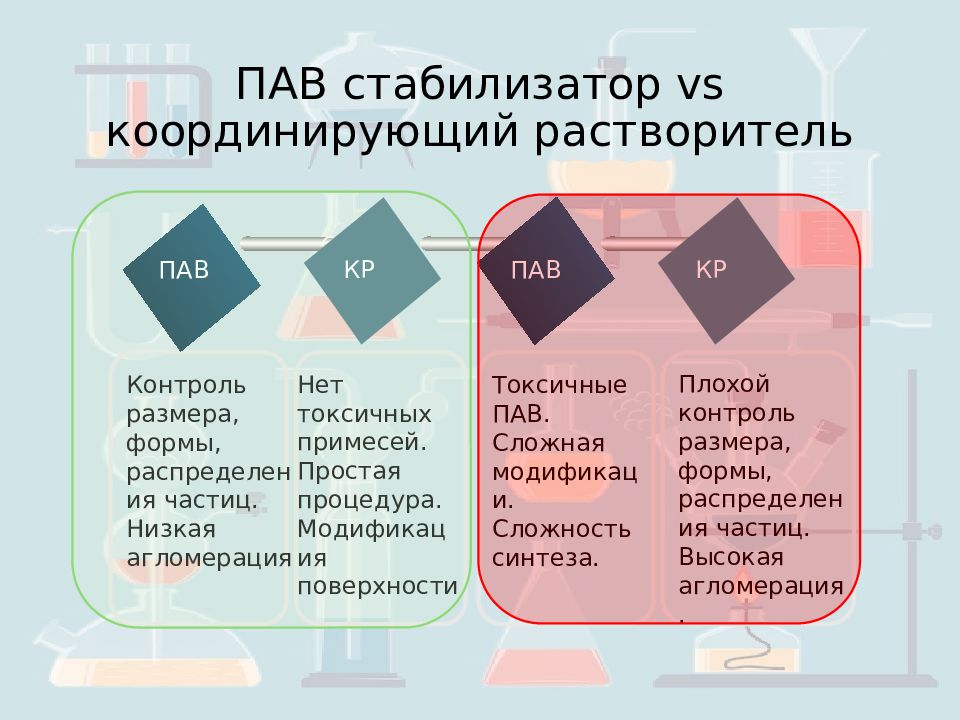
Слайд 3: ПАВ стабилизатор vs координирующий растворитель
ПАВ КР ПАВ КР Контроль размера, формы, распределения частиц. Низкая агломерация Нет токсичных примесей. Простая процедура. Модификация поверхности Токсичные ПАВ. Сложная модификаци. Сложность синтеза. Плохой контроль размера, формы, распределения частиц. Высокая агломерация.
Слайд 4
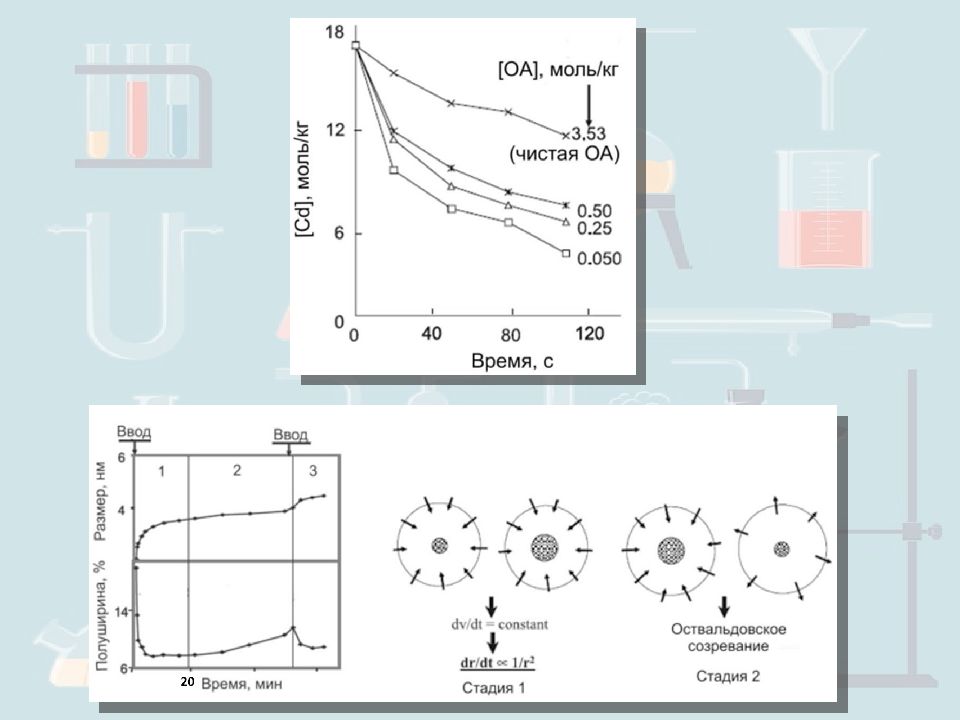
Факторы, влияющие на размер частиц Время синтеза. Концентрация соли металла. Вязкость раствора. Концентрация ПАВ. Температура.
Слайд 6
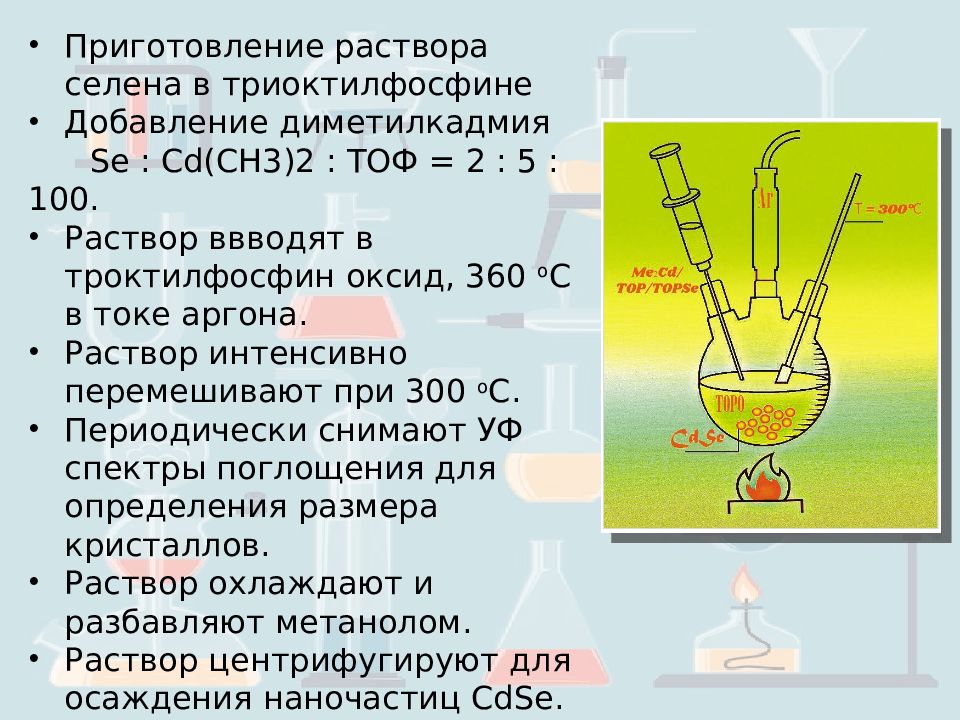
Приготовление раствора селена в триоктилфосфине Добавление диметилкадмия Se : Cd (CH3)2 : ТОФ = 2 : 5 : 100. Раствор ввводят в троктилфосфин оксид, 360 о С в токе аргона. Раствор интенсивно перемешивают при 300 о С. Периодически снимают УФ спектры поглощения для определения размера кристаллов. Раствор охлаждают и разбавляют метанолом. Раствор центрифугируют для осаждения наночастиц CdSe. Наночастицы промывают метанолом и высушивают.
Слайд 7
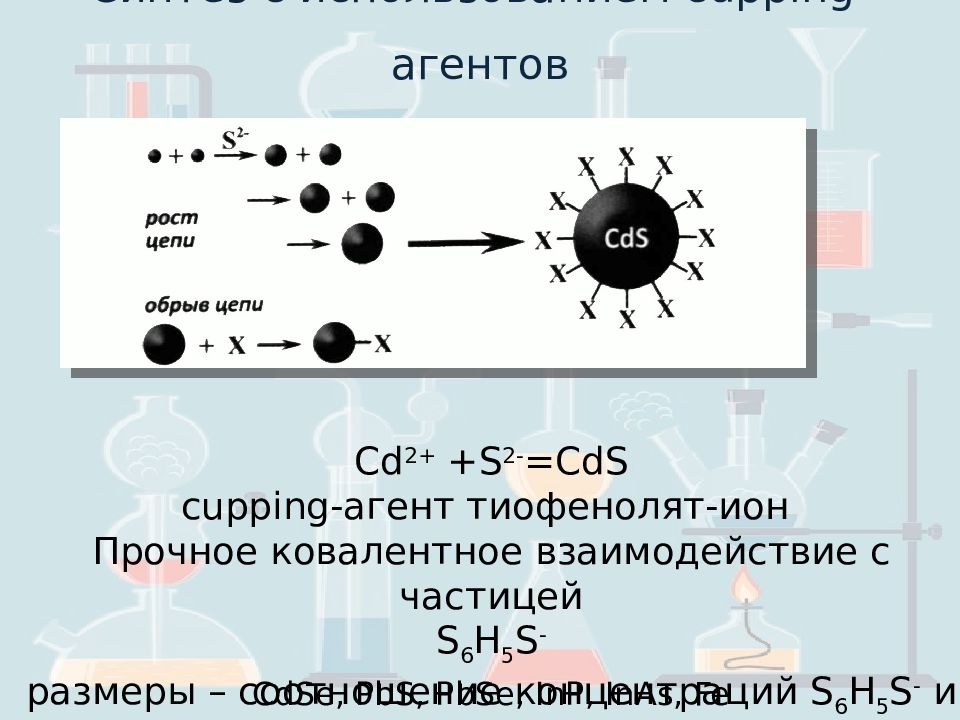
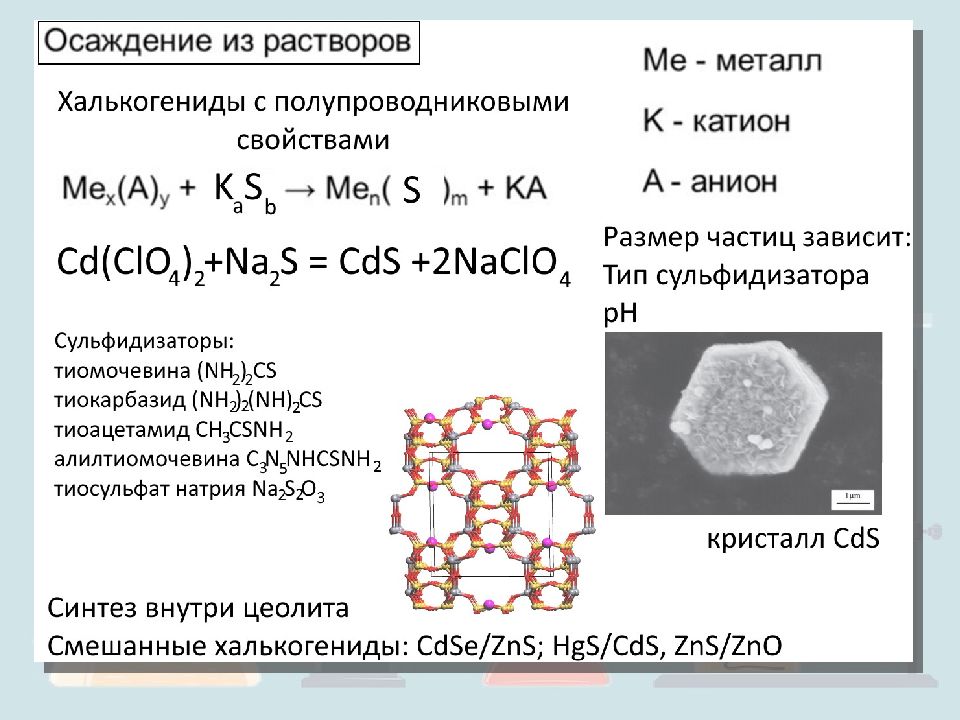
Синтез с использованием cupping- агентов CdSe, PbS, PbSe, InP, InAs, Fe Cd 2+ + S 2- = CdS cupping- агент тиофенолят -ион Прочное ковалентное взаимодействие с частицей S 6 H 5 S - размеры – соотношение концентраций S 6 H 5 S - и S 2-
Слайд 8
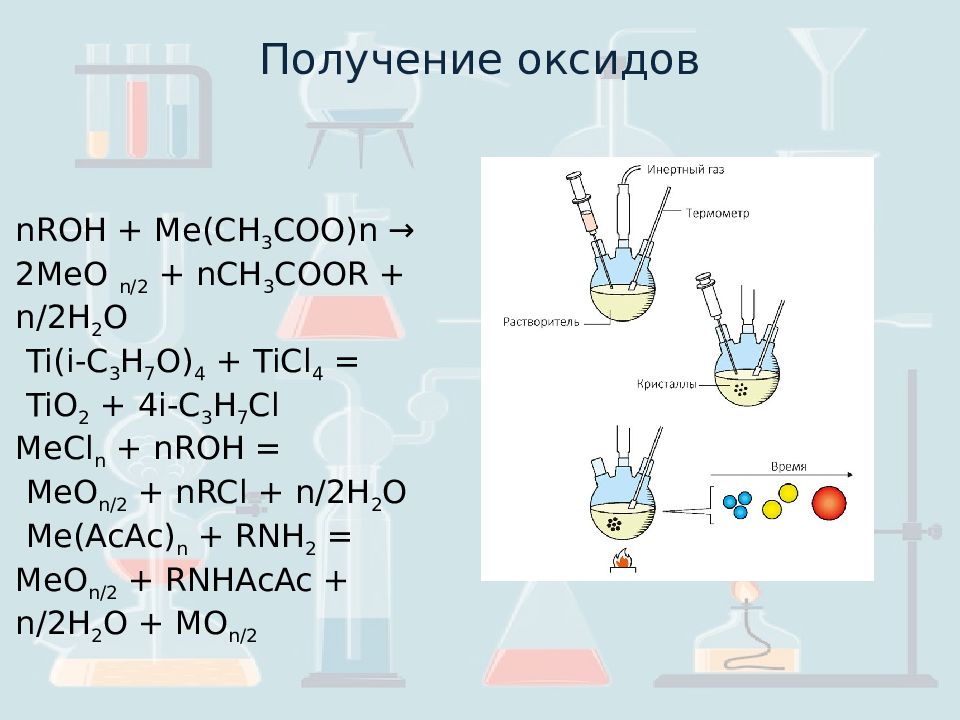
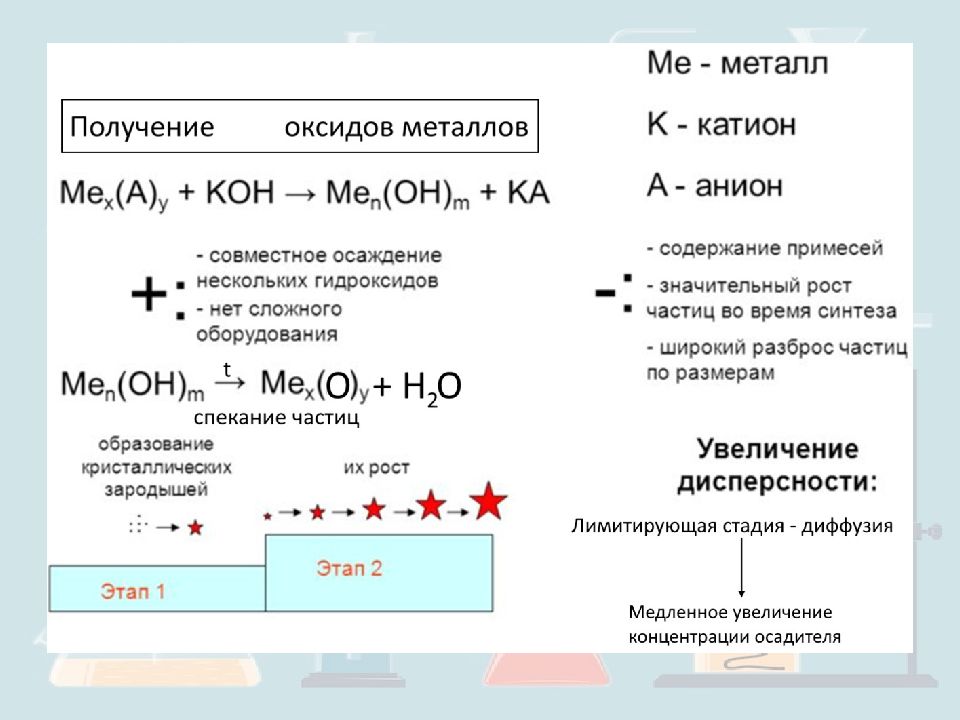
nROH + Me(CH 3 COO)n → 2MeO n/2 + nCH 3 COOR + n/2H 2 O Ti (i-C 3 H 7 O) 4 + TiCl 4 = TiO 2 + 4i-C 3 H 7 Cl MeCl n + nROH = MeO n /2 + nRCl + n/2H 2 O Me( AcAc ) n + RNH 2 = MeO n /2 + RNHAcAc + n/2H 2 O + MO n /2 Получение оксидов
Слайд 9
Прекурсоры Раст -ли Стаб-ры Получают Cd(CH 3 ) 2, Zn(CH 3 ) 2, (CH 3 ) 3 As, S(TMS) 2, P(TMS) 3 ТОФ, ТОФО, ТБФ, гептадекан Жирные кислоты, пр-ые H 3 РО 4, фосфина и аммиака A II B VI и A III B V оксиды металлов Метод горячего впрыска
Слайд 12
ϐ - фактор формы s – пресыщение n – количество столкнувшихся частиц Для KCl s=2 I= 10 -15 см -3 t=32 млрд. s= 4 I= 10 18 см -3 n= 10 22 за t= 8400 с=2.33 ч Процесс осаждения наночастиц
Слайд 14
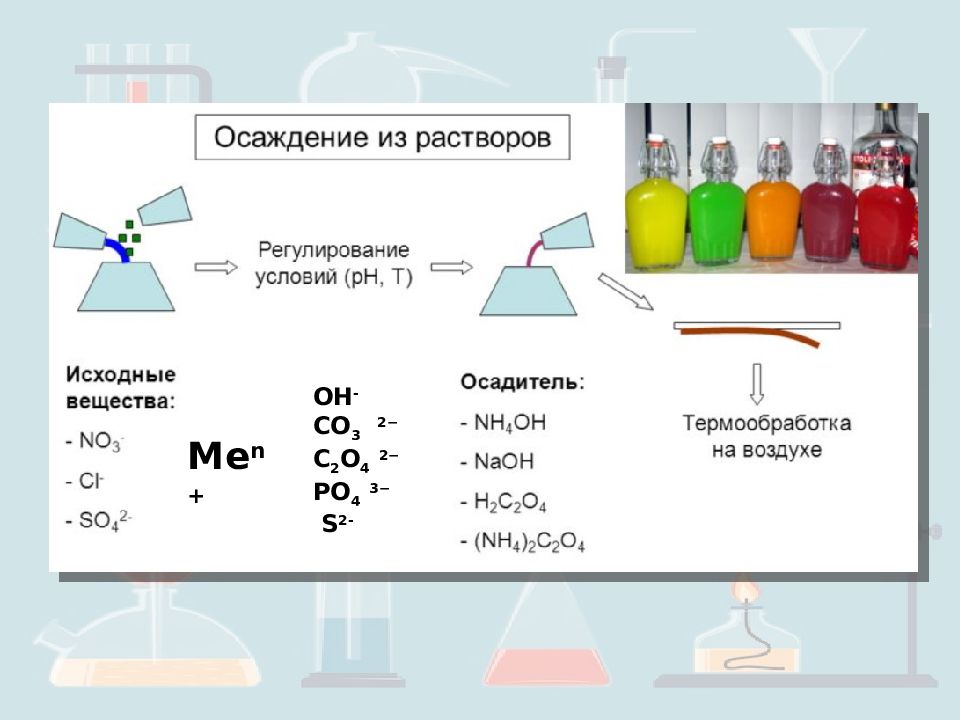
Изменение рН среды. Разложение эфиров и аминов с образованием [CO 3 ] 2−, [C 2 O 4 ] 2−, [SO 4 ] 2−, [PO 4 ] 3− или S 2-. Использование летучего растворителя. Использование восстанавливающего или окисляющего реагента. Применение фотохимических реакций. Способы осаждения наночастиц
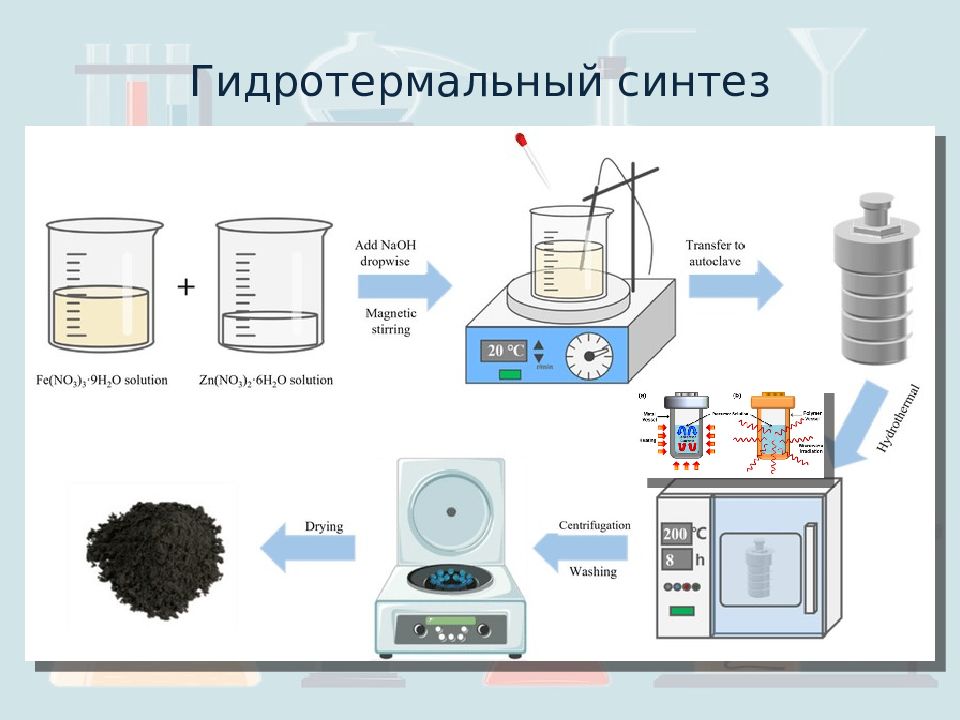
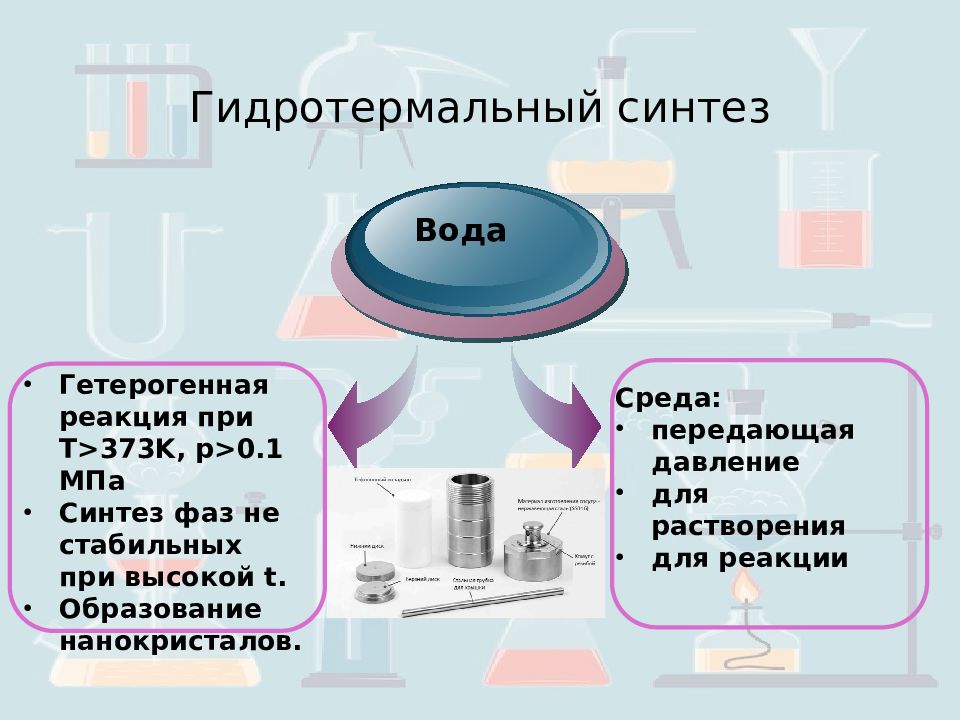
Слайд 17: Гидротермальный синтез
Гетерогенная реакция при Т >373K, p>0.1 МПа Синтез фаз не стабильных при высокой t. Образование нанокристалов. Вода Среда: передающая давление для растворения для реакции
Слайд 18: Гидротермальный синтез
Оксиды, халькогениды, нитриды, фосфаты Низкая t Узкое распределение Наноразмеры Контроль формы Кристалличность Простота синтеза Гидротермальный синтез
Слайд 19
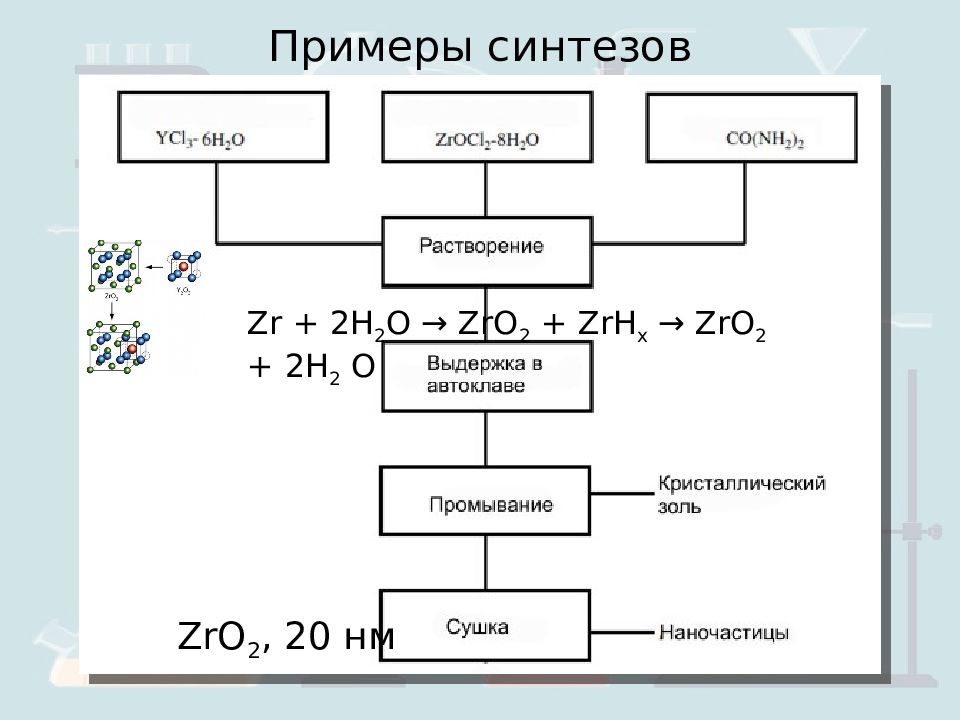
Примеры синтезов ZrO 2, 20 нм Zr + 2H 2 O → ZrO 2 + ZrH x → ZrO 2 + 2H 2 О
Слайд 20
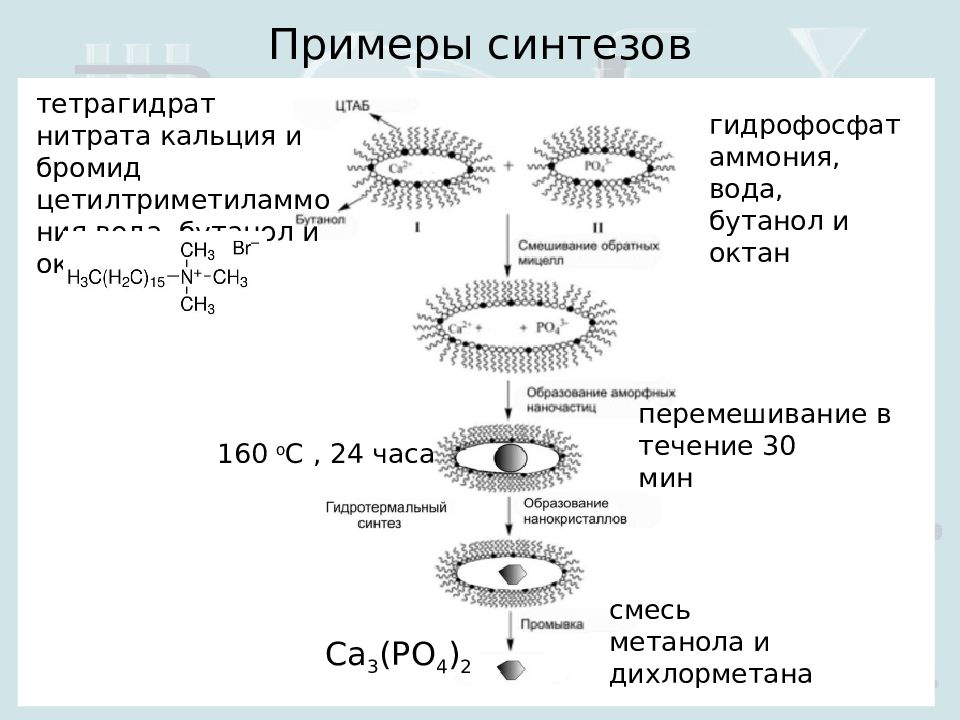
Примеры синтезов С a 3 (PO 4 ) 2 тетрагидрат нитрата кальция и бромид цетилтриметиламмония вода, бутанол и октан гидрофосфат аммония, вода, бутанол и октан 160 о С, 24 часа перемешивание в течение 30 мин смесь метанола и дихлорметана
Слайд 21
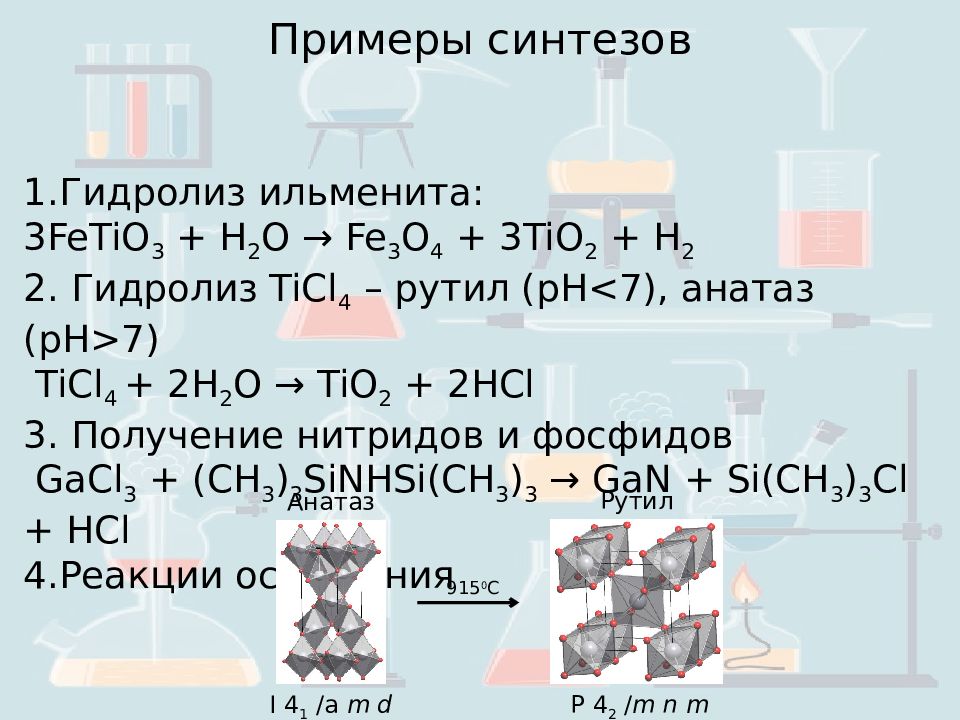
Гидролиз ильменита: 3 FeTiO 3 + H 2 O → Fe 3 O 4 + 3TiO 2 + H 2 2. Гидролиз TiCl 4 – рутил (pH<7), анатаз (pH>7) TiCl 4 + 2H 2 O → TiO 2 + 2HCl 3. Получение нитридов и фосфидов GaCl 3 + (CH 3 ) 3 SiNHSi(CH 3 ) 3 → GaN + Si(CH 3 ) 3 Cl + HCl 4. Реакции осаждения Примеры синтезов Анатаз I 4 1 /a m d Рутил P 4 2 / m n m 915 0 C
Последний слайд презентации: Химические методы
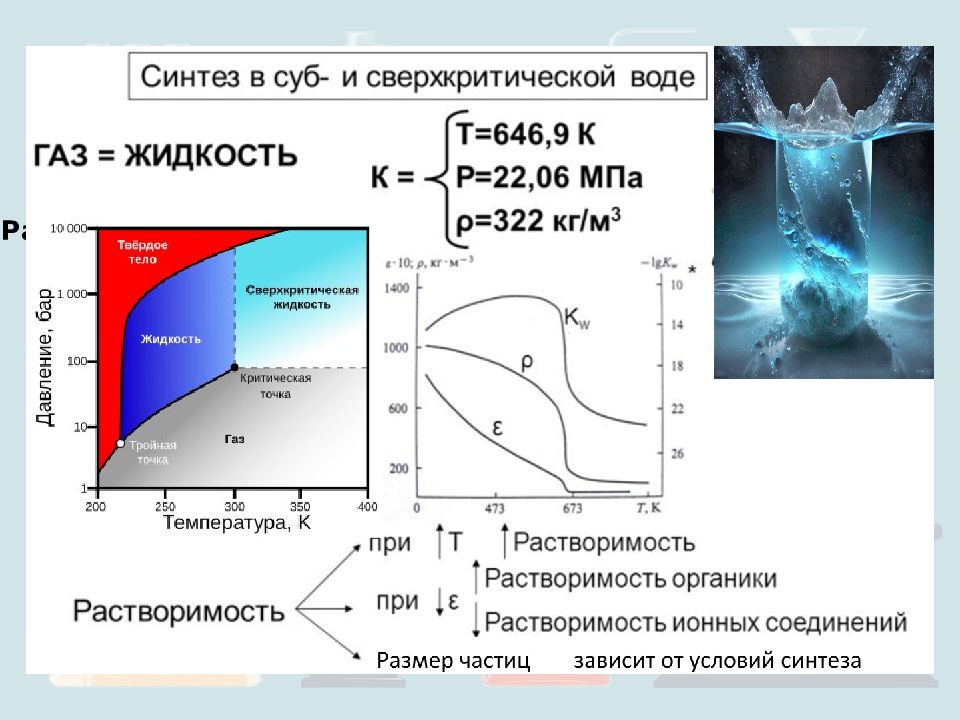
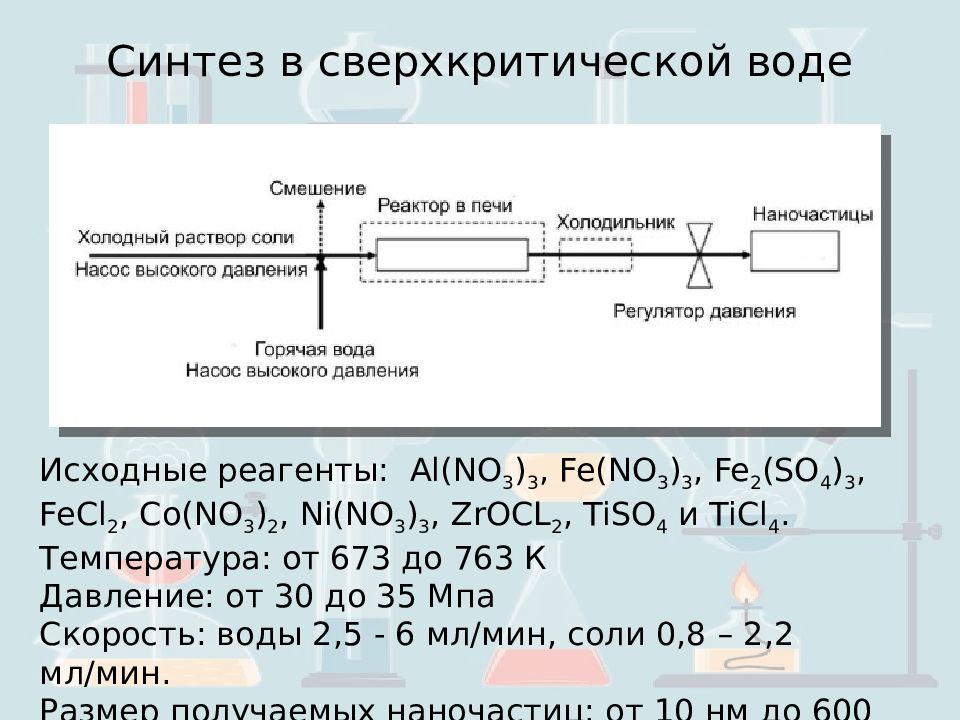
Синтез в сверхкритической воде Исходные реагенты: Al (NO 3 ) 3, Fe (NO 3 ) 3, Fe 2 (SO 4 ) 3, FeCl 2, Co (NO 3 ) 2, Ni (NO 3 ) 3, ZrOC L 2, TiSO 4 и TiCl 4. Температура: от 673 до 763 К Давление: от 30 до 35 Мпа Скорость: воды 2,5 - 6 мл/мин, соли 0,8 – 2,2 мл/мин. Размер получаемых наночастиц: от 10 нм до 600 нм. Получают: Al 5 Y 3 O 12, YVO 4, Me x O y, ZrO 2.