Слайд 4: ОДНОАТОМНЫЕ СПИРТЫ
Сложные вещества с общей формулой С n Н 2n+1 ОН, в которых гидроксильная группа соединена с углеводородным радикалом.
Слайд 5: Правила названия спиртов
Название предельного углеводорода + суффикс -ол. СН 3 ОН – метанол (метиловый спирт) С 2 Н 5 ОН – этанол (этиловый спирт) С 3 Н 7 ОН – пропанол С 4 Н 9 ОН – бутанол
Слайд 6: Метанол СН 3 ОН
Бесцветная жидкость, с водой смешивается в любых соотношениях. Горит бесцветным пламенем. ОЧЕНЬ ЯДОВИТ! Небольшое количество – общее отравление и слепота, большие количества смертельны.
Слайд 7: Этанол С 2 Н 5 ОН
Бесцветная жидкость со слабым запахом и жгучим вкусом. Смешивается с водой в любых соотношениях. Горит голубоватым пламенем.
Слайд 8: Получение этанола
1. Гидратация этилена: СН 2 = СН 2 + Н 2 О С 2 Н 5 ОН 2. Брожение сахаристых веществ: С 6 Н 12 О 6 2С 2 Н 5 ОН +2СО 2
Слайд 9: Химические свойства спиртов
1. Горение С 2 Н 5 ОН + 3О 2 2СО 2 + 3Н 2 О 2. Окисление С 2 Н 5 ОН + [ O ] CH 3 – C=O | H уксусный альдегид
Слайд 10: Химические свойства спиртов
3. Взаимодействие со щелочными металлами 2 С 2 Н 5 ОН + 2Na 2 С 2 Н 5 О Na + H 2 Химические свойства спиртов
Слайд 11: Действие этанола на организм человека
Разрушение клеток печени. Общее отравление организма. Нарушение работы желудочно-кишечного тракта, сердечно-сосудистой системы. Деградация личности.
Слайд 12: Многоатомные спирты
СН 2 – ОН CH 2 – OH | | CH 2 – OH CH – OH | CH 2 – OH Этиленгликоль Глицерин Бесцветные, сиропообразные жидкости, сладковатые на вкус. Ядовиты!
Слайд 13: Альдегиды
Органические вещества, в молекулах которых содержится альдегидная группа – С = О | Н
Слайд 14: Правила названия альдегидов
Название предельного углеводорода + суффикс –аль. Н – С = О - метаналь (муравьиный альдегид) | H СН 3 – С = О - этаналь (уксусный альдегид) | Н
Слайд 15: Физические свойства альдегидов
Этаналь – бесцветная летучая жидкость с резким запахом. Хорошо растворим в воде.
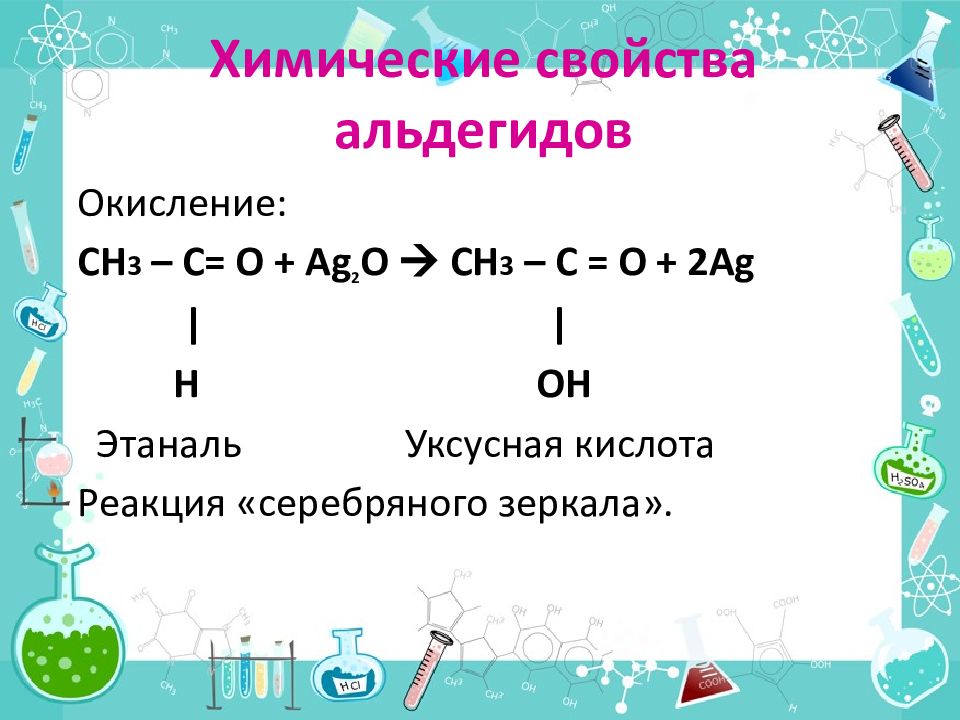
Слайд 16: Химические свойства альдегидов
Окисление: СН 3 – С= О + Ag 2 O CH 3 – C = O + 2Ag | | H OH Этаналь Уксусная кислота Реакция «серебряного зеркала».
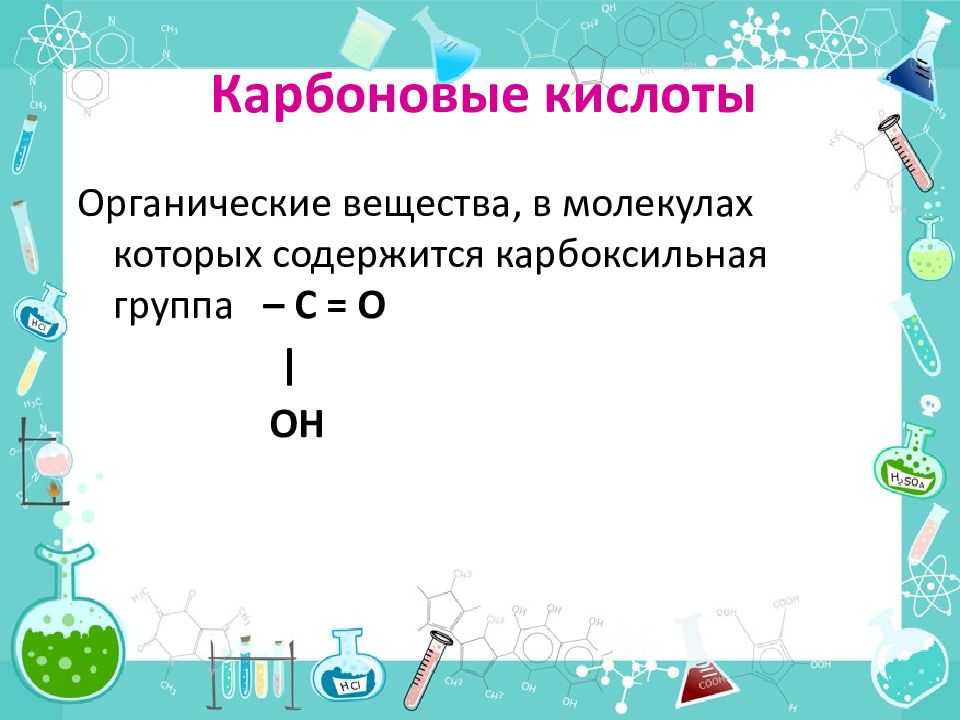
Слайд 17: Карбоновые кислоты
Органические вещества, в молекулах которых содержится карбоксильная группа – С = О | OH
Слайд 18: Правила названия карбоновых кислот
Название предельного углеводорода + - овая кислота. Н – С = О метановая кислота (муравьиная) | ОН СН 3 – С = О этановая кислота (уксусная) | OH С 17 Н 35 – С = О стеариновая кислота | OH
Слайд 19
Физические свойства уксусной кислоты Бесцветная жидкость с резким запахом. Физические свойства стеариновой кислоты Бесцветные кристаллы, нерастворимы в воде
Слайд 20: Химические свойства уксусной кислоты
Проявляет характерные свойства кислот. 1. Изменяет окраску индикатора: СН 3 СООН СН 3 СОО - + Н + 2. Взаимодействует с металлами: 2 СН 3 СООН + М g (CH 3 COO) 2 Mg + H 2
Слайд 21: Химические свойства уксусной кислоты
3. Взаимодействует с основными оксидами: 2СН 3 СООН + СаО (CH 3 COO) 2 Ca + H 2 O 4. Взаимодействует с основаниями: С H 3 COOH + NaOH CH 3 COONa + H 2 O 5. Взаимодействует с солями: 2CH 3 COOH + Na 2 CO 3 2CH 3 COONa + CO 2 + H 2 O Химические свойства уксусной кислоты
Последний слайд презентации: КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
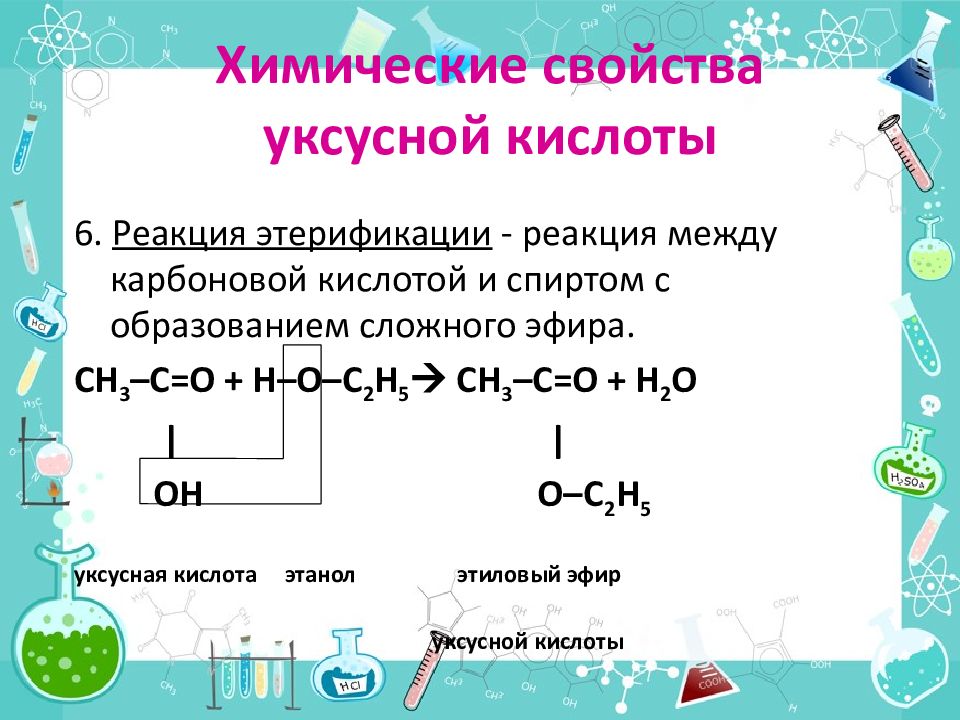
6. Реакция этерификации - реакция между карбоновой кислотой и спиртом с образованием сложного эфира. CH 3 –C=O + H–O–C 2 H 5 CH 3 –C=O + Н 2 О | | OH O–C 2 H 5 уксусная кислота этанол этиловый эфир уксусной кислоты Химические свойства уксусной кислоты