Слайд 2
Комплексные соединения ( координационные соединения) – сложные химические вещества, в составе которых имеются комплексные ионы, образованные центральным атомом и связанным с ним лигандами.
Слайд 3
Теорию комплексных соединений –( координационную теорию), разработал в 1893 г. ш вейцарский химик Альфред Вернер, который в 1913 стал лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
Слайд 4
Положения координационной теории Вернера в центре комплексного соединения находится центральный ион – комплексообразователь. Ионами –коплексообразователями являются катионы металлов, а также некоторые неметаллы, например В, Р, Si. Наибольшую склонность к комплексо-образованию проявляют ионы d-элементов.
Слайд 5
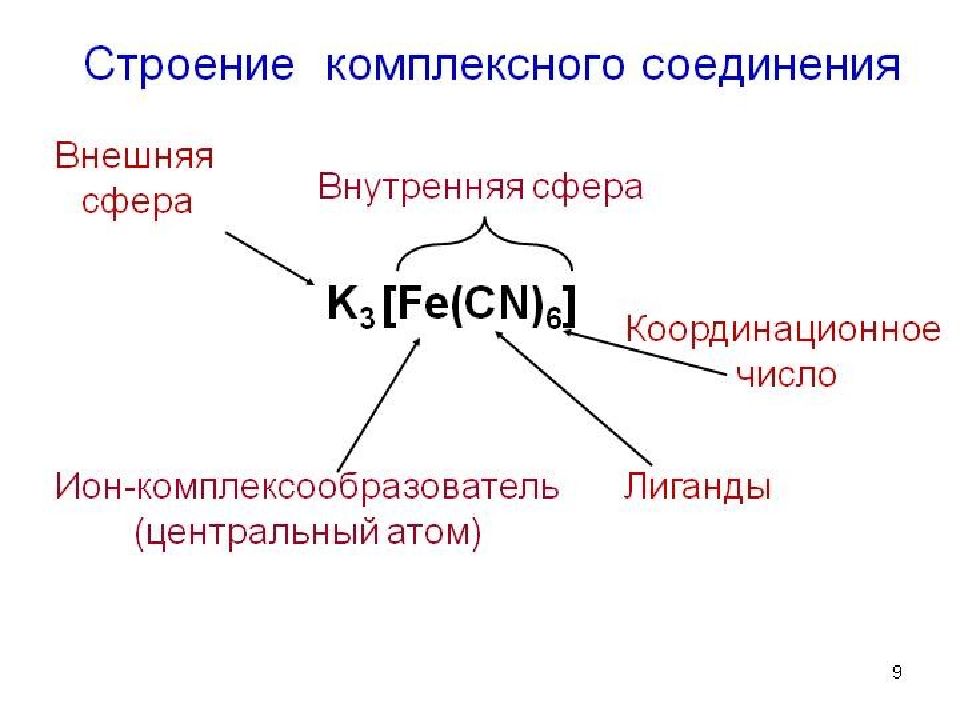
Вокруг центрального иона-комплексо-образователя находятся противоположно заряженные ионы или нейтральные молекулы, которые называются лигандами ( от латинского " ligare " – связывать ). Ион-комплексообразователь и лиганды c оставляют внутреннюю сферу комплекса, которую обозначают квадратными скобками. Число лигандов, которые координируются вокруг центрального иона-комплексо-образователя, называется координационным числом.
Слайд 7
ЦЕНТРАЛЬНЫЙ АТОМ ( ион-комплексообразователь) Чаще всего центральными атомами являются ионы металлов d -элементов: Cu, Ag, Pt, Cr, Fe, Zn и др. В состав некоторых комплексных соединений могут входить и ионы щелочных и щелочно-земельных металлов ( Na, Ca, Mg ).
Слайд 8
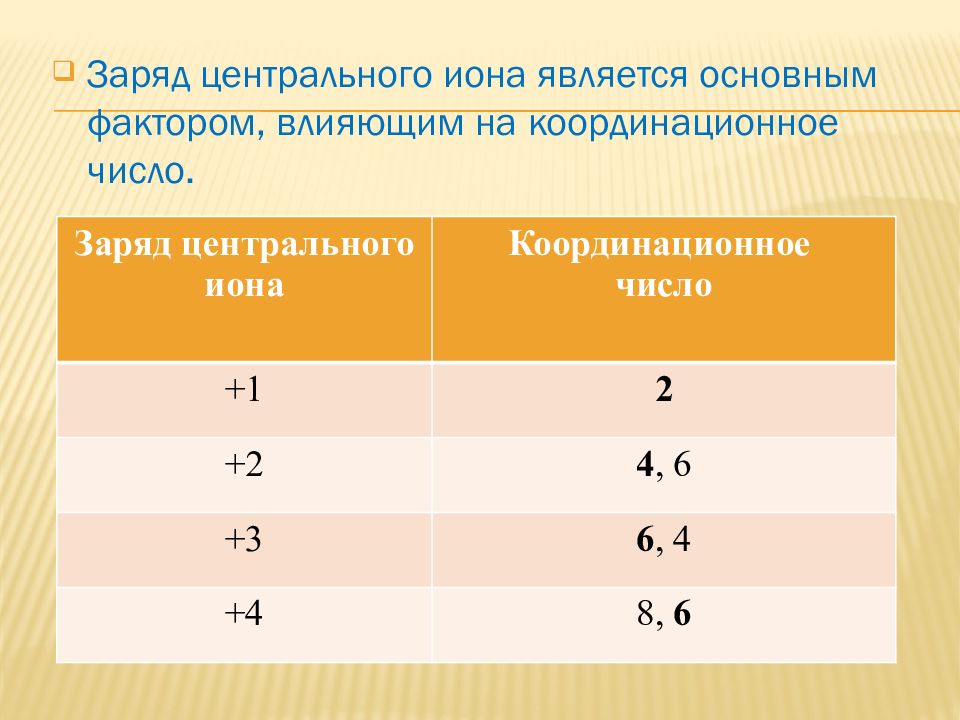
Заряд центрального иона является основным фактором, влияющим на координационное число. Заряд центрального иона Координационное число +1 2 +2 4, 6 +3 6, 4 +4 8, 6
Слайд 9
Координационное число не является неизменной величиной. Даже для одних и тех же комплексообразователей и лигандов координационное число зависит от агрегатного состояния вещества, от концентрации, температуры.
Слайд 10
ЛИГАНДЫ Лигандами могут быть: нейтральные молекулы H 2 O, NH 3, CO, карбамида ( NH 2 ) 2 CO, этилендиамина NH 2 CH 2 CH 2 NH 2, α -аминоуксусной кислоты NH 2 CH 2 COOH, этилендиаминтетрауксусной кислоты (ЭДТА). - ионы ( CN -, F -, Cl -, Br -, I -, NO 2 -, OH -, C 2 O 4 2-, CO 3 2- )
Слайд 11
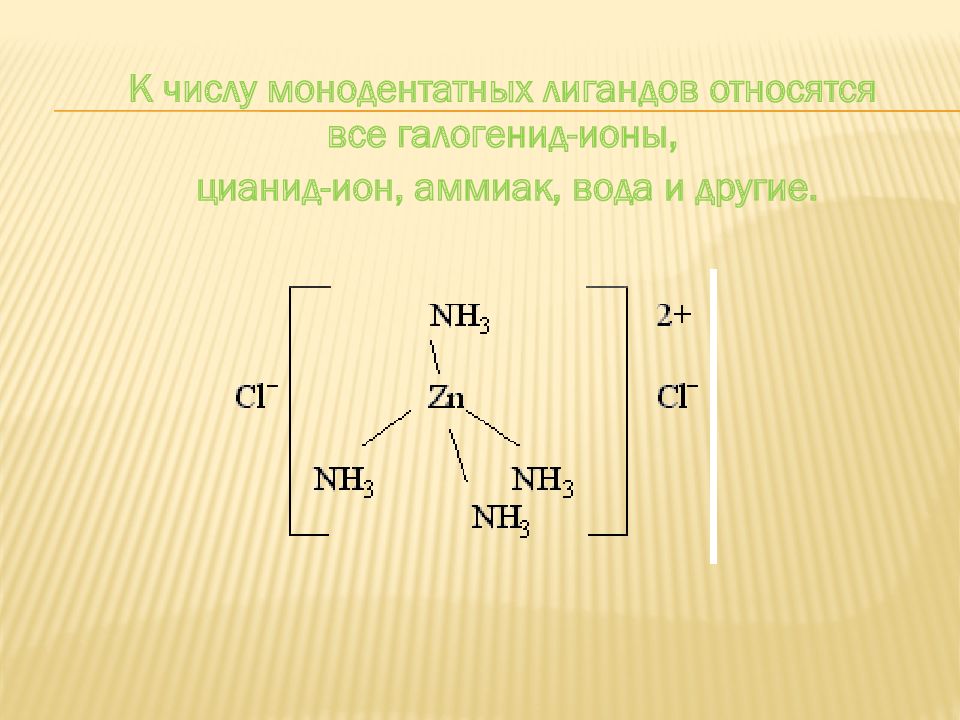
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные лиганды, занимающие во внутренней сфере одно место, бидентатные лиганды, занимающие два места, и полидентатные лиганды, занимающие несколько мест.
Слайд 12
К числу моноде н татных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Слайд 13
Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными. Это этилендиамин, карбонат-ион, оксалат-ион и др. Каждая молекула или ион бидентатного лиганда образует с комплексообразователем две химические связи в соответствии с особенностями своего строения :
Слайд 14
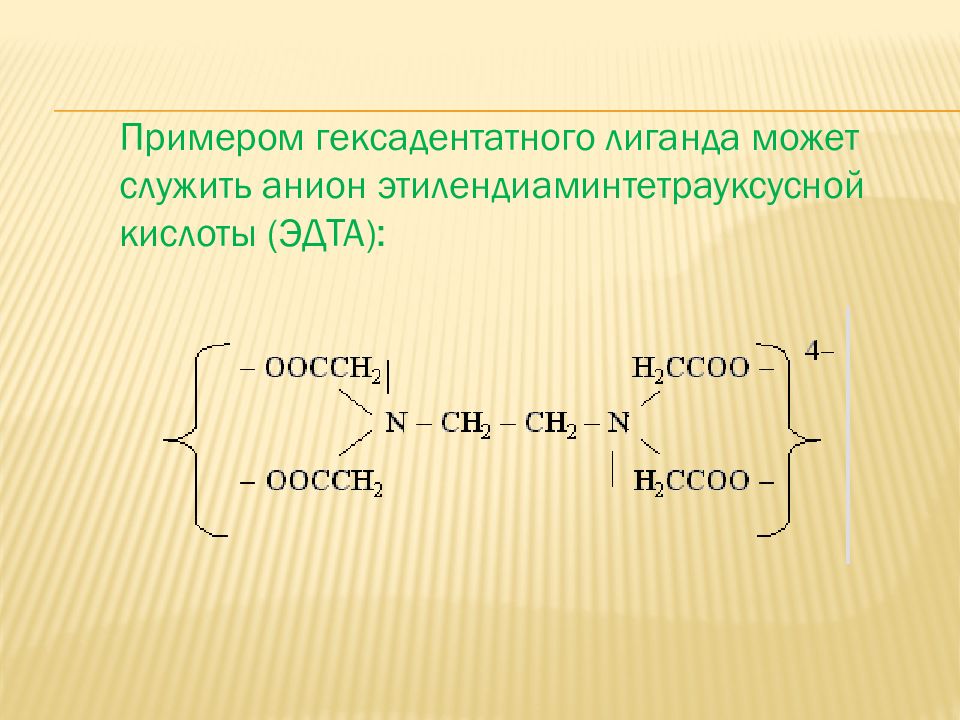
Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты (ЭДТА):
Слайд 15
Природа химической связи в комплексных соединениях Во внутренней сфере между комплексообразователем и лигандами существуют ковалентные связи, образованные по обменному и по донорно-акцепторному механизму. Роль донора (поставщика электронов) играет лиганд, а акцептором, принимающим электроны, является комплексообразователь. Донорно-акцепторная связь возникает как результат перекрывания свободных валентных орбиталей комплексообразователя с заполненными орбиталями донора. Между внешней и внутренней сферой существует ионная связь.
Слайд 17
По природе лиганда 1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [ Cu (NH 3 ) 4 ]SO 4, [ Co (NH 3 ) 6 ]Cl 3, [ Pt (NH 3 ) 6 ]Cl 4 и др. 2) Аквакомплексы — комплексы, в которых лигандом выступает вода : [ Co (H 2 O) 6 ]Cl 2, [ Al (H 2 O) 6 ]Cl 3 и др. 3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II) : [ Fe (CO) 5 ], [ Ni (CO) 4 ].
Слайд 18
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. K 2 [PtCl 4 ], H 2 [CoCl 4 ], H 2 [SiF 6 ]. 5) Гидроксокомплексы — комплексы, в которых в качестве лигандов выступают гидроксид-ионы: Na 2 [ Zn (OH) 4 ], Na 2 [ Sn (OH) 6 ] и др. 6) Смешанные комплексы включают в себя различные лиганды. Например: [ Pt (NH 3 ) 2 Cl 2 ], (NH 4 ) 2 [Co 2 (C 2 O 4 ) 2 (OH) 2 ]
Слайд 19
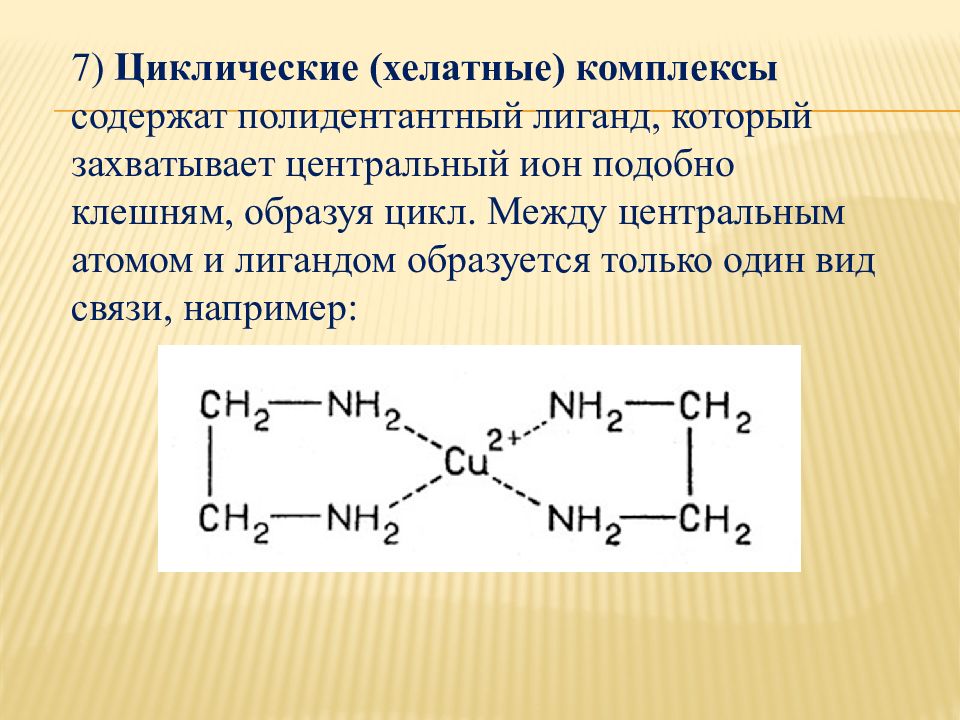
7) Циклические (хелатные) комплексы содержат полидентантный лиганд, который захватывает центральный ион подобно клешням, образуя цикл. Между центральным атомом и лигандом образуется только один вид связи, например:
Слайд 20
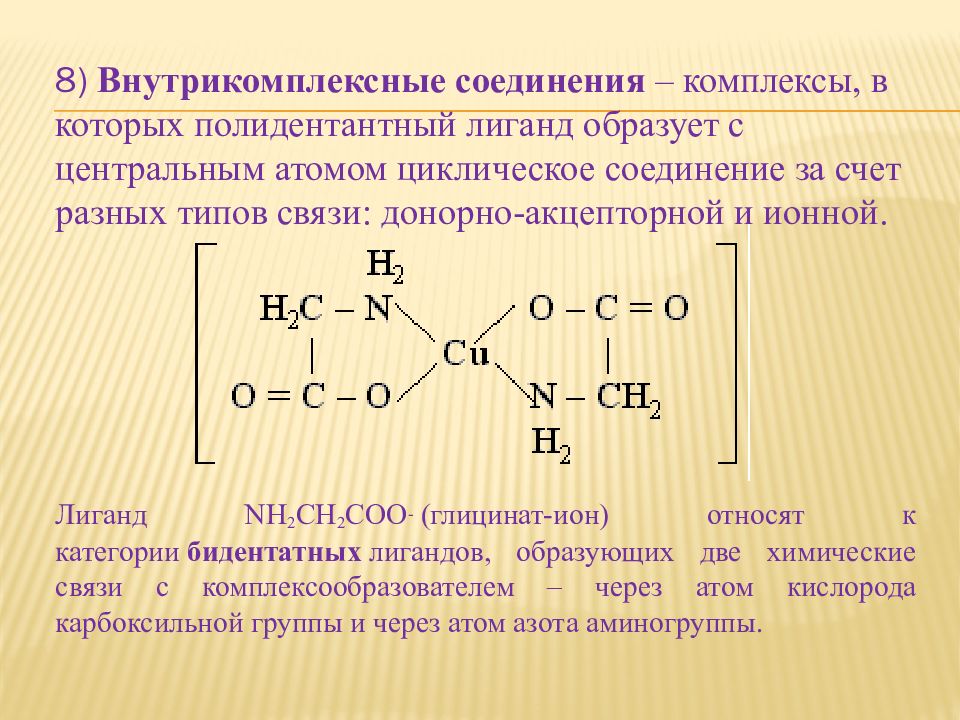
8) Внутрикомплексные соединения – комплексы, в которых полидентантный лиганд образует с центральным атомом циклическое соединение за счет разных типов связи: донорно-акцепторной и ионной. Лиганд NH 2 CH 2 COO - ( глицинат -ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем – через атом кислорода карбоксильной группы и через атом азота аминогруппы.
Слайд 21
Номенклатура Основы современной номенклатуры комплексных соединений были заложены Альфредом Вернером. До его работ в этой области химии не существовало никакой системы. Комплексные соединения называли, руководствуясь их внешним видом или происхождением, например: красная кровяная соль желтая кровяная соль K 3 [ Fe (CN) 6 ] K 4 [ Fe (CN) 6 ]
Слайд 22
Соль содержит комплексный катион [ C о (NH 3 ) 4 Cl 2 ] Cl хлорид дихлоротетраамминкобальта ( III ) -называют анион соли ( хлорид ); -называют входящие во внутреннюю сферу лиганды -анионы с окончанием на «о» ( хлоро ), указывая их количество ( 2 - ди ): дихлоро ; -называют лиганды, представляющие собой нейтральные молекулы ( аммин ), указывая их количество ( 4-тетра ); -называют центральный ион в русской транскрипции в родительном падеже ( кобальта ) - указывают в скобках заряд иона-комплексообразователя римскими цифрами ( III )
Слайд 23
Соль содержит комплексный анион K 4 [Fe(CN) 6 ] гексацианоферрат ( II ) калия -называют лиганды -анионы с окончанием на «о» с указанием их количества ( гексациано ); -называют комплексообразователь, используя латинское название элемента с прибавлением суффикса « ат » ( феррат ); -указывают в скобках заряд иона-комплексообразователя римскими цифрами ( II ); -называют катион внешней сферы в родительном падеже ( калия )
Слайд 24
Химические свойства Комплексные соединения можно условно разделить на две большие группы: электролиты и неэлектролиты. К неэлектролитам относят нейтральные комплексы. 1. Отщепление ионов внешней сферы Комплексы, имеющие ионную внешнюю сферу, в растворе подвергаются д иссоциации на комплексный ион и ионы внешней сферы и ведут себя в разбавленных растворах как сильные электролиты. [ Cu (NH 3 ) 4 ]SO 4 = [ Cu (NH 3 ) 4 ] 2+ + SO 4 2- K 3 [ Fe (CN) 6 ] = 3K + + [ Fe (CN) 6 ] 3-
Слайд 25
Если во внешней сфере комплексного соединения находятся гидроксид-ионы, то это соединение – сильное основание (диссоциация идет нацело, рН > 7). Пример соединения этого типа – гидроксид тетраамминцинка ( II): [ Zn (NH 3 ) 4 ](OH) 2 = [ Zn (NH 3 ) 4 ] 2+ + 2OH - Комплексные соединения с внешнесферными катионами водорода, например, тетрафторобората водорода в водном растворе нацело подвергаются протолизу. Они являются сильными кислотами : H[BF 4 ] + H 2 O = [BF 4 ] - + H 3 O +
Слайд 26
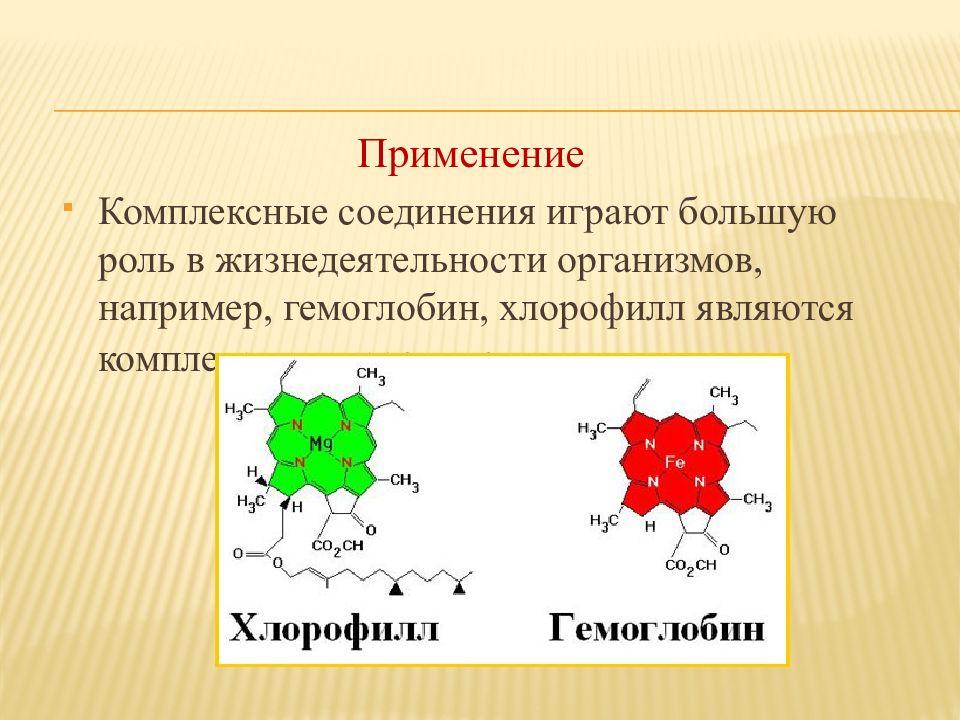
Применение Комплексные соединения играют большую роль в жизнедеятельности организмов, например, гемоглобин, хлорофилл являются комплексными соединениями.
Слайд 27
K 4 [ Fe (CN) 6 ] - желтая кровяная соль, содержащий ион железа Fe 2+, является реактивом на ионы железа Fe 3+ в растворе : 4Fe 3+ + 3[ Fe (CN) 6 ] 4- = Fe 4 [ Fe (CN) 6 ] 3 берлинская лазурь Fe 4 [ Fe (CN) 6 ] 3 гексацианоферрат (II) железа (III ) используется как краситель.
Слайд 28
K 3 [ Fe (CN) 6 ] - красная кровяная соль является реактивом на обнаружение ионов Fe 2+ в растворе : 3Fe 2+ + 2[ Fe (CN) 6 ] 3- = Fe 3 [ Fe (CN) 6 ] 2 турнбуллева синь Fe 3 [ Fe (CN) 6 ] 2 гексацианоферрат (III ) железа (II )
Последний слайд презентации: КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Литература Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2003. — 743 с. Глинка Н. Л. Общая химия. — М.: Высшая школа, 2003. — 743 с. Киселев Ю. М. Химия координационных соединений. — М.: Интеграл-Пресс, 2008. — 728 с.