Слайд 2
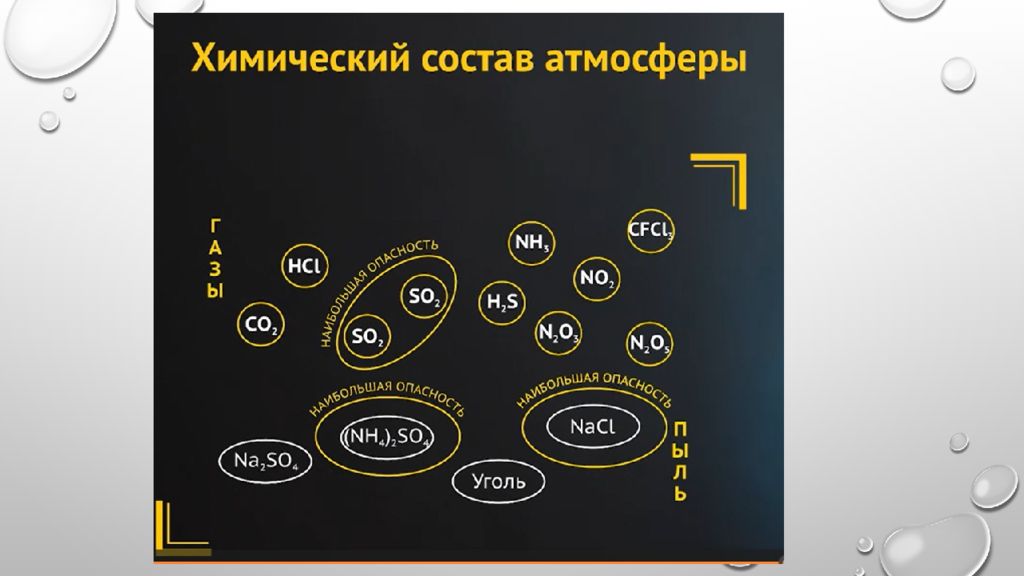
Коррозия металлов в природных средах Атмосферная коррозия металлов Атмосферная коррозия — это коррозия сооружений и оборудования, эксплуатирующихся в нормальной земной атмосфере.
Слайд 5
Основным стимулирующим фактором атмосферной коррозии является вода. При относительной влажности воздуха до 60 % следы влаги на поверхности металла отсутствуют. В этом случае коррозия протекает по химическому механизму. Образующиеся на поверхности оксидные пленки обладают защитными свойствами и тормозят развитие коррозионных разрушений.
Слайд 6
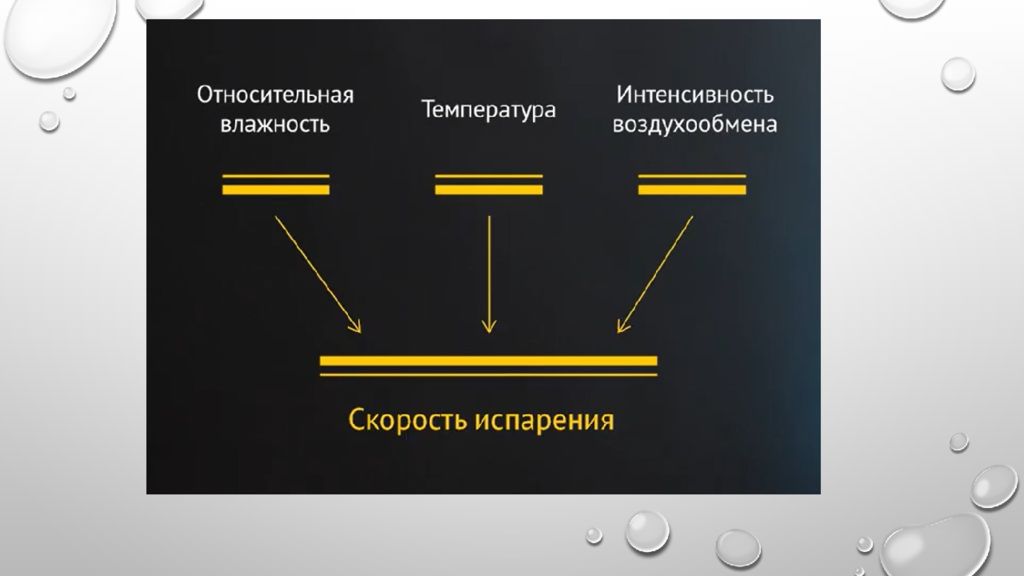
При относительной влажности воздуха, равной 60-70%, начинается конденсация влаги и на поверхности металла появляется адсорбционная пленка воды. Относительная влажность, при которой начинается конденсация влаги на поверхности металла, называется критической влажностью. Она зависит от состояния металла и от степени загрязнения воздуха.
Слайд 7
При образовании адсорбционного слоя влаги (толщиной порядка нескольких молекулярных слоев) на поверхности металла появляется электролит. В этих условиях реализуется электрохимический механизм и скорость коррозии значительно возрастает. Пленка влаги имеет небольшую толщину, кислород проникает через нее беспрепятственно и катодный процесс не затруднен.
Слайд 8
Критическую влажность снижают частицы адсорбированных загрязнителей, притягивающих влагу из воздуха (природные или антропогенные) Например сульфат аммония (уменьшают критическую влажность с 70 до 50%)или даже продукты коррозии
Слайд 9
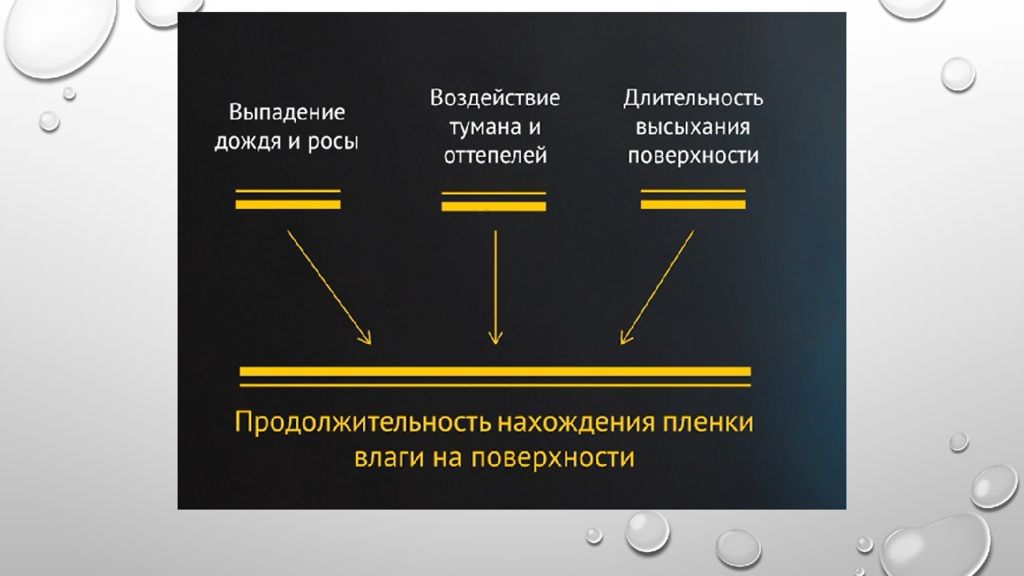
При относительной влажности, близкой к 100 %, или при непосредственном увлажнении металла (дождь, туман), на поверхности происходит образование видимых фазовых слоев воды.
Слайд 10
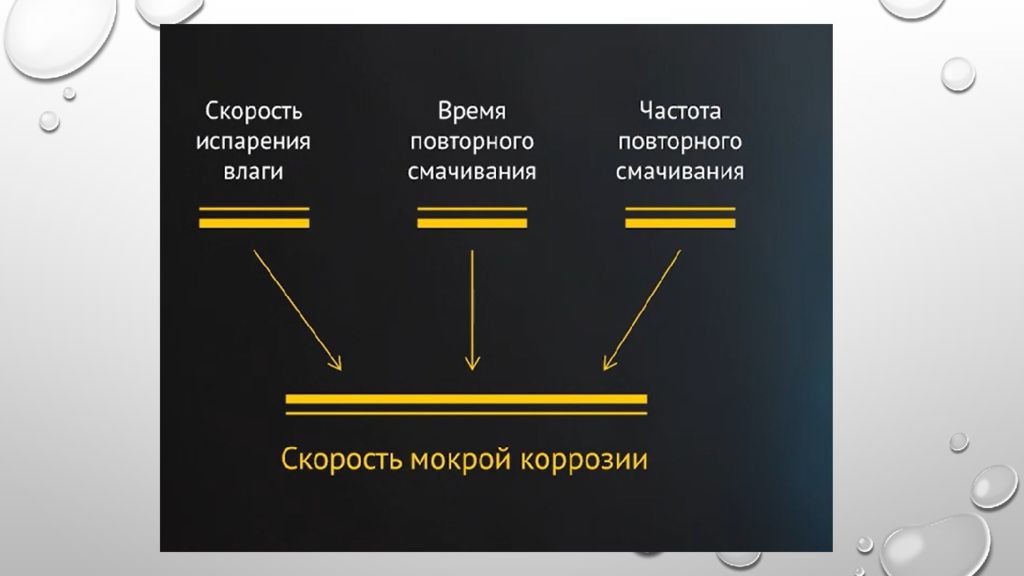
Процесс коррозии несколько затрудняется по сравнению с влажной коррозией. При образовании фазовых пленок в области мокрой коррозии затруднятся доставка кислорода и наблюдается катодное торможение процесса.
Слайд 17
Для изоляции металла от окружающей среды на него наносят различного рода покрытия: лаки, краски, металлические покрытия. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических. Последние по характеру защитного действия можно разделить на анодные и катодные
Слайд 18
Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом ( более активный ) , чем защищаемый, то оно называется анодным покрытием. Пример анодного покрытия может служить – хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент : А (–) Cr H 2 O, O 2 Fe (+) К на аноде: Cr – 2e → Cr 2+ на катоде: 2 H 2 O + O 2 + 4e → 4 OH – Cr 2+ + 2 OH – → Cr(OH) 2 Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH) 3 : 4 Cr(OH) 2 + 2H 2 O + O 2 → 4 Cr(OH) 3 Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Слайд 20
Неметаллические покрытия. Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум). Химические покрытия. В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся: оксидирование – получение устойчивых оксидных пленок (Al 2 O 3, ZnO и др.); фосфатирование – получение защитной пленки фосфатов (Fe 3 (PO 4 ) 2, Mn 3 (PO 4 ) 2 );
Слайд 21
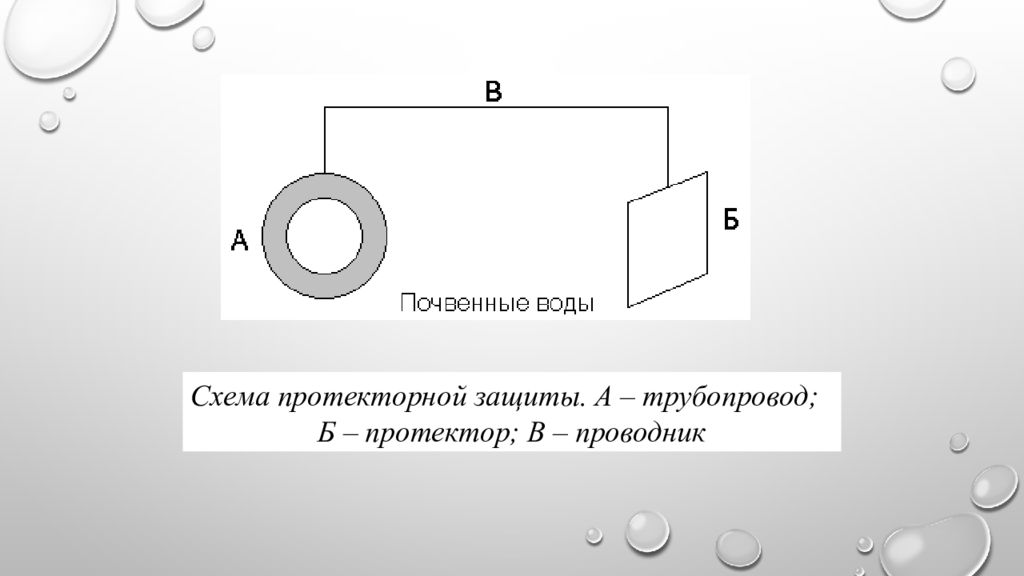
Протекторная защита. Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению
Слайд 22
Схема протекторной защиты. А – трубопровод; Б – протектор; В – проводник
Слайд 23
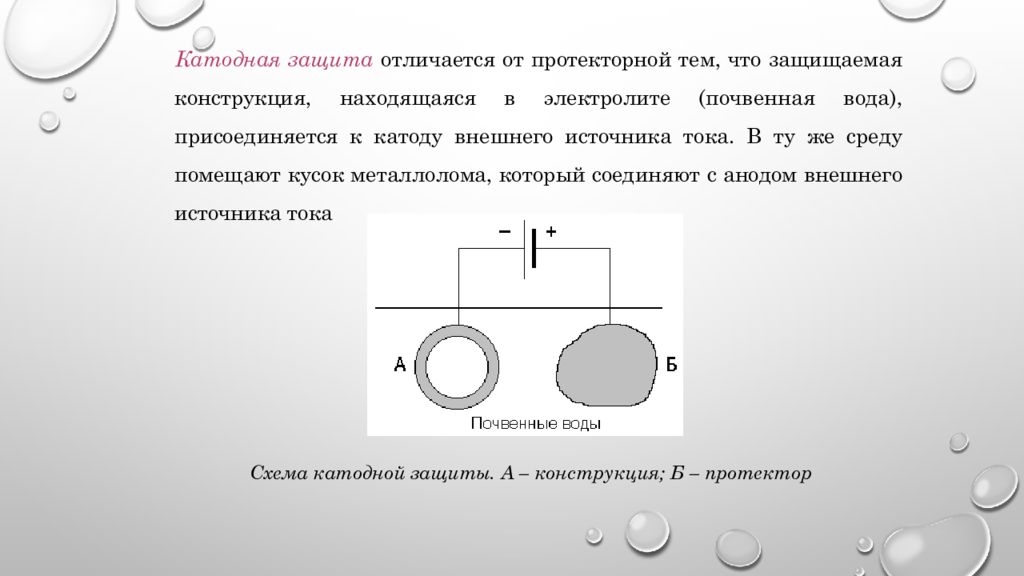
Катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают кусок металлолома, который соединяют с анодом внешнего источника тока Схема катодной защиты. А – конструкция; Б – протектор
Слайд 26
Ингибиторы коррозии- химические соединения или их композиции, присутствие которых в небольшом количестве в агрессивной среде замедляет коррозию металлов, например неорганические: NaNO3, K2CrO4, органические : уротропин, диэтиламин они адсорбируются на поверхности металлов, образуя тонкие пленки. Летучие (атмосферные ингибиторы) (серии ИФХАН); Ингибиторы применяются при химической очистке от накипи паровых котлов, снятиии окалины с обработанных изделий, при хранении и перевозке соляной кислоты в стальной таре.
Слайд 27
В качестве ингибиторов коррозии используют как органические, так и неорганические вещества различного химического состава. Различные ингибиторы действуют разными способами: либо, адсорбируясь на поверхности металла, влияют на электродные процессы локальных микроэлементов, тормозя их дальнейшее действие; либо же, вследствие своего окисляющего действия, образуют на поверхности металла плотную, хорошо защищающую его оксидную пленку Принцип действия значительного числа ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности и последующем торможении катодных или анодных процессов электрохимической коррозии.
Слайд 28
Летучие ингибиторы атмосферной коррозии самопроизвольно адсорбируются на поверхности изделия, находятся при нормальной температуре в летучем состоянии. Воздействуют на кинетику электродных реакций. К ним относятся соли слабых неорганических и органических кислот, аминов (бензоаты, нитриты, фосфаты, нитрофеноляты, нитробензоаты и др.) Летучие ингибиторы атмосферной коррозии адсорбируются на поверхности защищаемого металла тонким мономолекулярным слоем, происходит его взаимодействие с металлом.
Слайд 29
Анодные ингибиторы чаще всего используют в нейтральных средах при коррозии с кислородной деполяризацией. К таким ингибиторам относятся неорганические вещества‑окислители: хроматы, бихроматы, нитриты, молибдаты, вольфраматы щелочных металлов Ингибирующее действие фосфатов, полифосфатов, боратов, силикатов, солей бензойной кислоты проявляется только при наличии в электролите растворенного кислорода, который и играет роль пассиватора. Эти вещества способствуют адсорбции кислорода на поверхности металла,переводя его в пассивное состояние. Помимо этого, они тормозят анодный процесс растворения металла за счет образования труднорастворимых защитных пленок самого разнообразного характера.
Слайд 30
В зависимости от класса ингибирующего соединения оно может ускорять катодную реакцию (переводит поверхность металла в пассивное состояние), либо тормозить анодную и катодную. Действие ингибитора зависит от его строения и состава, механизма испарения, давления насыщенного пара, адсорбционных свойств поверхности, самого ингибитора, способности изменять кинетику процесса. Для защиты металлов от атмосферной коррозии во время перевозки, хранения и консервации очень часто используют ингибированную антикоррозионную бумагу. При производстве ингибированной бумаги, основным ее активным элементом является ингибирующее вещество.
Слайд 31
Антикоррозионные смазки В качестве таких смазок используются нефтяные масла, вазелин, воск. Нефтяные смазки относительно дешевы, не взаимодействуют с защищаемым металлом, достаточно стабильны при хранении и применении, их легко наносить, удалять, возобновлять. Применение таких смазок не требует тщатель ‑ ной подготовки поверхности защищаемого изделия Слой смазки, нанесенный на металлическую поверхность, препятствует проникновению воды и кислорода воздуха к металлу и тем самым затрудняет протекание коррозионных процессов. Консистентные смазки наносят только на сухую поверхность. Для усиления защитных свойств смазок в них дополнительно вводят ингибиторы коррозии. Консистентные ингибированные смазки применяют для консервации наружных поверхностей машин, станков и механизмов. Наряду с маслами в качестве защитных смазок используется воск