Слайд 2
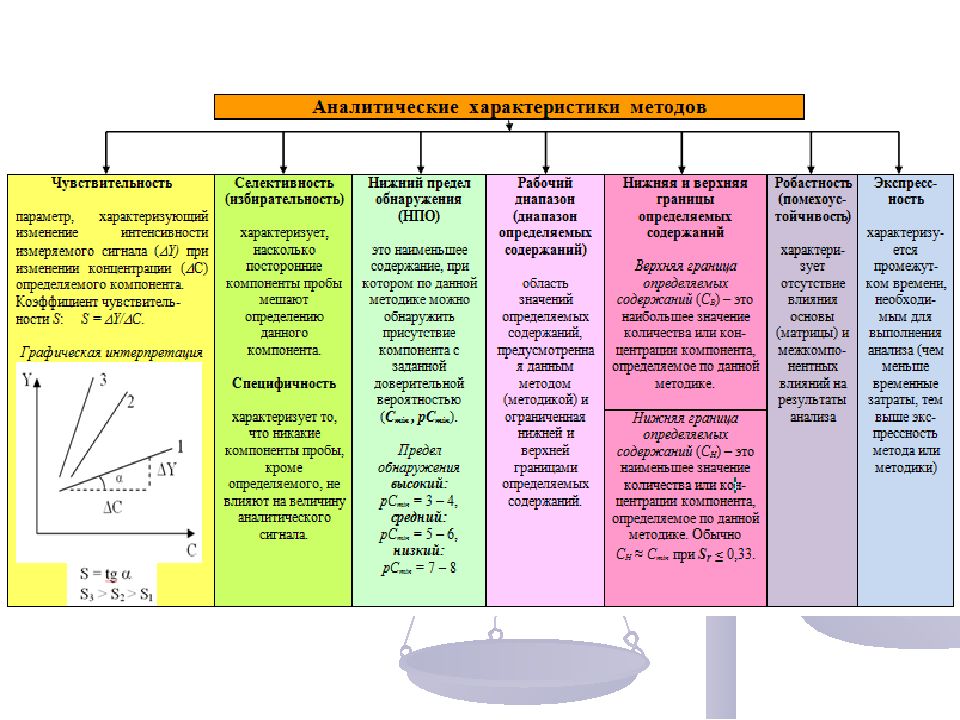
Статистическая обработка результатов анализа Для стандартизованного представления результата измерения необходимы следующие исходные данные: n – число измерений (число реализаций измерительной операции в соответствии с утвержденной методикой); Р – доверительная вероятность (вероятность включения в доверительный интервал результата наблюдения или включения достоверного значения параметра в этот интервал); Х i – результаты измерения; t n, P – коэффициент Стьюдента, зависящий от n и Р
Слайд 9
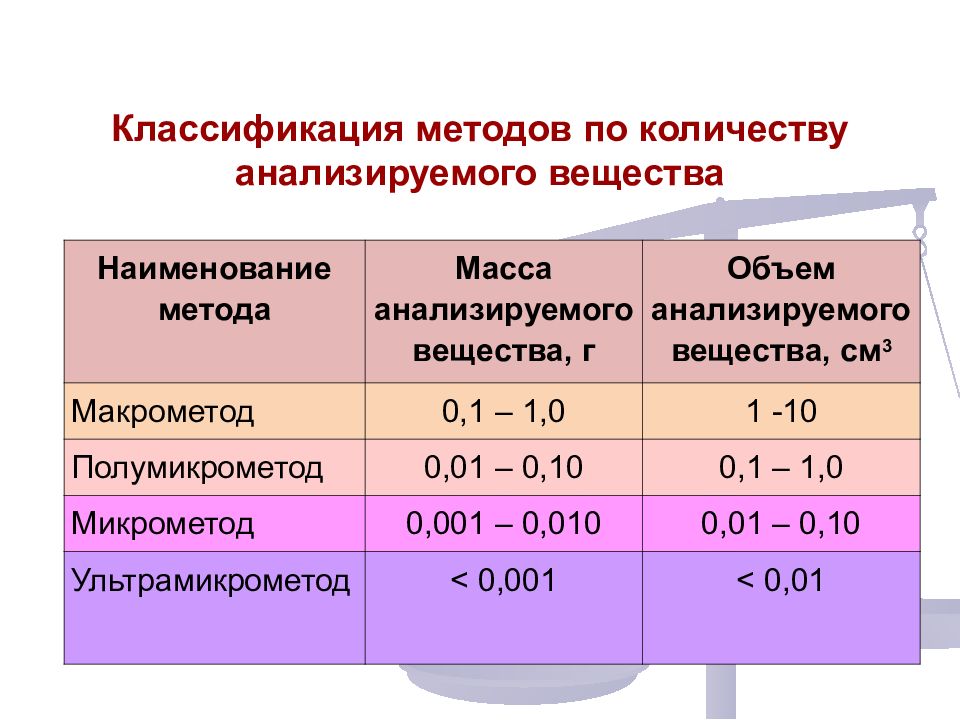
Классификация методов по количеству анализируемого вещества Наименование метода Масса анализируемого вещества, г Объем анализируемого вещества, см 3 Макрометод 0,1 – 1,0 1 -10 Полумикрометод 0,01 – 0,10 0,1 – 1,0 Микрометод 0,001 – 0,010 0,01 – 0,10 Ультрамикрометод < 0, 001 < 0, 01
Слайд 10
Диапазон концентраций (содержания) вещества в анализируемой пробе и общепринятый термин, характеризующий количество определяемого компонента, взаимосвязаны: а) если массовая доля анализируемого вещества составляет более 10%, то речь идет об определении (анализе) основного компонента ; б) если массовая доля анализируемого вещества составляет от 0,01% до 10 %, то говорят об определении примесей ; в) если массовая доля анализируемого вещества находится в интервале (10 -6 ÷ 10 -2 )%, то проводится анализ следовых количеств (определение следов вещества).
Слайд 11
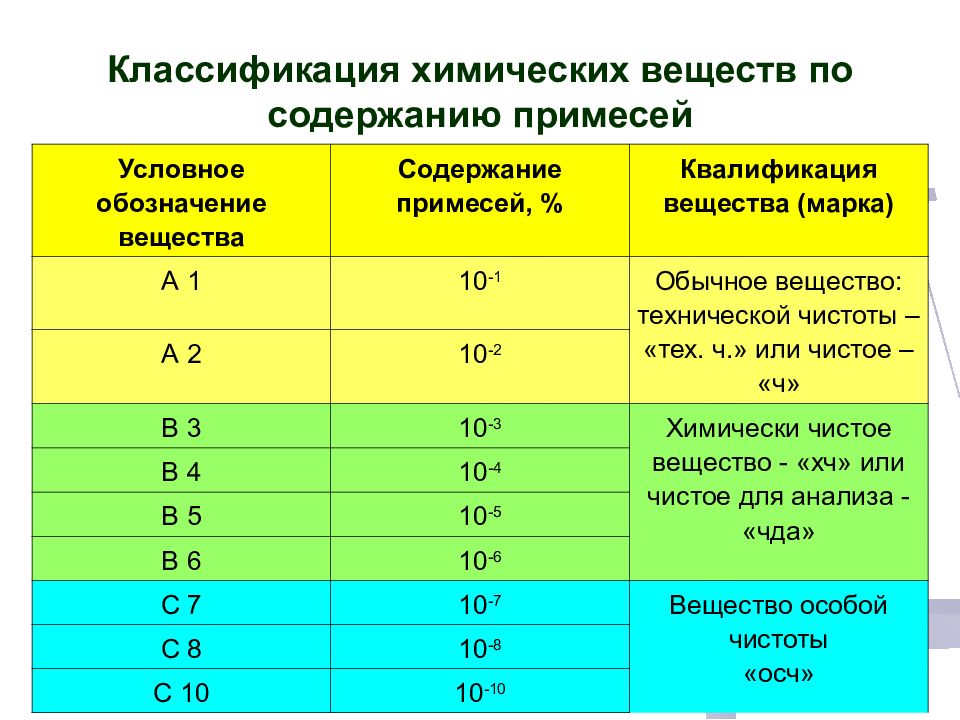
Классификация химических веществ по содержанию примесей Условное обозначение вещества Содержание примесей, % Квалификация вещества (марка) А 1 10 -1 Обычное вещество: технической чистоты – «тех. ч.» или чистое – «ч» А 2 10 -2 В 3 10 -3 Химически чистое вещество - «хч» или чистое для анализа - «чда» В 4 10 -4 В 5 10 -5 В 6 10 -6 С 7 10 -7 Вещество особой чистоты «осч» С 8 10 -8 С 10 10 -10
Слайд 13
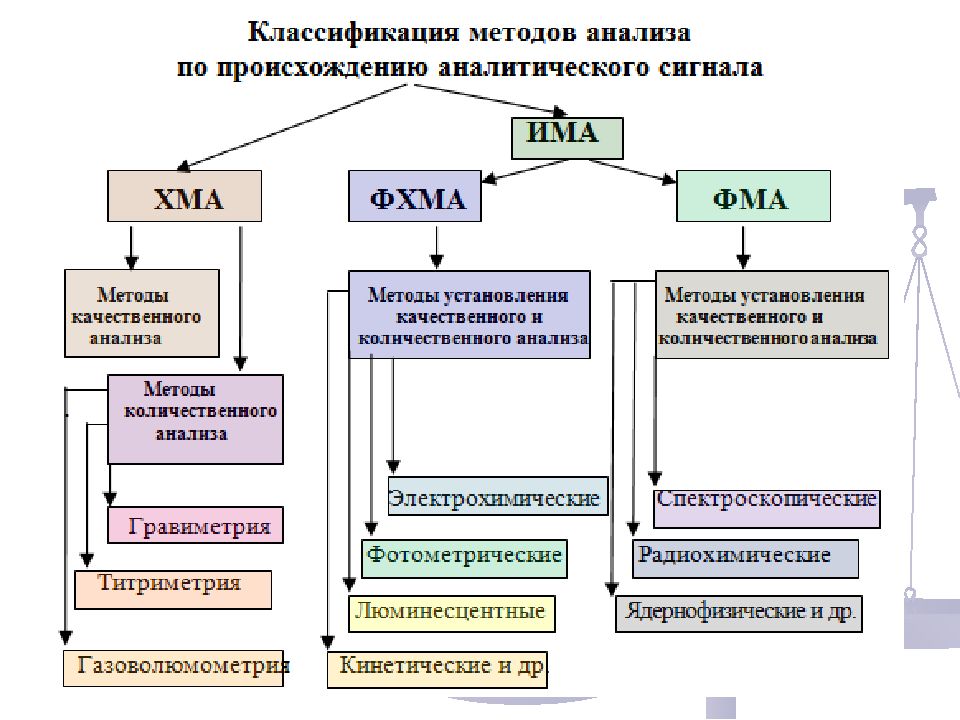
Достоинства и недостатки ХМА Основными достоинствами химических методов являются: простота выполнения анализа, отсутствие сложного аппаратурного оформления и достаточно высокая точность (0,10 – 0,01 %). К недостаткам химических методов следует отнести: большую продолжительность анализа (недостаточно высокую экспрессность) и сравнительно высокий предел обнаружения (10 -1 – 10 -2 %).
Слайд 14
Достоинства и недостатки ИМА ИМА обладают рядом преимуществ, это: высокая экспрессность; хорошая чувствительность; объективность результатов анализа; одновременное получение качественной и количественной информации; возможность автоматизации и использования компьютерной техники; возможность проведения неразрушающего и дистанционного анализа. В то же время ИМА обладают и недостатками, среди которых следует можно выделить: - необходимость использования стандартных образцов и эталонов для градуировки аналитического сигнала; - наличие достаточно трудоемкой стадии предварительной подготовки пробы, которая наиболее часто осуществляется с помощью химических методов разделения и концентрирования.
Слайд 15
КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ Химические методы анализа основаны на протекании химической реакции: Х + R → Р, где Х - определяемый компонент, R – реагент, Р - продукты реакции.
Слайд 16
Основные термины и определения Количество – величина, пропорциональная числу элементарных объектов. Единицей количества вещества является моль. Обозначают эту величину n (Х), где Х – химическая формула элементарного объекта. Моль - количество вещества, содержащее столько частиц, сколько их содержится в 12 г изотопа 12 С. Один моль любого вещества содержит 6,022∙10 23 частиц (N А, число Авогадро).
Слайд 17
Масса единицы количества вещества (1 моля) называется молярной массой обозначается через М( X ), обычно имеет размерность - г/моль или мг/ммоль и численно равна относительной молекулярной массе. Молярная масса определяется как отношение массы вещества m ( X ) к его количеству n ( X ) :
Слайд 18
В основе проведения всех количественных расчетов лежит принцип (закон) эквивалентности или эквивалентных соотношений, в соответствии с которым химические элементы и их соединения реагируют друг с другом в строго определенных массовых соотношениях в соответствии с их эквивалентами. В системе СИ под эквивалентом понимают некую реальную или условную частицу, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентной одному иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях).
Слайд 19
Обозначение химического эквивалента для некоторого вещества Х записывают в виде, называют фактором эквивалентности (число, показывающее, какая доля (часть) молекулы вещества эквивалентна одному протону или электрону). где z численно равно числу протонов или электронов, участвующих в реакции с веществом Х, а величину
Слайд 20
Закон эквивалентов или эквивалентных соотношений можно выразить в виде математического уравнения : Молярная масса эквивалента связана с молярной массой вещества соотношением
Слайд 21
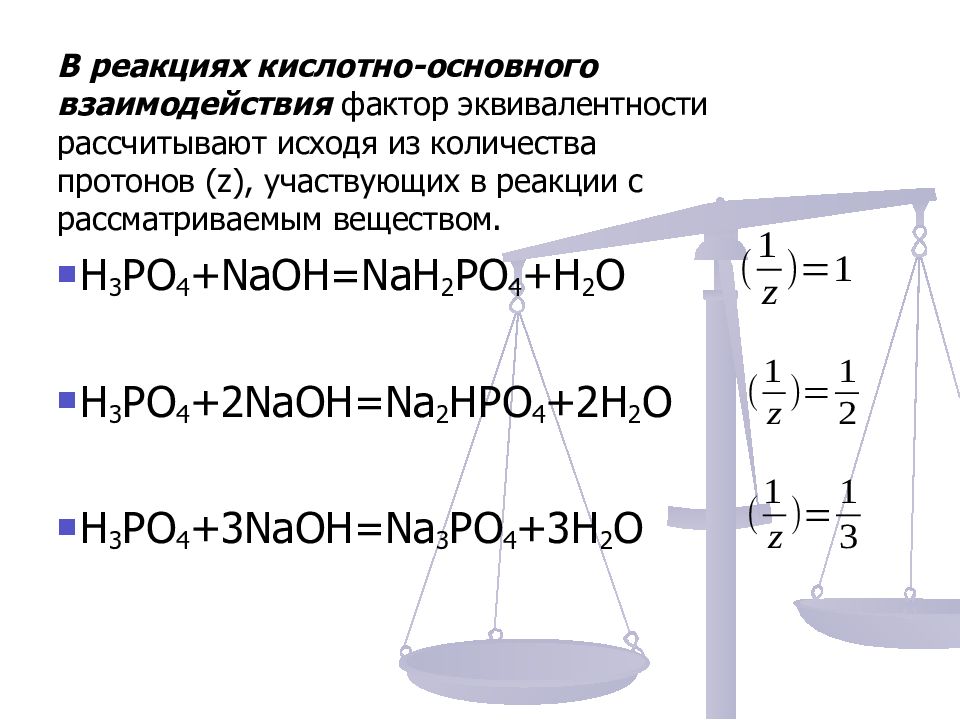
В реакциях кислотно-основного взаимодействия фактор эквивалентности рассчитывают исходя из количества протонов (z), участвующих в реакции с рассматриваемым веществом. H 3 РО 4 + NaOH = Na Н 2 РО 4 + H 2 O H 3 РО 4 +2 NaOH = Na 2 НРО 4 +2 H 2 O H 3 РО 4 +3 NaOH = Na 3 РО 4 +3 H 2 O
Слайд 22
Концентрация показывает, какое количество вещества находится в единице объема (в г/мл, мг/м 3, моль/л, ммоль/л и др.), если речь идет об анализе растворов или газов. Когда проводится анализ твердых объектов, то чаще используется массовая доля, которая показывает, сколько частей одного компонента приходится на сто (миллион, миллиард) частей анализируемого объекта. Понятие «концентрация» не надо путать с « содержанием» – количеством определяемого вещества в объекте в целом (например, массой какого-либо компонента в пробе, образце и т.д.).
Слайд 23
Способы выражения концентраций 1. Молярная концентрация С( X ) показывает количество растворенного вещества (моль) в единице объема раствора (литр) V ( X ) : 2. Молярная концентрация эквивалента (устаревшее – нормальная концентрация) показывает количество молей эквивалентов растворенного вещества в единице объема раствора (обычно, в 1 л раствора):
Последний слайд презентации: ЛЕКЦИЯ 2
3. Массовая концентрация или титр (по растворенному веществу) Т( X ) показывает, какая масса вещества содержится в единице объема раствора ( г/л, мг/мл, г/мл, мкг/мл ): Титр по определяемому веществу Т( R /Х) показывает, какая масса анализируемого вещества m (Х) реагирует с 1 мл рабочего раствора реагента R : 4. Массовая доля (Х) показывает отношение массы определяемого вещества в смеси к общей массе смеси: Наиболее часто массовую долю выражают в процентах (%), ( % показывает число частей определяемого компонента, приходящихся на сто частей объекта). При оценке очень малых концентраций удобно использовать промилле (‰) – число частей компонента на тысячу, ppm – число частей на миллион или рр b – на миллиард частей объекта. Указанные единицы получают в результате умножения значения долей на соответствующие коэффициенты: % – на 100, ‰ – на 10 3, ppm – на 10 6, ppb – на 10 9.