Первый слайд презентации: ЛЕКЦИЯ 4 Классификация и механизмы органических реакций
Слайд 2
План 4.1. Классификация органических реакций 4.2. Классификация реагентов 4.3.Реакции радикального заме - щения ( S R ) 4.4 Реакции электрофильного при - соединения ( А Е )
Слайд 3: 4.1 Классификация органических реакций
по направлению Реакции замещения S Реакции присоединения A Реакции элиминирования E Молекулярные перегруппировки по молекулярности Мономолекулярные Бимолекулярные Тримолекулярные
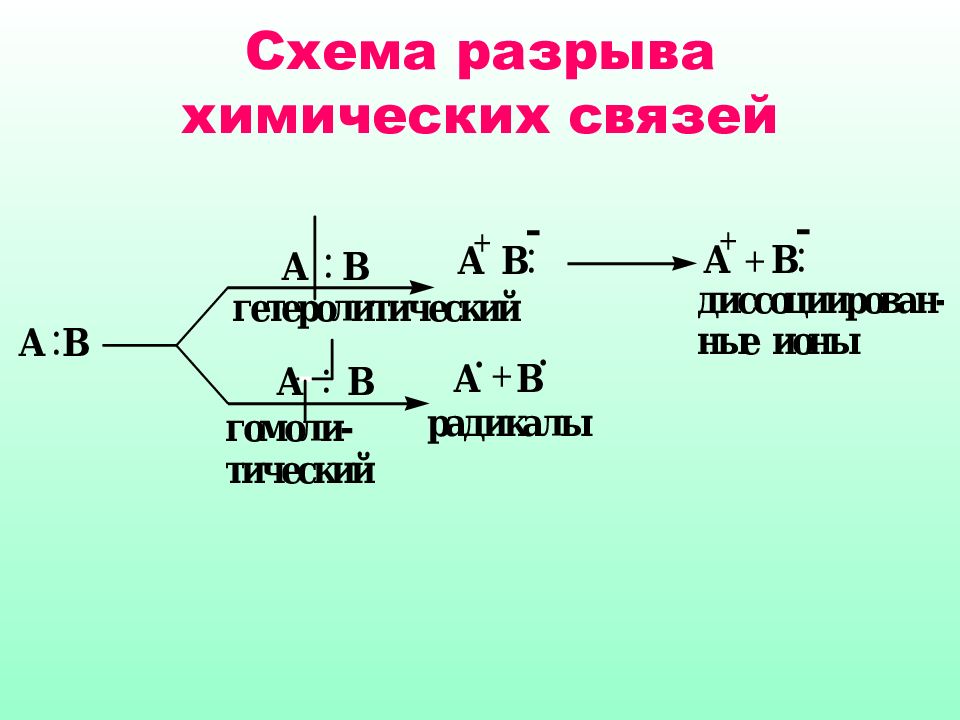
Слайд 4: По способу разрыва и образования связей
Гетеролитические (ионные) * электрофильные * нуклеофильные Гомолитические (радикальные) Молекулярные По способу разрыва и образования связей
Слайд 7
Гетеролитические реакции называют ионными, поскольку они сопровождаются образованием органических ионов, протекают в органических растворителях Гомолитические реакции протекают преимущественно в газовой фазе
Слайд 8
Гетеролитические реакции в зависимости от электронной природы атакующей частицы делят на нуклеофильные (символ N ) и электрофильные (символ Е ). При этом условно принято считать одну из взаимодействующих частиц реагентом, а другую субстратом, на которую действует реагент
Слайд 9
Субстрат – молекула, которая поставляет атом углерода для образования новой связи Тип реакции ( нуклеофильный или электрофильный ) опре - деляется характером реагента
Слайд 10
Реагент с неподеленной электронной парой, взаимодействующий с субстратом, имеющим недостаток электронов, называют «нуклеофильным» (любящим, ищущим ядро), а реакции нуклеофильными
Слайд 11
Реагент с электронным де - фицитом, взаимодействующий с субстратом, обладающим из - бытком электронов, называют «электрофильным», а реакцию электрофильной
Слайд 12
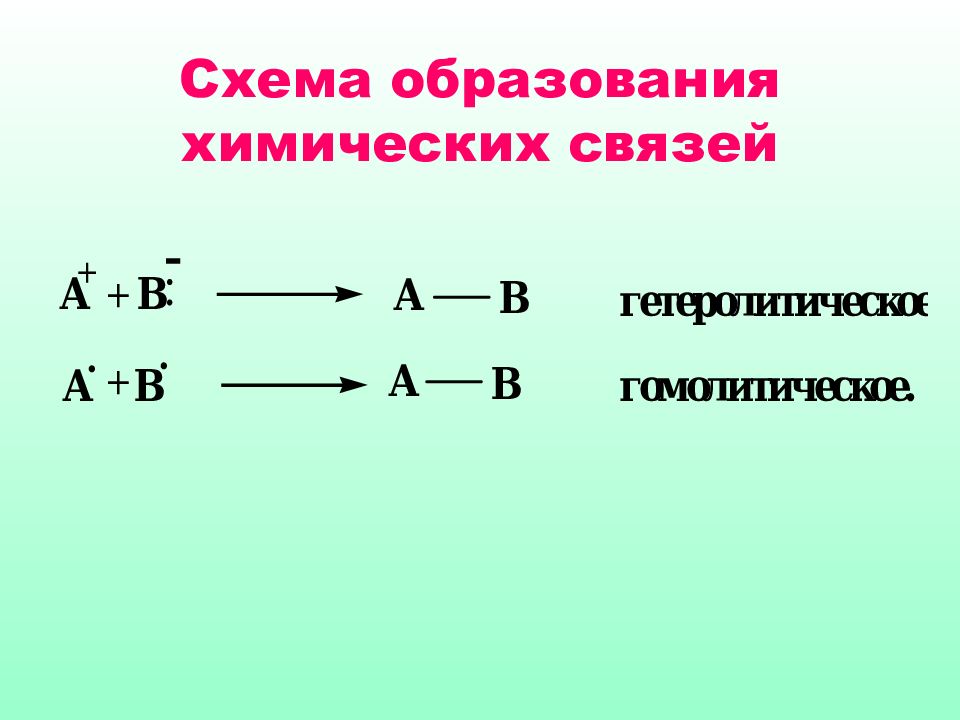
Нуклеофильные и электрофильные реакции всегда связаны между собой Р еакци и, сопровождаю щиеся одновременным (согласованным) разрывом и образованием связей, называют молекулярными (синхронными, согласованными )
Слайд 14: 4.2. Классификация реагентов
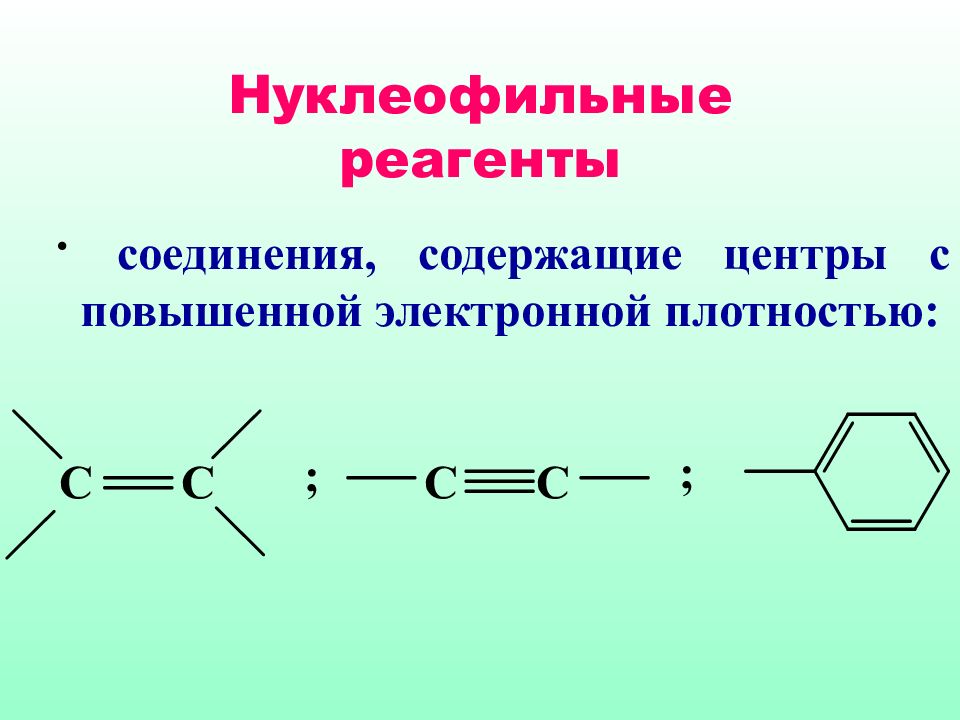
К нуклеофильным реагентам относят молекулы, содержащие одну или более неподеленных пар электронов; ионы, несущие отрицательный заряд (анионы); молекулы, имеющие центры с повышенной плотностью
Слайд 15: Нуклеофильные реагенты
нейтральные молекулы, имеющие неподеленные пары электронов : анионы: OH — ; CN — ; NH 2 — ; RCOO — ; RS — ; Cl — ; Br — ; I — ; HSO 3 — ;
Слайд 16: Нуклеофильные реагенты
соединения, содержащие центры с повышенной электронной плотностью:
Слайд 17: Электрофильные реагенты
нейтральные молекулы, имеющие вакантную орбиталь: SO 3, кислоты Льюиса ( AlCl 3, SnCl 4, FeBr 3, BF 3 ) катионы: протон (Н + ), ионы металлов (Ме n+ ), SO 3 H +, NO 2 +, NO +
Слайд 18
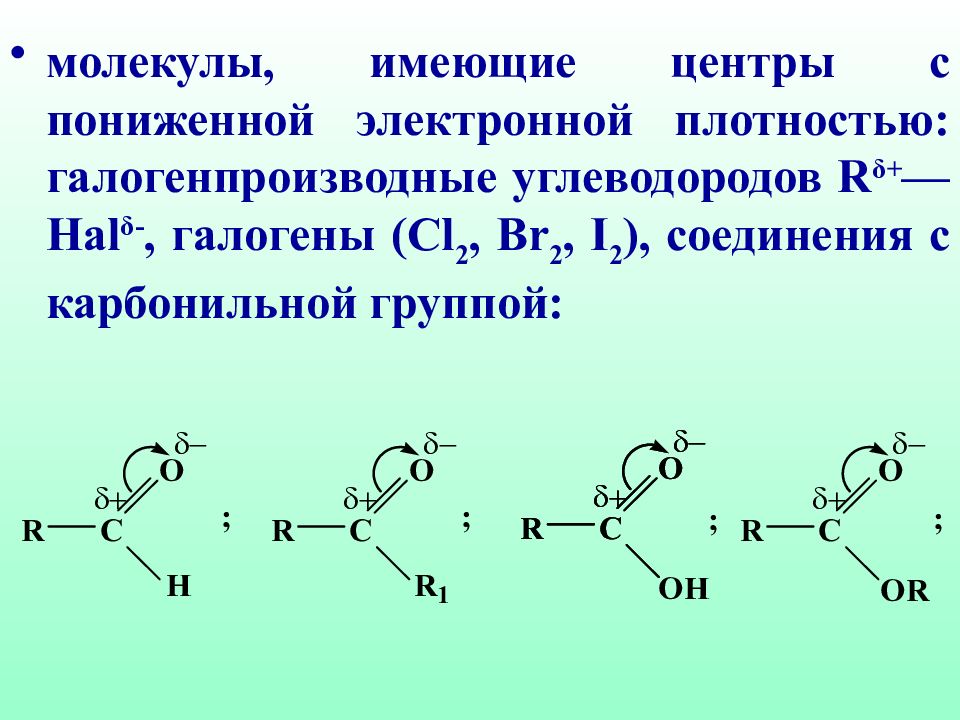
молекулы, имеющие центры с пониженной электронной плотностью: галогенпроизводные углеводо родов R δ+ — Hal δ -, галогены (Cl 2, Br 2, I 2 ), соединения с карбонильной группой:
Слайд 19
В органической химии реакции, как правило протекают в несколько стадий, т.е. с образованием промежуточных, короткоживущих частиц (интермедиаты) : карбкатионы, карбанионы, радикалы
Слайд 20
Карбкатионы – положительно заряженные частицы, атом углерода, несущий положительный заряд находится в s р 2 – гибридизации. Атом углерода с приобретением положительного заряда изменяет свое валентное состояние от s р 3 до s р 2, что энергетически более выгодно.
Слайд 21
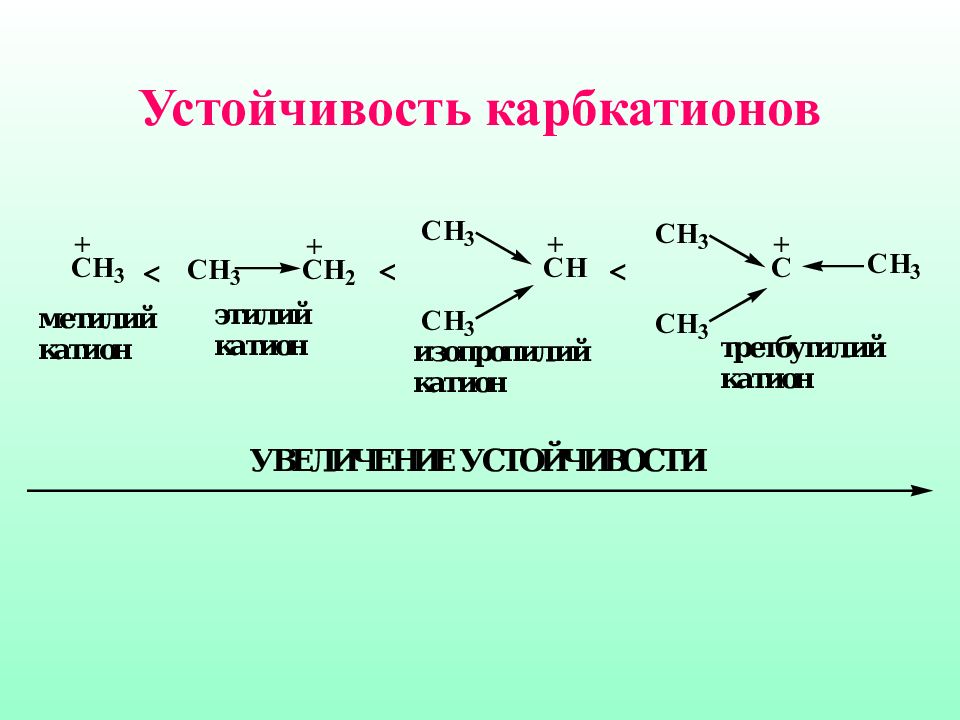
Важной характеристикой карбкатионов является их устойчивость, которая определяется степенью делокализации положительного заряда
Слайд 24
Карбанионы – отрицательно заряженные частицы, заряд которых обусловлен наличием в их структуре атома С с неподеленной электронной парой. При этом атом углерода, несущий отрицательный заряд, может быть как в sp 2, так и в s р 3 -гибридизации
Слайд 25
Устойчивость карбанионов зависит от степени делокализации отрицательного заряда на атоме углерода. Чем она выше, тем выше их устойчивость и тем ниже их реакционная способность. Наиболее устойчивы циклические карбанионы, в структуре которых имеется общая π-электронная плотность, включающая в себя 4 n +2 π-электрона
Слайд 27
Свободные радикалы – любая электронейтральная активная частица, содержащая одноэлектронную орбиталь. К свободным радикалам могут быть отнесены частицы, содержащие неспаренный электрон не только на атоме углерода (С·), но и на других атомах: R 2 N · ; R О ·
Слайд 28: 4.3. Реакции радикального замещения ( S R )
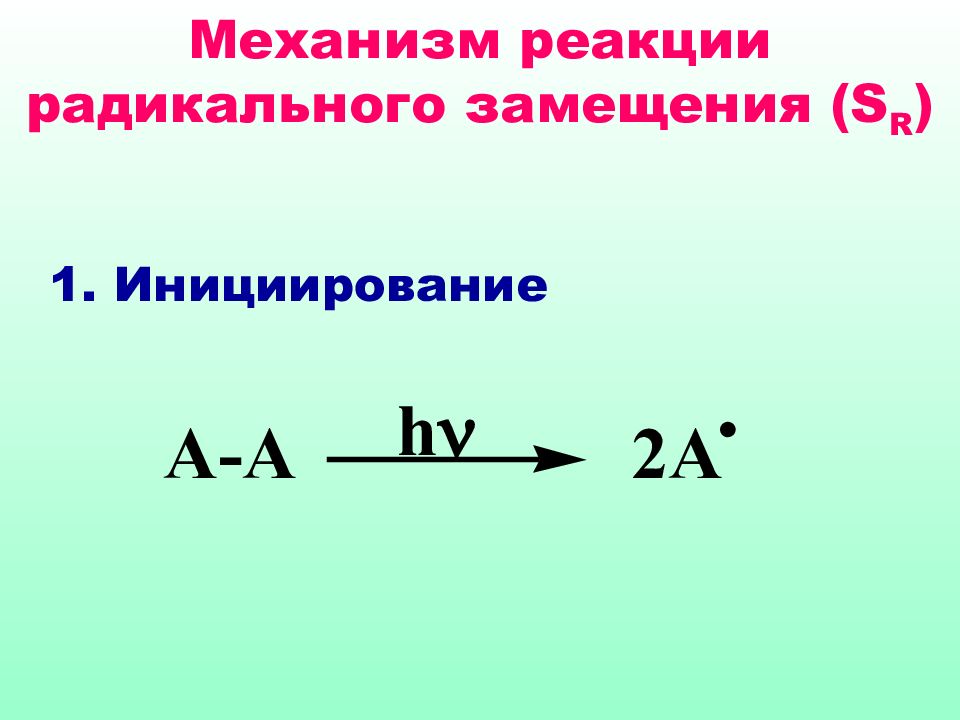
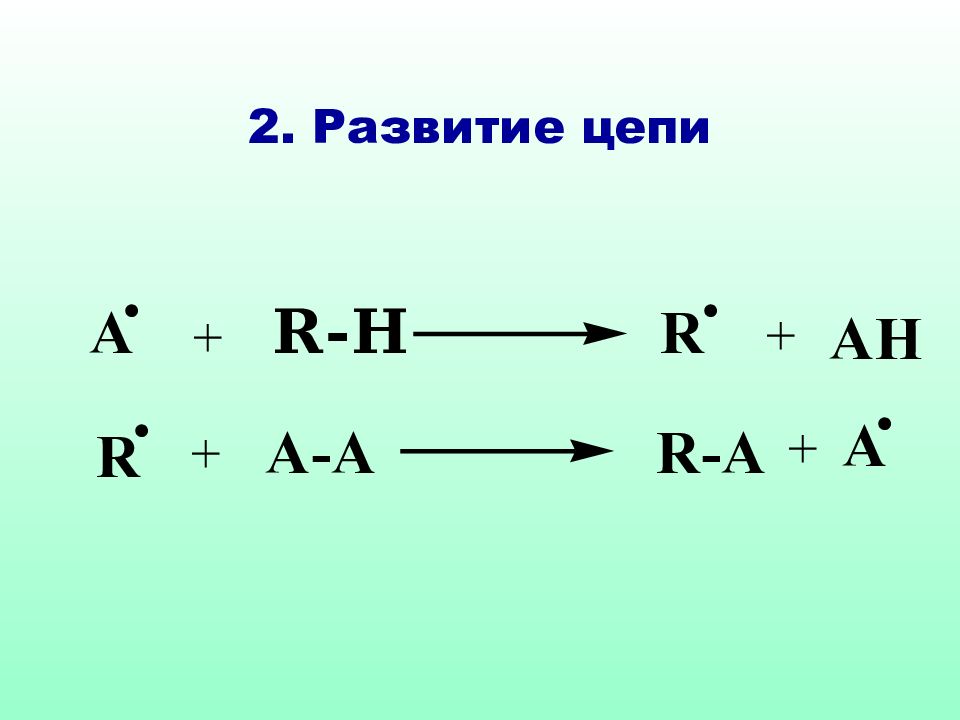
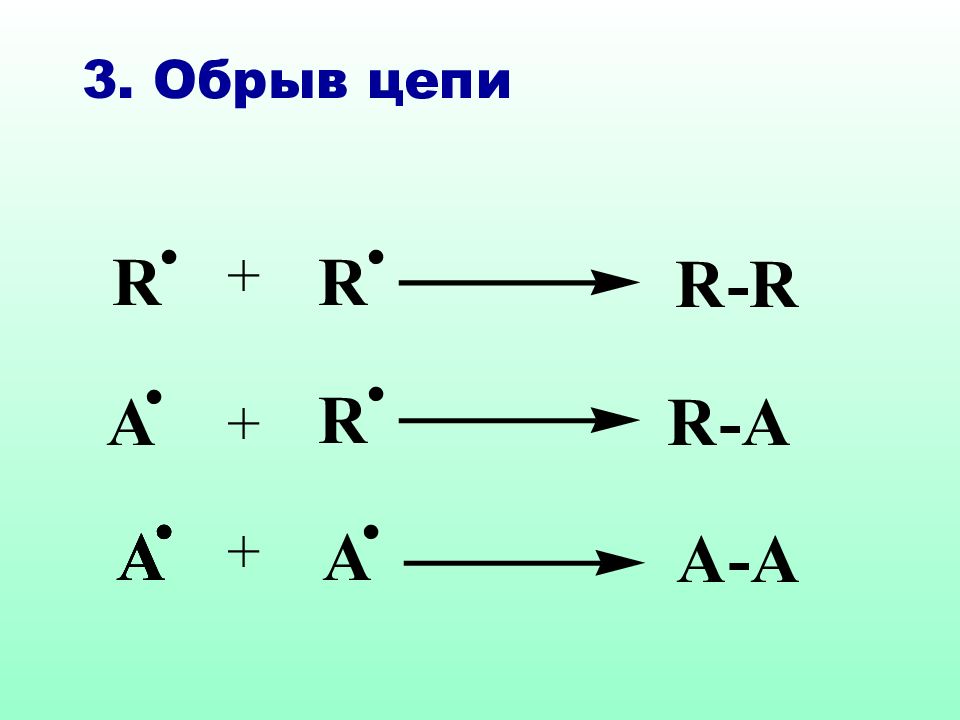
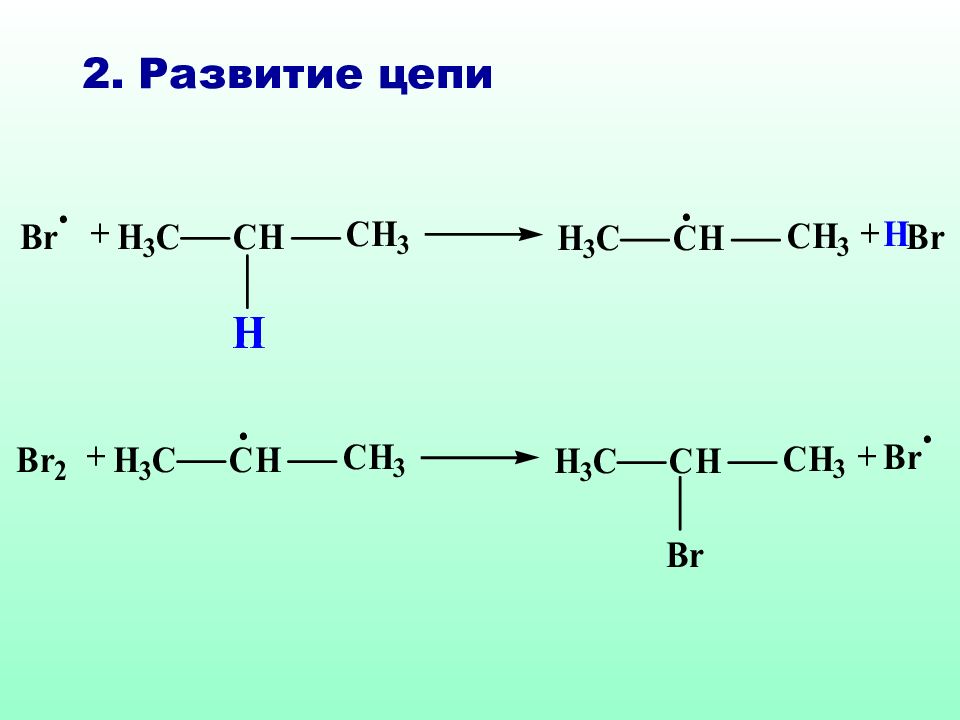
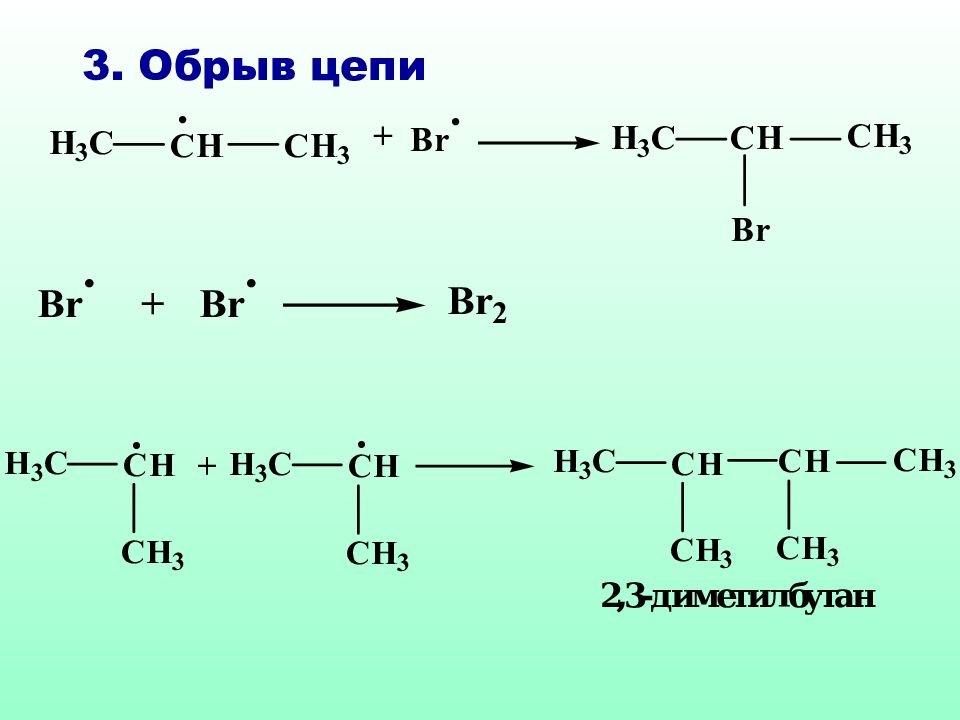
Реакции S R характерны для соединений алифатического и а ли циклического рядов. Как правило, они протекают по цепному механизму, основными стадиями которого являются : инициирование, развитие (рост цепи) и обрыв цепи.
Слайд 29
На стадии инициирования образуются свободные радикалы, дающие начало цепному процессу Свободные радикалы могут возникать за счет термического или фотохимического инициирования, а также в результате ОВ реакций
Слайд 35
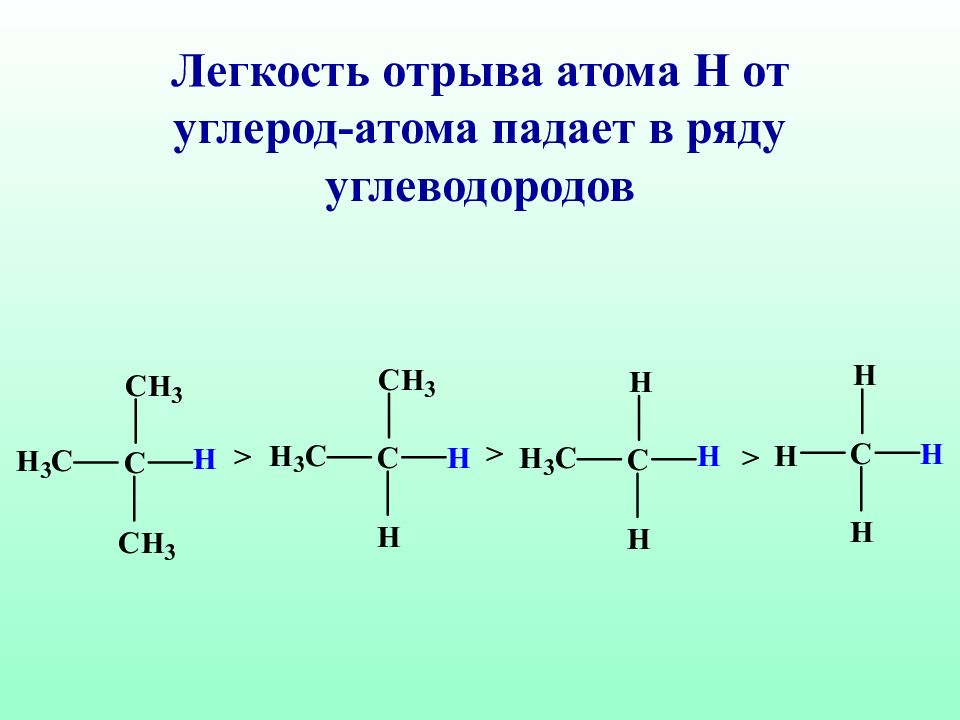
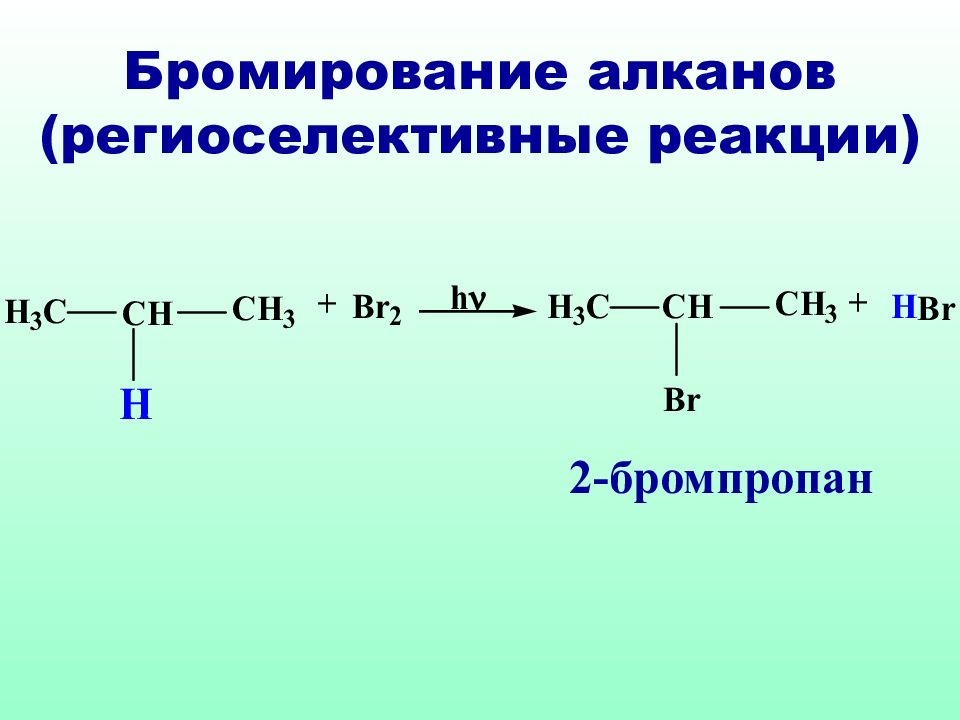
Р адикалы брома (В r˙) облада ю т высокой избирательностью: если в молекуле имеются вторичный, а тем более третичный атом углерода, то бромирование преимущественно идет у третичного (вторичного) атома углерода. Такие реакции называются региоселективными (избирательными по месту действия) реакциями
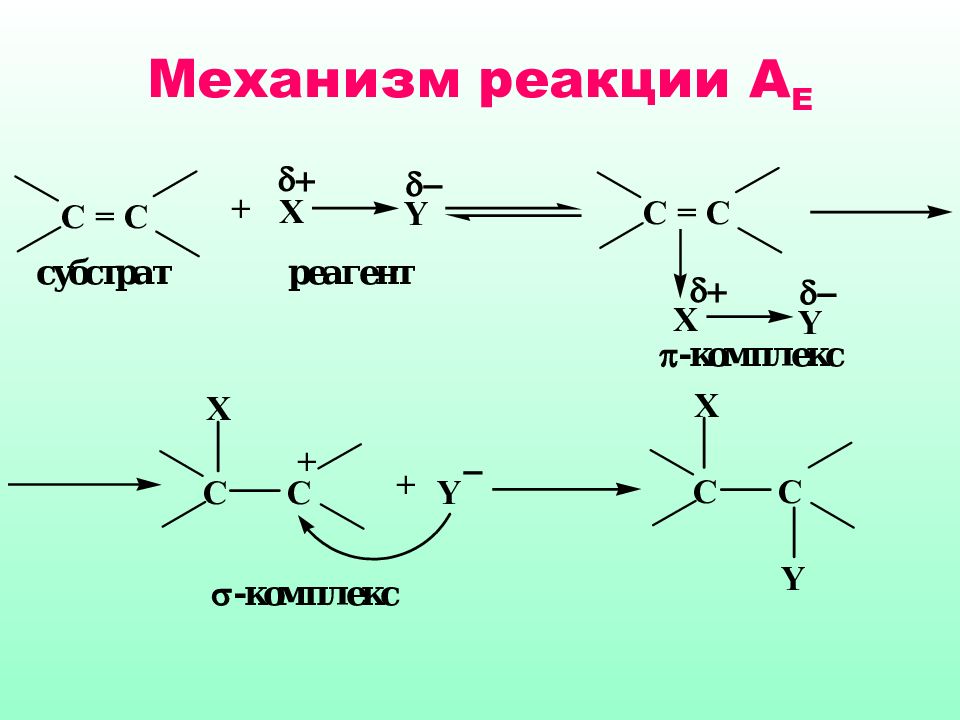
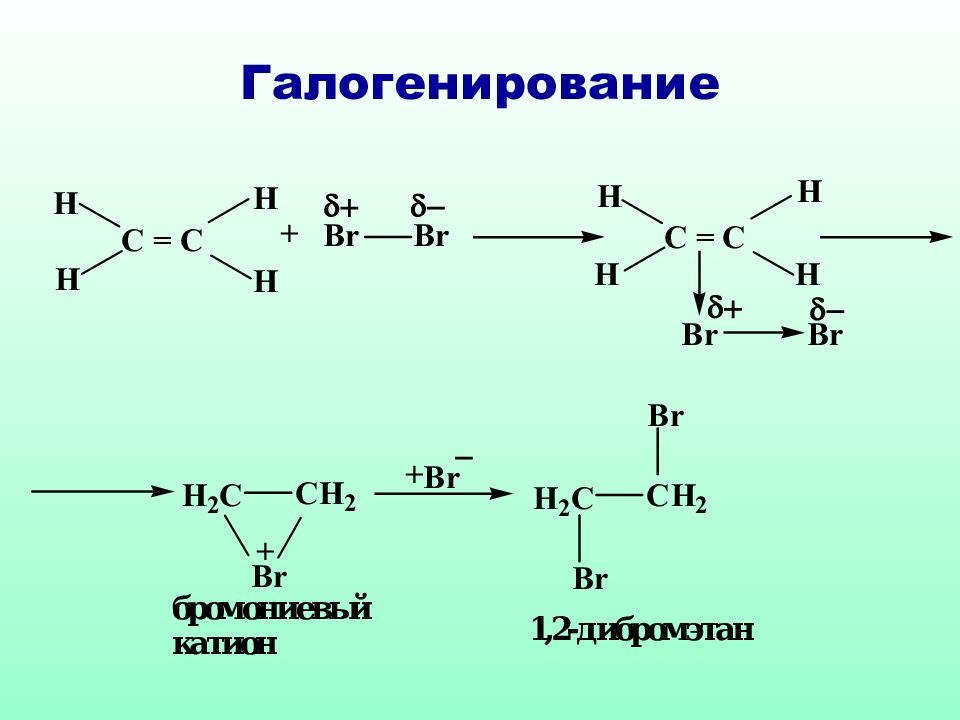
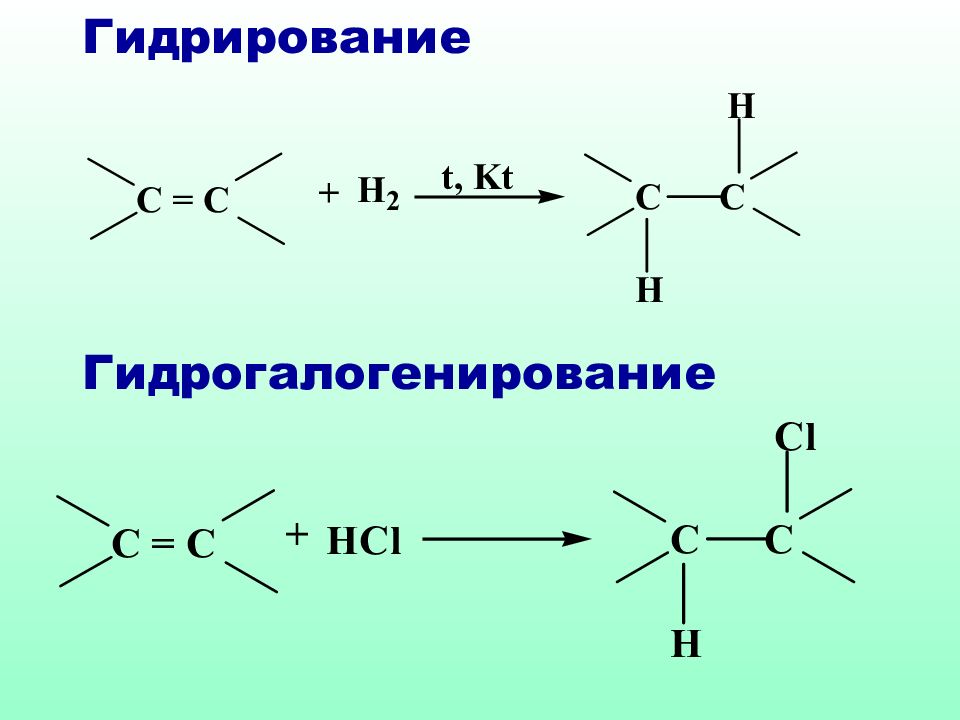
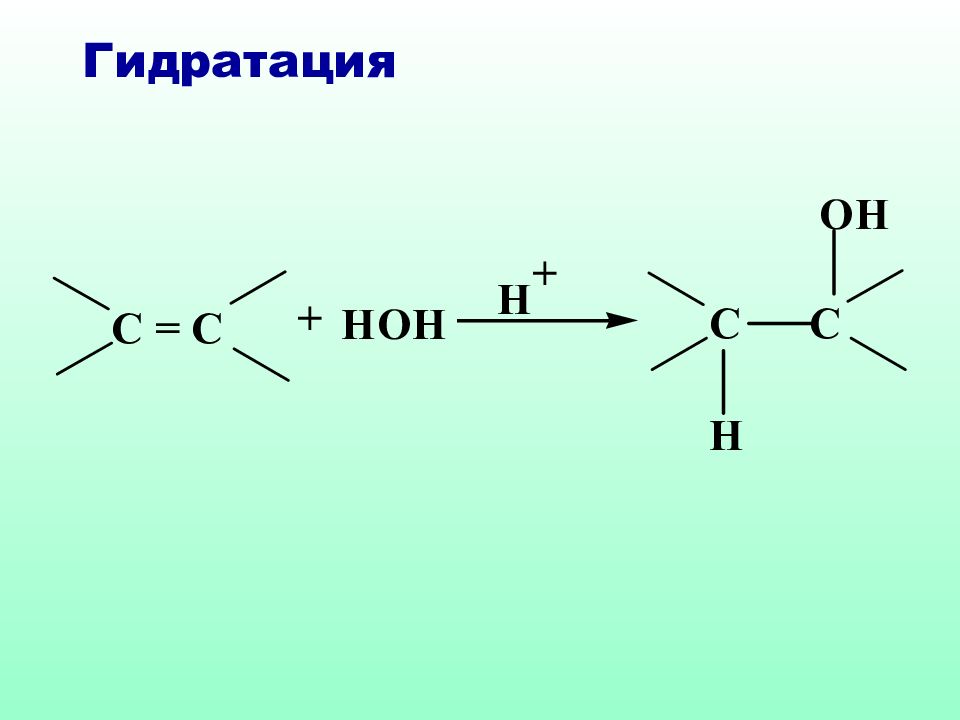
Слайд 40: 4.4. Реакции электрофильного присоединения
Электрофильное присоединение ( А Е ) характерно для ненасыщенных систем, содержащих двойные или тройные связи. Нуклеофильный характер таких соединений обусловлен наличием π-связи, которая представляет собой область с повышенной электронной плотностью, обладает поляризуемостью и легко разрывается под действием электрофильных реагентов
Слайд 45
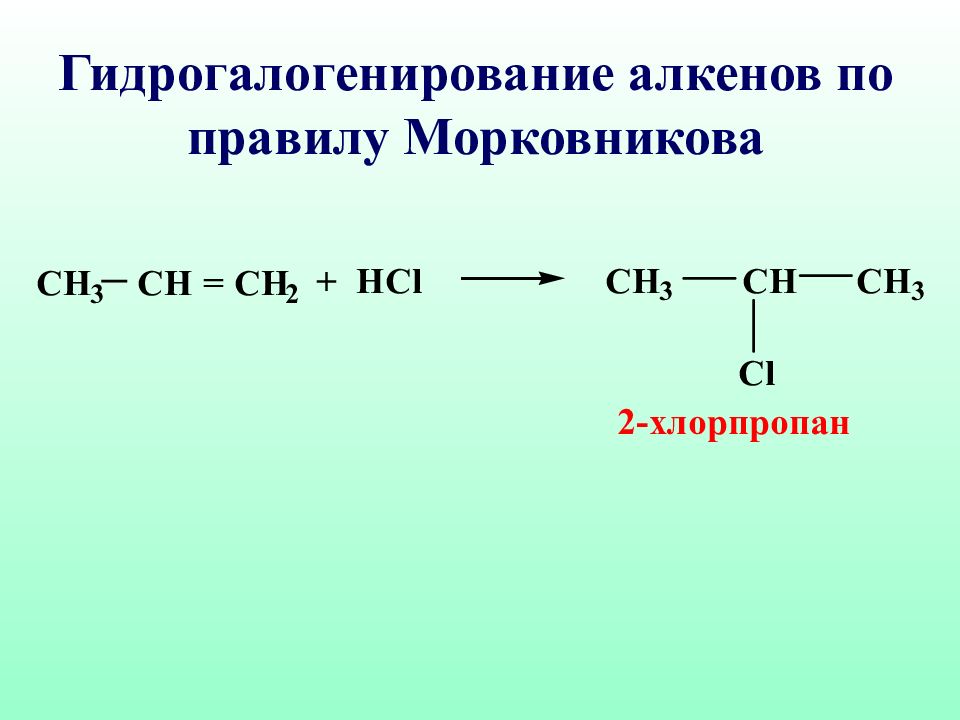
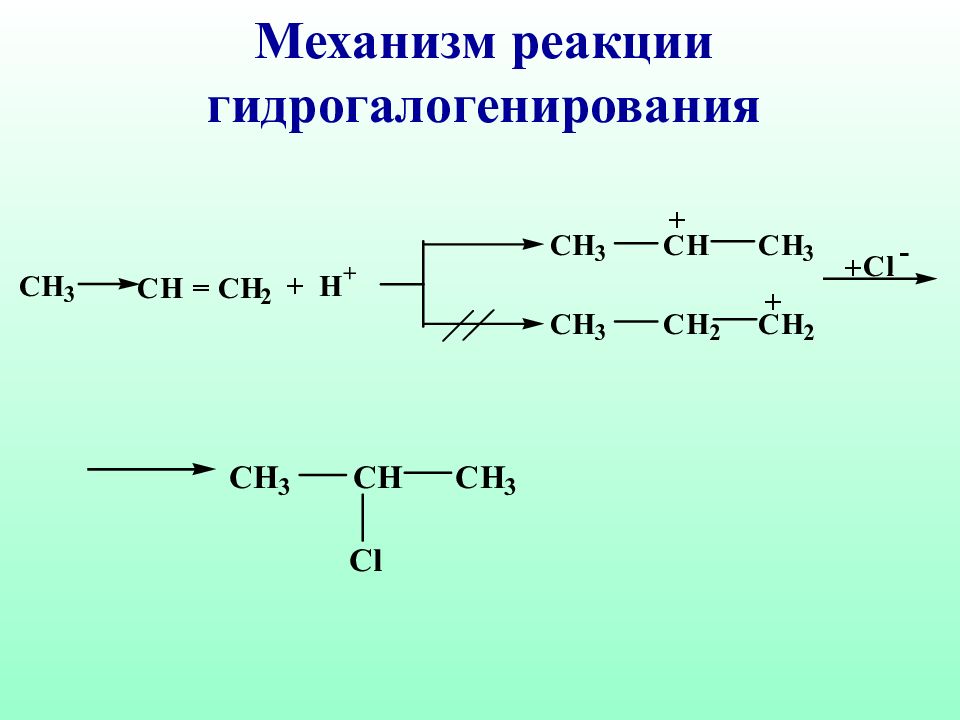
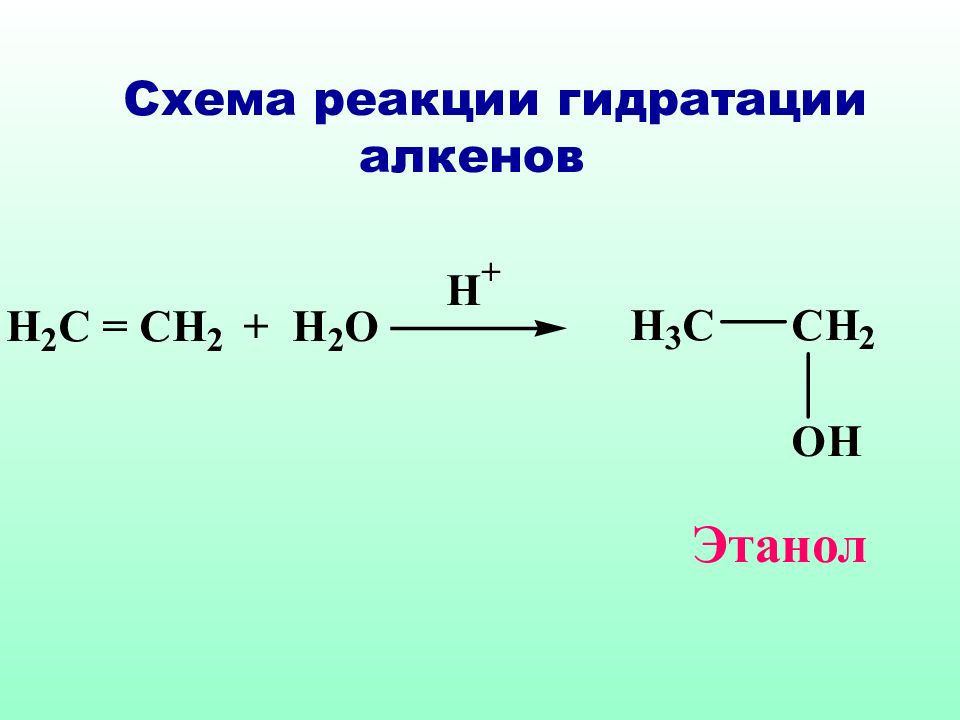
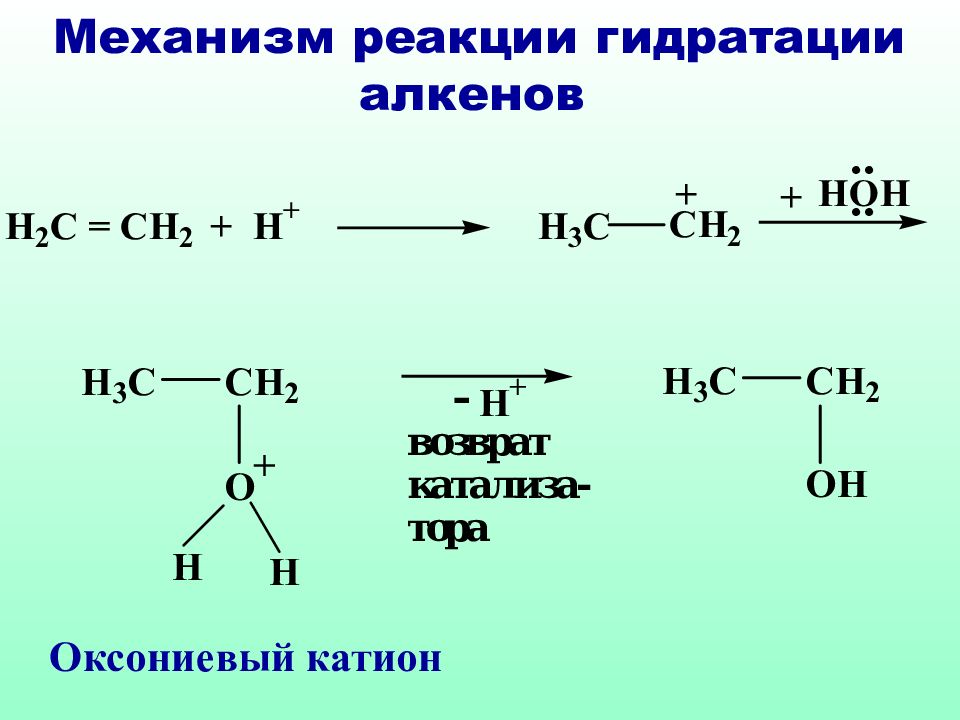
Правило Марковникова : при взаимодействии реагентов типа НХ с несимметричными алкенами, водород присоединяется к наиболее гидрогенизированному атому углерода Владимир Марковников ( 1837 – 1904 )
Слайд 50
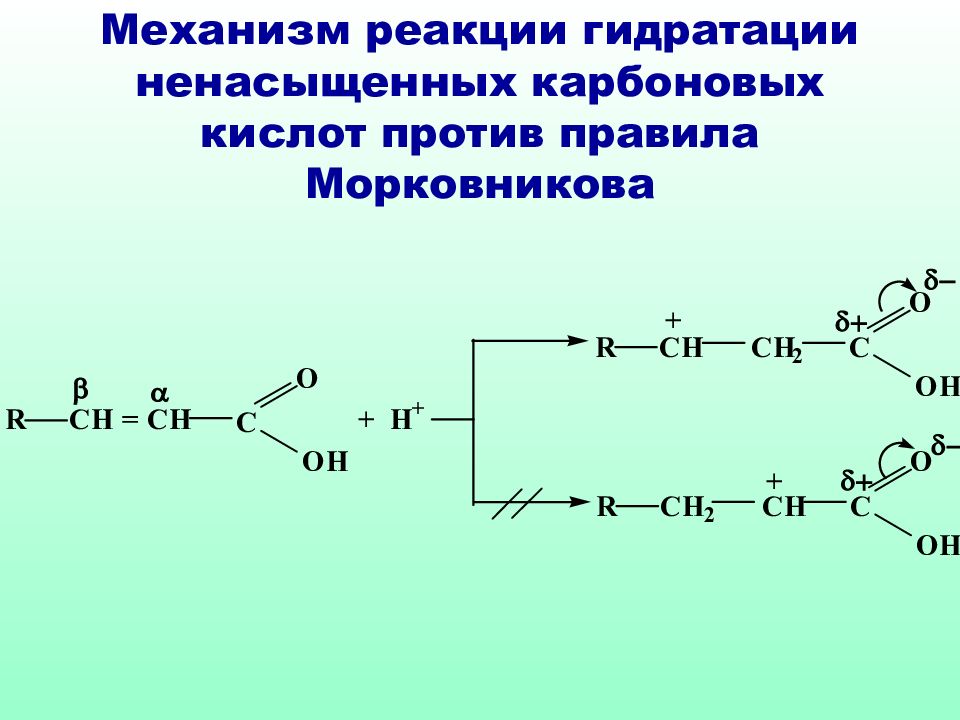
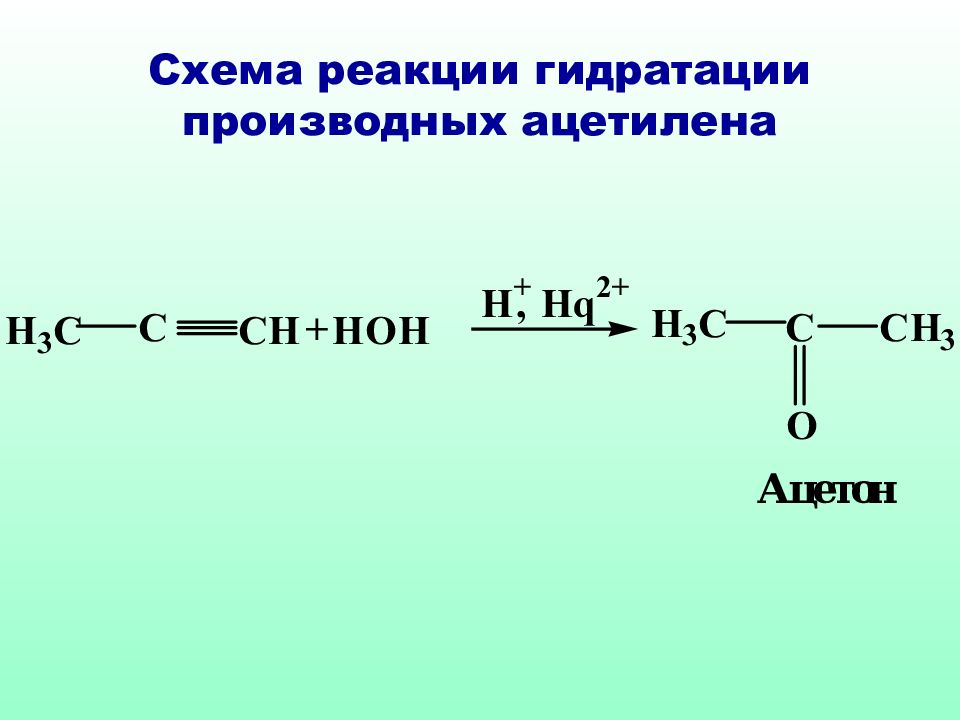
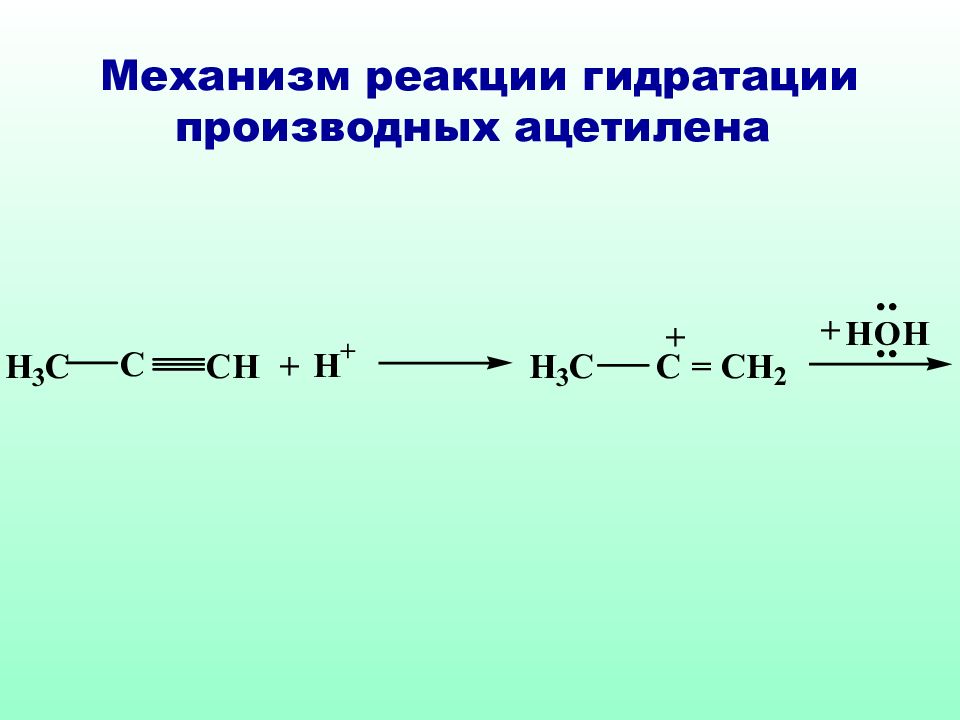
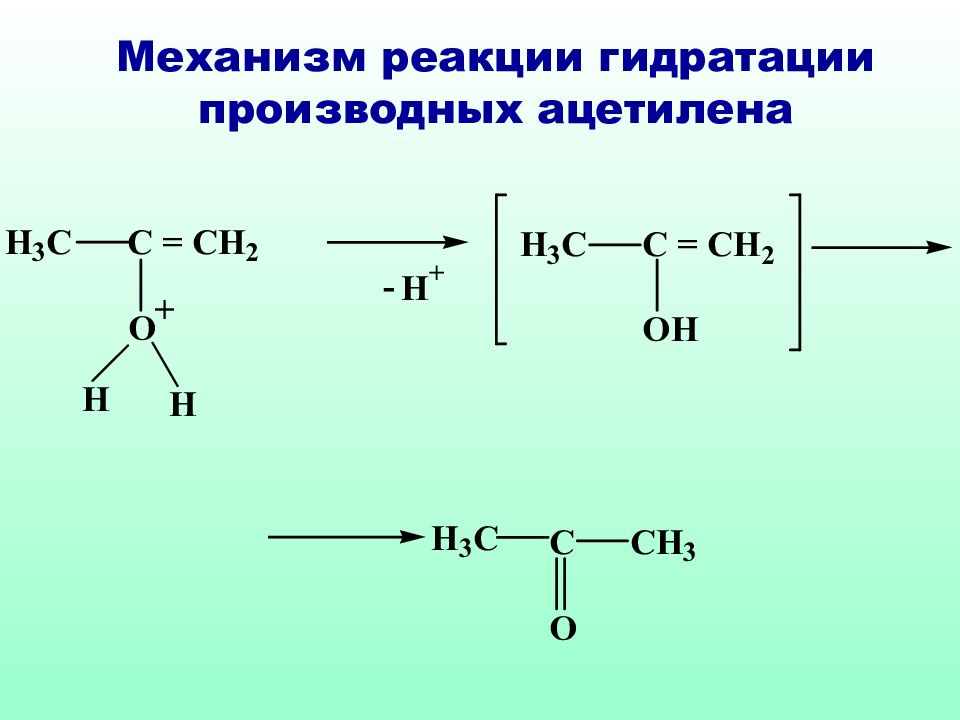
Классическое правило Марковникова идеально применимо только к самим алкенам, в случае их производных необходимо учитывать и механизм реакции и устойчивость образующихся интермедиатов
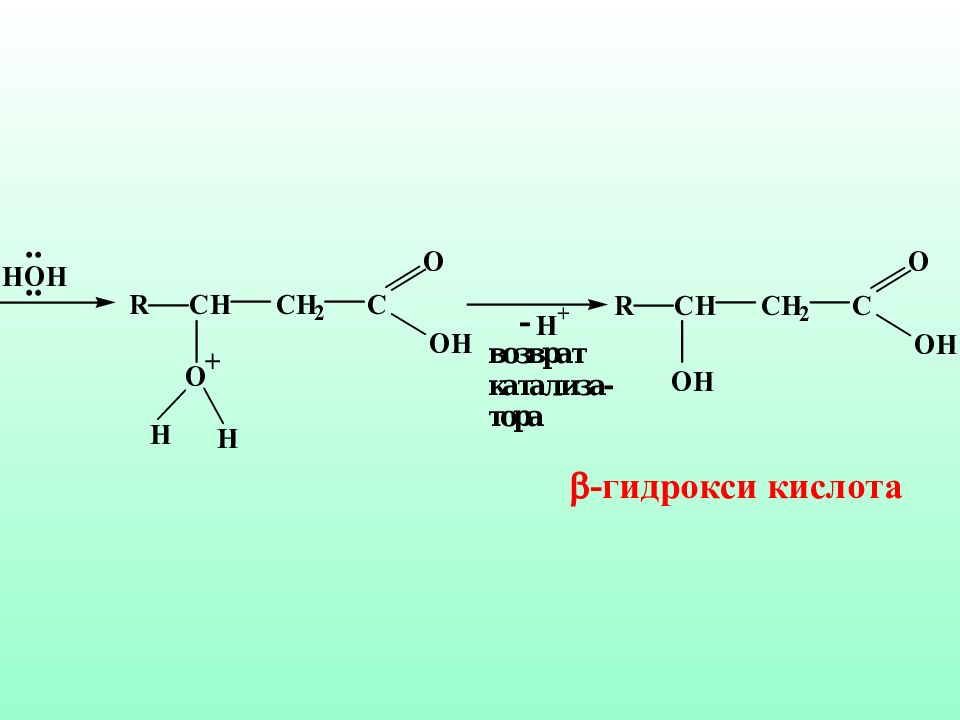
Слайд 51: Механизм реакции гидратации ненасыщенных карбоновых кислот против правила Морковникова
Слайд 53
Такого типа гидратация in vivo является частью процесса β-окисления ненасыщенных жирных кислот в организме
Слайд 54
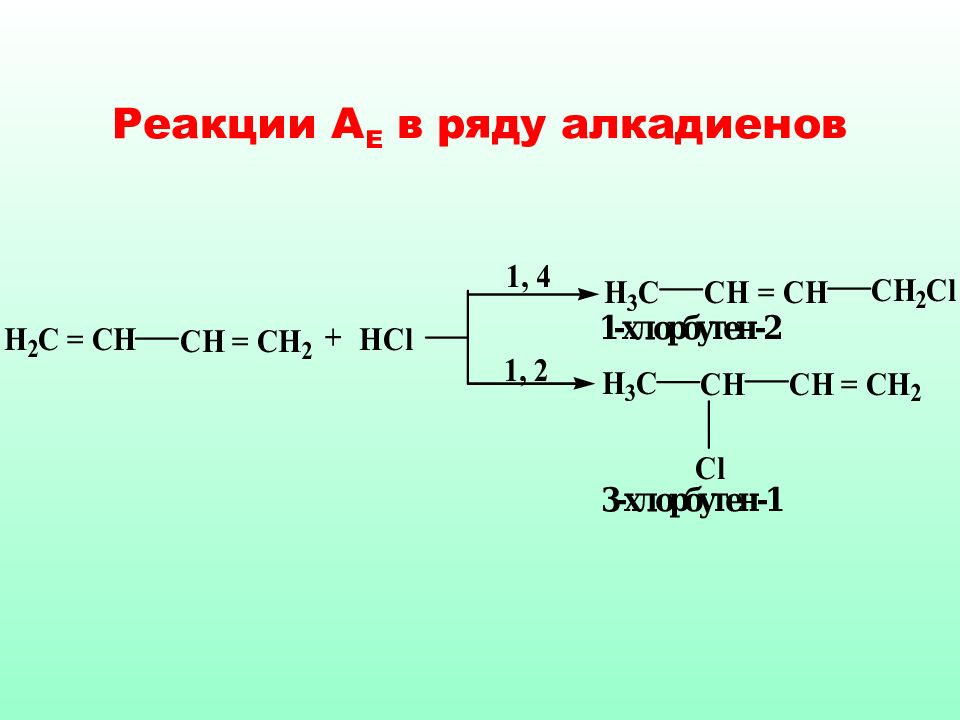
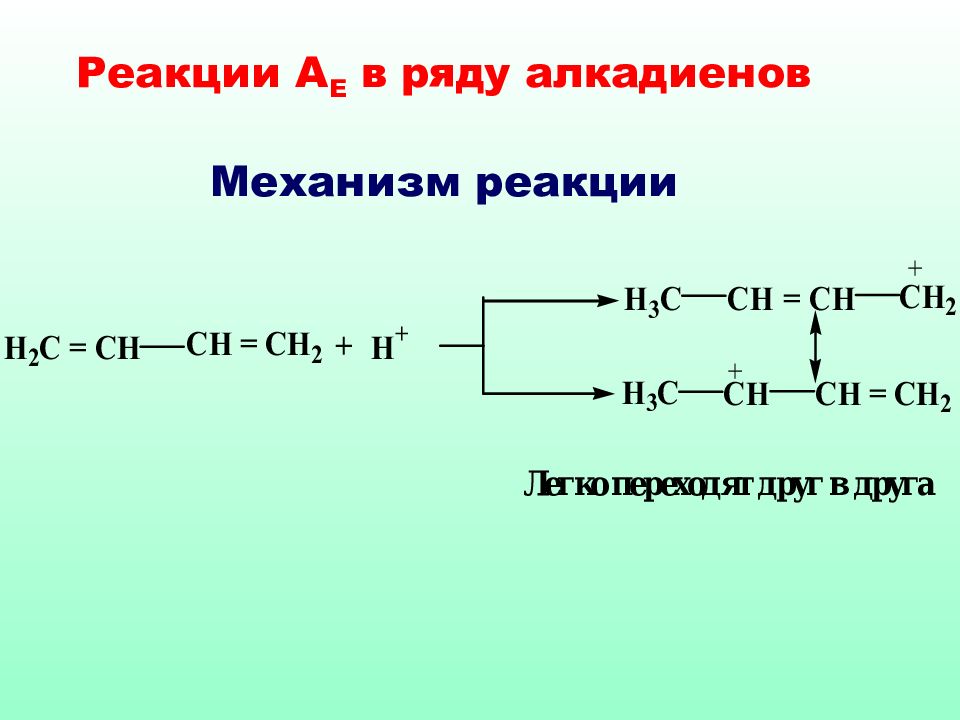
Сопряженные системы (алкадиены) термодинамически наиболее устойчивы, по э тому часто встреча ются в природе. Реакции А Е с такими диенами протекают с образованием двух продуктов 1,4- и 1,2-присоединения
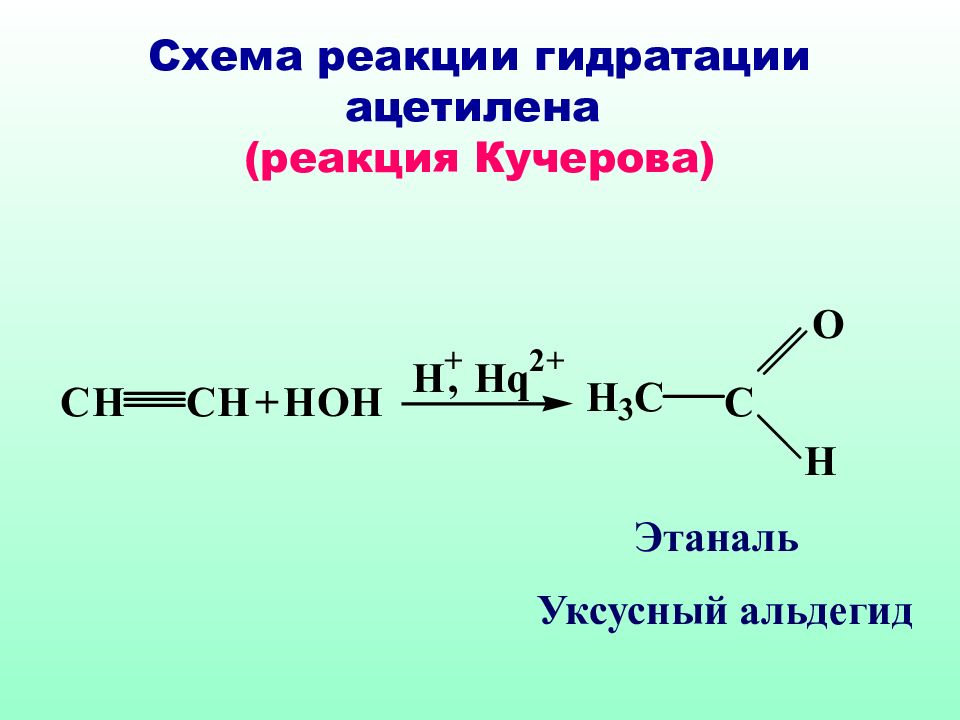
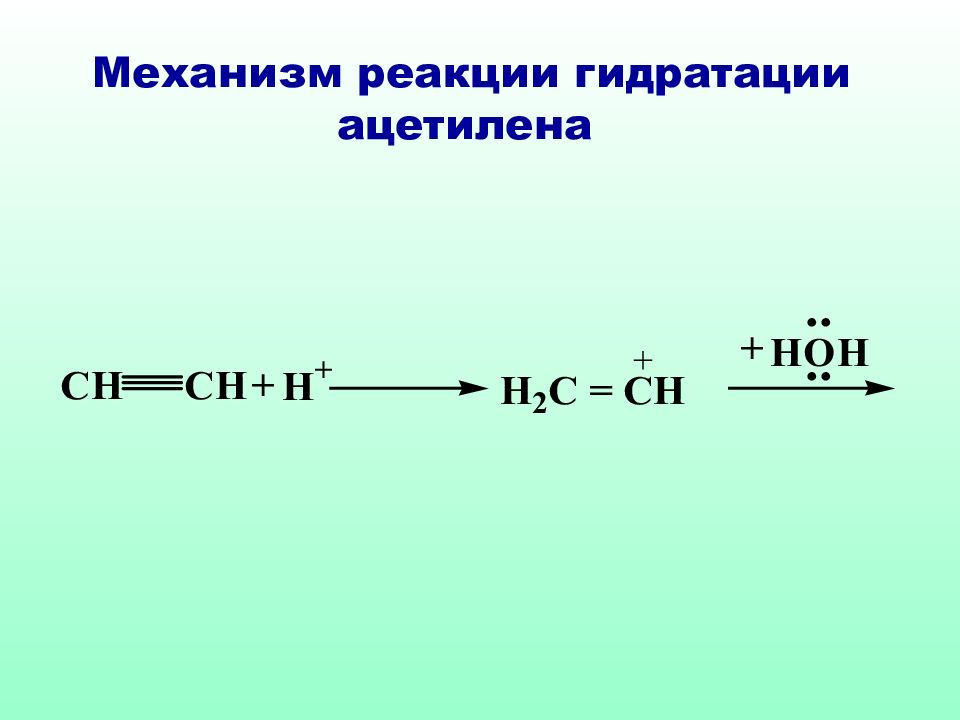
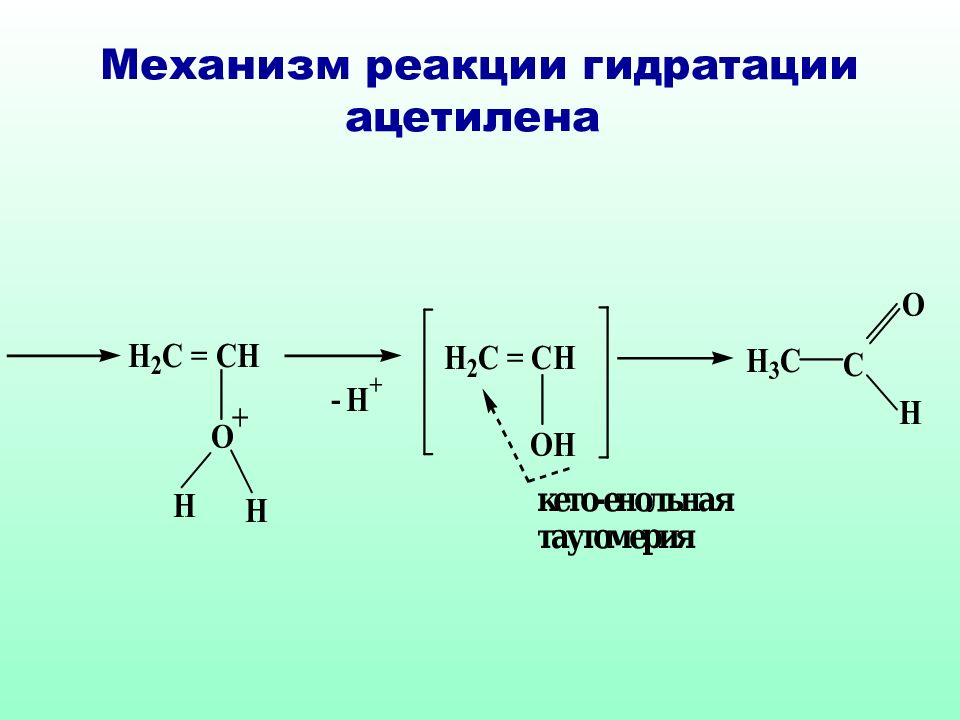
Слайд 57: Схема реакции гидратации ацетилена (реакция Кучерова)
Этаналь Уксусный альдегид