Слайд 2
Металлические материалы Ферриты (Fe 2 O 3 +MeO) Ферримагнетики (+): полупроводники→ нет вихревых токов → применяют в полях высокой частоты; керамика → легко получать; низкая стоимость (-) : чувствительны к температуре, хрупкость, низкая J Композиционные магнитные материалы: Металлопорошковыемагнитодиэлектрики Классификация: по составу
Слайд 3
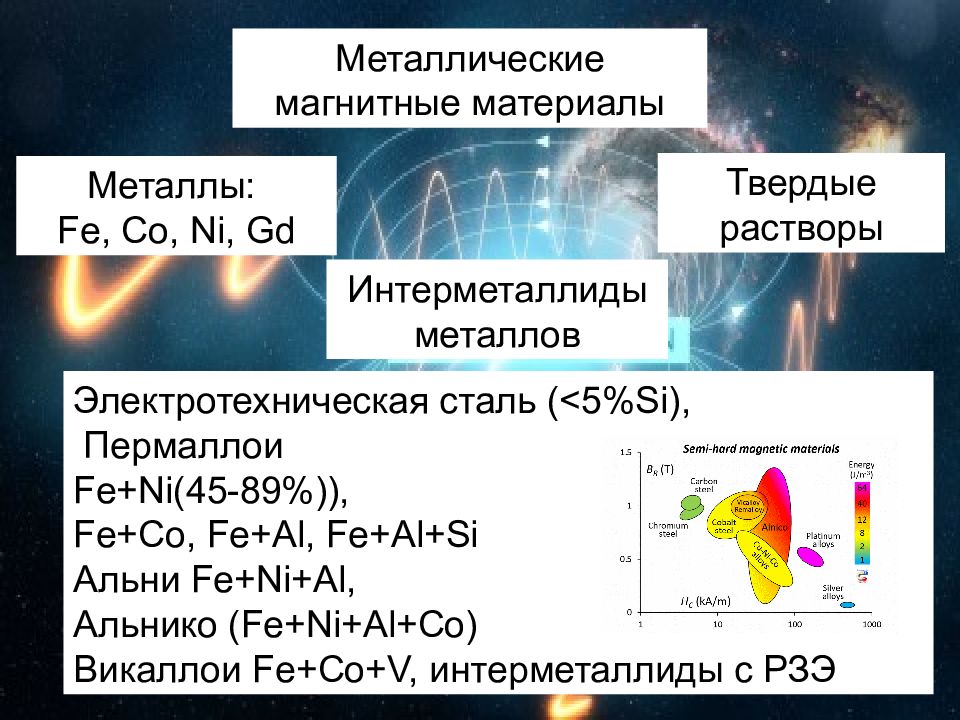
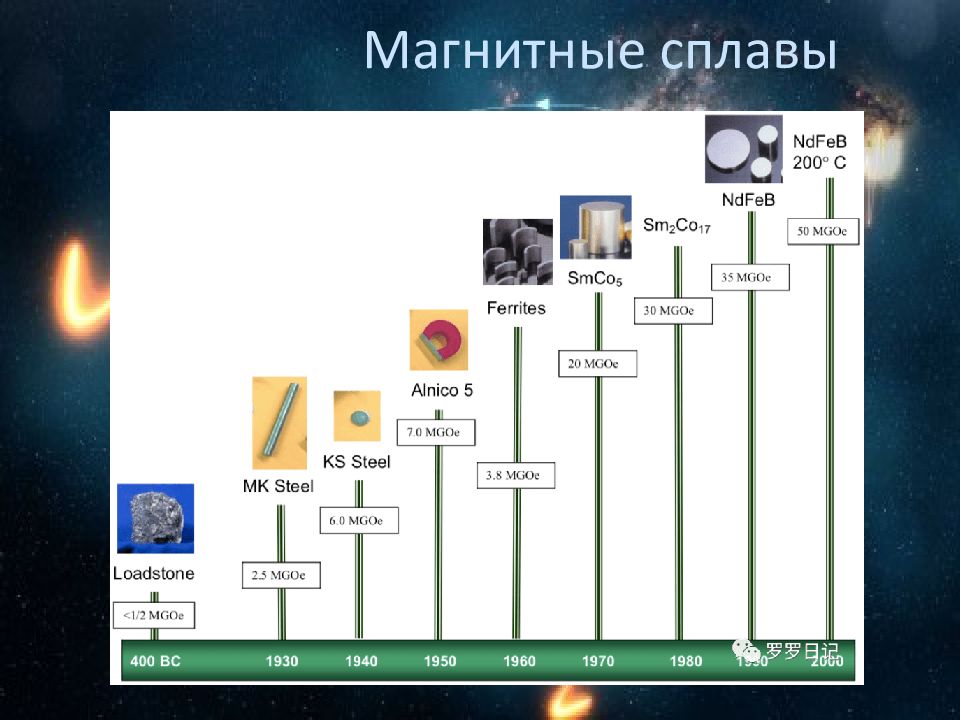
Твердые растворы Металлические магнитные материалы Металлы: Fe, Co, Ni, Gd Электротехническая сталь ( <5%Si ), Пермаллои Fe+Ni (45-89 %)), Fe+Co, Fe+Al, Fe+Al+Si Альни Fe+Ni+Al, Альнико ( Fe+Ni+Al +Со) Викаллои Fe+Co+V, интерметаллиды с РЗЭ Интерметаллиды металлов
Слайд 4: Химические свойства
Взаимодействие с простыми веществами Взаимодействие со сложными веществами
Слайд 9: Применение сталей
Изготовление проводов (0,1-0,15% С), ( ρ ≈ 10 ∙10 -8 Ом ∙ м) Электротехническая сталь — тонколистовая магнитно-мягкая сталь ( Si 0,8-4,5%) Электромагнитные показатели: высокая магнитная проницаемость; низкая коэрцитивная сила узкая петля гистерезиса; высокое удельное электрическое сопротивление ( снижение вихревых токов). Сталь 10895 временное сопротивление, не менее — 270 Н/мм 2 ; относительное удлинение, не менее — 24%; относительное сужение, не менее — 60%; число твердости по Бринеллю, не более — 131; диаметр отпечатка, не менее — 5,2 мм. C Mn Si P S Cu 0.035 0.3 0,3 0,020 0.030 0.3
Слайд 11: Открытие никеля
Аксель Кронстед 1751 Иеримия Рихтер 1804 Обжиг NiAs, восстановление углем, и растворение королька в кислоте, 32 перекристаллизации никелевого купороса, восстановление цинком - чистый металл
Слайд 12
4NiAs+5O 2 =4NiO+2As 2 O 3 Открытие никеля 2NiO+C=2Ni+CO 2 Ni+H 2 SO 4 =NiSO 4 +H 2 Ni+2H 2 SO 4 =NiSO 4 +SO 2 +2H 2 O NiSO 4 +Zn=Ni+ZnSO 4
Слайд 14
Сплавы Мельхиор ( Cu+Ni+Fe ) ; Нейзильбер ( Cu+Ni+Zn ) ; Белое золото ( Au+Ni ) ; Монель -металл( Ni+Cu+Mn ); Нихром ( Ni + Cr ); Пермаллой ( Ni + Fe+Cu+Cr ); Альнико ( Al+Co + Ni ); Нитинол ( Ni+Ti ).
Слайд 15
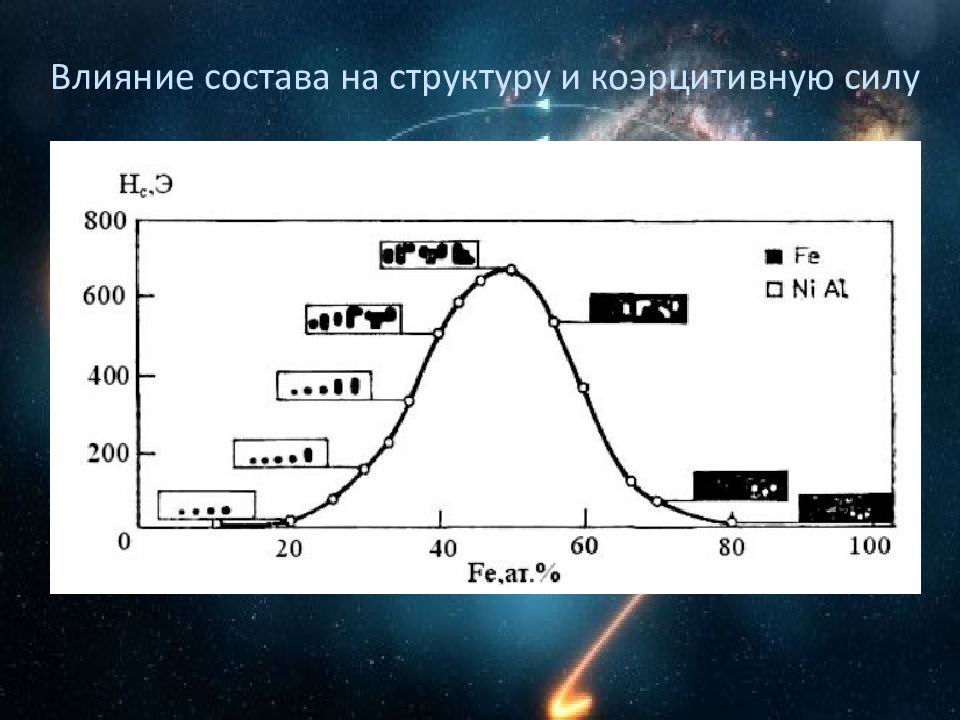
Литые магнитотвердые материалы α ( ГЦК ) Ni центры граней куба, Al вершины α1 Ni 3 Al (ГЦК) β (ОЦК) центры куба и половина вершин Fe, остальное Al β1 –Fe 3 Al (ОЦК) β2 - FeAl или NiAl (ОЦК) βm – магнитная фаза ( Fe), βn – немагнитная фаза (Ni-Al) ( Fe-Ni-Al); ( Fe-Ni-Al-Co )
Слайд 16
Литые магнитотвердые материалы +) температурная стабильность +) простота технологии производства -) высокая твердость и хрупкость (Fe-Ni-Al); ( Fe-Ni-Al-Co). состава Fe 2 NiAl β – магнитная, неупорядоченная (Fe) Нс до 176 кА/м, (ВН) max ~ 88 кДж/м3 β 2 - слабомагнитная, (Ni-Al ) β → β + β2 T= 900 – 1000 оС,
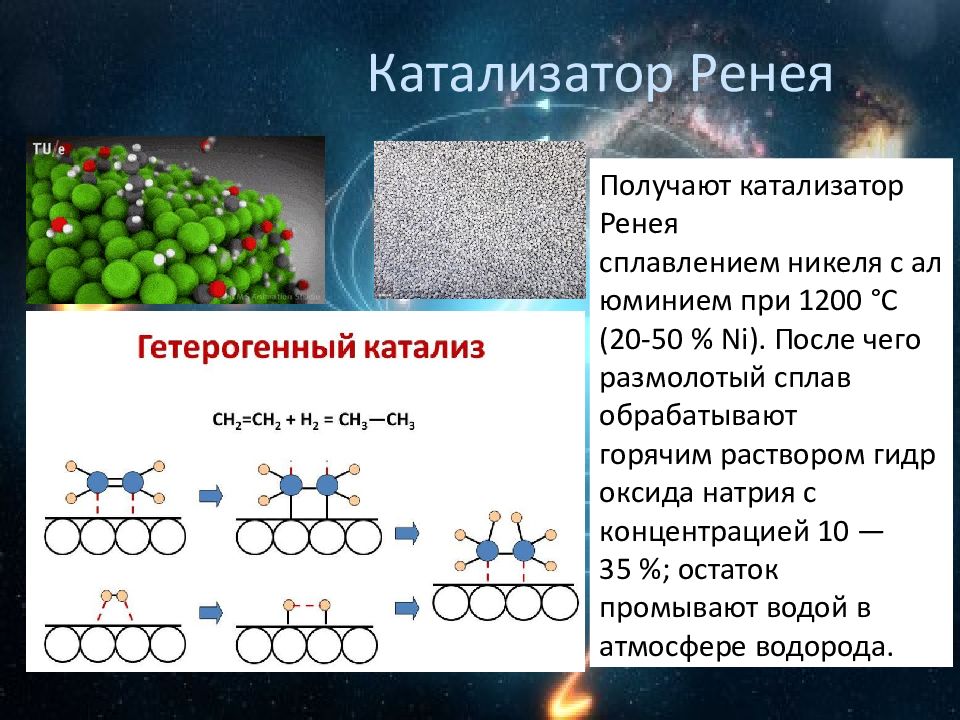
Слайд 19: Катализатор Ренея
Получают катализатор Ренея сплавлением никеля с алюминием при 1200 °C (20-50 % Ni ). После чего размолотый сплав обрабатывают горячим раствором гидроксида натрия с концентрацией 10 — 35 %; остаток промывают водой в атмосфере водорода.
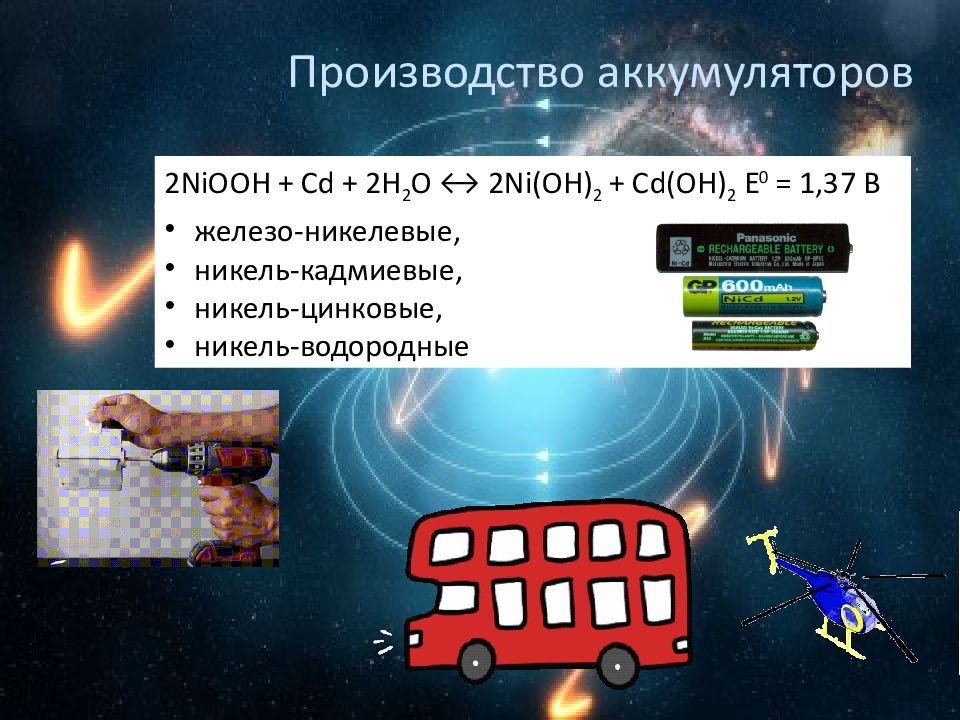
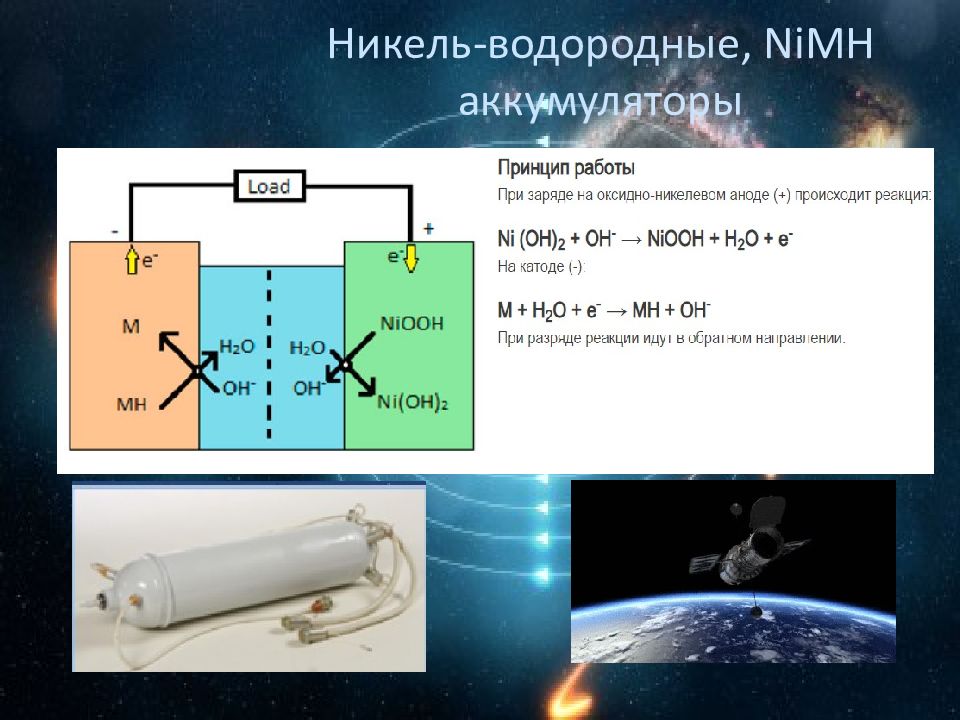
Слайд 20: Производство аккумуляторов
2NiOOH + Cd + 2H 2 O ↔ 2Ni(OH) 2 + Cd(OH) 2 E 0 = 1,37 В железо-никелевые, никель-кадмиевые, никель-цинковые, никель-водородные
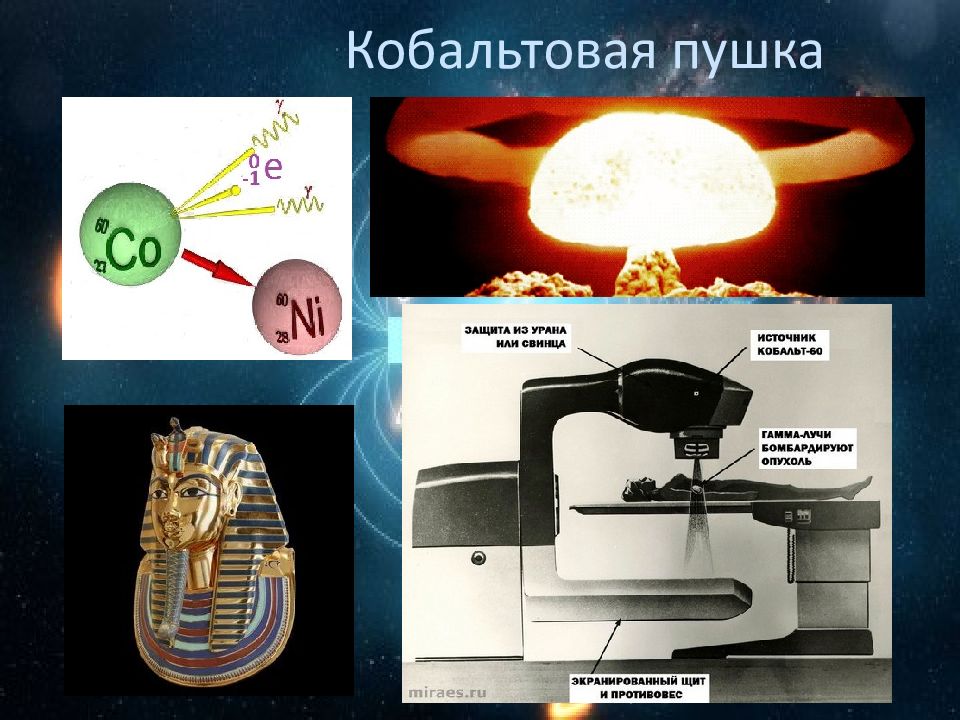
Слайд 22: Самый злой
Почему кобальт токсичен? Каролит CuCo 2 S 4, линнеит Co 3 S 4, кобальтин CoAsS, кобальтоносный пирит ( Fe, Co )S 2, смальтин CoAs 2, скуттерудит ( Co, Ni)As 3
Слайд 23: Самый злой
Co 3 S 4 +7O 2 =3CoSO 4 +SO 2 4CoAs 2 +9O 2 =2 С o 2 O 3 + 4As 2 O 3 CoAs 2 +O 2 = С o 2 O 3 + As 2 O 3
Слайд 24: Получение
Растворяют руду с помощью серной кислоты, или аммиака. Гидроксид кальция реагирует с сульфатом кобальта с образованием гидроксида кобальта (II ). CoSO 4 +Ca(OH) 2 =Co(OH) 2 +CaSO 4 Отделение от никеля: Гидроксид кобальта (II) окисляется гипохлоритом кальция с образованием гидроксида кобальта (III ). CaOCl 2 +2Co(OH) 2 +H 2 O=2Co(OH) 3 +CaCl 2 Гидроксид кобальта (III) дегидратируется и переходит в оксид кобальта Co 2 O 3, при избытке хлорной извести. 2 Co(OH) 3 = Co 2 О 3 + 3 H 2 O 3. Выделяют кобальт на катодах в процессе электролиза. К: Со 2+ +2е=Со 0 А: 2Н 2 О-4е=О 2 +4Н + 2CoSO 4 + 2 H 2 O = 2 Со 0 +О 2 + 2 Н 2 SO 4 Получение
Слайд 27
Сплавы альнико 8-12 % алюминия, 15-26 % никеля, 5-24 % кобальта, до 6 % меди, до 1 % титана, остальное железо. Альнико получают литьём, из порошков и горячей деформацией слитка, после чего подвергают термомагнитной обработке.
Слайд 28
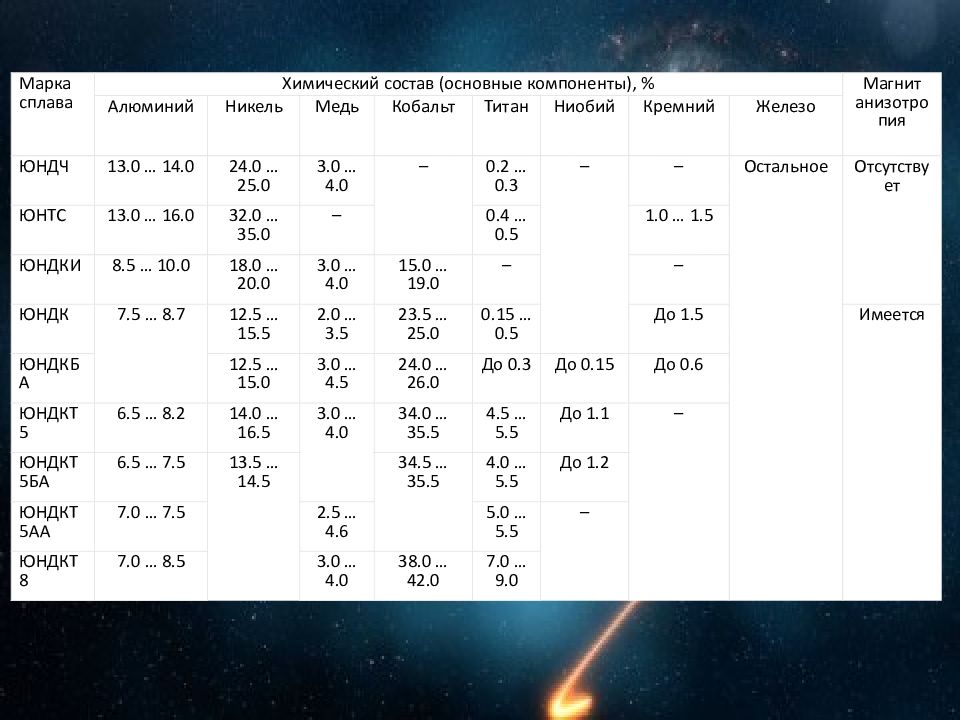
Марка сплава Химический состав (основные компоненты), % Магнит анизотропия Алюминий Никель Медь Кобальт Титан Ниобий Кремний Железо ЮНДЧ 13.0 … 14.0 24.0 … 25.0 3.0 … 4.0 – 0.2 … 0.3 – – Остальное Отсутствует ЮНТС 13.0 … 16.0 32.0 … 35.0 – 0.4 … 0.5 1.0 … 1.5 ЮНДКИ 8.5 … 10.0 18.0 … 20.0 3.0 … 4.0 15.0 … 19.0 – – ЮНДК 7.5 … 8.7 12.5 … 15.5 2.0 … 3.5 23.5 … 25.0 0.15 … 0.5 До 1.5 Имеется ЮНДКБА 12.5 … 15.0 3.0 … 4.5 24.0 … 26.0 До 0.3 До 0.15 До 0.6 ЮНДКТ5 6.5 … 8.2 14.0 … 16.5 3.0 … 4.0 34.0 … 35.5 4.5 … 5.5 До 1.1 – ЮНДКТ5БА 6.5 … 7.5 13.5 … 14.5 34.5 … 35.5 4.0 … 5.5 До 1.2 ЮНДКТ5АА 7.0 … 7.5 2.5 … 4.6 5.0 … 5.5 – ЮНДКТ8 7.0 … 8.5 3.0 … 4.0 38.0 … 42.0 7.0 … 9.0
Слайд 29
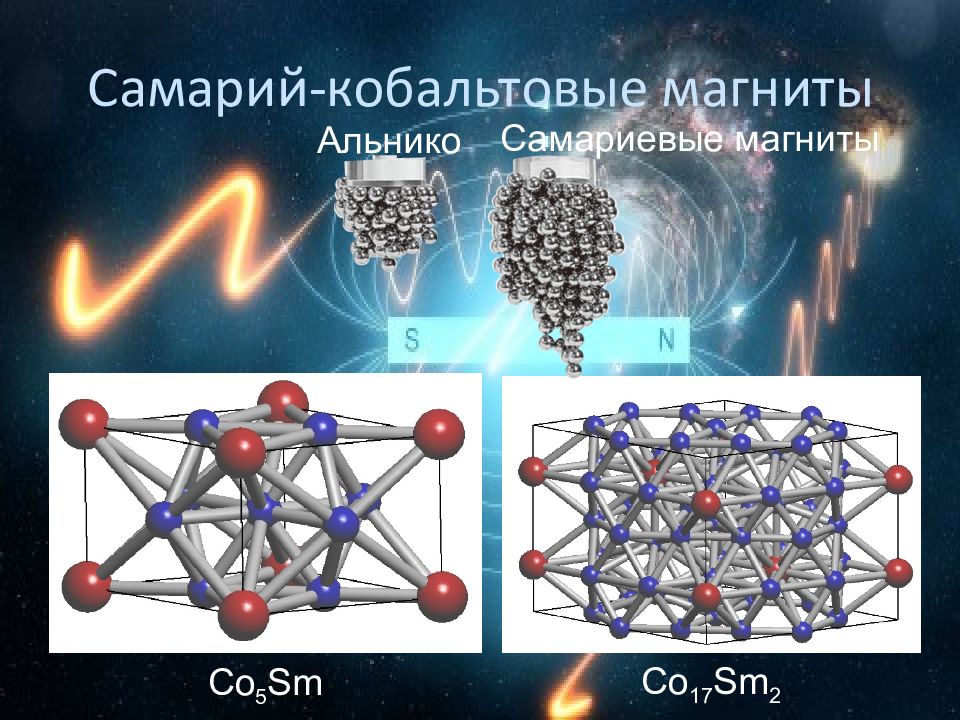
Co 5 Sm Co 17 Sm 2 Самарий-кобальтовые магниты Альнико Самариевые магниты
Слайд 30
получение сплава (сплавов) нужного состава, приготовление тонкодисперсного порошка прессование порошка в магнитном поле для формирования текстуры спекание порошковой заготовки проведение термической обработки спеченного магнита для повышения коэрцитивной силы. Технология изготовления
Слайд 31
Получение сплава а) прямым сплавлением компонентов (высокочастотным индукционным нагревом в тиглях из нитрида бора или корунда); б) совместным восстановлением; в) электролизом расплавов с кобальтом в качестве расходуемого анода (большой расход энергии).
Слайд 32: Супертвердые жаропрочные сплавы
Стеллиты (С o+Cr + W) Победиты ( WC(90%)+ С o) Легированные стали
Слайд 33: Аккумуляторы
Кобальтит лития LiCoO 2 получают спеканием нитратов лития и кобальта 2Co(NO 3 ) 2 +2LiNO 3 =2LiCoO 2 +O 2 +6NO 2
Слайд 34
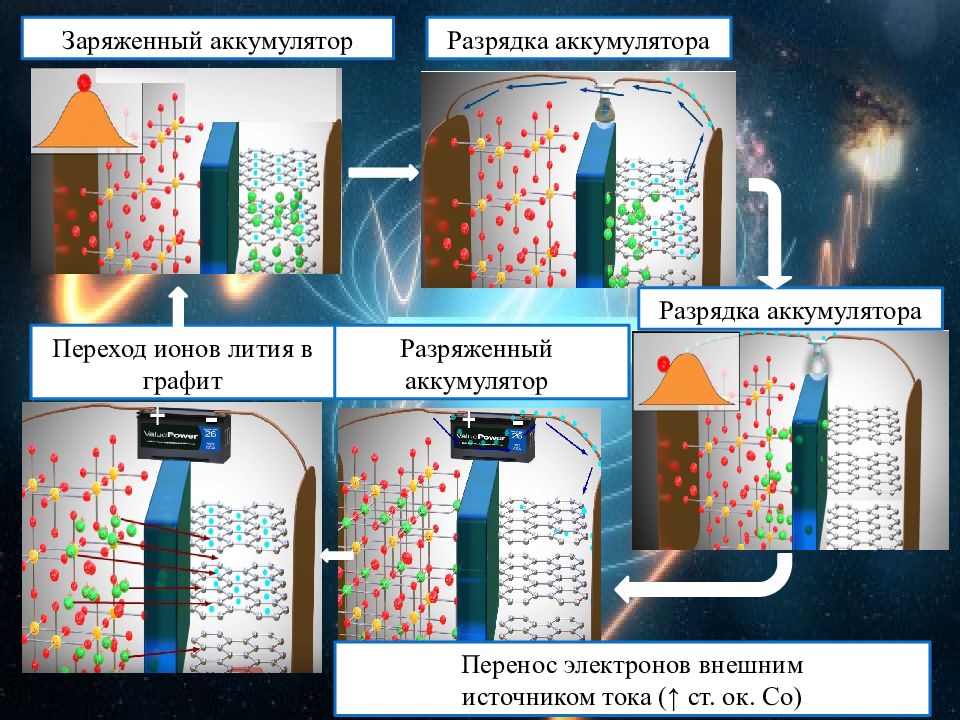
Разрядка аккумулятора Разряженный аккумулятор Перенос электронов внешним источником тока (↑ ст. ок. Со) Разрядка аккумулятора Переход ионов лития в графит Заряженный аккумулятор
Слайд 35
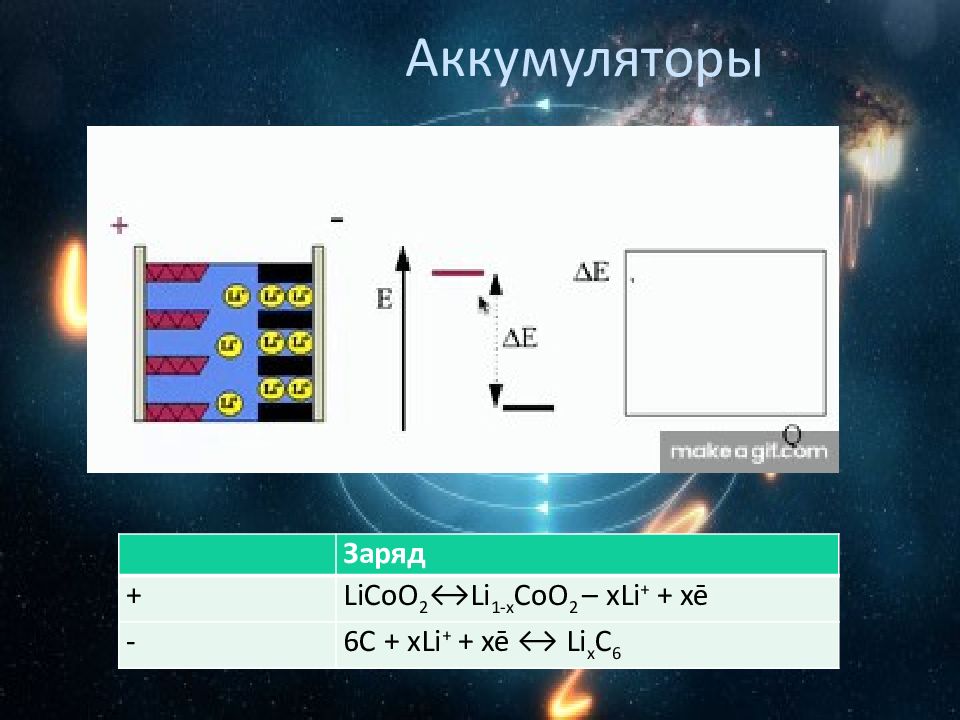
Заряд + LiCo О 2 ↔ Li 1-х CoO 2 – xLi + + x ē - 6C + xLi + + xē ↔ Li x C 6 Аккумуляторы
Слайд 37
Краски Безводная соль Гидратированная соль Почему растворы солей кобальта розовые, а кобальтовая краска синяя?
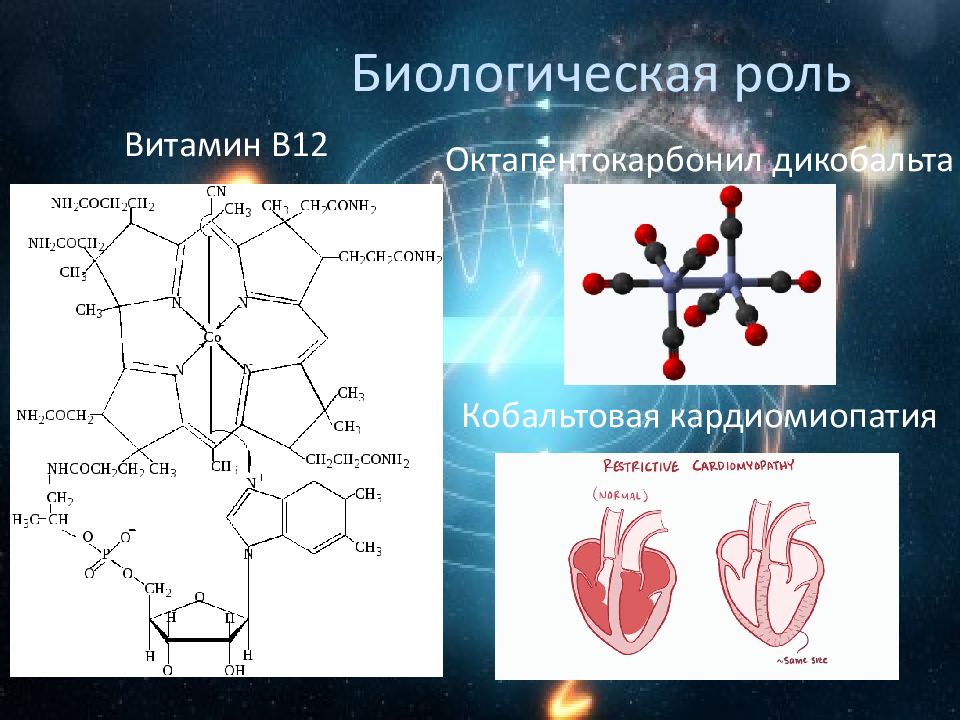
Слайд 39: Биологическая роль
Кобальтовая кардиомиопатия Витамин В12 Октапентокарбонил дикобальта
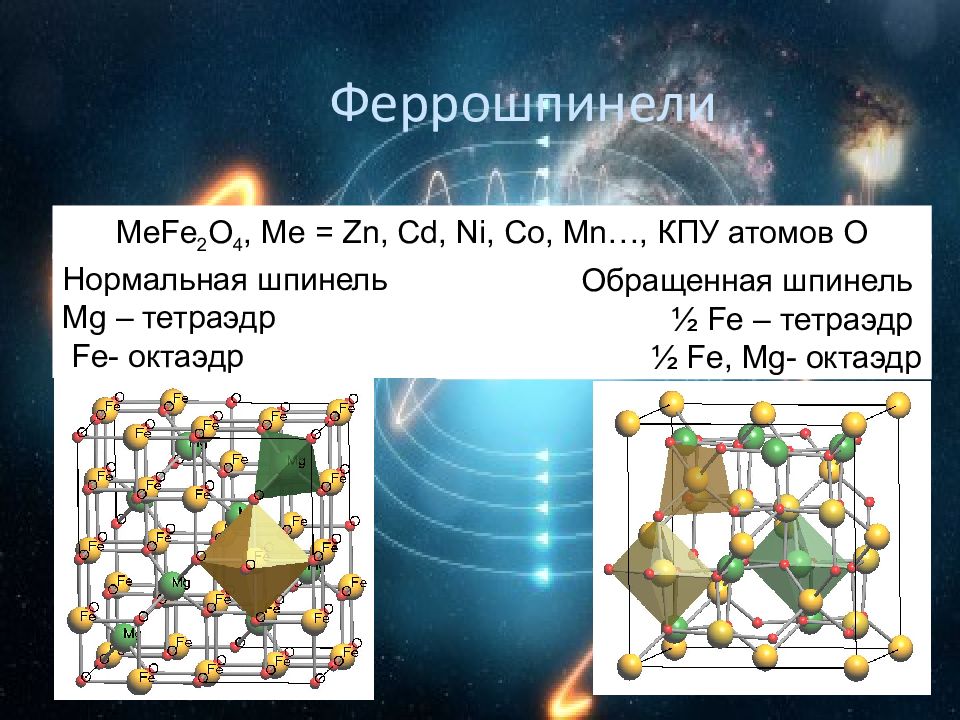
Слайд 40
Ферриты Структурный тип шпинели ( феррошпинели ) MeFe 2 O 4, Ме = Zn, Cd, Ni, Co, Mn … Структурный тип граната ( феррогранаты ) A 3 B 2 X 3 O 12 Структурный тип магнетоплюмбита ( гексаферриты ) BaFe 12 O 19 Структурный тип перовскита ( ортоферриты )
Слайд 41
Феррошпинели MeFe 2 O 4, Ме = Zn, Cd, Ni, Co, Mn …, КПУ атомов О Нормальная шпинель Mg – тетраэдр Fe- октаэдр Обращенная шпинель ½ Fe – тетраэдр ½ Fe, Mg- октаэдр
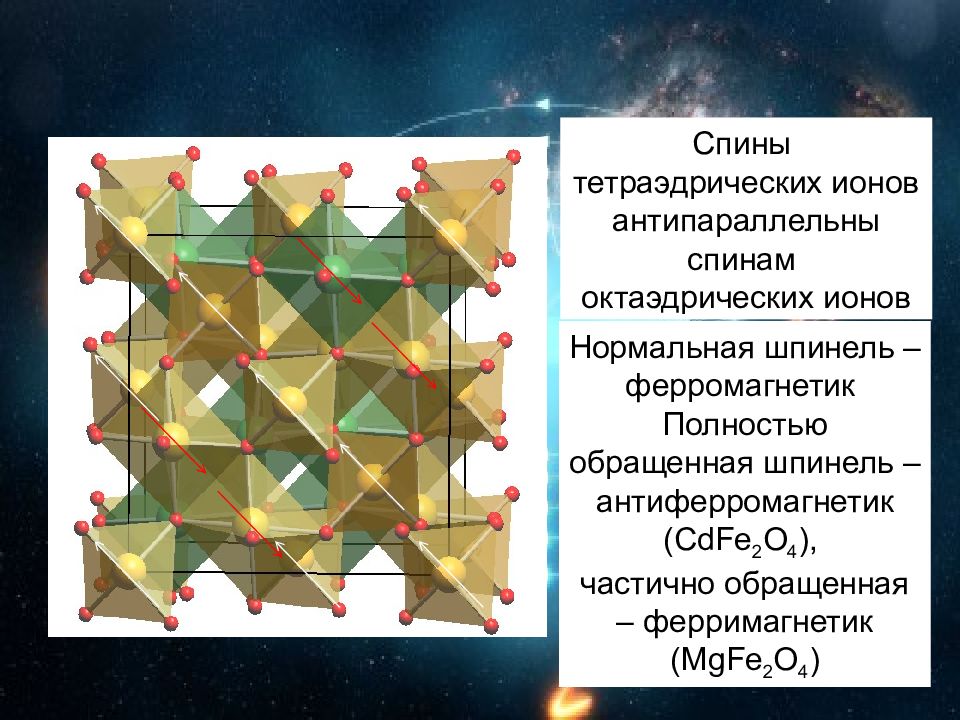
Слайд 42
Спины тетраэдрических ионов антипараллельны спинам октаэдрических ионов Нормальная шпинель – ферромагнетик Полностью обращенная шпинель – антиферромагнетик ( CdFe 2 O 4 ), частично обращенная – ферримагнетик ( MgFe 2 O 4 )
Слайд 43
A 3 B 2 X 3 O 12 ОЦК атомов О, где A ( большой радиус, КЧ=8): Mg, Ca, РЗЭ( Y) ; B - ( маленький радиус, КЧ=6): Al, Fe, Cr, Ti. Zn X ( маленький радиус, КЧ= 4 ): Si, Ge, Zn, V Железоиттриевые гранаты (ЖИГ) - Y 3 Fe 5 O 12 на одну ячейку магнитный момент одного Fe 3+ Феррогранаты
Слайд 44
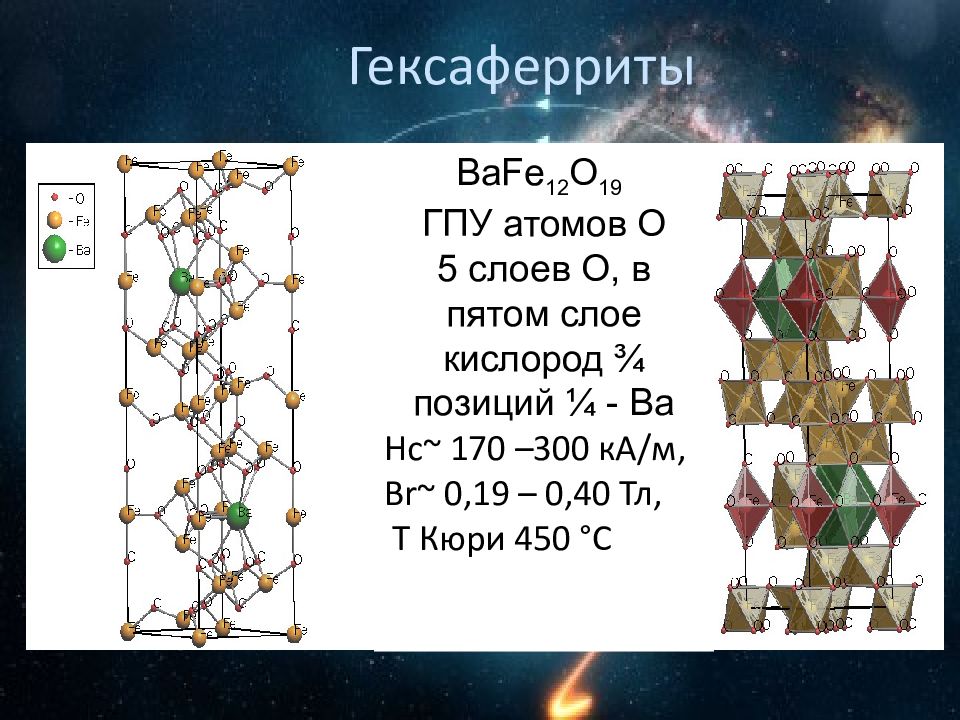
1 2 3 4 5 Гексаферриты BaFe 12 O 19 ГПУ атомов О 5 слоев О, в пятом слое кислород ¾ позиций ¼ - Ва Hc ~ 170 –300 кА/м, Br ~ 0,19 – 0,40 Тл, Т Кюри 450 ° C
Слайд 46
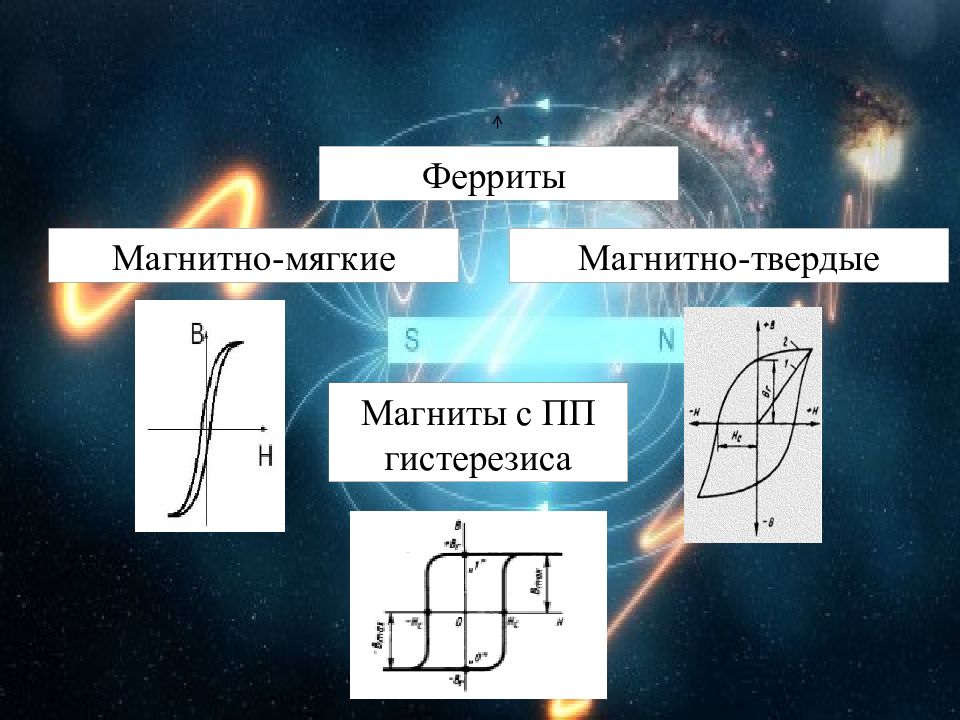
Магнитомягкие Магнитотвердые Ферриты с прямоугольной петлей Fe 2 O 3 + NiO, MgO, ZnO Fe 2 O 3 + BaO, SrO 40% Fe 2 O 3, 40% MnO и 20% MgO ( CdO ) Трансформаторные сердечники Постоянные магниты Запоминающие устройства Ферриты
Слайд 47
1. Расчет весовых значений окислов и солей и их взвешивание Технологическая схема 2. Помол и перемешивание смеси, п ри мокром помоле полученную шихту подвергают сушке 3. Брикетирование и гранулирование 4. Предварительный обжиг 5. Вторичный помол и перемешивание смеси 7. Высокотемпературное спекание 6. Формование 8. Контроль (внешний вид, геометрические размеры, физико-механические свойства)
Слайд 48
Подготовка шихты Основное сырье: Fe 2 O 3, Mn 2 O 3, ZnO, NiO, BaCO 3, SrCO 3 и CaCO 3 Взвешивание Смешивание Спекание Размалывание