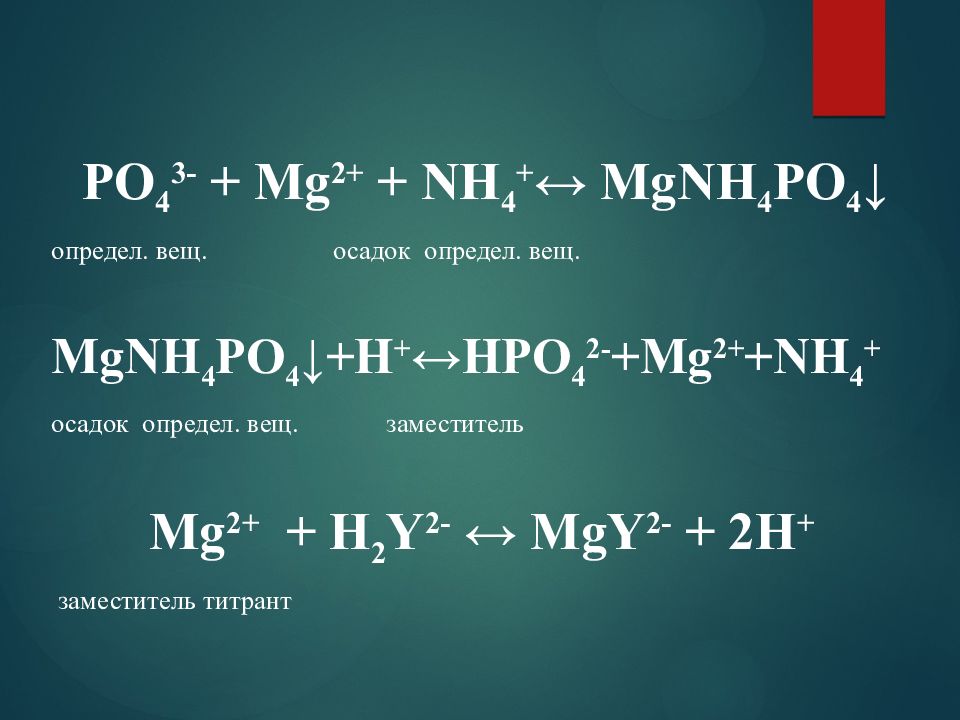Слайд 2: Комплексометрическое титрование, или комплексометрия -
В методе комплексометрического титрования выделяют такие методы: меркуриметрия фторидометрия цианидометрия комплексонометрия
Слайд 3: Требования к реакциям в комплексометрии:
Реакция должна протекать стехиометрически. Реакция должна протекать количественно и до конца, константа стойкости комплекса должна быть больше 10 8. Реакция образования комплексного соединения должна протекать быстро. Должна быть возможность фиксации точки эквивалентности. В условиях проведения титрования не должны протекать конкурирующие реакции.
Слайд 4
В меркуриметрии используют образование галогенидных и псевдогалогенидных комплексов Hg(II). В условиях титрования протекает реакция: 2Cl - + Hg 2+ =HgCl 2 Аналогично протекают с бромид-, йодид-, роданид- и цианид-ионами; можно определять также соли Hg(II).
Слайд 5: Меркуриметрия
Титрант : вторичный стандартный раствор Hg (NO 3 ) 2 Стандартизация: по первичному стандартному раствору натрий хлорида NaCl : Hg (NO 3 ) 2 + 2 NaCl = HgCl 2 + 2 NaNO 3 Главный недостаток меркуриметрии – высокая токсичность соединений меркурия.
Слайд 6
И ндикаторы: 1. раствор натрий пентацианонитрозоферрата (ІІІ) (натрий нитропруссид) Na 2 [Fe(CN) 5 NO], который образует с Hg 2+ -ионами малорастворимую белую соль : Na 2 [Fe(CN) 5 NO] + Hg(NO 3 ) 2 = 2NaNO 3 + Hg[Fe(CN) 5 NO] 2. Раствор дифенилкарбазона, который образует с ионами Hg 2+ осадок интенсивного синего цвета.
Слайд 7
Меркуриметрическое определение йодидов базируется на реакции: Hg 2+ + 4I - = [HgI 4 ] 2- В т.э.: [HgI 4 ] 2- + Hg 2+ = HgI 2 осадок красного цвета
Слайд 8
Определение роданидов (тиоцианатов SCN - ): как индикатор используют раствор соли Fe(III) До т.э.: Fe 3+ + 3SCN - = Fe(SCN) 3 красная окраска раствора Реакция титрования: Hg 2+ + 2SCN - = Hg(SCN) 2 Конец титрования: 2 Fe(SCN) 3 + 3Hg(NO 3 ) 2 = 3Hg(SCN) 2 + 2Fe(NO 3 ) 3. красная окраска раствора исчезает
Слайд 9
Определение солей меркурия (ІІ) : титрант - раствор калий тиоцианата, индикатор - ионы Fe(III). В точке эквивалентности возникает красная окраска ферум (ІІІ) тиоцианата: До т.э.: Hg 2+ + 2SCN - = Hg(SCN) 2 В т.э.: Fe 3+ + 3SCN - = Fe(SCN) 3
Слайд 10: Фторидометрия
Титрант: перв. станд. раствор NaF Определяемые ионы: алюминий, цирконий, торий, кальций. Реакции: Al 3+ + 6F - = [AlF 6 ] 3- Zr IV + 6F - = [ZrF 6 ] 2- Th IV + 6F - = [ThF 6 ] 2- Са 2+ определяют обратным титрованием : Ca 2+ + 2F - = CaF 2 избыток 6F - + Al 3+ = [AlF 6 ] 3- остаток
Слайд 11
Индикаторы: кислотно-основные ( метиловый оранжевый), поскольку реакция растворов - кислая: Al 3+ + HOH = AlOH 2+ + H + ализарин сульфат (комплексы с цирконием – красно-фиолетовые, с торием – фиолетовые) Фторидометрия служит для определения сравнительно высоких концентраций (0,2-0,5 моль/л). Относительная ошибка может достигать 1-3%.
Слайд 12: Цианидометрия
Титрант: втор. станд. р-р калий цианида KCN Стандартизация: по станд. раст. AgNO 3 : Ag + + 2CN - = [Ag(CN) 2 ] - [Ag(CN) 2 ] - + Ag + = 2AgCN в к.т.т. появляется опалесценция Определяемые вещества: тяжелые металлы, которые образуют устойчивые цианидные комплексы определенного состава, например, [Ni(CN) 4 ] 2-, [Co(CN) 4 ] 3-, [Zn(CN) 4 ] 2- и др.
Слайд 13
Реакция метода: [Ni(NH 3 ) 4 ] 2+ + 4CN - = [Ni(CN) 4 ] 2- + 4NH 3 Среда: щелочная (аммиачная) Индикаторы: суспензия аргентум йодида AgI. В т.э.: исчезает муть AgI + 2CN - =[Ag(CN) 2 ] - + I - Цианид калия сильный яд !
Слайд 14: Комплексонометрия
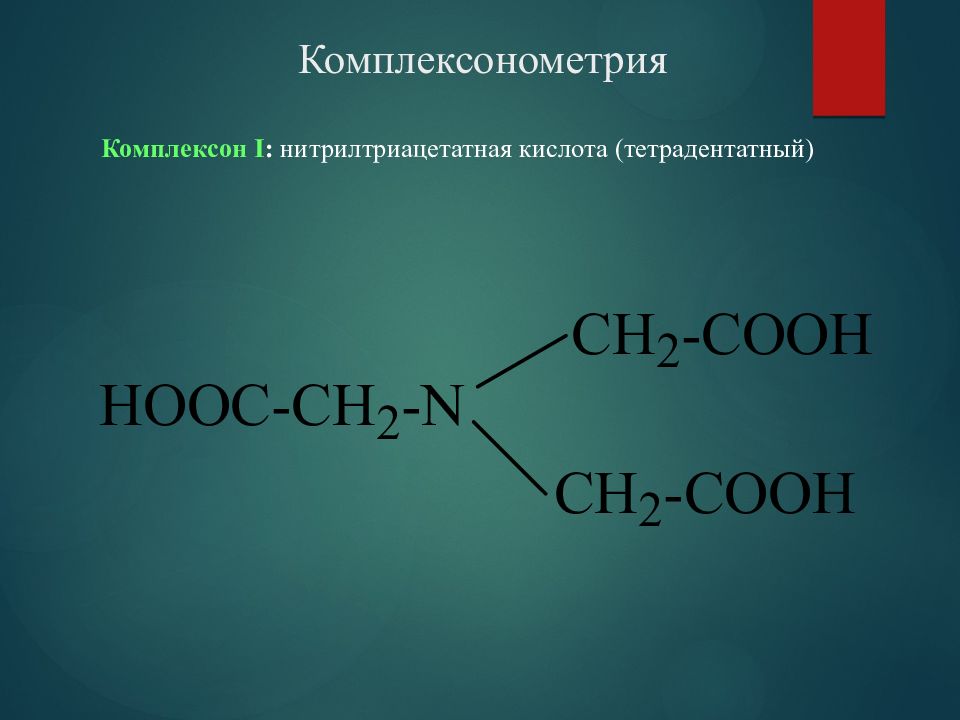
Комплексон І : нитрилтриацетатная кислота (тетрадентатный)
Слайд 15
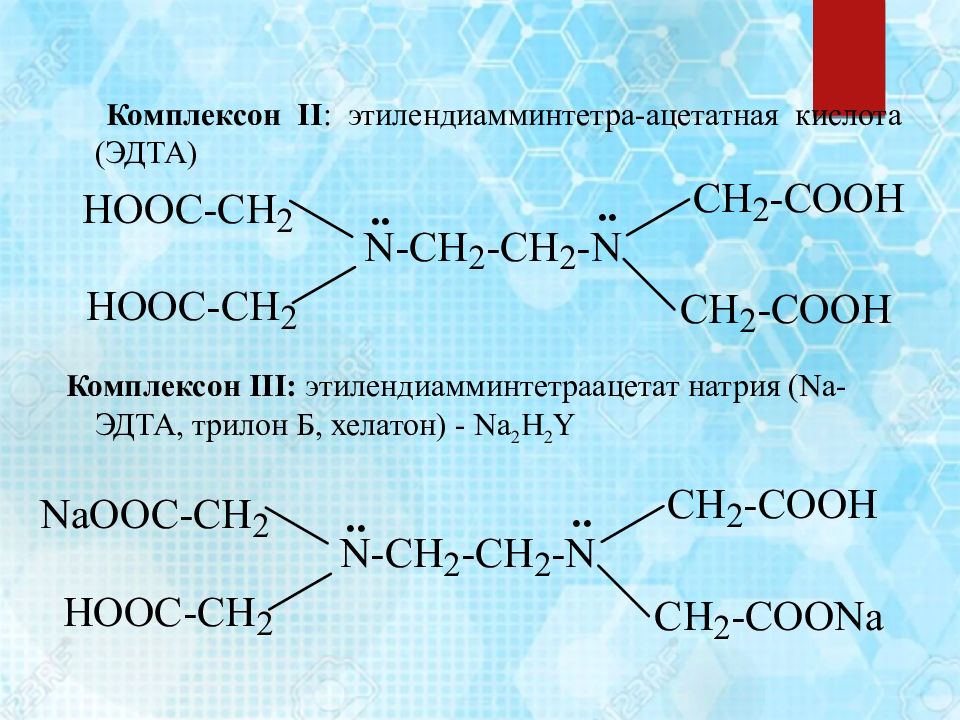
Комплексон ІІ : этилендиамминтетра-ацетатная кислота (ЭДТА) Комплексон ІІІ: этилендиамминтетраацетат натрия (Na-ЭДТА, трилон Б, хелатон) - Na 2 H 2 Y
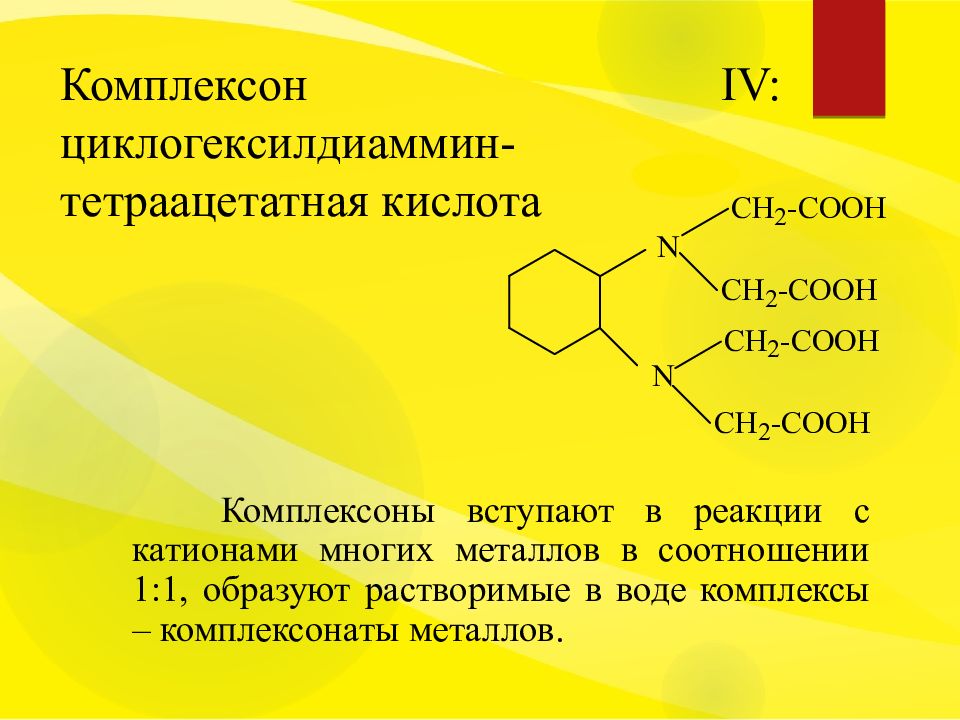
Слайд 16: Комплексон ІV: циклогексилдиаммин-тетраацетатная кислота
Комплексоны вступают в реакции с катионами многих металлов в соотношении 1:1, образуют растворимые в воде комплексы – комплексонаты металлов.
Слайд 17: Преимущества использования комплексонов
хорошо растворимы в воде и некоторых других органических растворителях повышенная устойчивость комплексов реакции протекают стехиометрически (нет ступенчатого комплексообразования) некоторые комплексоны являются специфическими реагентами на отдельные ионы металлов (избирательное действие) широкое использование их как маскирующих реагентов быстрота протекания реакции
Слайд 18: Комплексонометрия
Титрант : 0,05 моль/л раствор натрий эдетата Стандартизация титранта за веществами : Zn + H 2 SO 4 ZnSO 4 + H 2 MgSO 4 CaCO 3 + HCl Ca 2+ + 2Cl - + H 2 O + CO 2 ZnO + HCl Zn 2+ + 2Cl - + H 2 O Реакции метода: Са 2+ + H 2 Y 2- → CaY 2- + 2H + In 3+ + H 2 Y 2- → InY - + 2H + Th 4+ + H 2 Y 2- → ThY + 2H +
Слайд 19: Комплексонометрия
Индикаторы: металлохромные Общая реакция метода : Me n + + H 2 Y 2- MeY n -4 + 2 H + Me n+ + Y 4- MeY (n-4)+ На концентрацию ионов металла влияет рН – образуются гидроксокомплексы На концентрацию Y 4- влияет рН среды
Слайд 21: Зависимость мольной доли эдетат-иона от рН среды
1,0 2,1 10 -18 7,0 4,8 10 -4 2,0 3,7 10 -14 8,0 5,4 10 -3 3,0 2,5 10 -11 9,0 5,2 10 -2 4,0 3,6 10 -9 10,0 3,5 10 -1 6,0 2,2 10 -5 11,0 9,8 10 -1
Слайд 22: Условия комплексонометрического титрования
высокая устойчивость комплексонатов металлов ( β ст. ) придерживание конкретного значения кислотности среды использование буферных растворов (для связывания ионов Н +, которые выделяются) только отдельные катионы ( Fе 3+, In 3+, Sc 3+, Zn IV, Тh IV ), которые образуют очень устойчивые комплексы с комплексоном, титруются в кислой среде
Слайд 23: Прямое комплексонометрическое титрование
Условия использования: высокая скорость реакции реакция проходит количественно, стехиометрически, до конца есть индикатор, который позволяет надежно фиксировать к.т.т. можно титровать смесь катионов, если Определяемые ионы: большинство катионов металлов
Слайд 24: Способы повышения селективности прямого титрования:
Регулирование рН среды ионы Fе 3+, Ga 3+, In 3+, Tl 3+, Ві 3+, Zr IV, Тh IV (если lg β С > 20) при рН~ 2 при рН = 5 – Аl 3+, Co 3+, Ni 2+, Cu 2+, Zn 2+, Cd 2+ при рН = 9 – щелочноземельные металлы 2. Использование маскирующих реагентов: ионы F -, P 2 O 7 2-, CN -, Н 2 С 4 Н 4 О 6 и др. ионы Со(II), Ni (II), Zn (II), Cd (II) и Hg (II) могут быть замаскированы цианид-ионами 3. Изменение степени окисления Fe 3+ маскируют восстановлением до Fe 2+
Слайд 25: Обратное комплексонометрическое титрование
Условия использования: невозможно выбрать индикатор реакция проходит медленно если при данном рН раствора, ионы металла образуют осадок соответствующего гидроксида или основной соли для определения анионов
Слайд 26
Дополнительные титранты: соли Zn 2+ или Мg 2+ Ме 1 х+ + Н 2 Y 2- ↔ Ме 1 Y х-4 + 2Н + определ. ион избыток Н 2 Y 2- + М g 2+ ↔ М g Y 2- + 2Н + остаток дополнительный титрант
Слайд 27: Обратное комплексонометрическое титрование и определение анионов
SO 4 2- + Ba 2+ ↔ BaSO 4 ↓ определ. ион избыток Ba 2+ + Н 2 Y 2- ↔ Ba Y 2- + 2Н + остаток
Слайд 28: Непрямое комплексонометрическое титрование
Условия использования: образование очень устойчивых комплексов с индикатором отсутствие индикатора для определения анионов Определяемые ионы: Th IV, Нg 2+, РО 4 3-, СО 3 2- и др.
Слайд 29: Непрямое комплексонометрическое титрование
Ме n+ + МgY 2- ↔ МеY n-4 + Мg 2+ определ. вещ. заместитель Мg 2+ + Н 2 Y 2- ↔ МgY 2- + 2Н + заместитель титрант
Слайд 30
РО 4 3- + Мg 2+ + NH 4 + ↔ МgNH 4 РО 4 ↓ определ. вещ. осадок определ. вещ. МgNH 4 РО 4 ↓+Н + ↔HРО 4 2- +Мg 2+ +NH 4 + осадок определ. вещ. заместитель Мg 2+ + Н 2 Y 2- ↔ МgY 2- + 2Н + заместитель титрант
Слайд 31: Требования к индикаторам в комплексонометрии
металл и индикатор должны давать комплекс в соотношении 1:1 окраска индикатора должна отличаться от окраски комплекса MeInd комплекс MeInd должен быть достаточно устойчивым устойчивость комплекса MeInd должна быть меньше устойчивости комплексоната металла MeY, который является продуктом титрования (разница в 10-100 раз) комплекс MeІnd должен быть лабильным изменение окраски при титровании должно быть контрастным
Слайд 32: Металлоиндикаторы
сами не окрашены металлохромные специфические: Fe 3+ - сульфосалициловая сами окрашены, поскольку кислота (красная окраска) имеют хромофорные Ві 3+ - тиомочевина (желтая) группы и образуют с металлами окрашенные комплексы Металлохромные индикаторы: а) –N=N- (ЭХЧ Т, арсеназо ІІІ) б) трифенилметановые красители в) другие индикаторы ( мурексид, дитизон, ализарин)
Слайд 33: Механизм изменения окраски металлохромных индикаторов
Me 2+ + Іnd MeІnd - синий красный MeІnd + H 2 Y 2- MeY 2- + H 2 Іnd красный бесцветный синий
Слайд 34
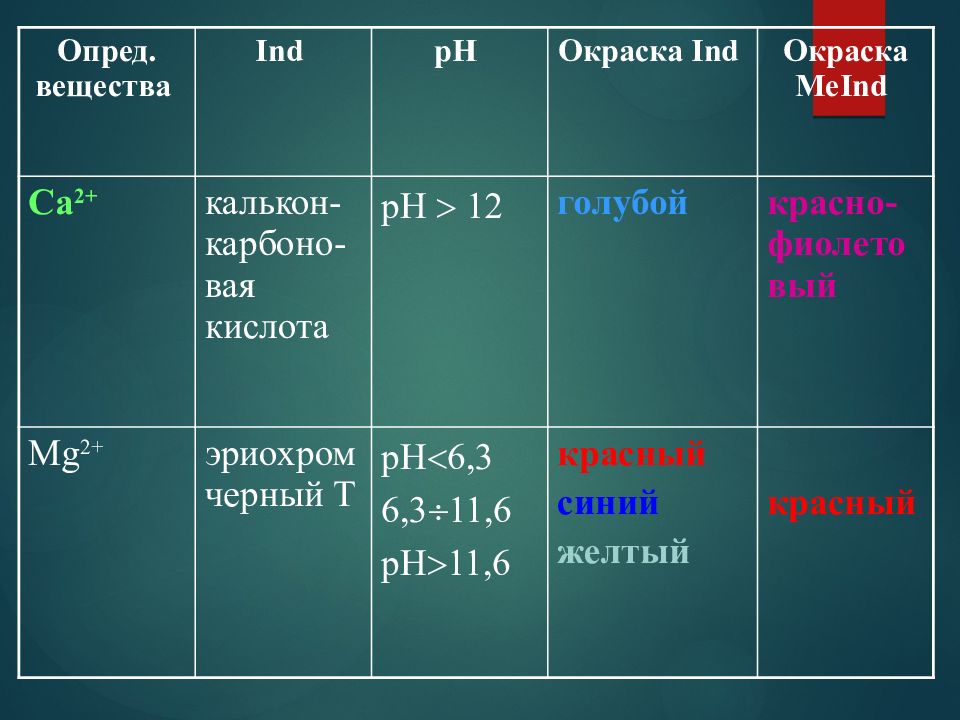
Опред. вещества Ind pH Окраска Ind Окраска MeInd Са 2+ калькон-карбоно-вая кислота pH 12 голубой красно-фиолетовый Mg 2+ эриохром черный Т рН 6,3 6,3 11,6 рН 11,6 красный синий желтый красный
Последний слайд презентации: Методы комплексонометрического титрования
Определ. вещества Ind pH Окраска Ind Окраска MeInd Pb 2+, Zn 2+, Bi 3+ ксиленоловый оранжевый 2 рН 6,4 рН 6,4 желтый красно-фиолетовый красный Al 3+, Zn 2+ дитизон рН 6,3 зеленоватый с синим оттенком красно-фиолетовый