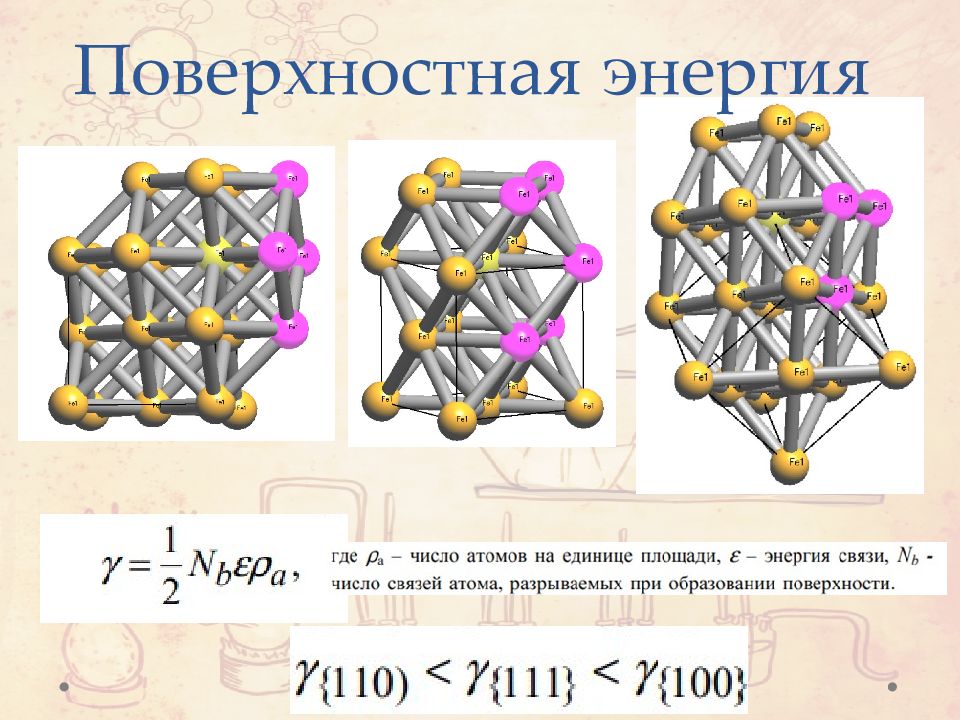
Слайд 2
Устойчивость системы с гигантской поверхностной энергией. Требования к материалам 2. Узкое распределением по размерам частиц, необходимой морфологией, химическим состава и микроструктурой. 3. Устойчивость материала к агломерации. 4. Химическая стабильность. 5. Высокая производительность и экономичность синтеза
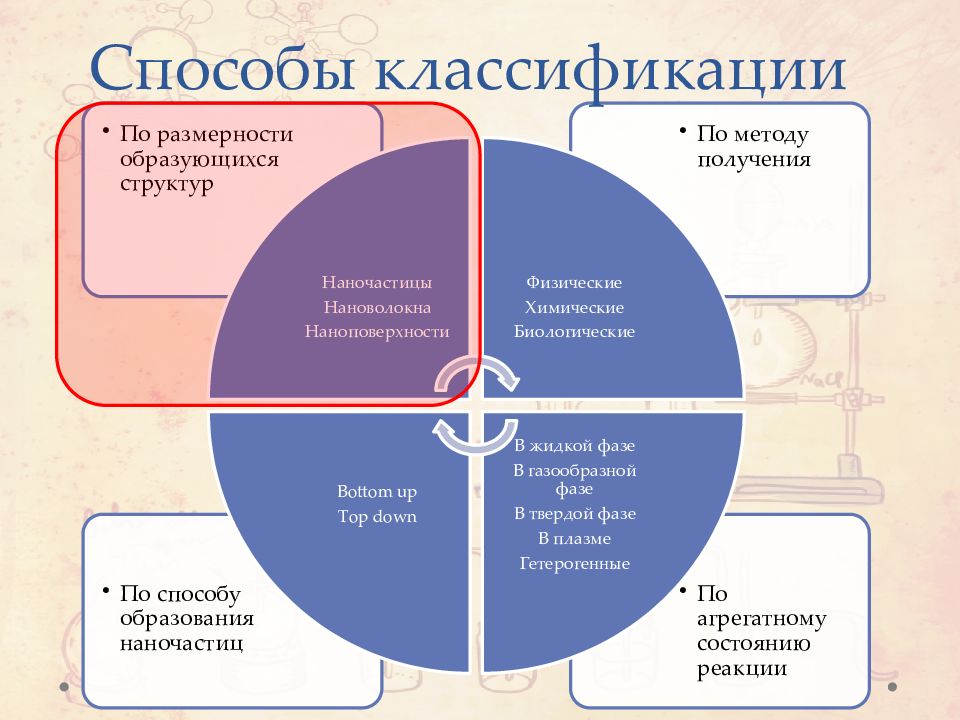
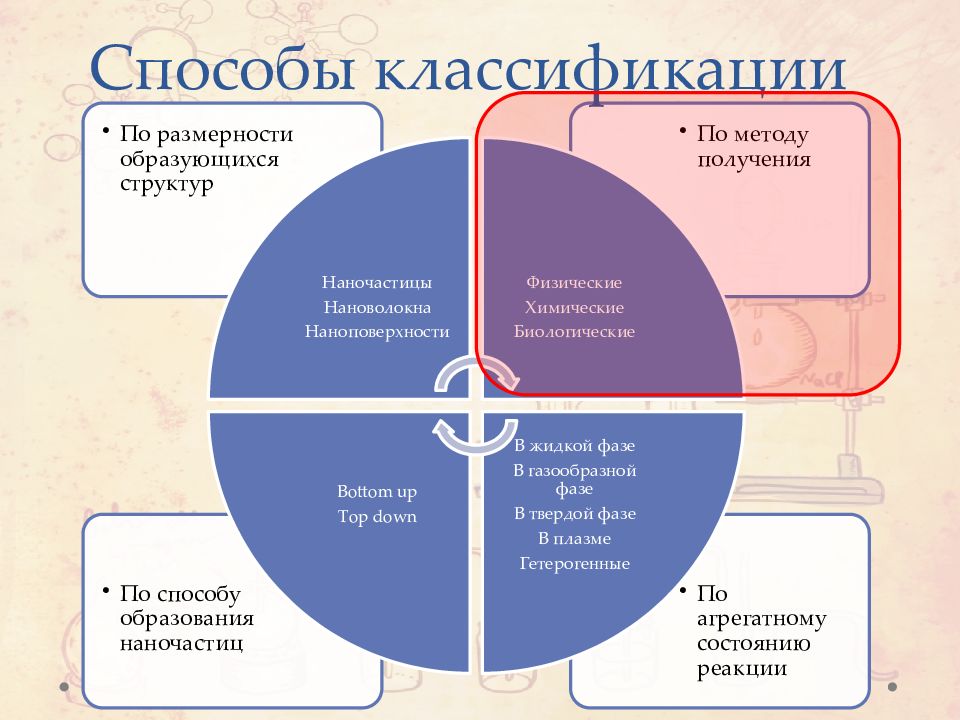
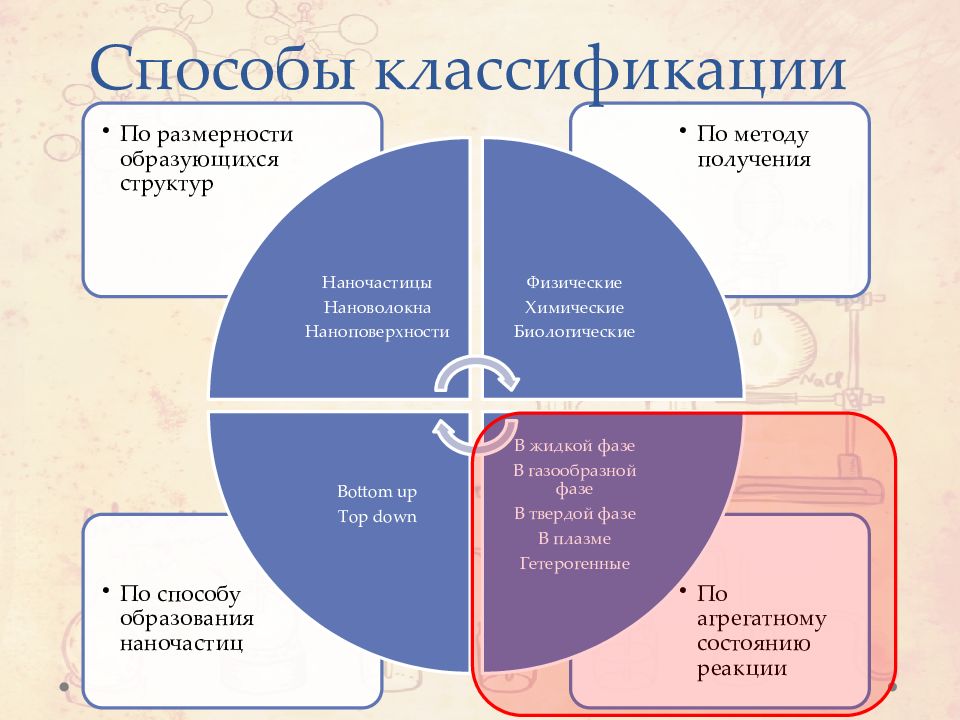
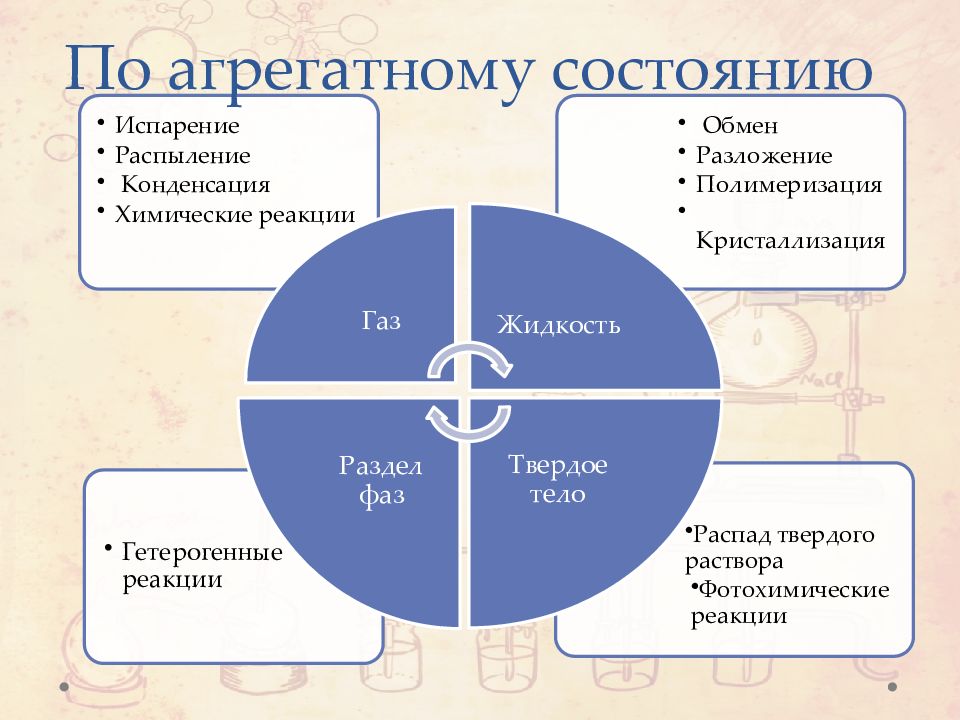
Слайд 12
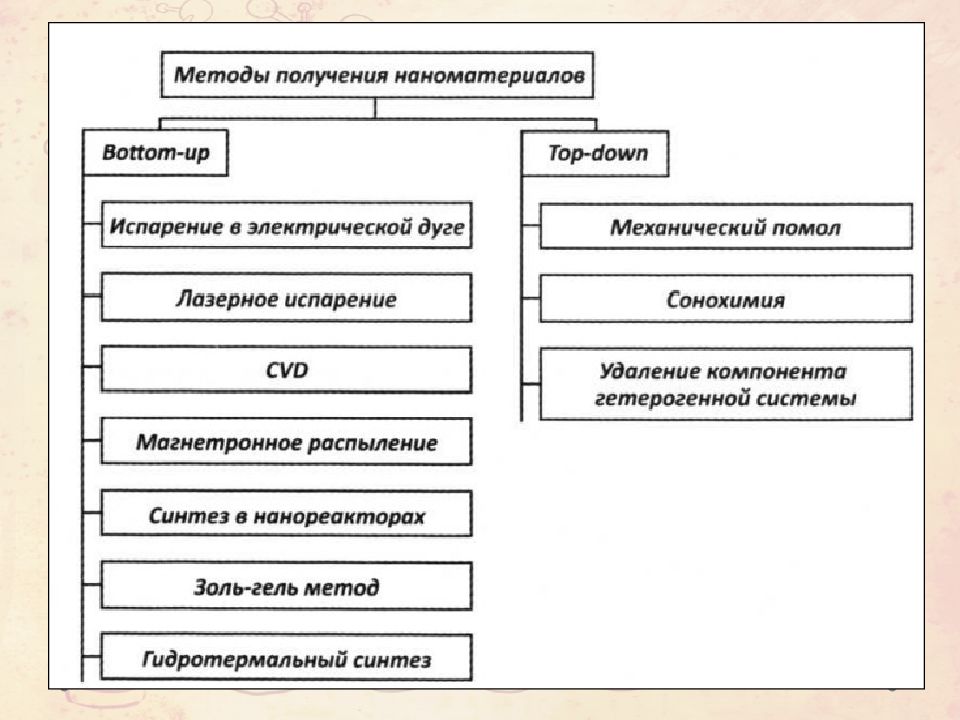
Методы получения Технология Top-Down ( Диспергационные методы) Технология Bottom - Up (Конденсационные методы) Работа диспергирования W=W деформ + W обр-ия поверхн W деформ = kV W обр-ия поверхн = S Δσ k- коэф. пропорц V – объем тела S – площадь поверхности σ - поверхностное натяжение Стадия образование кристалла Стадия роста кристалла υ образования крист > υ роста крист
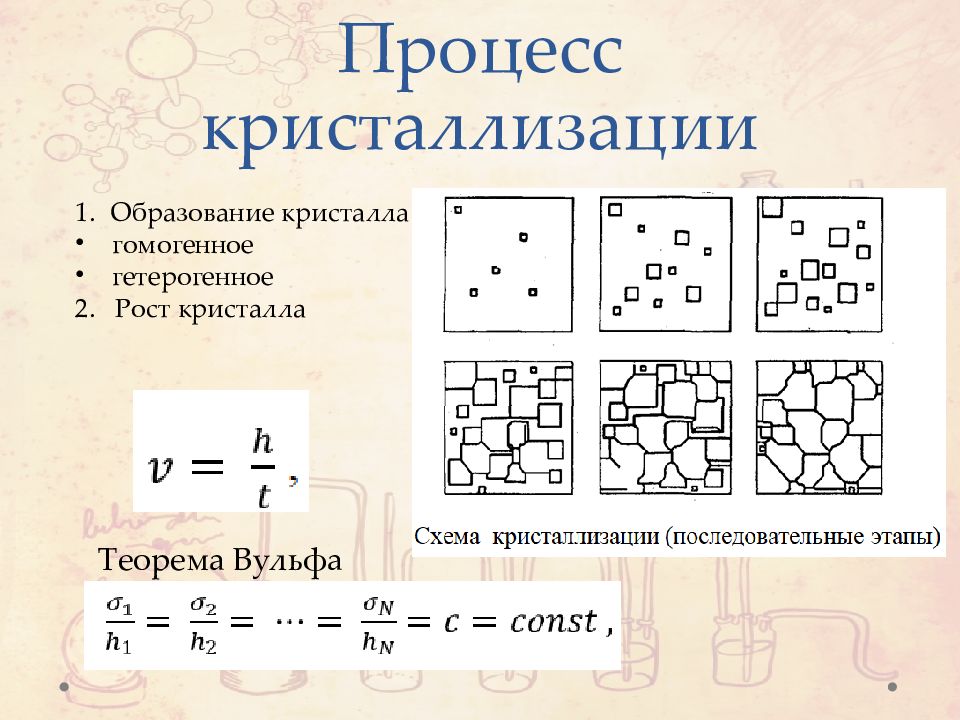
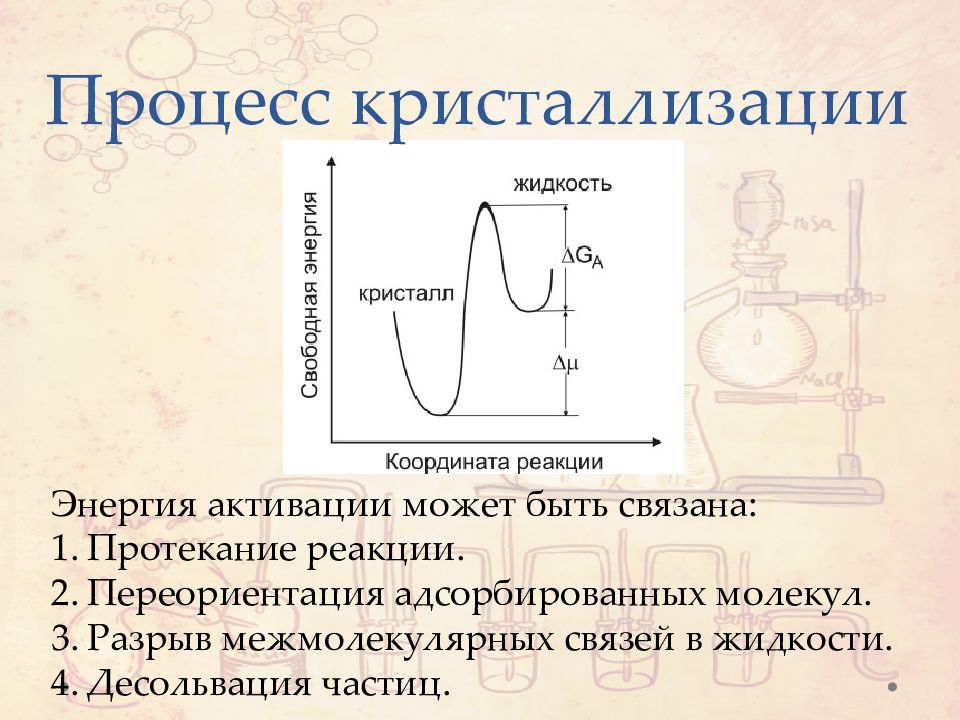
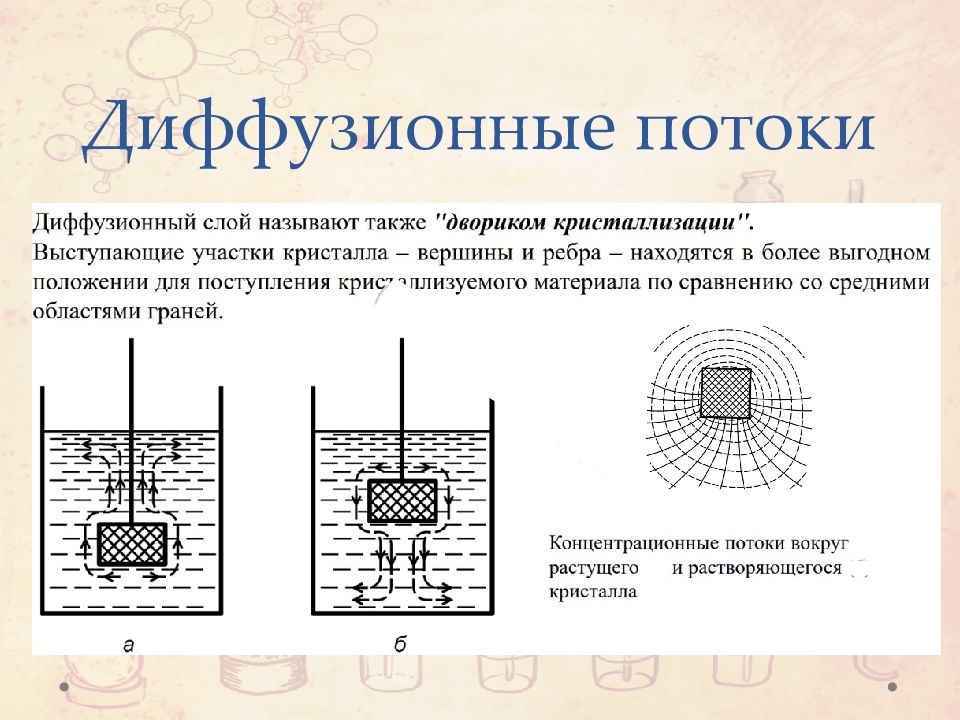
Слайд 13: Процесс кристаллизации
Теорема Вульфа Образование кристалла гомогенное гетерогенное 2. Рост кристалла
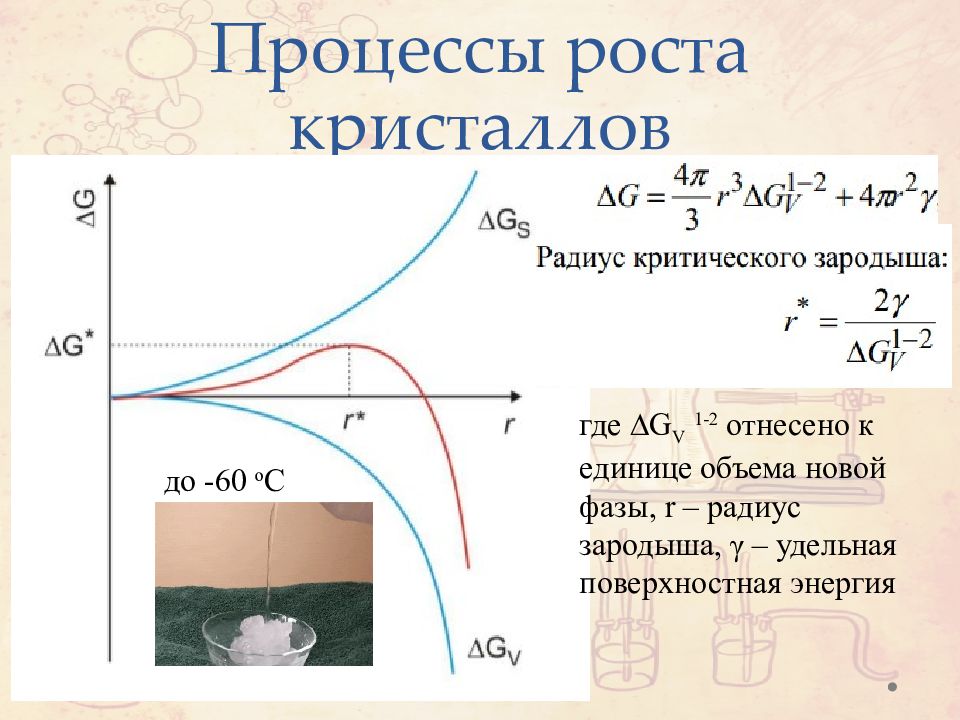
Слайд 14: Процессы роста кристаллов
где ∆G V 1-2 отнесено к единице объема новой фазы, r – радиус зародыша, γ – удельная поверхностная энергия до -60 о С
Слайд 15: Процесс кристаллизации
Энергия активации может быть связана: Протекание реакции. Переориентация адсорбированных молекул. Разрыв межмолекулярных связей в жидкости. Десольвация частиц.
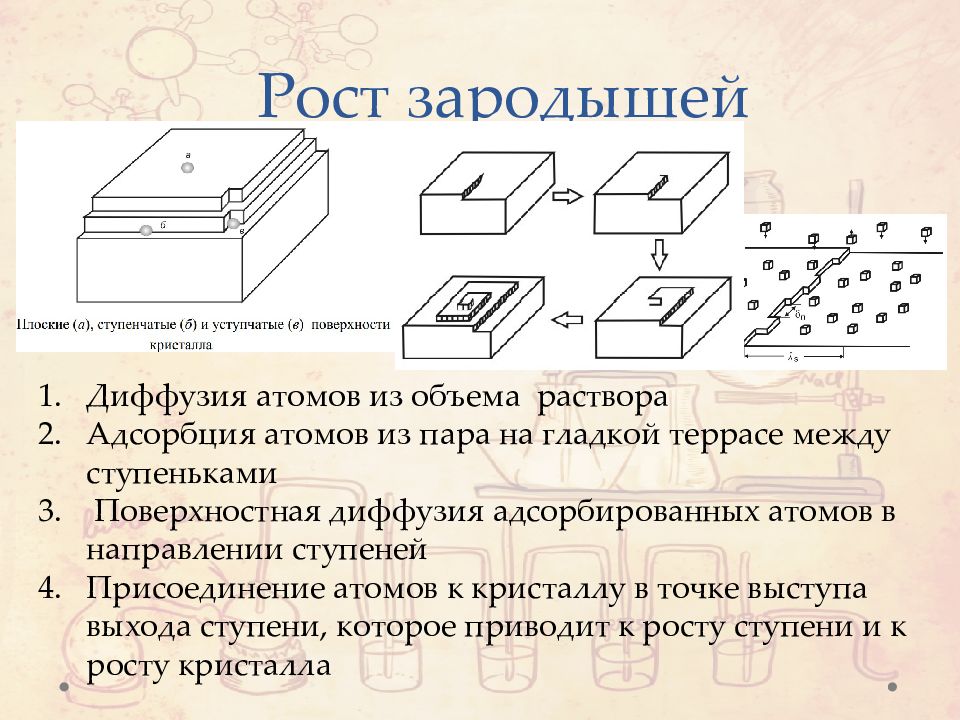
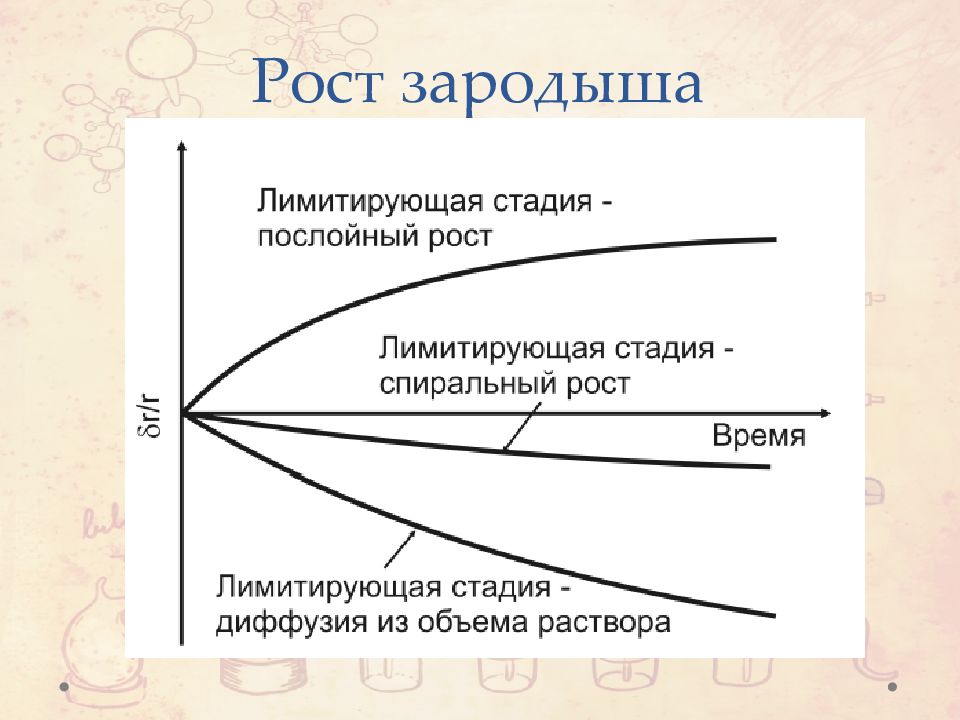
Слайд 16: Рост зародышей
Диффузия атомов из объема раствора Адсорбция атомов из пара на гладкой террасе между ступеньками Поверхностная диффузия адсорбированных атомов в направлении ступеней Присоединение атомов к кристаллу в точке выступа выхода ступени, которое приводит к росту ступени и к росту кристалла
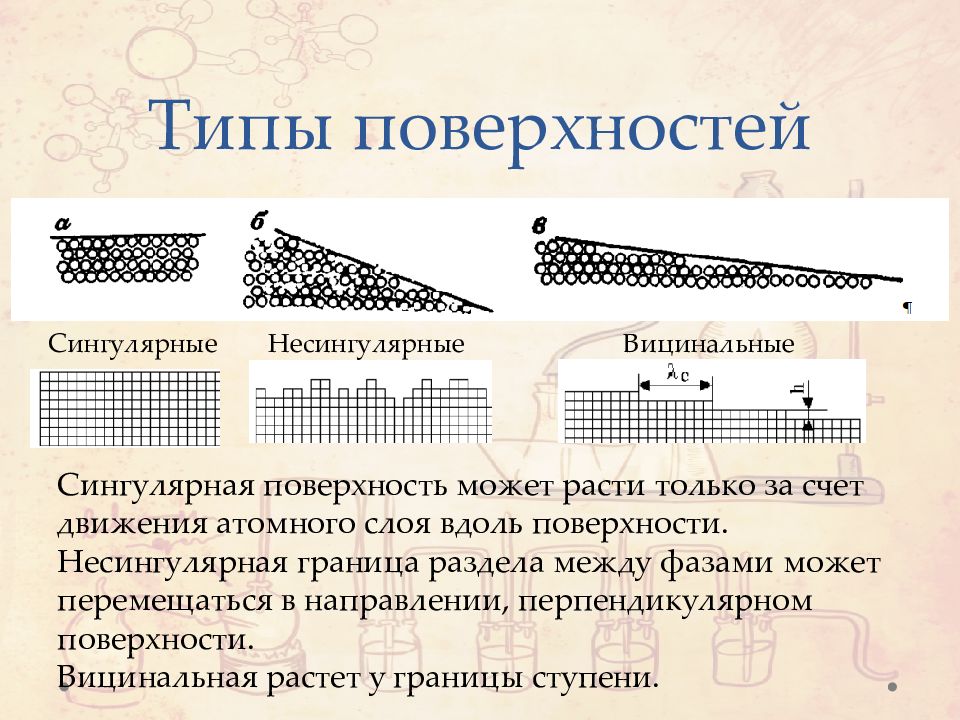
Слайд 19: Типы поверхностей
Сингулярные Несингулярные Вицинальные Сингулярная поверхность может расти только за счет движения атомного слоя вдоль поверхности. Несингулярная граница раздела между фазами может перемещаться в направлении, перпендикулярном поверхности. Вицинальная растет у границы ступени.
Слайд 21
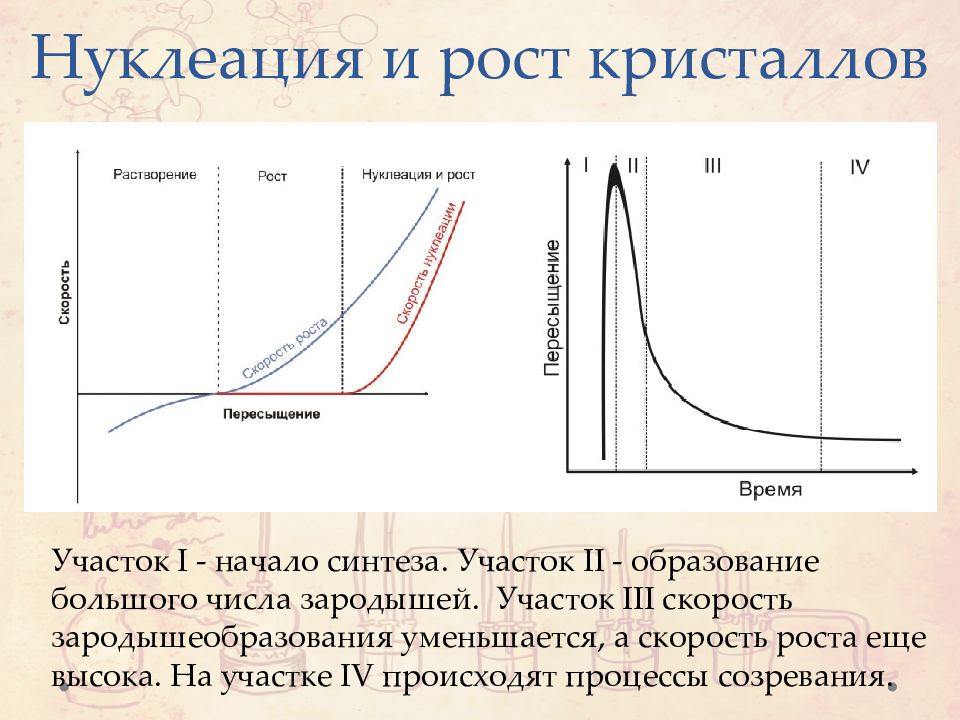
Нуклеация и рост кристаллов Участок I - начало синтеза. Участок II - образование большого числа зародышей. Участок III скорость зародышеобразования уменьшается, а скорость роста еще высока. На участке IV происходят процессы созревания.
Слайд 25
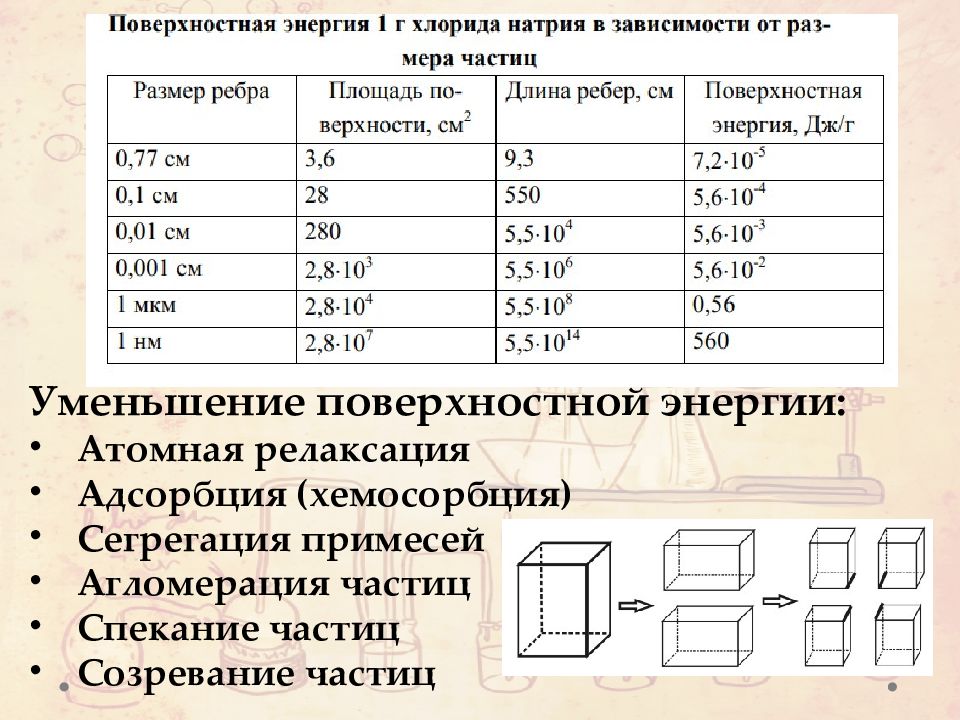
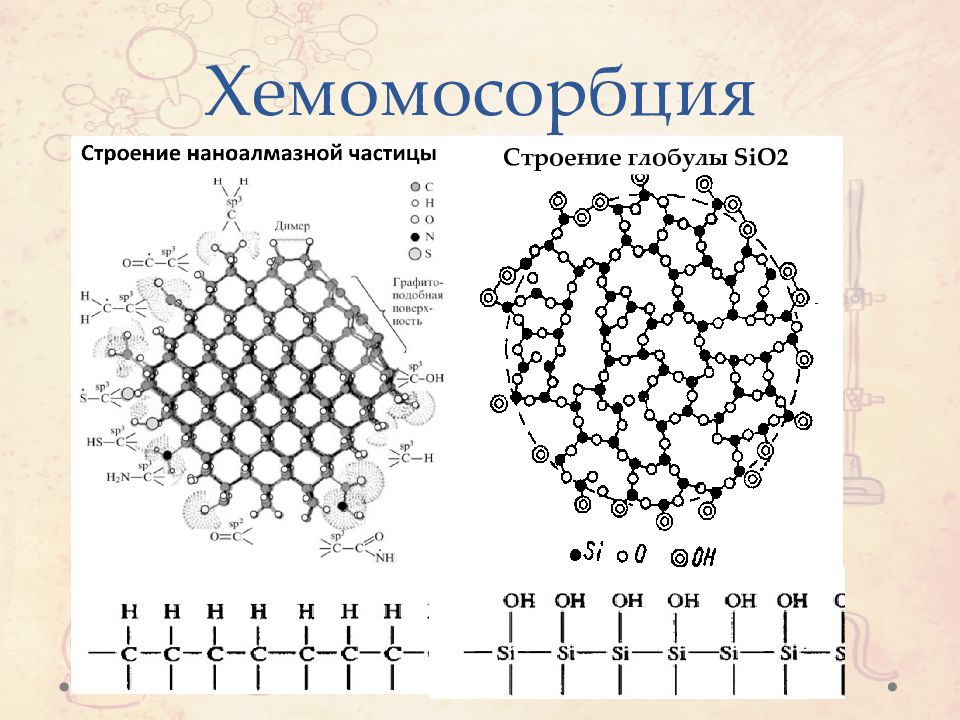
Уменьшение поверхностной энергии: Атомная релаксация Адсорбция (хемосорбция) Сегрегация примесей Агломерация частиц Спекание частиц Созревание частиц
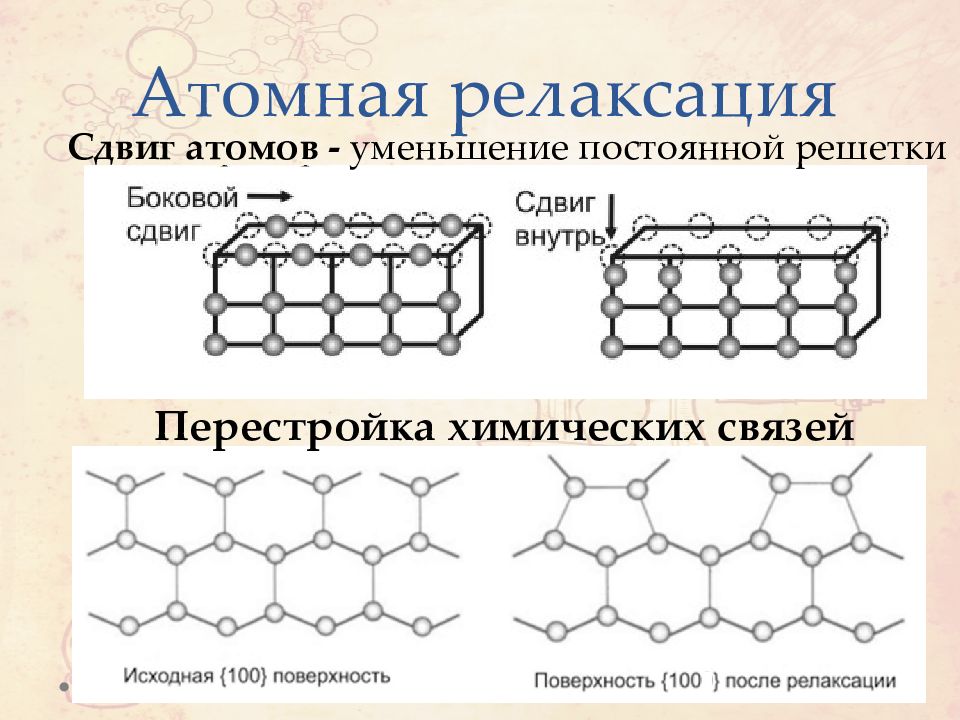
Слайд 26: Атомная релаксация
Сдвиг атомов - уменьшение постоянной решетки Перестройка химических связей
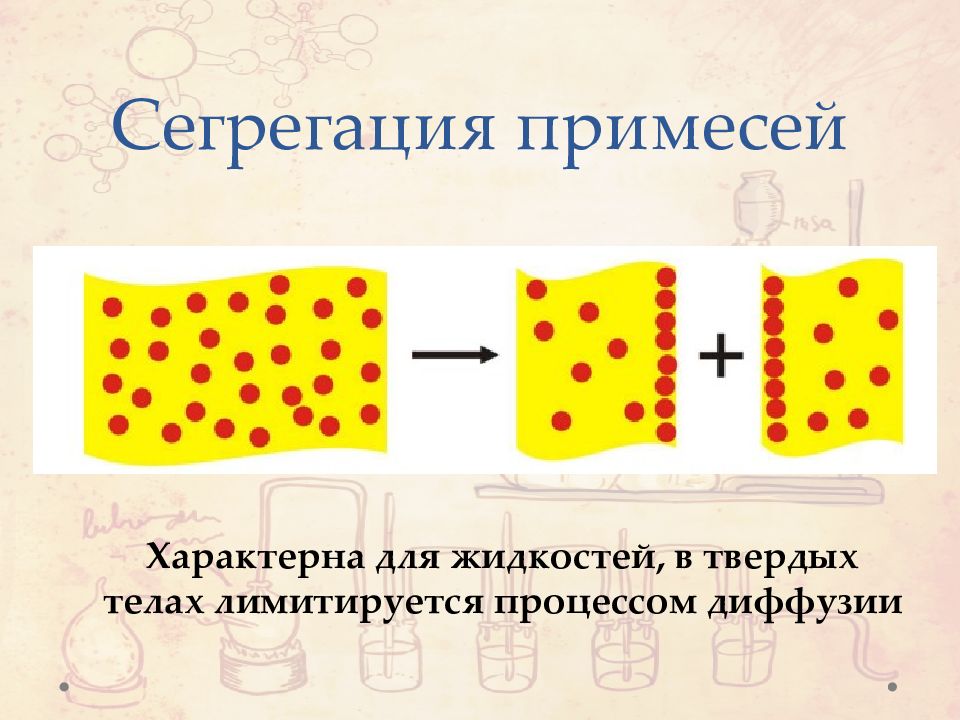
Слайд 28: Сегрегация примесей
Характерна для жидкостей, в твердых телах лимитируется процессом диффузии
Слайд 29: Агломерация наночастиц
Происходит за счет Ван-дер-Ваальсового взаимодействия Практически необратима При синтезе стараться избегать процессов агломерации
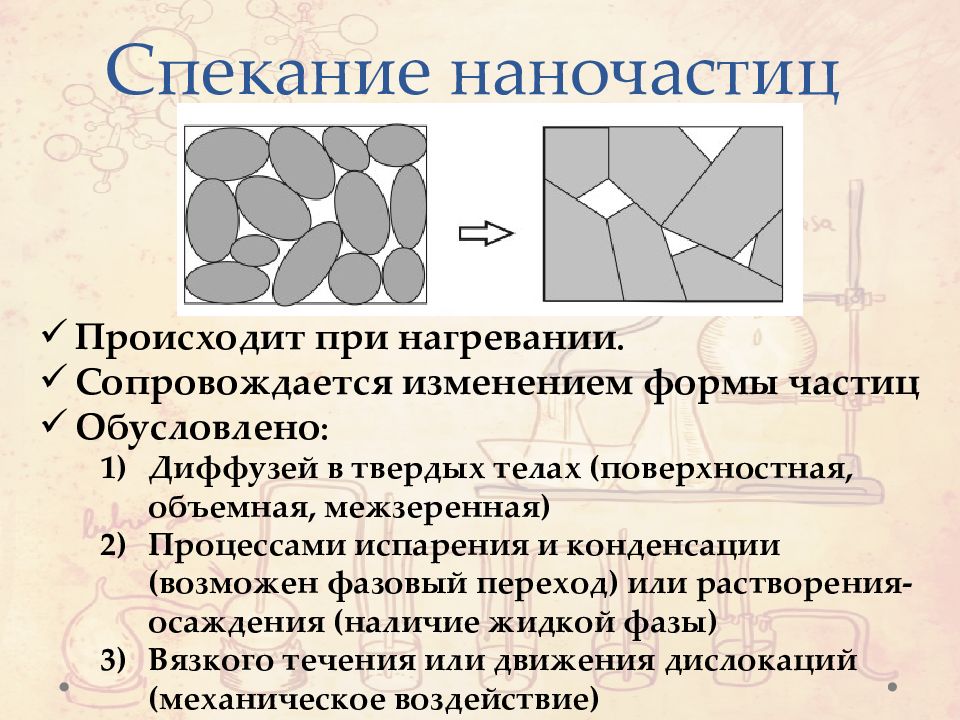
Слайд 30: Спекание наночастиц
Происходит при нагревании. Сопровождается изменением формы частиц Обусловлено : Диффузей в твердых телах (поверхностная, объемная, межзеренная ) Процессами испарения и конденсации (возможен фазовый переход) или растворения-осаждения (наличие жидкой фазы) Вязкого течения или движения дислокаций (механическое воздействие)
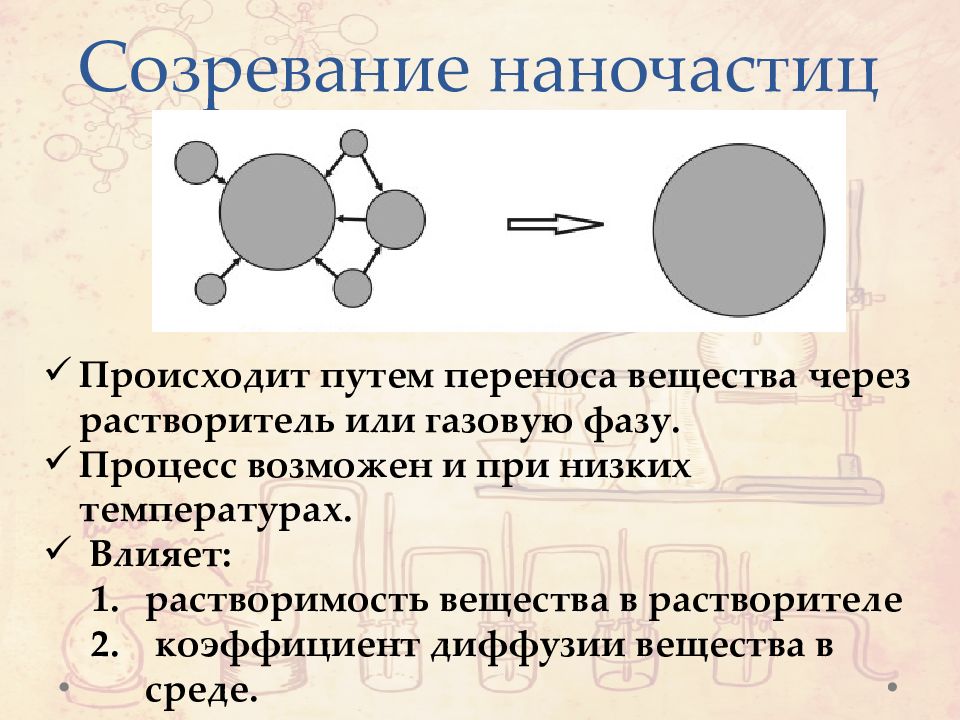
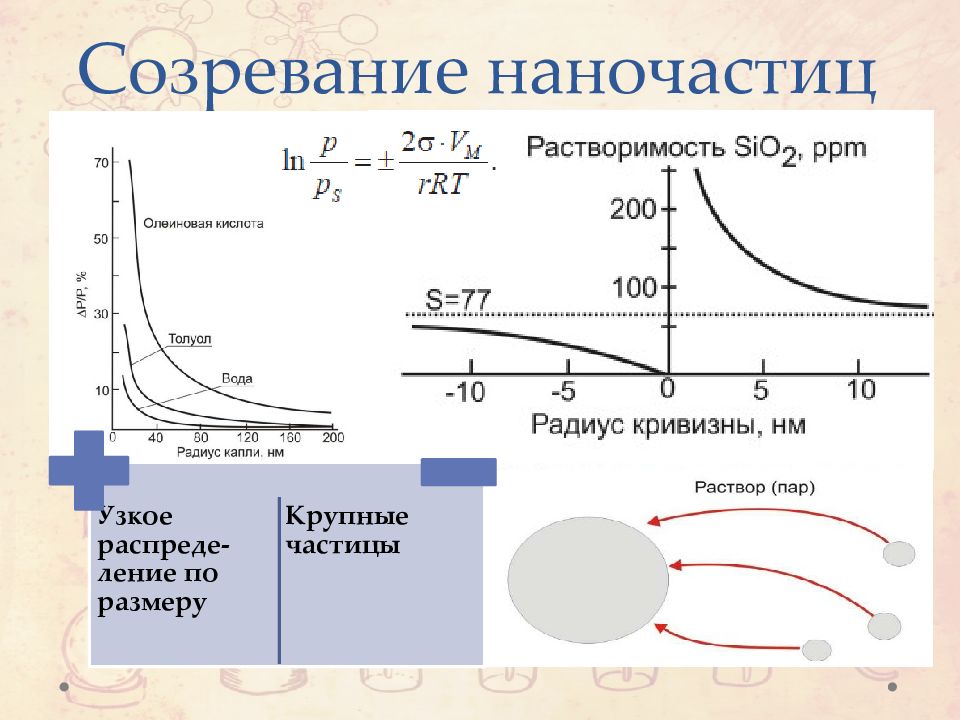
Слайд 31: Созревание наночастиц
Происходит путем переноса вещества через растворитель или газовую фазу. Процесс возможен и при низких температурах. Влияет: растворимость вещества в растворителе коэффициент диффузии вещества в среде.
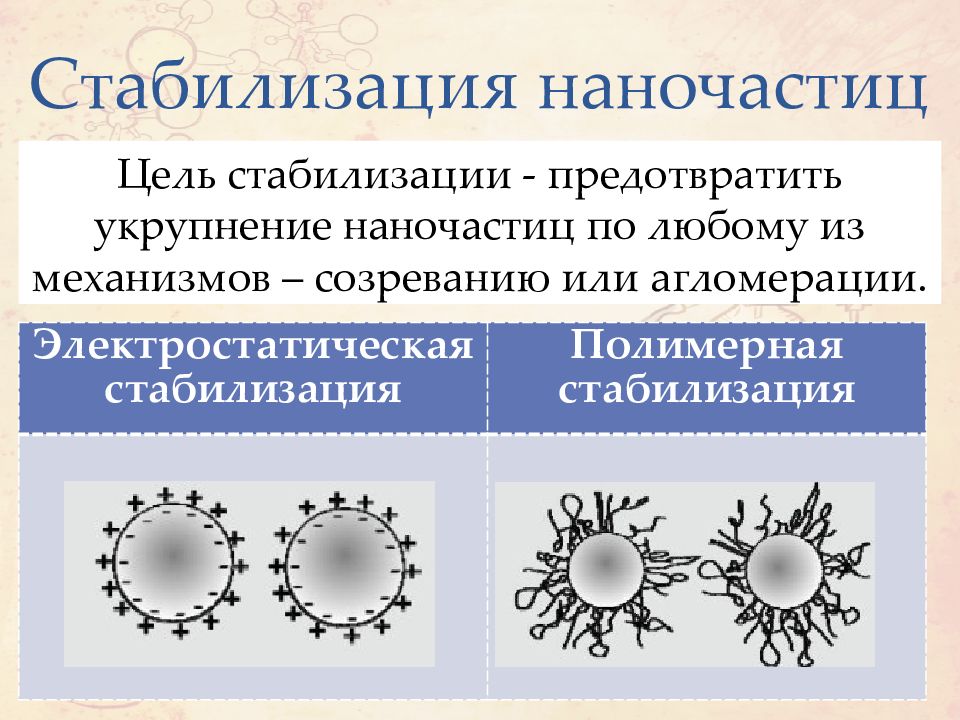
Слайд 33: Стабилизация наночастиц
Цель стабилизации - предотвратить укрупнение наночастиц по любому из механизмов – созреванию или агломерации. Электростатическая стабилизация Полимерная стабилизация
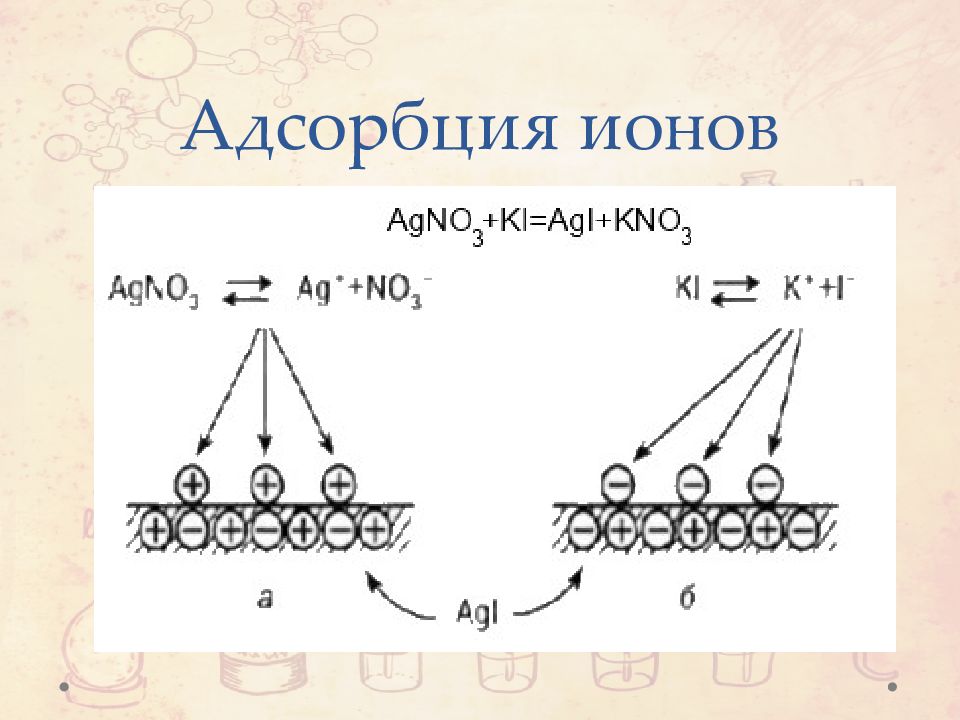
Слайд 34: Электростатическая стабилизация
Электрический заряд, обусловлен: 1. Адсорбция и десорбция ионов 2. Диссоциация поверхностных групп 3. Перенос электронов через границу раздела фаз
Слайд 36: Диссоциация поверхностных групп
рН < т.н.з. поверхность заряжена положительно рН > т.н.з. поверхность заряжена отрицательно
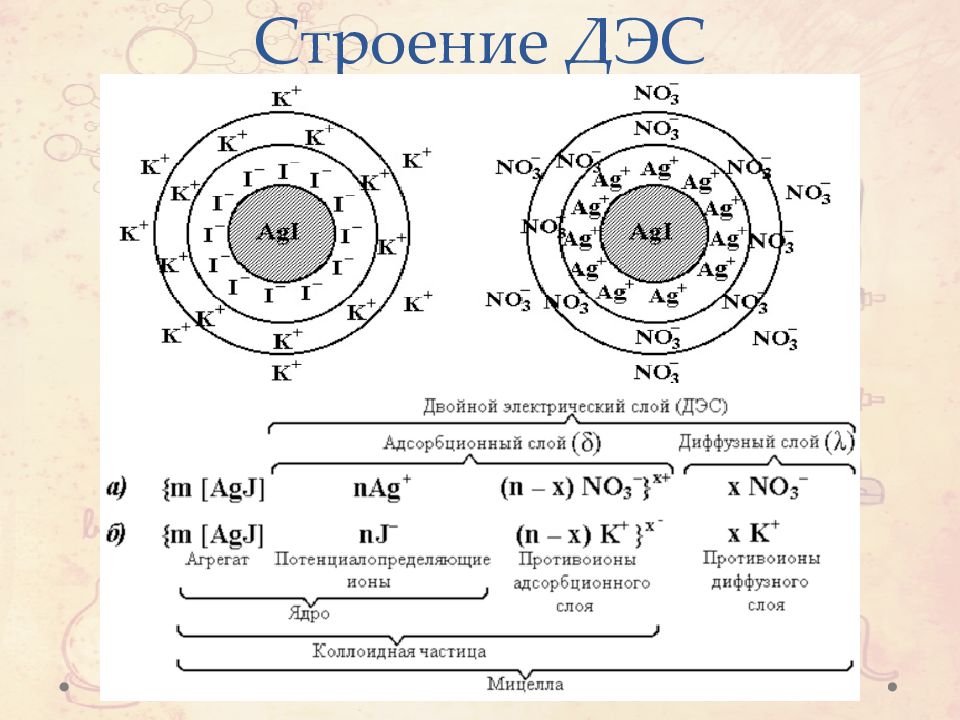
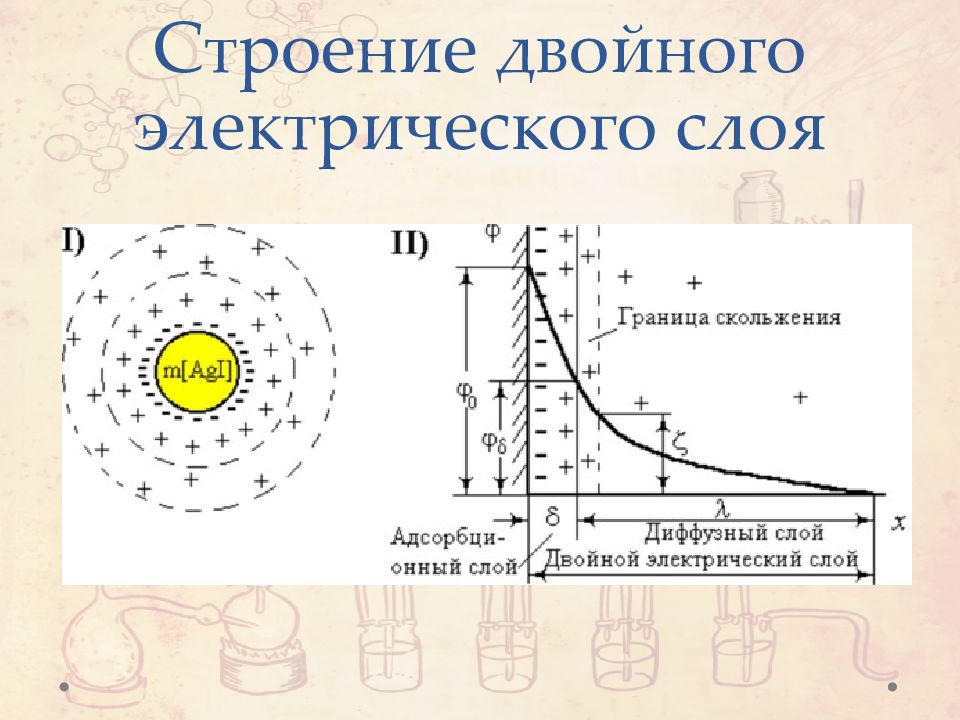
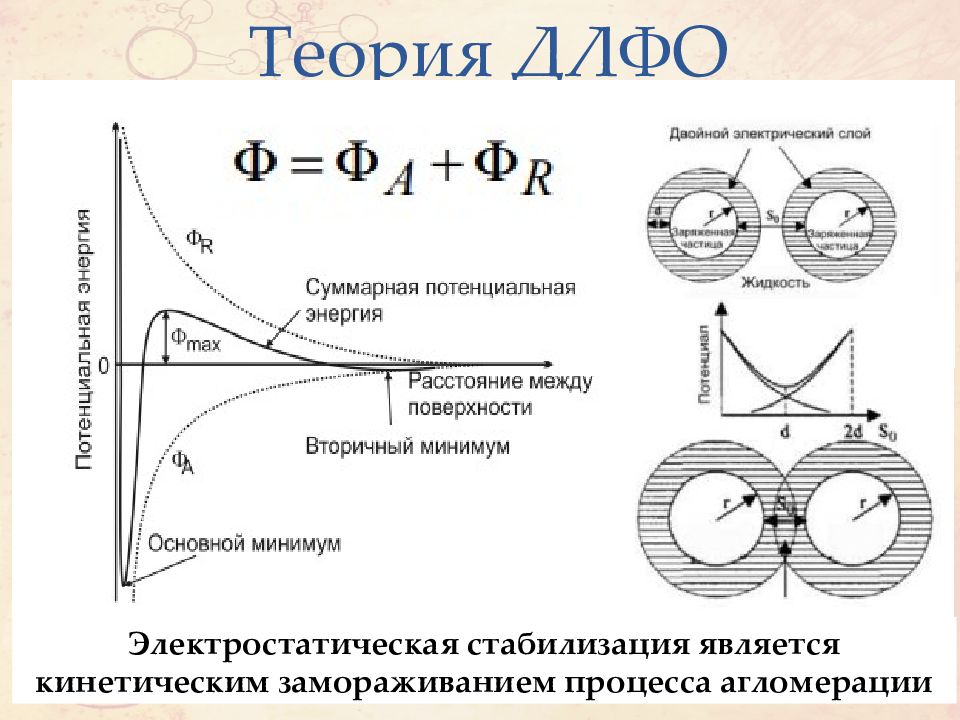
Слайд 40: Теория ДЛФО
Электростатическая стабилизация является кинетическим замораживанием процесса агломерации
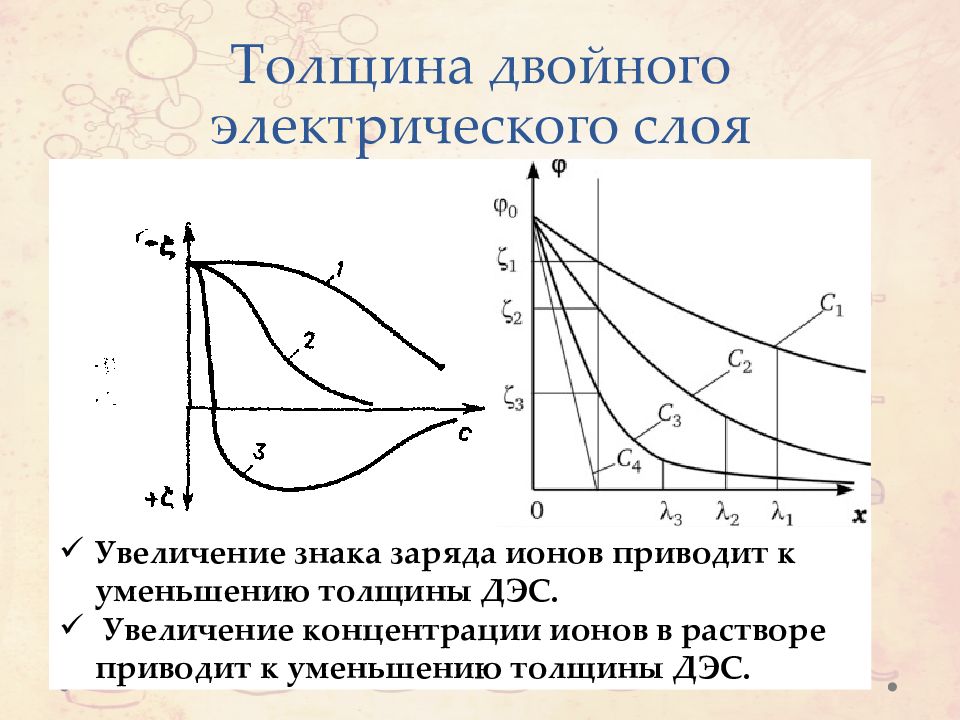
Слайд 41: Толщина двойного электрического слоя
Увеличение знака заряда ионов приводит к уменьшению толщины ДЭС. Увеличение концентрации ионов в растворе приводит к уменьшению толщины ДЭС.
Слайд 42: Электростатическая стабилизация
2FeCl 3 + 3Ba(OH) 2 = 2FeOOH↓ + 3BaCl 2 + 2H 2 O FeCl 3 + 3NH 4 OH = FeOOH ↓ + 3NH 4 Cl + H 2 O Fe 2 (SO 4 ) 3 + 6NH 4 OH = 2FeOOH↓ + 6(NH 4 )2SO 4 + 2H 2 O Ограничения: Применима только для разбавленных систем и ионов малого заряда. Не может применяться для систем, чувствительных к составу электролита Невозможно выделить наночастицы из раствора, так как стабилизация необратима. Нельзя применять к многофазным системам.
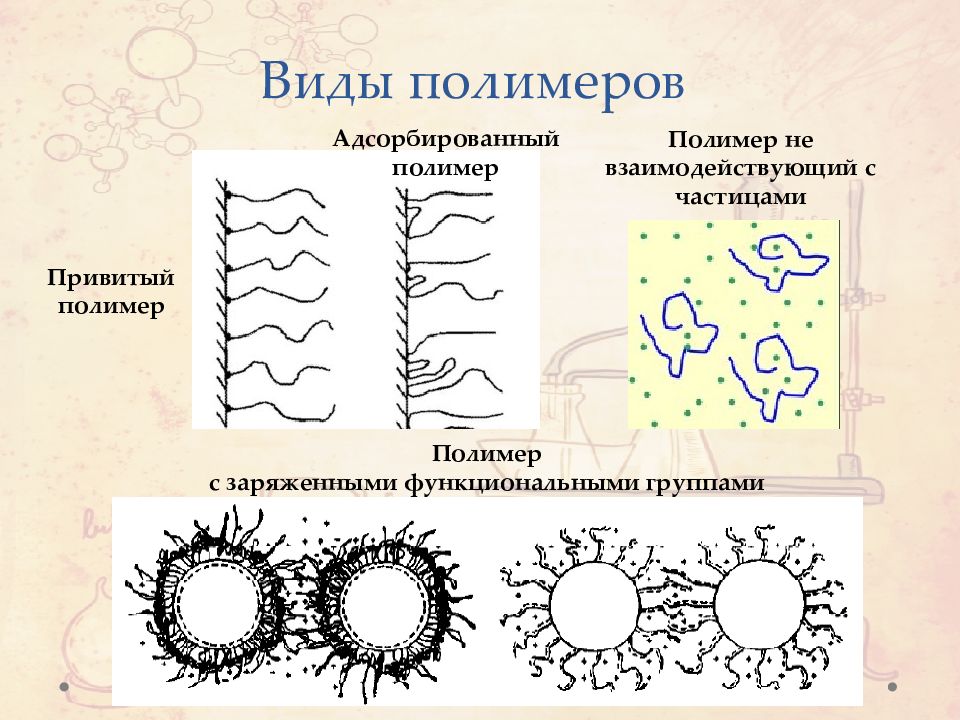
Слайд 44: Виды полимеров
Привитый полимер Адсорбированный полимер Виды полимеров Полимер не взаимодействующий с частицами Полимер с заряженными функциональными группами
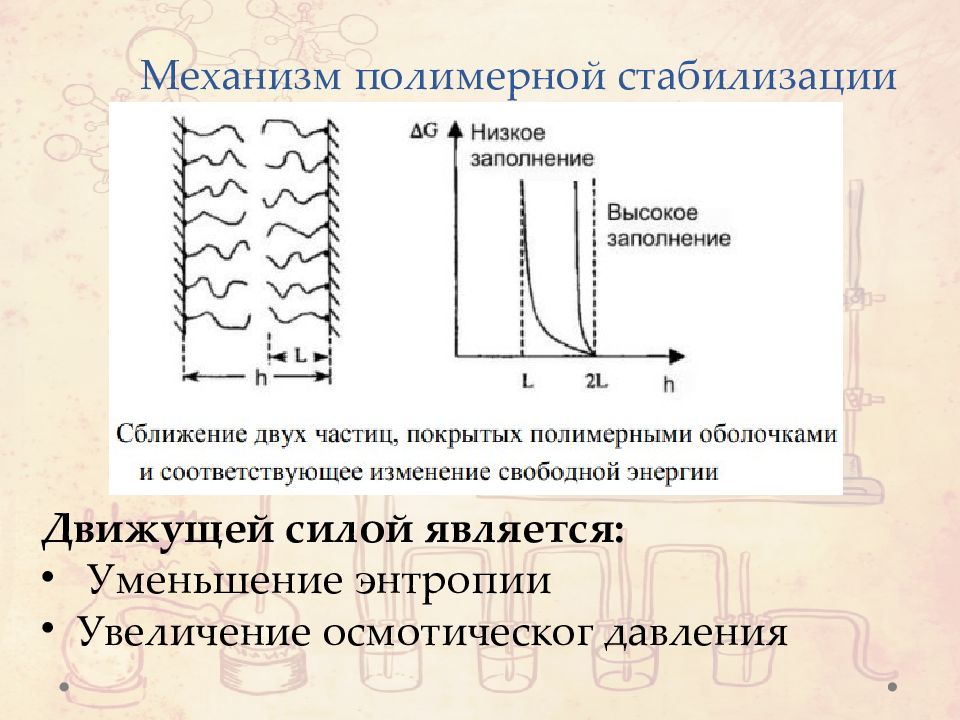
Слайд 45: Механизм полимерной стабилизации
Движущей силой является: Уменьшение энтропии Увеличение осмотическог давления
Последний слайд презентации: Методы синтеза: Преимущества полимерной стабилизации
Это метод термодинамической стабилизации, так что всегда возможен обратный процесс диспергирования сухих наночастиц. Могут быть получены высококонцентрированные дисперсии, и дисперсионная среда даже может быть полностью удалена. Система не чувствительна к электролитам. Пригодна для многофазных систем.