Слайд 2
Генная инженерия Генетическая инжене́рия (генная инженерия) - совокупность приёмов, методов и технологий получения рекомбинантных РНК и ДНК, выделения генов из организма (клеток), осуществления манипуляций с генами, введения их в другие организмы и выращивания искусственных организмов после удаления выбранных генов из ДНК. Генетическая инженерия не является наукой в широком смысле, но является инструментом биотехнологии, используя методы таких биологических наук, как молекулярная и клеточная биология, генетика, микробиология, вирусология
Слайд 3
Генная инженерия Рекомбинантная структура (англ. Recombinant structure ) - гибридная (англ. recombination — рекомбинация) нуклеиновая кислота (ДНК или РНК) или белок, полученные в результате объединения in vitro чужеродных фрагментов и содержащие новые сочетания последовательностей нуклеотидов или аминокислот, соответственно
Слайд 4
Генная инженерия Рекомбинация - процесс обмена генетическим материалом путем разрыва и соединения разных молекул нуклеиновых кислот, то есть перераспределение генетического материала, приводящее к созданию новых комбинаций генов. В естественных условиях рекомбинация у эукариот — обмен участками хромосом в процессе клеточного деления. У прокариот рекомбинация осуществляется при передаче ДНК путём конъюгации, трансформации или трансдукции, либо в процессе обмена участками вирусных геномов.
Слайд 5
Генная инженерия Конъюга́ция (от лат. conjugatio — соединение) — однонаправленный перенос части генетического материала (плазмид или бактериальной хромосомы) при непосредственном контакте двух бактериальных клеток. Посредством конъюгации бактерии обмениваются генетическим материалом, поддерживая своё генетическое разнообразие. Трансформа́ция (англ. transformation ) — процесс поглощения бактериальной клеткой молекулы ДНК из внешней среды. Для того, чтобы быть способной к трансформации, клетка должна быть компетентной, то есть молекулы ДНК должны иметь возможность проникнуть в неё через клеточные покровы.
Слайд 6
Генная инженерия Трансду́кция (от лат. transductio — перемещение) — процесс переноса ДНК между клетками при помощи вирусов. Примером трансдукции является перенос бактериальной ДНК из одной клетки в другую бактериофагом.
Слайд 7
Генная инженерия Трансфе́кция — процесс введения нуклеиновой кислоты в клетки эукариот невирусным методом. Аналогичный процесс в отношении прокариот называется трансформация. Трансфекция обычно включает образование в плазматической мембране отверстий, через которые внутрь клетки может проникать внеклеточный материал. Трансфицирован может быть генетический материал, такой как ДНК или РНК, а также белки, например, антитела. Для трансфекции часто используют сильное электрическое поле ( электропорация ) или электростатически заряженные липиды, способные к образованию липосом, структур, которые сливаются с плазматической мембраной, выбрасывая внутрь клетки заключенный в них материал. Известны и другие методы трансфекции.
Слайд 8
Генная инженерия Плазми́ды (англ. plasmids ) — небольшие молекулы ДНК, физически обособленные от хромосом и способные к автономной репликации. Главным образом, плазмиды встречаются у бактерий, а также у некоторых архей и эукариот (грибов и высших растений). Чаще всего плазмиды представляют собой двухцепочечные кольцевые молекулы. Искусственные плазмиды используются как векторы в клонировании ДНК, причём благодаря их способности к репликации обеспечивается возможность репликации рекомбинантной ДНК в клетке-хозяине.
Слайд 9
Разрезание ДНК эндонуклеазами рестрикции Система рестрикции-модификации - ферментативная система бактерий, разрушающая попавшую в клетку чужеродную ДНК. Основная её функция — защита клетки от чужеродного генетического материала, например, бактериофагов и плазмид. Для компонентов системы характерны два типа активности — метилтрансферазная ( метилазная ) и эндонуклеазная. За каждую из них могут отвечать как отдельные белки, так и один белок, сочетающий в себе обе функции
Слайд 10
Разрезание ДНК эндонуклеазами рестрикции Эндонуклеаза EcoRV в комплексе с расщепленным фрагментом ДНК
Слайд 11
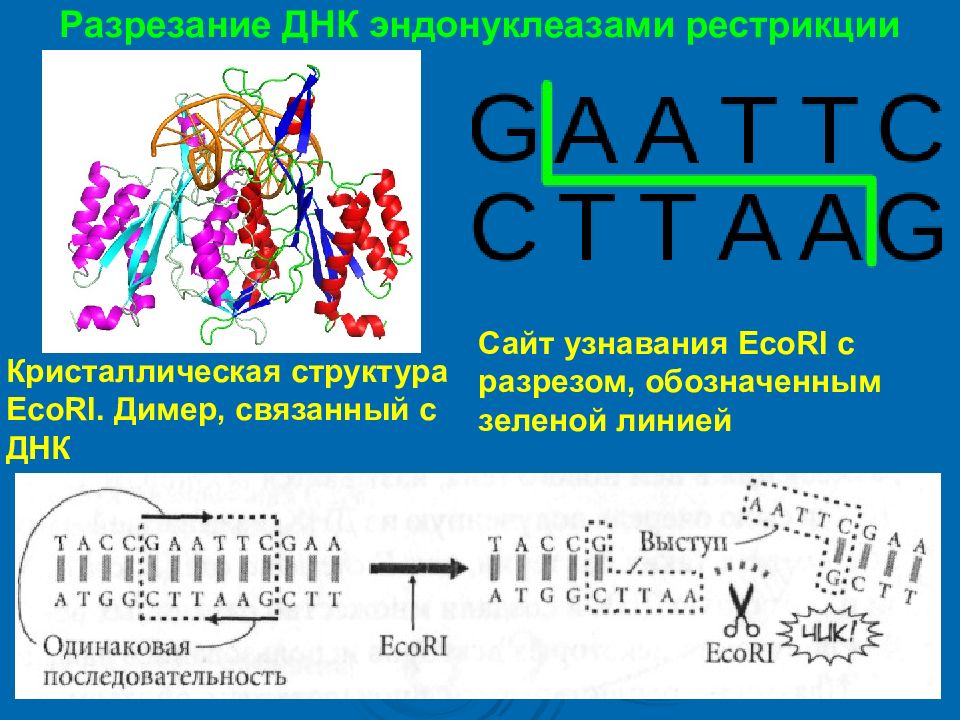
Разрезание ДНК эндонуклеазами рестрикции Кристаллическая структура EcoRI. Димер, связанный с ДНК Сайт узнавания EcoRI с разрезом, обозначенным зеленой линией
Слайд 12
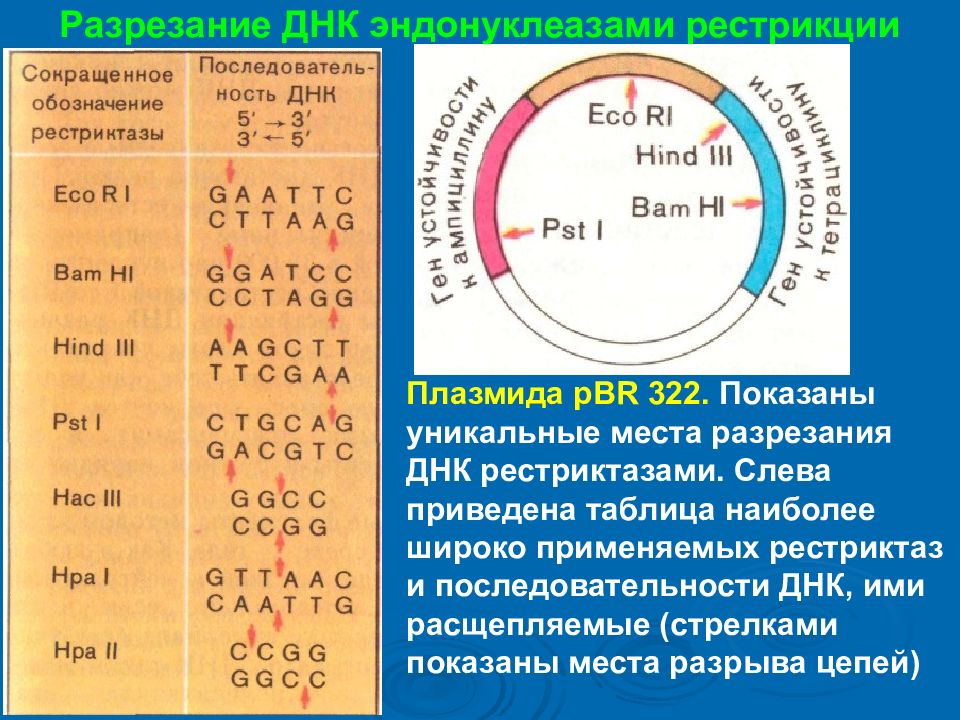
Разрезание ДНК эндонуклеазами рестрикции Плазмида pBR 322. Показаны уникальные места разрезания ДНК рестриктазами. Слева приведена таблица наиболее широко применяемых рестриктаз и последовательности ДНК, ими расщепляемые (стрелками показаны места разрыва цепей )
Слайд 13
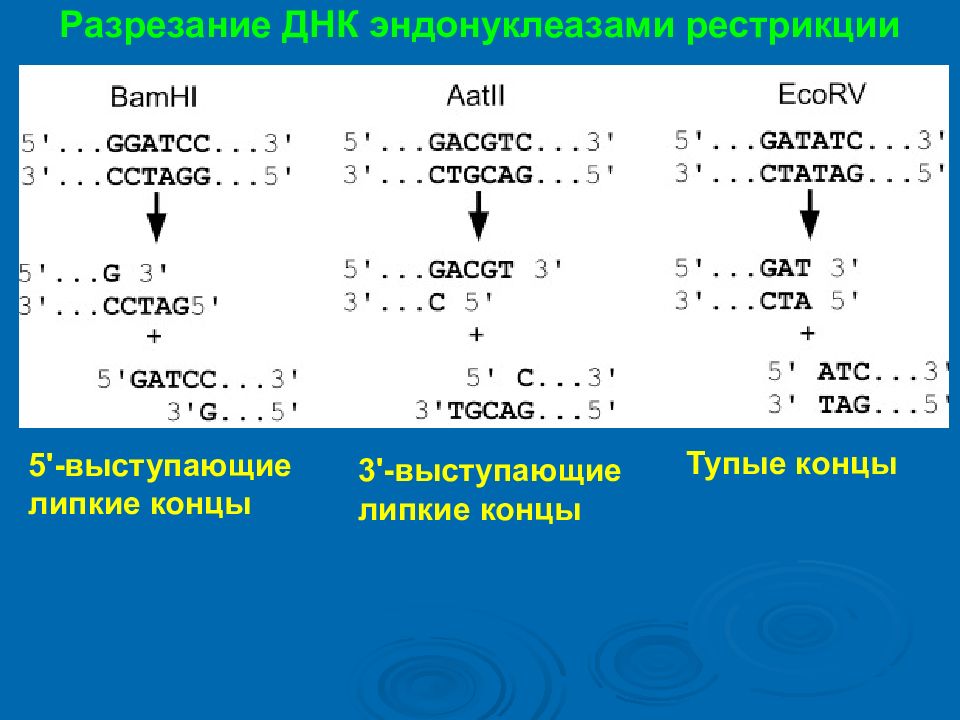
Разрезание ДНК эндонуклеазами рестрикции 5'-выступающие липкие концы 3'- выступающие липкие концы Тупые концы
Слайд 14
Генная инженерия Клоном называют множество идентичных копий, образованных из одного предшественника. Молекулярное клонирование - введение интересующего фрагмента ДНК в молекулу-вектор, которая вместе с собой размножит этот фрагмент в какой-то клетке. Для получения рекомбинантной ДНК используется клонирование ДНК, либо клонирование кДНК Клонирование ДНК часто применяют для амплификации фрагментов, содержащих гены, а также любые другие последовательности — например, промоторы, некодирующие последовательности, химически синтезированные олигонуклеотиды и случайные участки ДНК.
Слайд 15
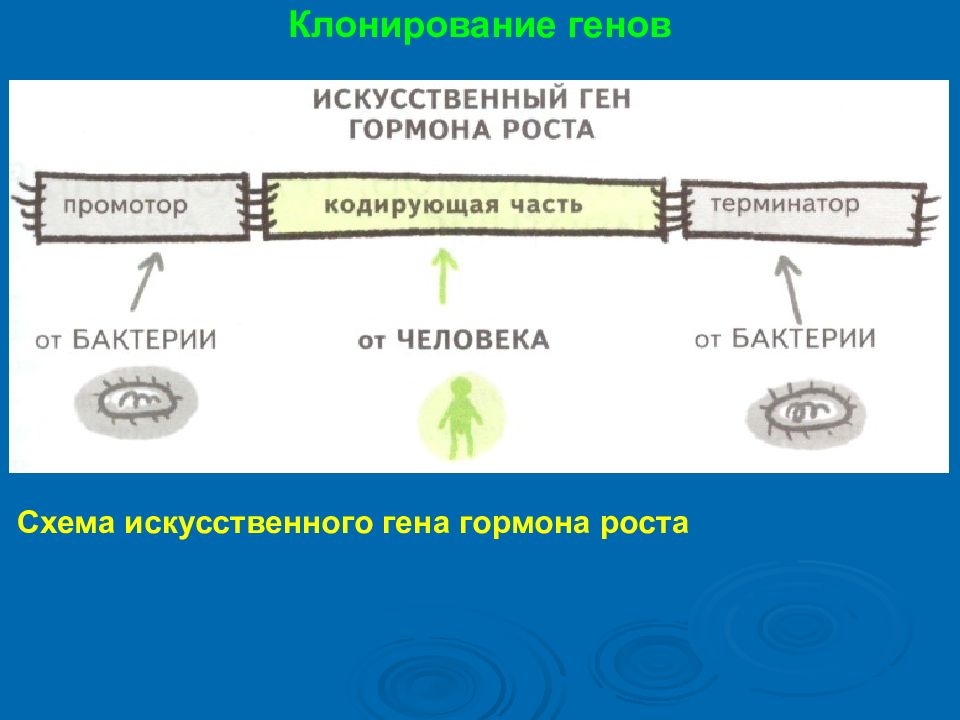
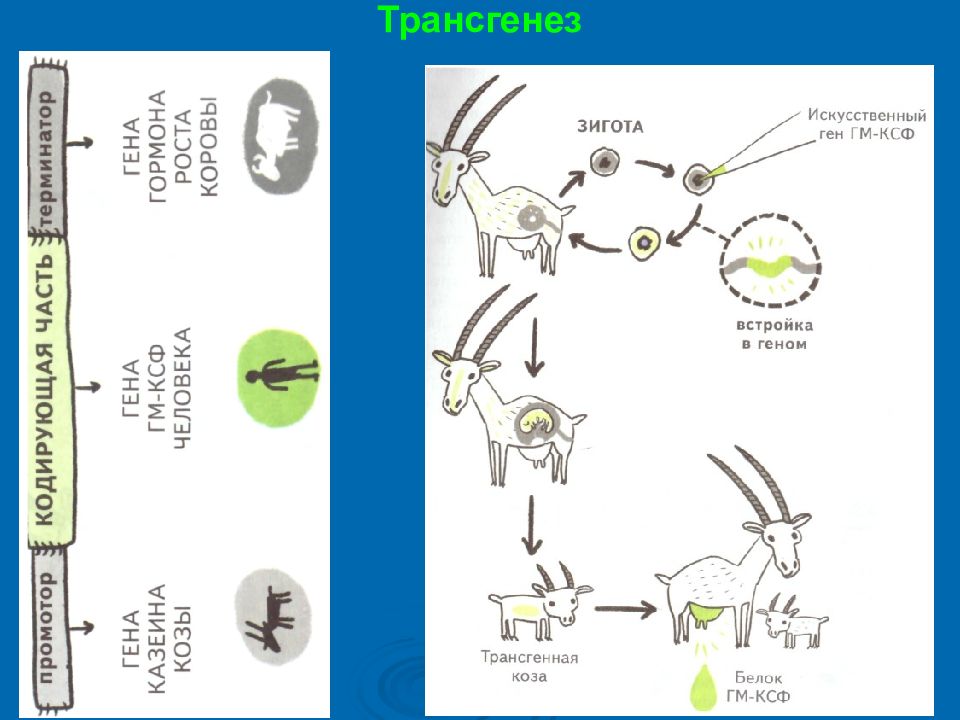
Клонирование генов Главное правило генной инженерии - если кодирующую часть для искусственного гена мы можем брать у любого организма, то части, регулирующие транскрипцию (промотор и терминатор), нужно брать у того организма, в котором искусственный ген будет работать. Руководствуясь этим правилом, для сборки искусственного гена используют промотор и терминатор от какого-нибудь гена кишечной палочки (если клонируем в E. coli ), про который известно, что он работает очень активно.
Слайд 17
Генная инженерия Вектор (в генетике и молекулярной биологии) — молекула нуклеиновой кислоты, чаще всего ДНК, используемая в генетической инженерии для пе-редачи генетического материала внутрь клетки, в том числе, в клетку живого многоклеточного организма in vivo.
Слайд 18
Генная инженерия Идеальный вектор должен обладать: местами для удобного встраивания фрагментов ДНК; достаточной ёмкостью; селективными маркерами, позволяющими выявлять клетки с этим вектором — как «пустым», так и со «вставкой»; участками ДНК, обеспечивающими его поддержание в виде отдельного репликона, либо интеграцию клонированного фрагмента в хозяйский геном; участками ДНК, обеспечивающими (если требуется) эффективную экспрессию встроенного гена в выбранном хозяине.
Слайд 19
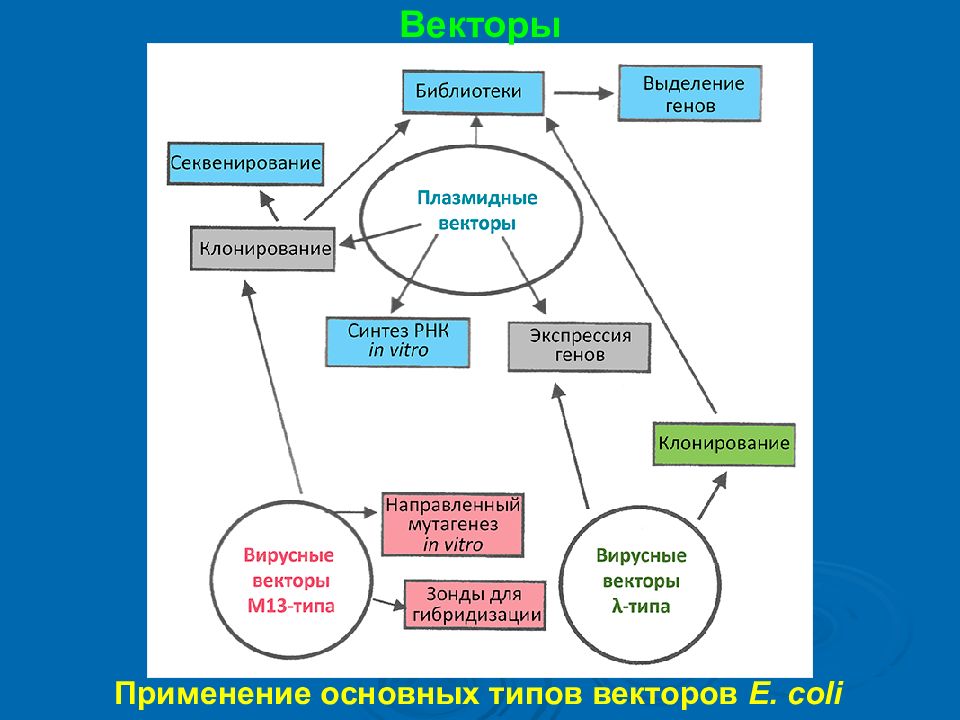
Генная инженерия Классифицируют векторы в зависимости от хозяев, в которых им предстоит попасть (бактериальные, дрожжевые и т.п.), в зависимости от типа репликона ( плазмидные, вирусные, комбинированные, челночные, искусственные хромосомы) и в зависимости от функционального назначения (интегративные, экспрессионные, векторы для клонирования, секвенирования или транскрипции).
Слайд 20
Генная инженерия Существующие векторы: плазмиды, фазмиды, векторы на основе вируса SV40, векторы на основе аденовирусов, векторы на основе герпесвирусов, векторы на основе ретровирусов, векторы на основе аденоассоциированного вируса.
Слайд 21
Векторы В природном виде векторы для клонирования обычно не используют, а создают химеры, содержащие только самое необходимое: место начала репликации ( origin, oriV ); соответствующий ген белка — инициатора репликации ( rep ) и другие элементы контроля репликации (необходимость во всём этом определяется типом ori );
Слайд 22
Векторы последовательности, обеспечивающие стабильное поддержание вектора в бактериальном потомстве (это нужно только для низкокопийных плазмид, которые не могут полагаться на авось при распределении своих дефицитных копий по разделяющимся клеткам хозяина); селективный/ детекционный маркер (чаще это ген устойчивости к антибиотику — ампициллину, тетрациклину, канамицину — и/или часть гена lacZ );
Слайд 23
Векторы полилинкер, или мультиклональный сайт (MCS) — компактный фрагмент ДНК, с последовательностями, распознаваемыми разными рестриктазами ; в разрез, сделанный каким-то ферментом (или двумя) как раз и вставляется клонируемый ген, поэтому сайты рестриктаз из MCS не должны встречаться где-то еще в векторе, иначе он развалится.
Слайд 24
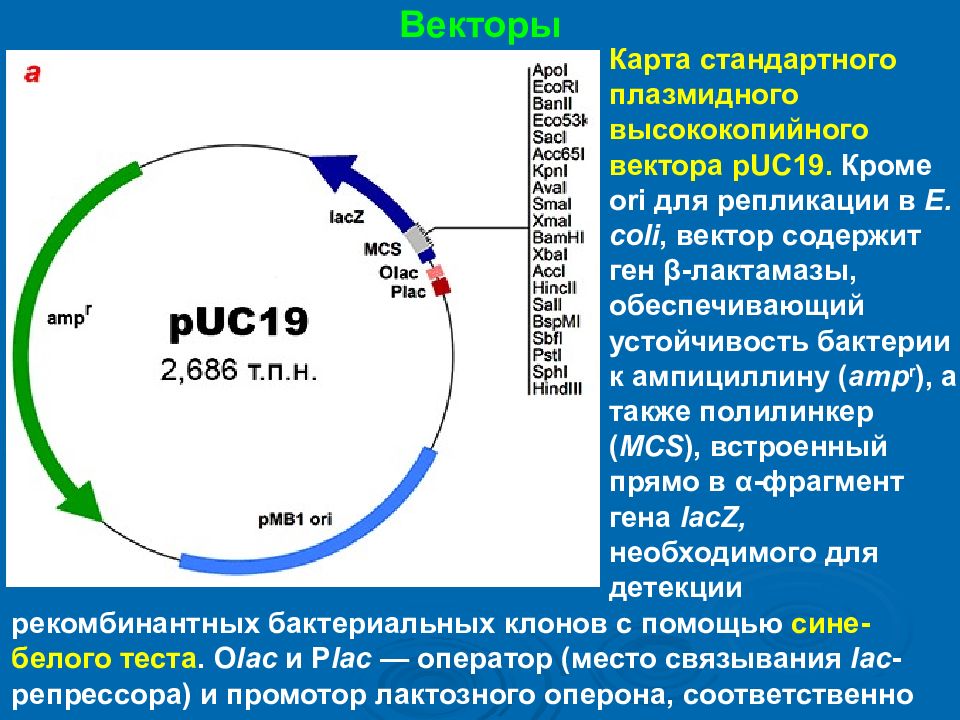
Векторы Карта стандартного плазмидного высококопийного вектора pUC19. Кроме ori для репликации в E. coli, вектор содержит ген β- лактамазы, обеспечивающий устойчивость бактерии к ампициллину ( amp r ), а также полилинкер ( MCS ), встроенный прямо в α-фрагмент гена lacZ, необходимого для детекции рекомбинантных бактериальных клонов с помощью сине-белого теста. O lac и P lac — оператор (место связывания lac -репрессора) и промотор лактозного оперона, соответственно
Слайд 25
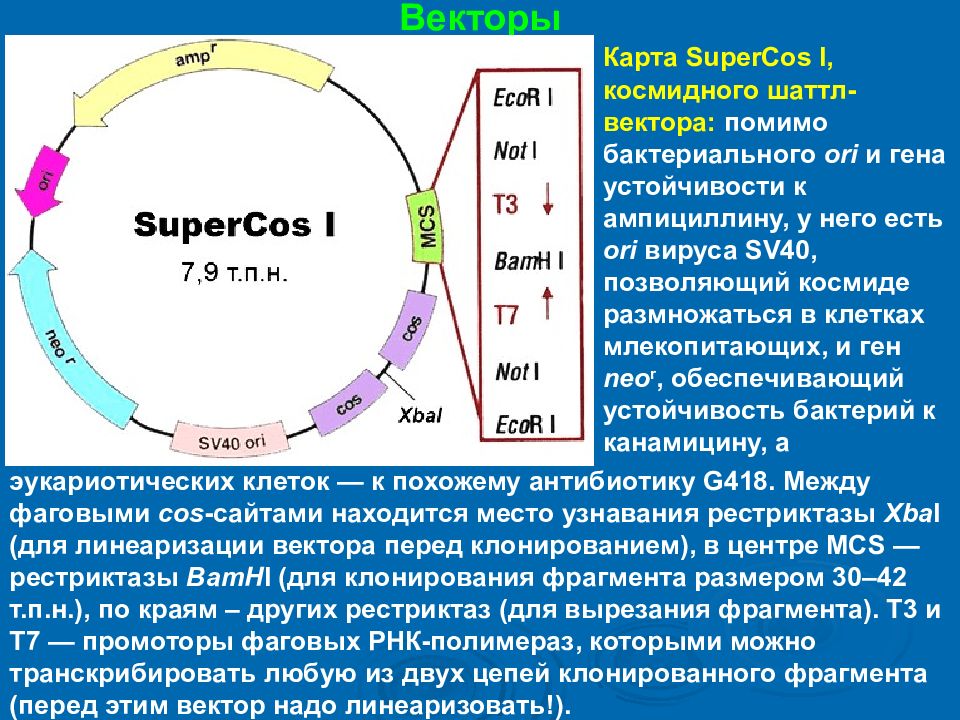
Векторы Карта SuperCos I, космидного шаттл-вектора: помимо бактериального ori и гена устойчивости к ампициллину, у него есть ori вируса SV40, позволяющий космиде размножаться в клетках млекопитающих, и ген neo r, обеспечивающий устойчивость бактерий к канамицину, а эукариотических клеток — к похожему антибиотику G418. Между фаговыми cos -сайтами находится место узнавания рестриктазы Xba I (для линеаризации вектора перед клонированием), в центре MCS — рестриктазы BamH I (для клонирования фрагмента размером 30–42 т.п.н.), по краям – других рестриктаз (для вырезания фрагмента). Т3 и Т7 — промоторы фаговых РНК-полимераз, которыми можно транскрибировать любую из двух цепей клонированного фрагмента (перед этим вектор надо линеаризовать!).
Слайд 26
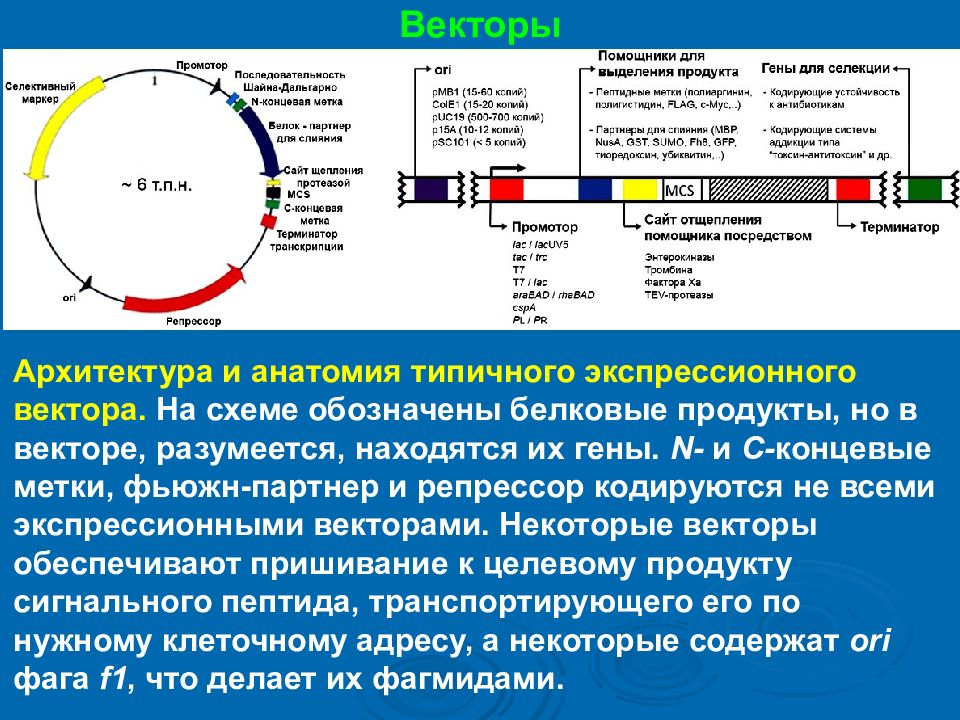
Векторы Архитектура и анатомия типичного экспрессионного вектора. На схеме обозначены белковые продукты, но в векторе, разумеется, находятся их гены. N- и C- концевые метки, фьюжн -партнер и репрессор кодируются не всеми экспрессионными векторами. Некоторые векторы обеспечивают пришивание к целевому продукту сигнального пептида, транспортирующего его по нужному клеточному адресу, а некоторые содержат ori фага f1, что делает их фагмидами.
Слайд 28
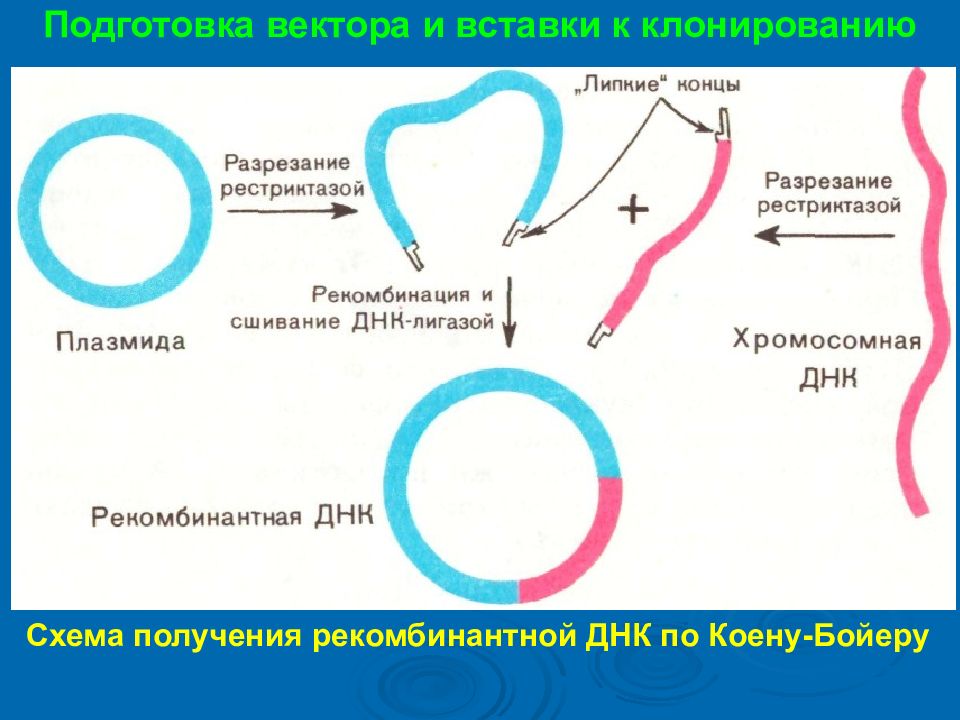
Подготовка вектора и вставки к клонированию Схема получения рекомбинантной ДНК по Коену-Бойеру
Слайд 29
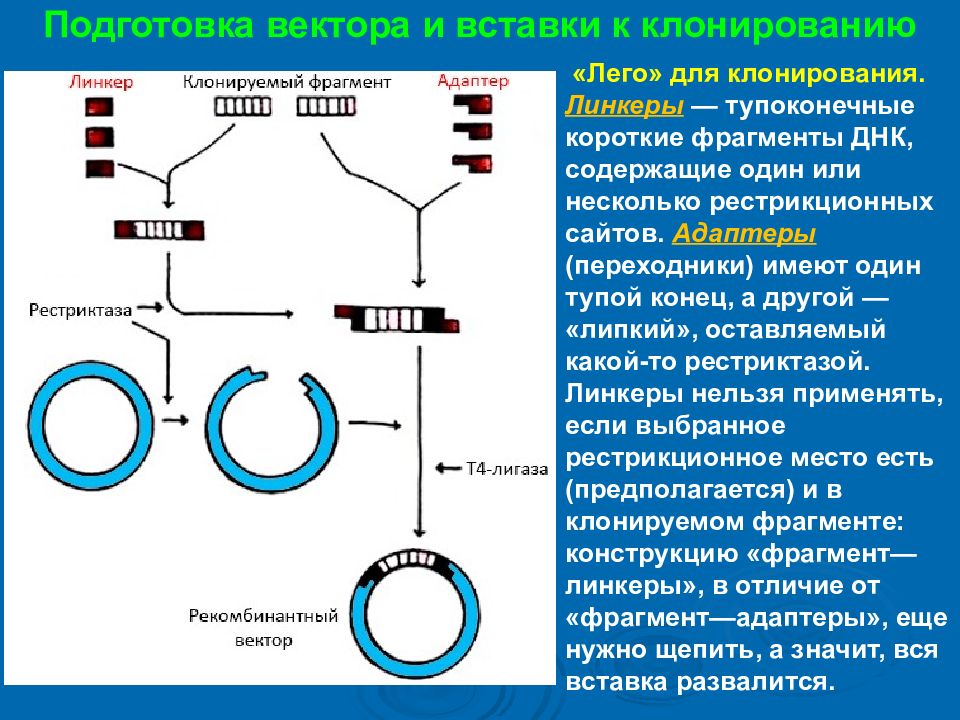
Подготовка вектора и вставки к клонированию « Лего » для клонирования. Линкеры — тупоконечные короткие фрагменты ДНК, содержащие один или несколько рестрикционных сайтов. Адаптеры (переходники) имеют один тупой конец, а другой — «липкий», оставляемый какой-то рестриктазой. Линкеры нельзя применять, если выбранное рестрикционное место есть (предполагается) и в клонируемом фрагменте: конструкцию «фрагмент—линкеры», в отличие от «фрагмент—адаптеры», еще нужно щепить, а значит, вся вставка развалится.
Слайд 30
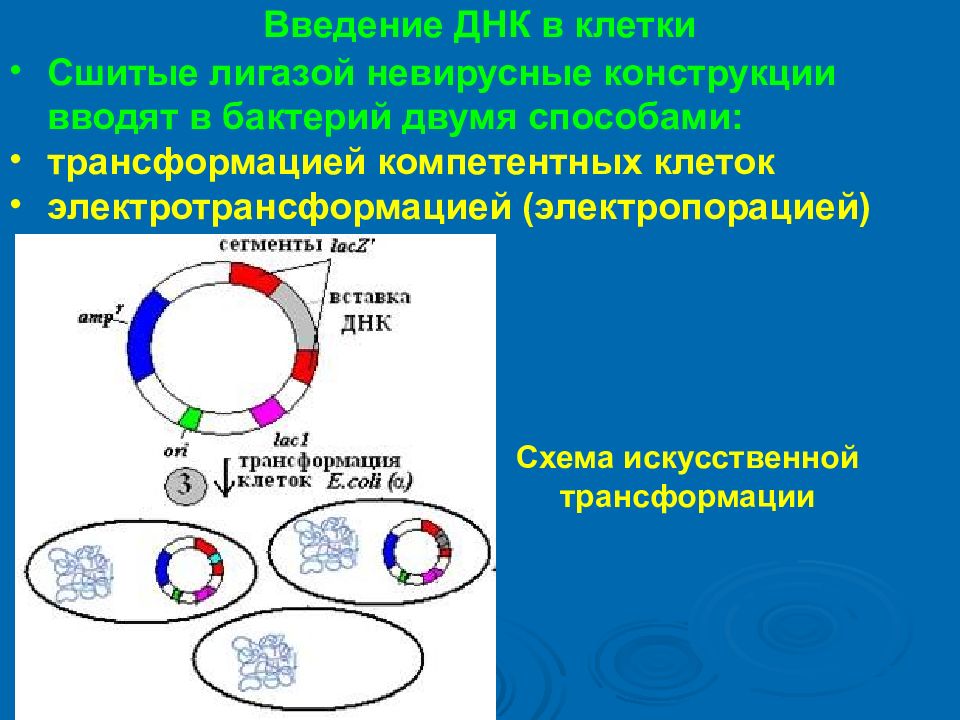
Введение ДНК в клетки Сшитые лигазой невирусные конструкции вводят в бактерий двумя способами : трансформацией компетентных клеток электротрансформацией ( электропорацией ) Схема искусственной трансформации
Слайд 31
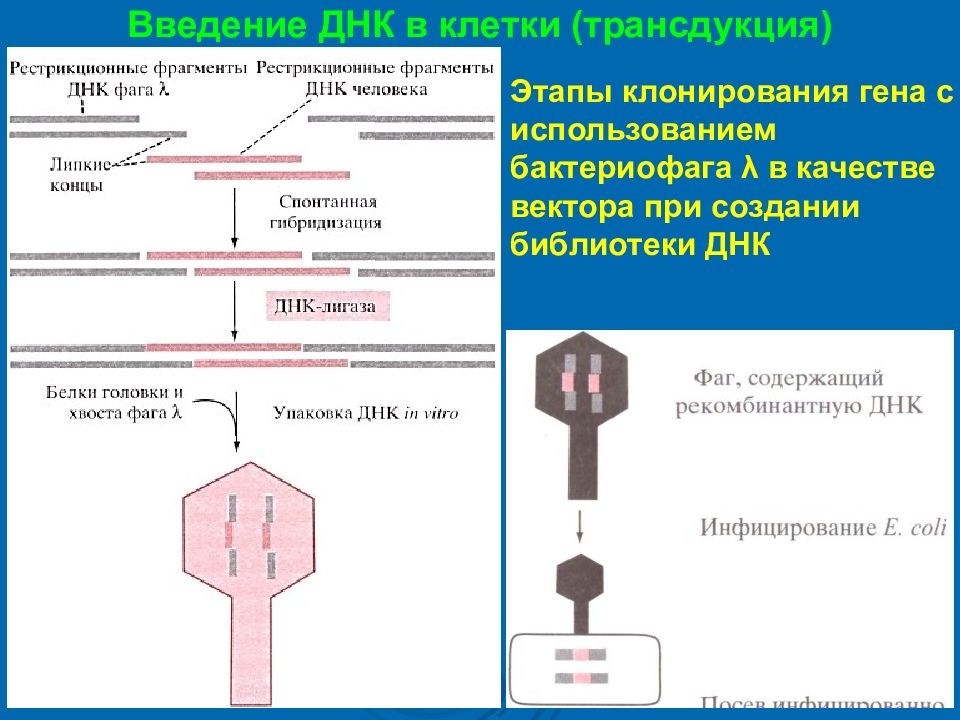
Введение ДНК в клетки (трансдукция) Этапы клонирования гена с использованием бактериофага λ в качестве вектора при создании библиотеки ДНК
Слайд 32
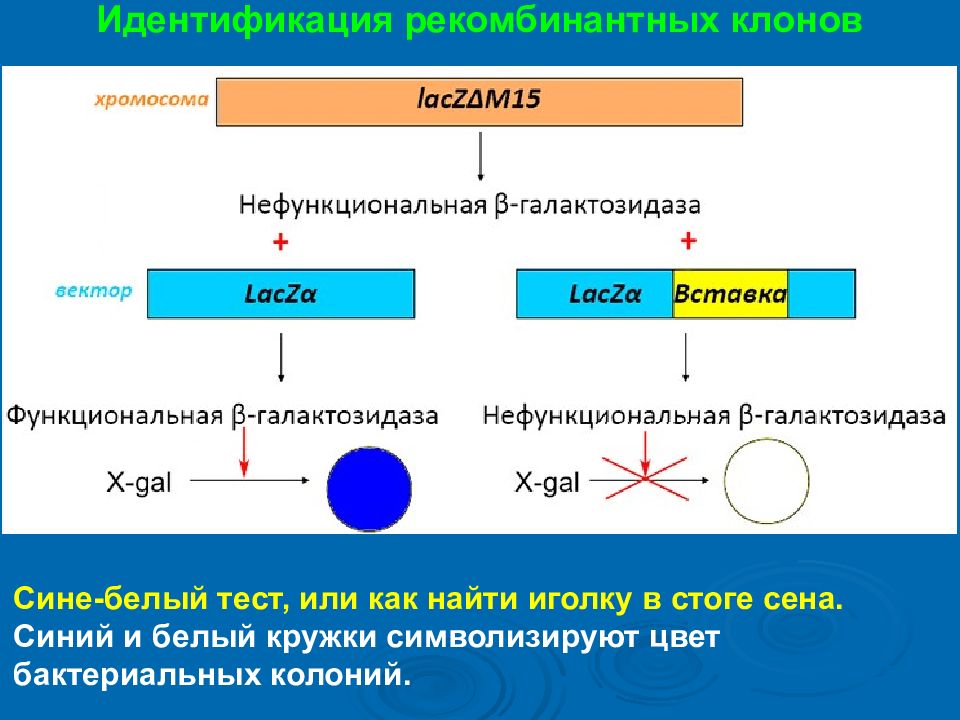
Идентификация рекомбинантных клонов Сине-белый тест, или как найти иголку в стоге сена. Синий и белый кружки символизируют цвет бактериальных колоний.
Слайд 33
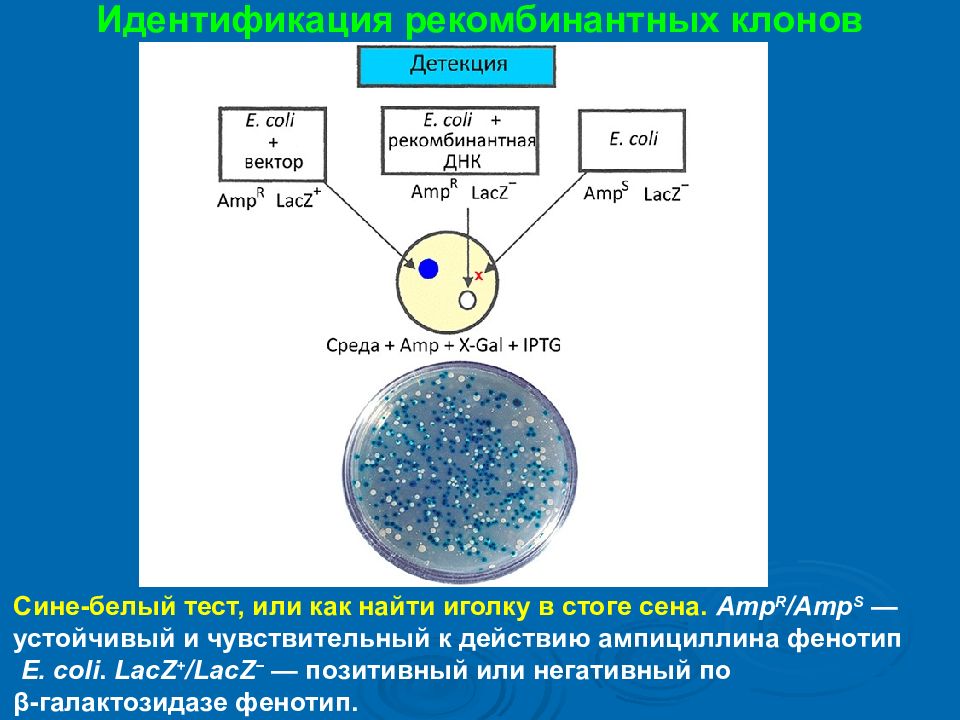
Идентификация рекомбинантных клонов Сине-белый тест, или как найти иголку в стоге сена. Amp R / Amp S — устойчивый и чувствительный к действию ампициллина фенотип E. coli. LacZ + / LacZ − — позитивный или негативный по β- галактозидазе фенотип.
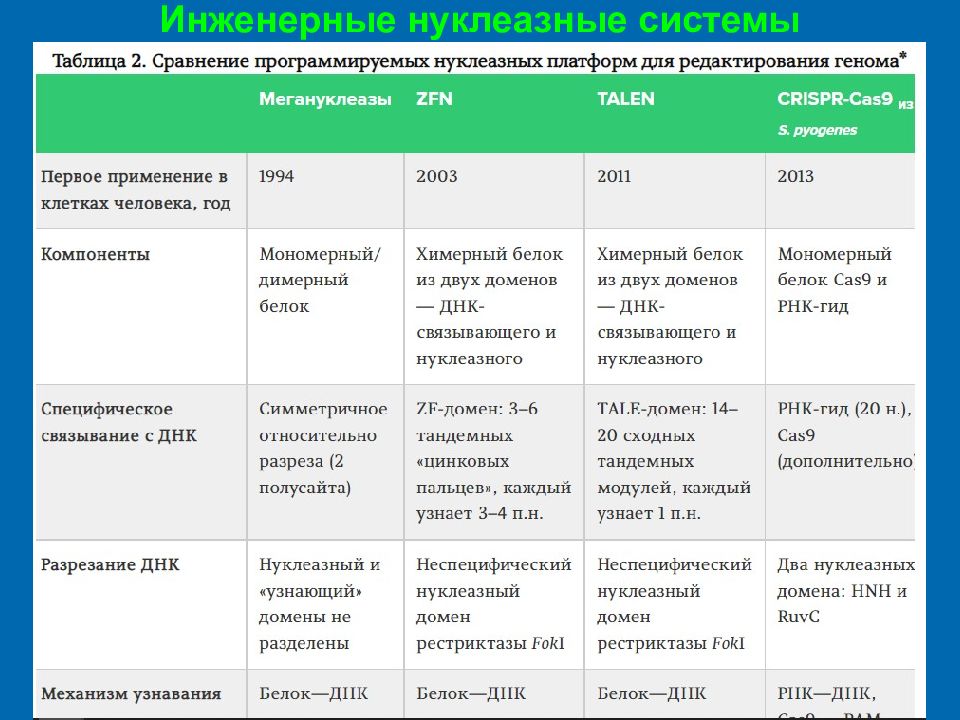
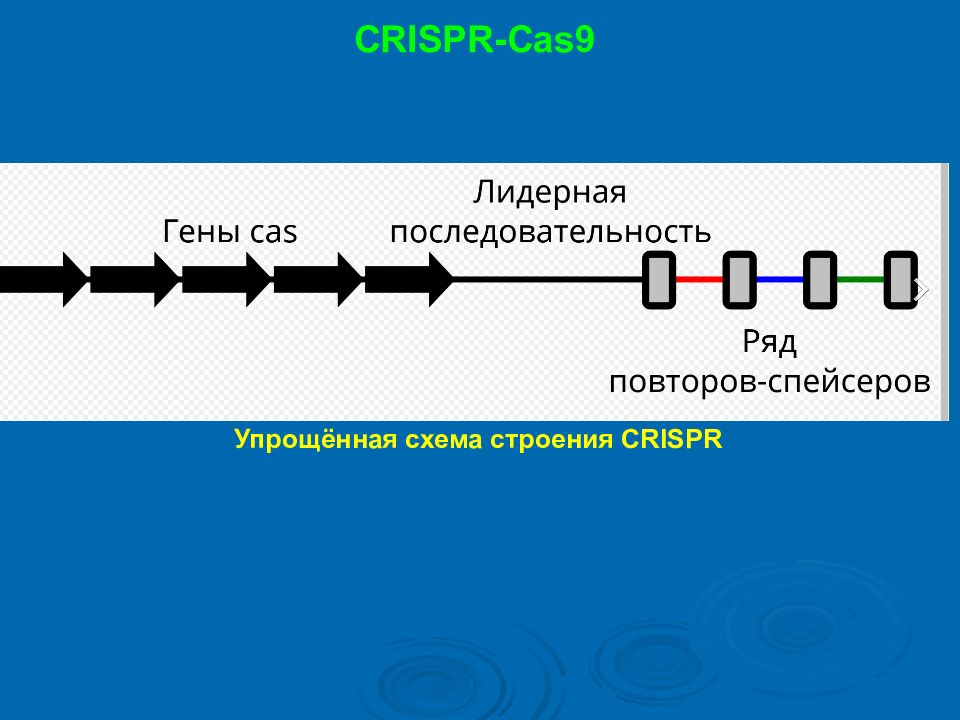
Слайд 37
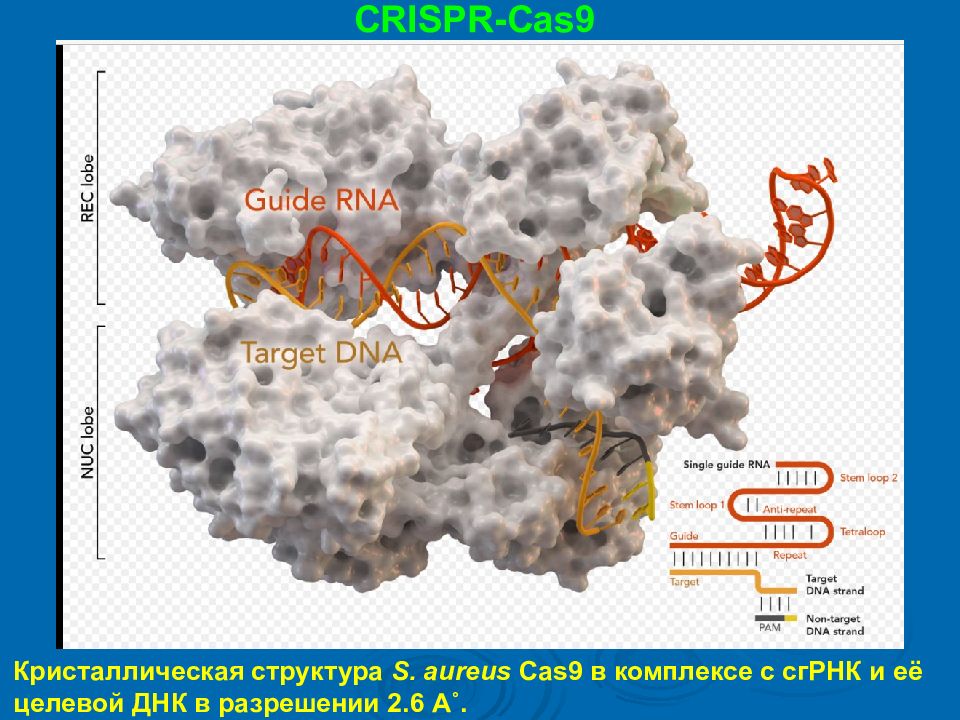
CRISPR-Cas9 Кристаллическая структура S. aureus Cas9 в комплексе с сгРНК и её целевой ДНК в разрешении 2.6 A˚.
Слайд 38
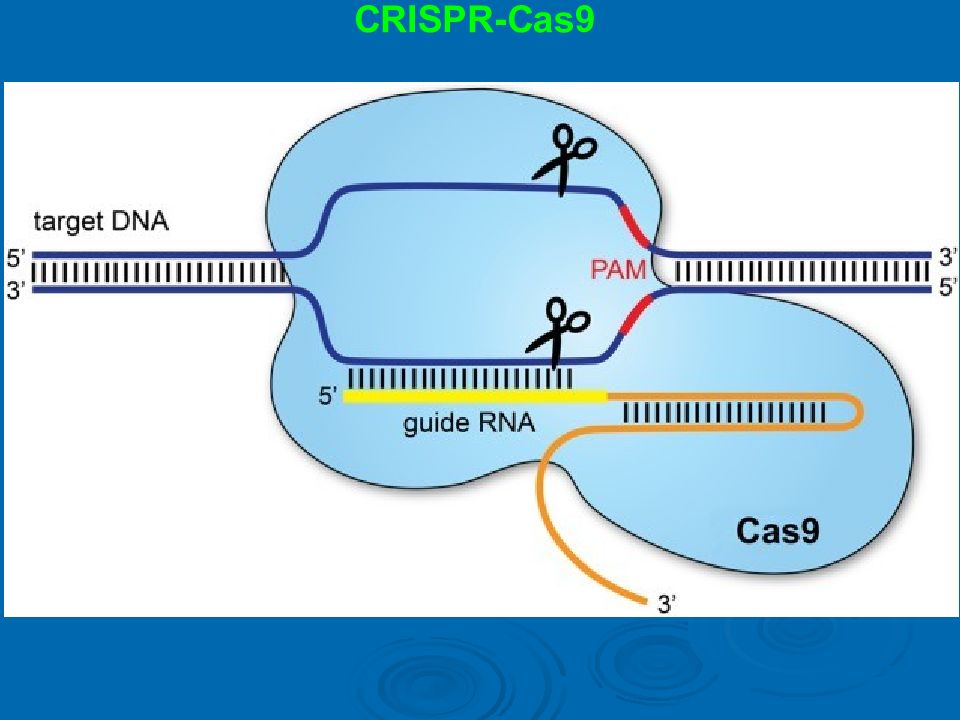
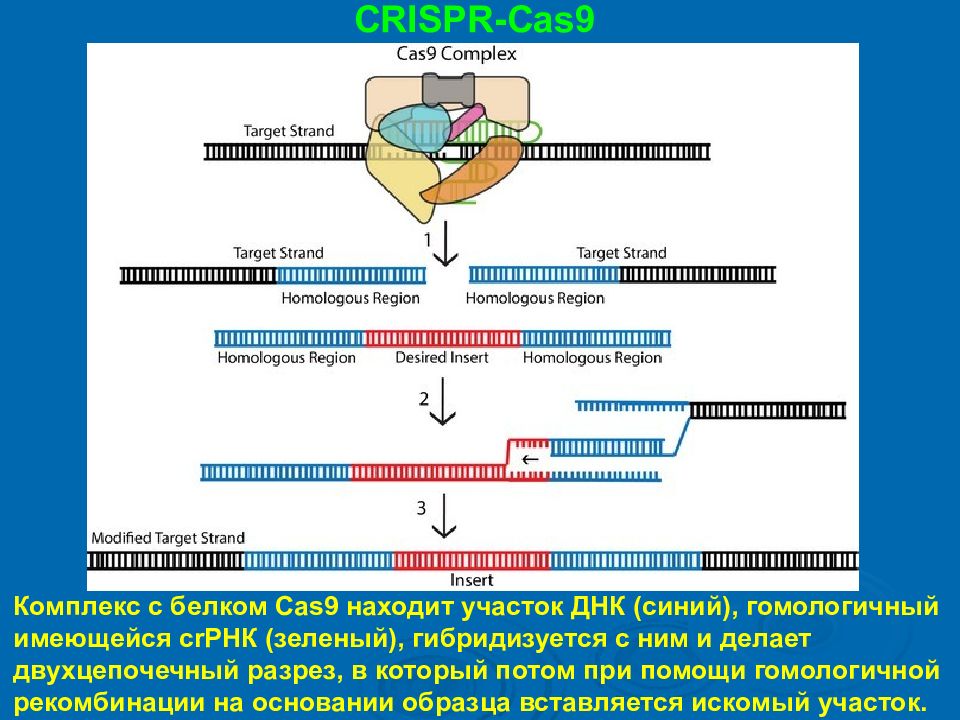
CRISPR-Cas9 Комплекс с белком Cas9 находит участок ДНК (синий), гомологичный имеющейся crРНК (зеленый), гибридизуется с ним и делает двухцепочечный разрез, в который потом при помощи гомологичной рекомбинации на основании образца вставляется искомый участок.
Слайд 41
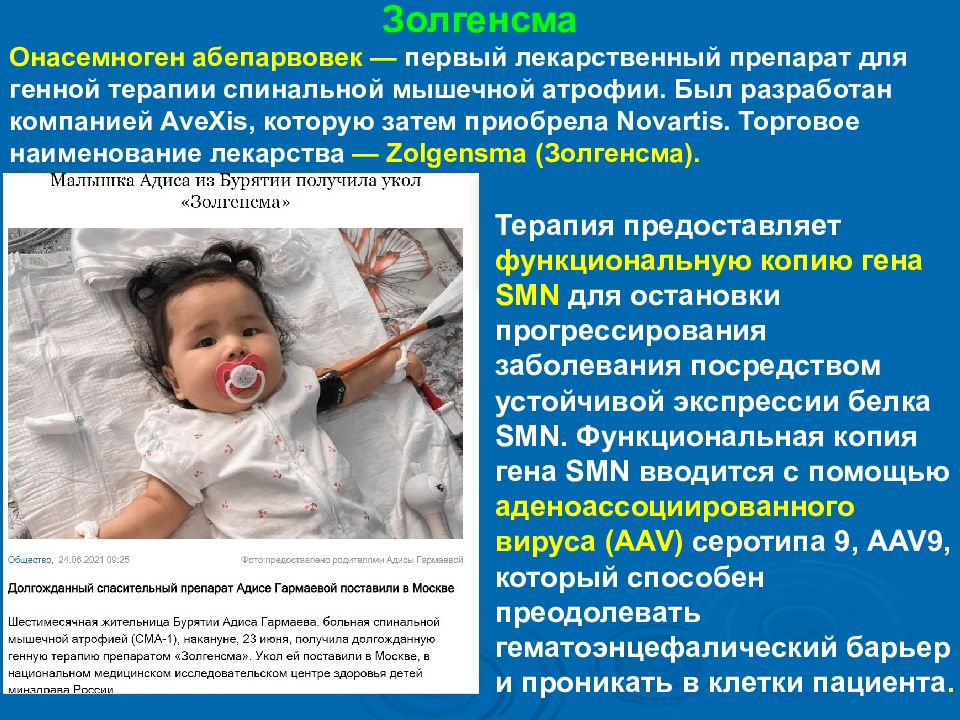
Золгенсма Онасемноген абепарвовек — первый лекарственный препарат для генной терапии спинальной мышечной атрофии. Был разработан компанией AveXis, которую затем приобрела Novartis. Торговое наименование лекарства — Zolgensma ( Золгенсма ). Терапия предоставляет функциональную копию гена SMN для остановки прогрессирования заболевания посредством устойчивой экспрессии белка SMN. Функциональная копия гена SMN вводится с помощью аденоассоциированного вируса (AAV) серотипа 9, AAV9, который способен преодолевать гематоэнцефалический барьер и проникать в клетки пациента.
Слайд 42
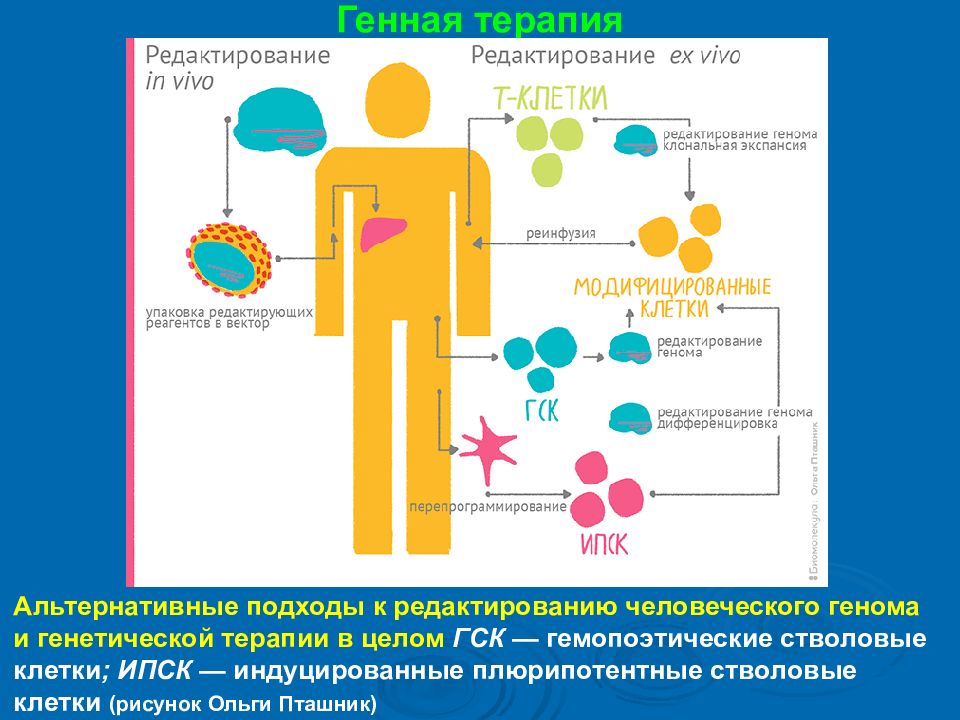
Генная терапия Альтернативные подходы к редактированию человеческого генома и генетической терапии в целом ГСК — гемопоэтические стволовые клетки ; ИПСК — индуцированные плюрипотентные стволовые клетки ( рисунок Ольги Пташник )
Слайд 44
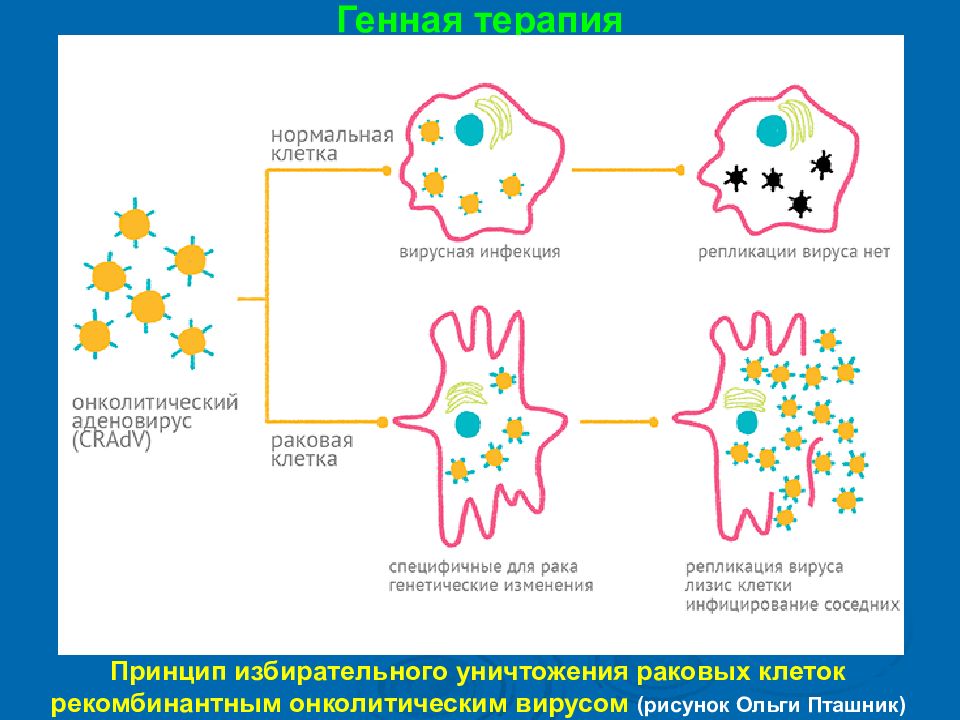
Генная терапия Принцип избирательного уничтожения раковых клеток рекомбинантным онколитическим вирусом (рисунок Ольги Пташник )
Слайд 45
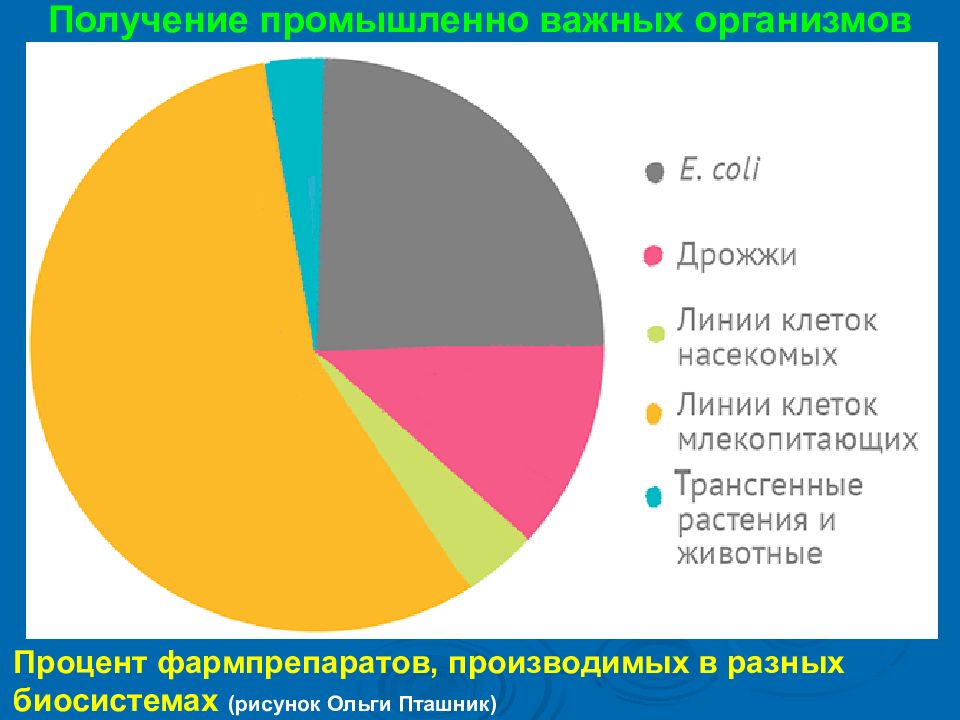
Получение промышленно важных организмов Процент фармпрепаратов, производимых в разных биосистемах ( рисунок Ольги Пташник )