Первый слайд презентации: Неметаллы, их положение в ПСХИ Д. И. Менделеева и особенности строения атомов
Слайд 2
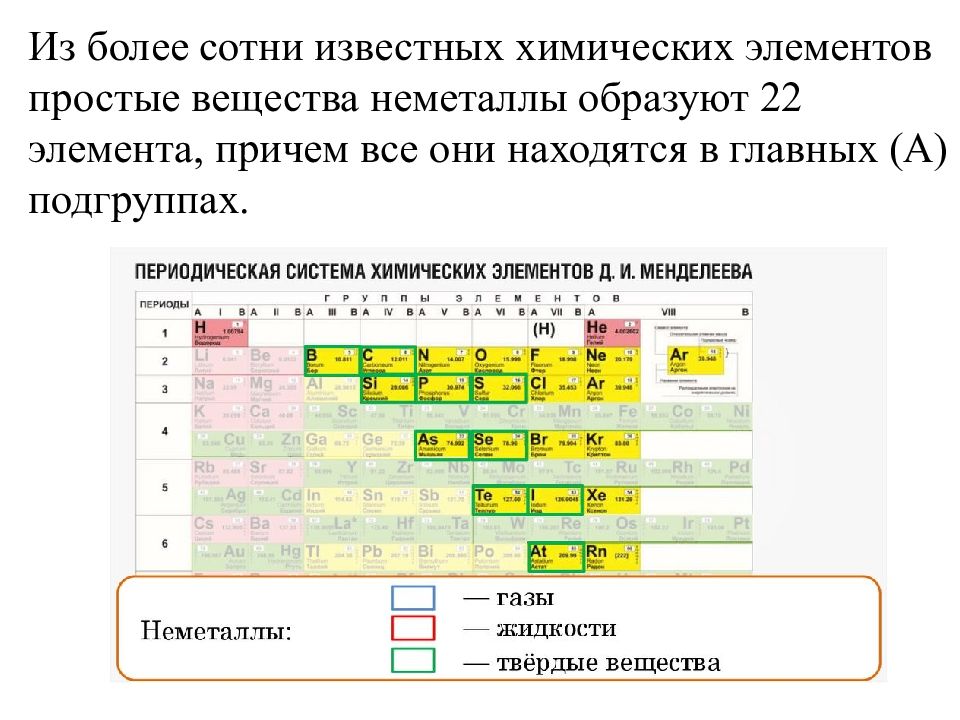
Из более сотни известных химических элементов простые вещества неметаллы образуют 22 элемента, причем все они находятся в главных (А) подгруппах.
Слайд 3
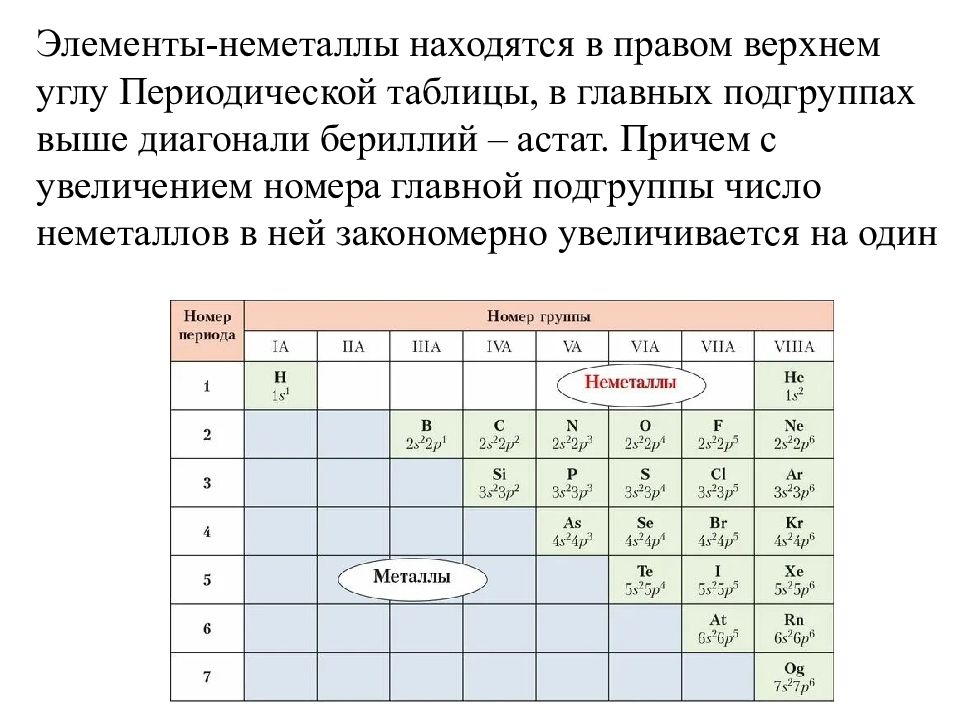
Элементы-неметаллы находятся в правом верхнем углу Периодической таблицы, в главных подгруппах выше диагонали бериллий – астат. Причем с увеличением номера главной подгруппы число неметаллов в ней закономерно увеличивается на один
Слайд 4: Особенности строения атомов неметаллов
Меньшие радиусы атомов по сравнению с металлами. Внешний электронный слой атомов неметаллов близок к завершению. Он содержит 4–8 электронов (исключение составляют бор, водород, гелий). Высокие значения электроотрицательности. Валентные электроны атомов неметаллов сильно связаны с ядром и покидают атом с трудом. Атомы неметаллов способны присоединять электроны до заполнения внешнего электронного слоя, но могут также отдавать валентные электроны более электроотрицательным атомам. Стремление образовывать ковалентные связи с атомами других неметаллов. Поэтому атомы неметаллов в простых веществах и соединениях с другими неметаллами связаны ковалентными связями.
Слайд 5: Особенности строения элементов VIII-A подгруппы
Элементы VIII-А подгруппы завершают каждый период. Особенностью строения атомов неона, аргона, криптона, ксенона и радона является устойчивый восьмиэлектронный внешний слой (октет), а гелия – двухэлектронный (дуплет). И х часто называют инертными, или благородными, газами. Последнее название более целесообразно, так как известны некоторые соединения этих элементов (например, оксид ксенона, фторид радона и др.).
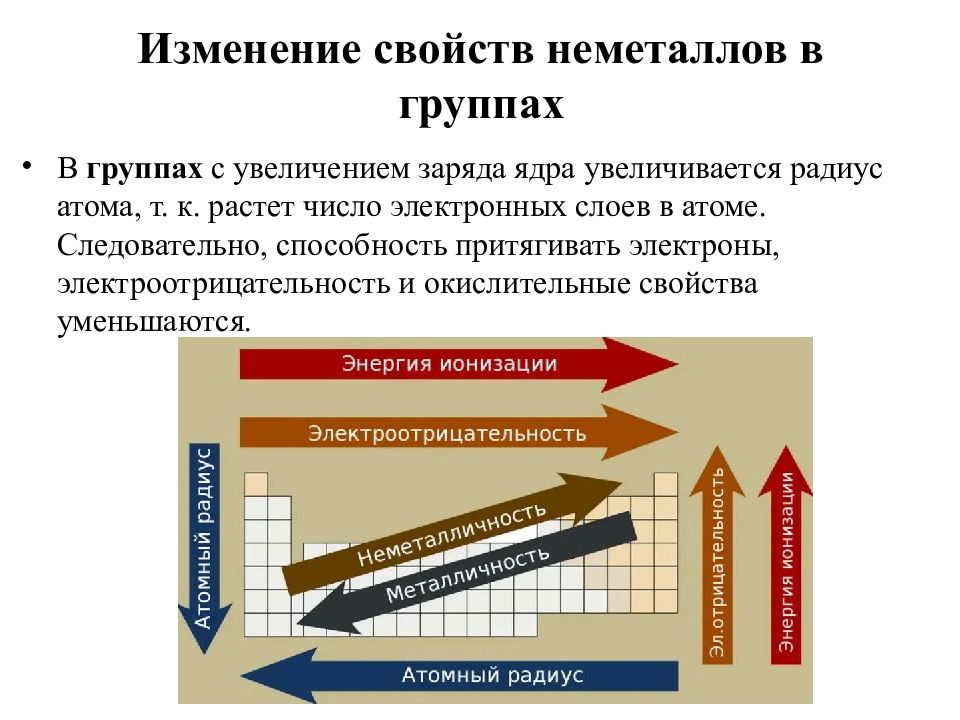
Слайд 6: Изменение свойств неметаллов в группах
В группах с увеличением заряда ядра увеличивается радиус атома, т. к. растет число электронных слоев в атоме. Следовательно, способность притягивать электроны, электроотрицательность и окислительные свойства уменьшаются.
Слайд 7
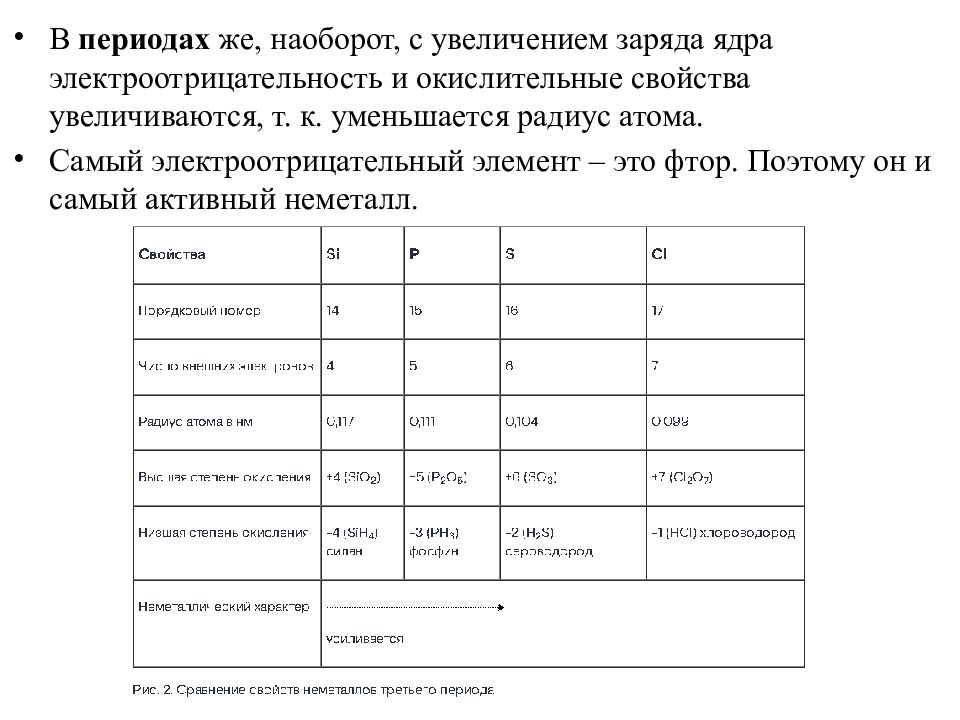
В периодах же, наоборот, с увеличением заряда ядра электроотрицательность и окислительные свойства увеличиваются, т. к. уменьшается радиус атома. Самый электроотрицательный элемент – это фтор. Поэтому он и самый активный неметалл.
Слайд 8: Распространенность в природе
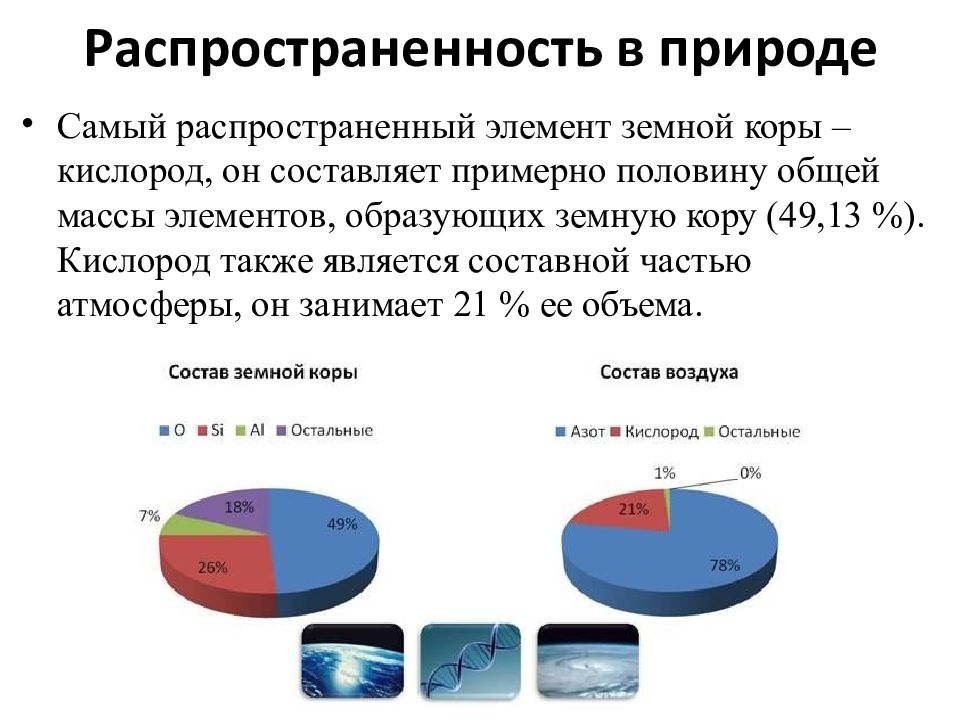
Самый распространенный элемент земной коры – кислород, он составляет примерно половину общей массы элементов, образующих земную кору (49,13 %). Кислород также является составной частью атмосферы, он занимает 21 % ее объема.
Слайд 9
Вторым по распространенности на земле элементом является кремний. Его в земной коре 27,6 % по массе. Кремний с кислородом образует самые разнообразные природные соединения вследствие своего особенного родства с кислородом.
Слайд 10
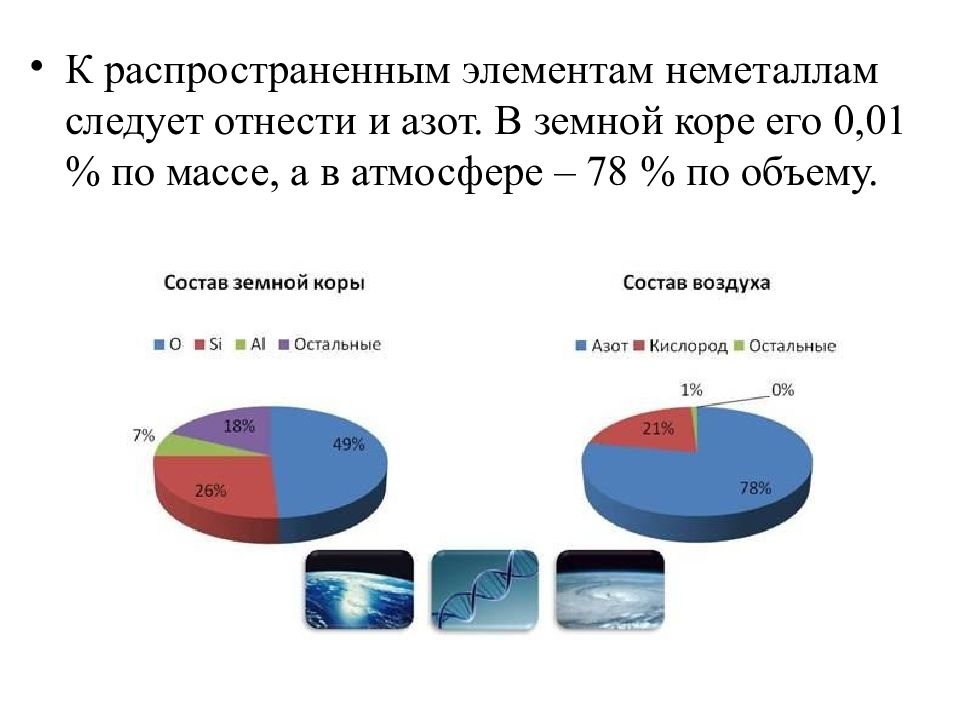
К распространенным элементам неметаллам следует отнести и азот. В земной коре его 0,01 % по массе, а в атмосфере – 78 % по объему.
Слайд 11
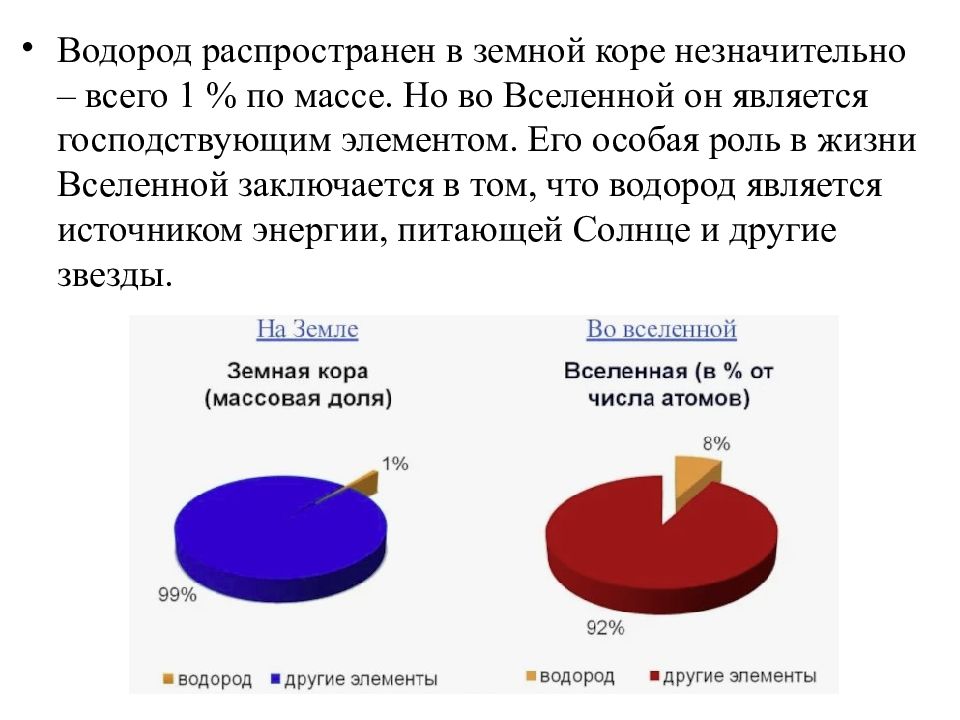
Водород распространен в земной коре незначительно – всего 1 % по массе. Но во Вселенной он является господствующим элементом. Его особая роль в жизни Вселенной заключается в том, что водород является источником энергии, питающей Солнце и другие звезды.
Последний слайд презентации: Неметаллы, их положение в ПСХИ Д. И. Менделеева и особенности строения атомов
В значительно меньших количествах, чем перечисленные элементы, в природе встречаются углерод, фосфор, сера. Но эти элементы наряду с кислородом, углеродом и водородом входят в состав живых организмов и выполняют важные биологические функции. Поэтому их называют биогенными элементами.