Слайд 2
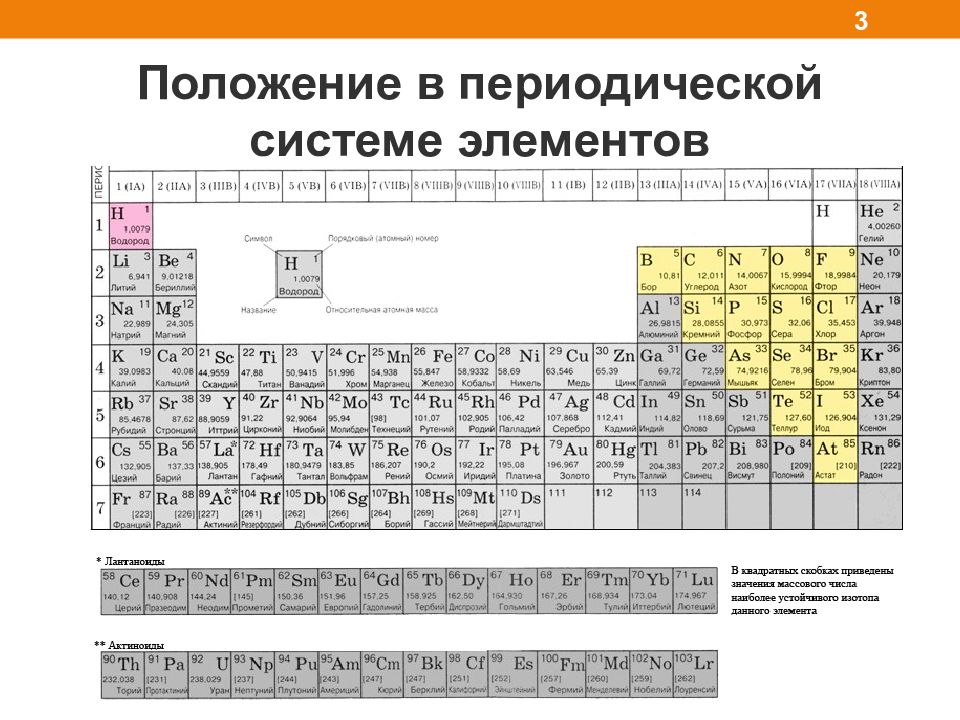
Неметаллы H He, Ne, Ar, Kr, Xe, Rn F, Cl, Br, I, At O, S, Se, Te N, P, As C, Si B 2
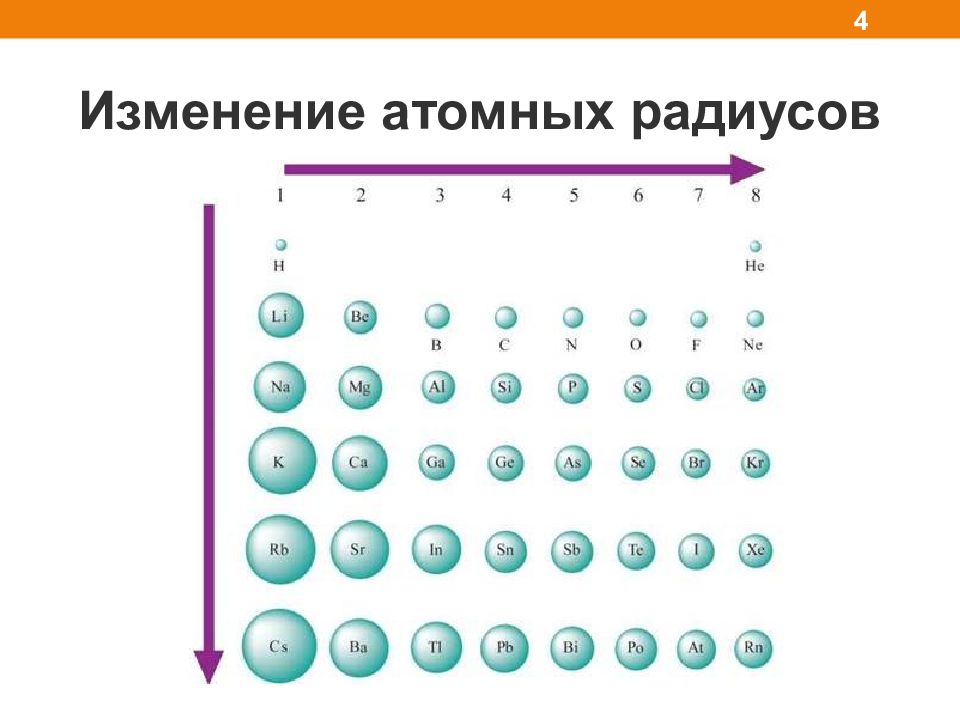
Слайд 5
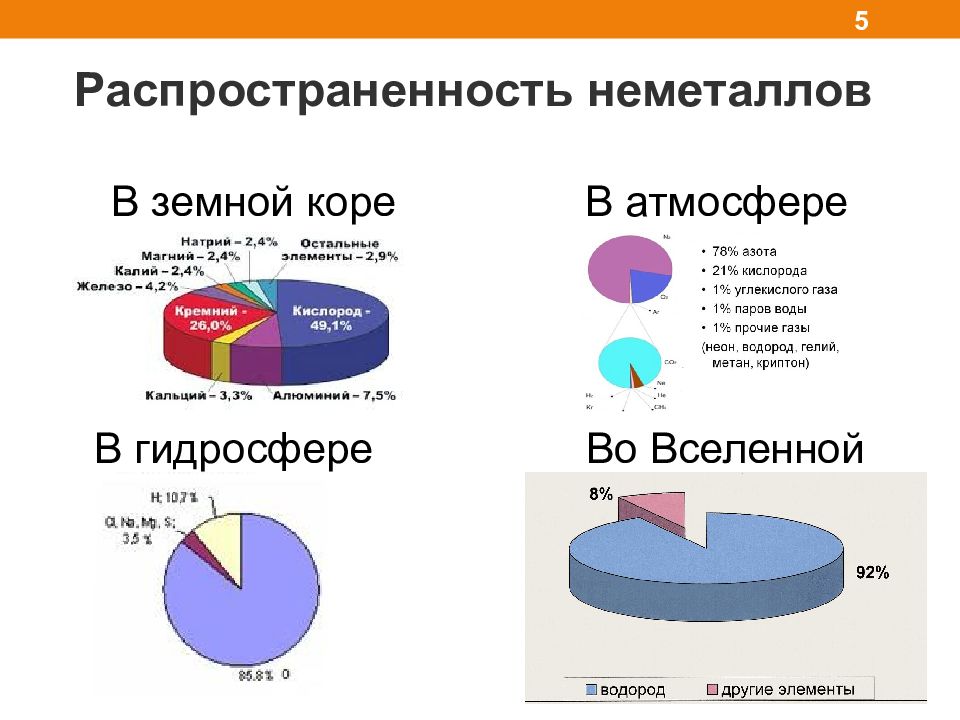
Распространенность неметаллов 5 В земной коре В атмосфере В гидросфере Во Вселенной
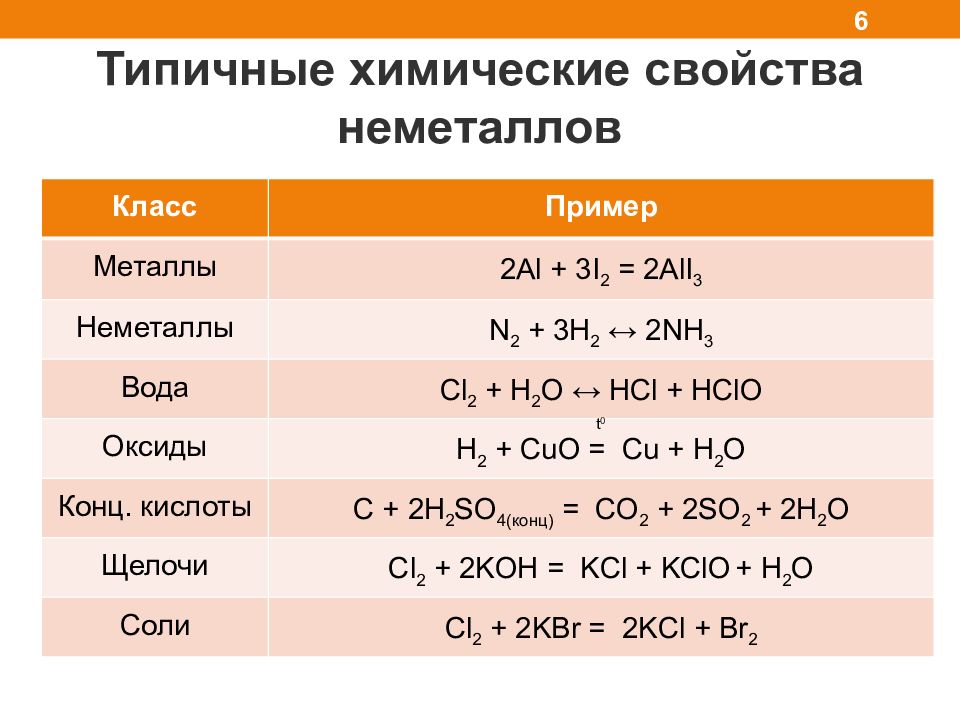
Слайд 6
Типичные химические свойства неметаллов 6 Класс Пример Металлы 2Al + 3I 2 = 2AlI 3 Неметаллы N 2 + 3H 2 ↔ 2NH 3 Вода Cl 2 + H 2 O ↔ HCl + HClO Оксиды H 2 + CuO = Cu + H 2 O Конц. кислоты C + 2 H 2 SO 4( конц) = CO 2 + 2 SO 2 + 2 H 2 O Щелочи Cl 2 + 2 KOH = KCl + KClO + H 2 O Соли Cl 2 + 2 KBr = 2KCl + Br 2 t 0
Слайд 7
Водород: положение в ПСХЭ 7 1 H 1 s 1 1 группа ( IA) 17 группа (VIIA) Восстановитель Окислитель СО = +1 СО = -1 1 s 1 ns 1 1 s 1 ns 2 np 5 Спектр с небольшим числом линий Гидриды ~ Галогениды Металлический водород (450 ГПа, Ливерморская национальная лаборатория (США), 1996) H 2 F 2, Cl 2, Br 2, I 2
Слайд 8
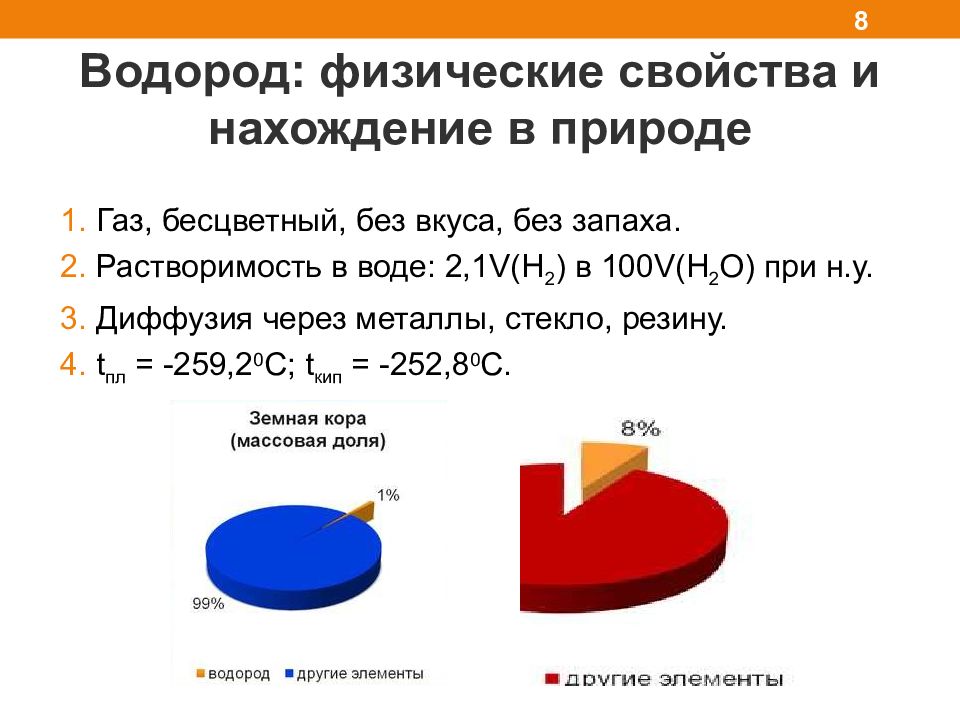
Водород: физические свойства и нахождение в природе 8 1. Газ, бесцветный, без вкуса, без запаха. 2. Растворимость в воде: 2,1 V(H 2 ) в 100 V(H 2 O) при н.у. 3. Диффузия через металлы, стекло, резину. 4. t пл = -259,2 0 С; t кип = -252,8 0 С.
Слайд 9
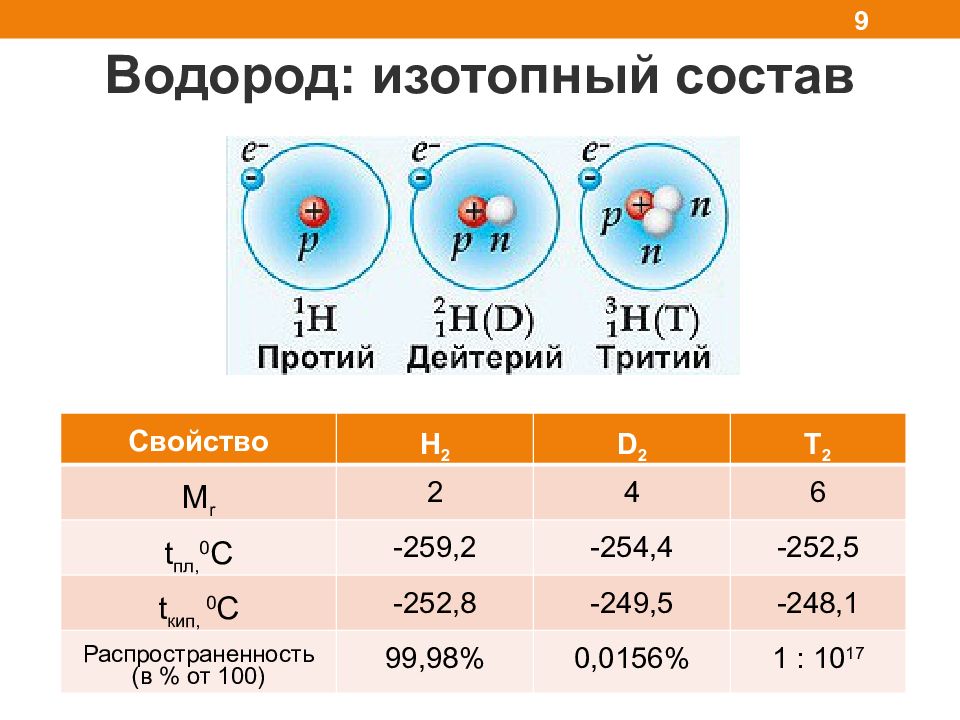
Водород: изотопный состав 9 Свойство H 2 D 2 T 2 M r 2 4 6 t пл, 0 С -259,2 -254,4 -252,5 t кип, 0 С -252,8 -249,5 -248,1 Распространенность (в % от 100) 99,98% 0,0156% 1 : 10 17
Слайд 10
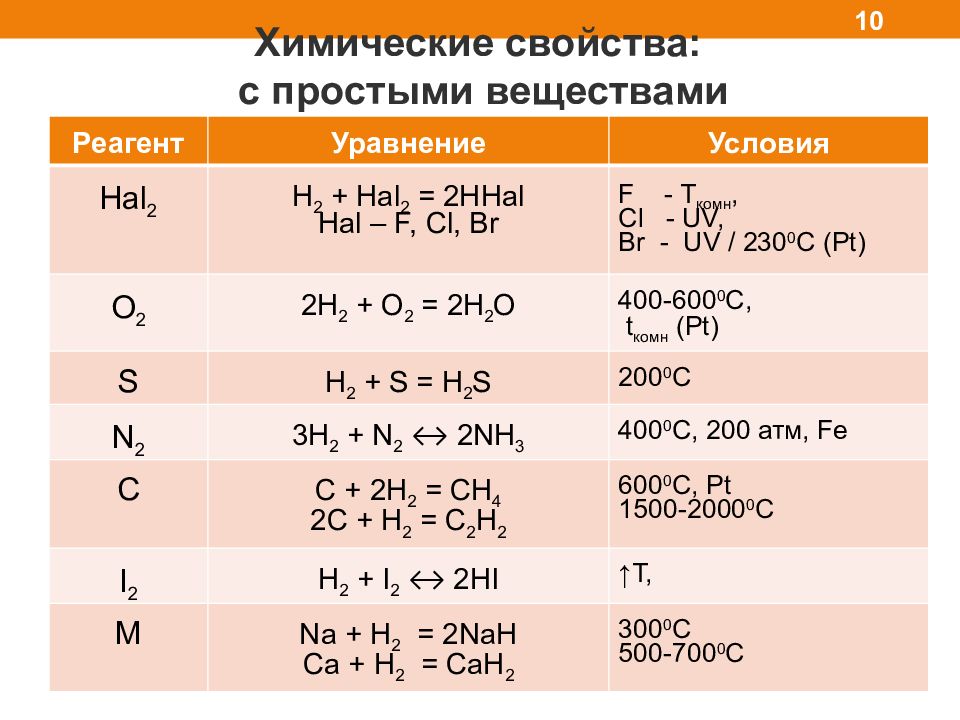
Химические свойства: с простыми веществами 10 Реагент Уравнение Условия Hal 2 H 2 + Hal 2 = 2HHal Hal – F, Cl, Br F - T комн, Cl - UV, Br - UV / 230 0 C (Pt) O 2 2 H 2 + O 2 = 2H 2 O 400-600 0 C, t комн (Pt) S H 2 + S = H 2 S 200 0 C N 2 3H 2 + N 2 ↔ 2NH 3 400 0 C, 200 атм, Fe C C + 2H 2 = CH 4 2C + H 2 = C 2 H 2 600 0 C, Pt 1500-2000 0 C I 2 H 2 + I 2 ↔ 2HI ↑T, M Na + H 2 = 2NaH Ca + H 2 = CaH 2 3 00 0 C 5 00 -700 0 C
Слайд 11
Химические свойства: со сложными веществами 11 Реагент Уравнение Условия Оксиды металлов H 2 + Fe 3 O 4 = 3Fe + 4H 2 O H 2 + Cu 2 O = 2Cu + H 2 O H 2 + Mn 3 O 4 = 3MnO + H 2 O 600 0 C 250-4 00 0 C ↑T Оксиды неметаллов 4H 2 + CO 2 = CH 4 + 2H 2 O 2NO+2H 2 = N 2 + 2H 2 O 200 0 C, Cu 2 O Соли H 2 + 2FeCl 3 = 2FeCl 2 + 2HCl H 2 + Ag 2 SO 4 = 2Ag + H 2 SO 4 2H 2 + BaSO 4 = BaS + 4H 2 O ↑T 200 0 C 550-1000 0 C Бинарные соединения H 2 + С aC 2 = Ca + C 2 H 2 4H 2 + CS 2 = CH 4 + 2H 2 S 3H 2 + 2BCl 3 = 2B + 6HCl 2000 0 C 50 0 C, Pt 800-1200 0 C
Слайд 12
Химические свойства: атомарный водород 12 C ильный восстановитель!!! 2CrCl 3 + 2HCl + 2Zn = 2CrCl 2 + 2ZnCl 2 + H 2 KNO 3 + 2HCl + Zn = KNO 2 + ZnCl 2 + H 2 O ( 2HCl + Zn = ZnCl 2 + 2 H 0 ) 3KNO 3 + 5KOH + 8Al +18H 2 O = 3NH 3 + 8K[Al(OH) 4 ] (2 Al + 2 KOH + 6 H 2 O = 2 K[Al(OH) 4 ] + 6 H 0 )
Слайд 13
Получение водорода 13 Способ Уравнение Металл + кислота Zn + H 2 SO 4 (20%) = ZnSO 4 + H 2 Металл + щелочь 2 Al + 2 KOH + 6 H 2 O = 3 H 2 + 2 K[Al(OH) 4 ] Fe + водяной пар (1000 0 C) 3Fe + 4H 2 O = Fe 3 O 4 + 4H 2 Уголь + водяной пар (1000 0 C) C + H 2 O = CO + H 2 Конверсия метана (1 1 00 0 C) CH 4 + H 2 O = CO + 3H 2 Электролиз растворов солей 2NaCl + 2H 2 O = 2NaOH + H 2 + Cl 2
Слайд 14
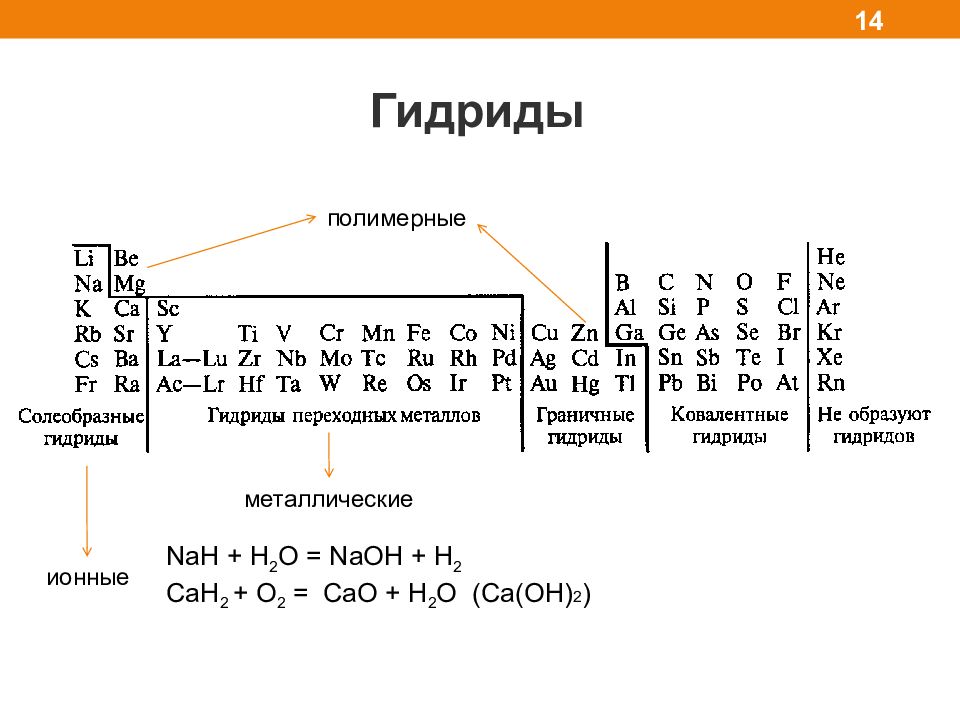
Гидриды 14 металлические полимерные ионные NaH + H 2 O = NaOH + H 2 CaH 2 + O 2 = CaO + H 2 O (Сa(OH) 2 )
Слайд 16
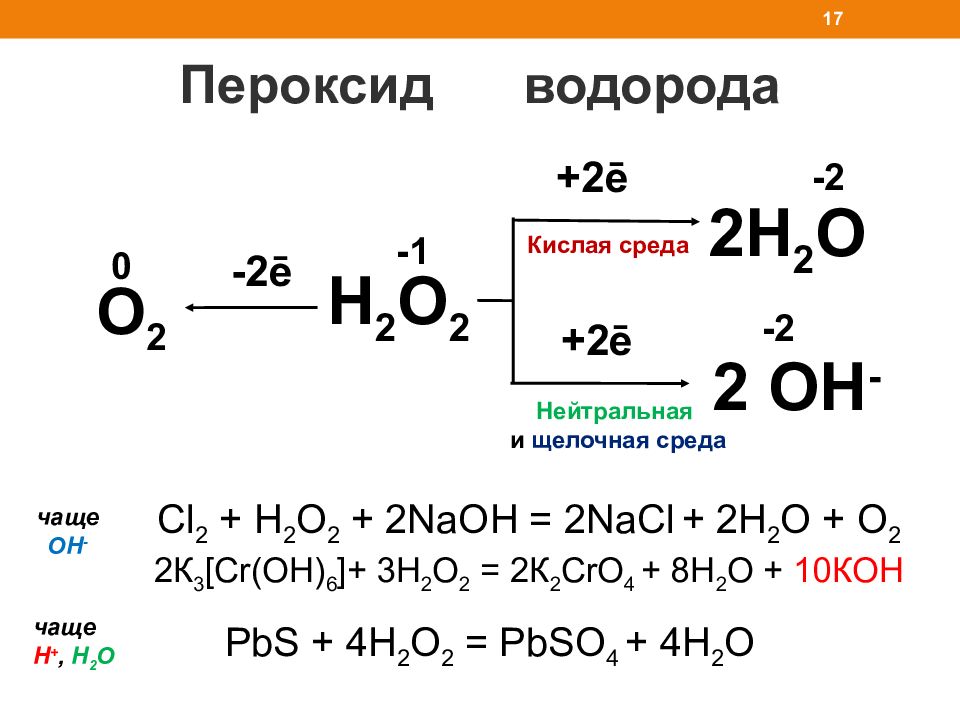
Пероксид водорода 16 Бесцветная вязкая жидкость Хорошо растворим в воде 30-40% раствор – «пергидроль» ρ = 1,443 г/см 3 t пл = - 0, 41 0 С t кип = 150, 2 0 С Неустойчив, самопроизвольно разлагается : 2H 2 O 2 = 2H 2 O+ O 2 Na 2 SO 3 + H 2 O 2 = Na 2 SO 4 +H 2 O -1 H 2 O 2 2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 = 5O 2 + 2MnSO 4 + K 2 SO 4 +8H 2 O Ox Red -1 +1 -2 0 -1 -2 +4 +6 -1 0 +7 +2 чаще H +, Н 2 О чаще ОН -
Слайд 17
Пероксид водорода 17 2H 2 O + 2ē + 2ē Нейтральная и щелочная среда Кислая среда -2 H 2 O 2 2 OH - -1 -2 O 2 0 - 2ē С l 2 + H 2 O 2 + 2NaOH = 2NaCl + 2H 2 O + O 2 2К 3 [ Cr(OH) 6 ]+ 3 H 2 O 2 = 2 К 2 Cr О 4 + 8 H 2 O + 10К OH чаще H +, Н 2 О чаще ОН - PbS + 4H 2 O 2 = PbSO 4 + 4H 2 O
Слайд 18
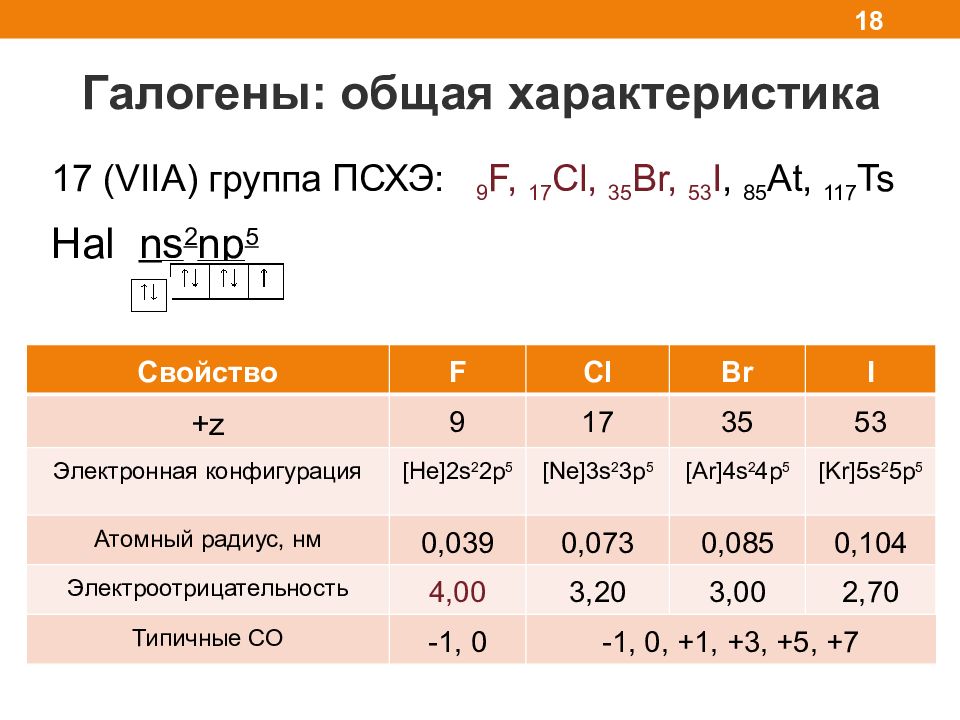
Галогены: общая характеристика 18 17 ( VIIA) группа ПСХЭ: 9 F, 17 Cl, 35 Br, 53 I, 85 At, 117 Ts Hal ns 2 np 5 Свойство F Cl Br I +z 9 17 35 53 Электронная конфигурация [He]2s 2 2p 5 [Ne]3s 2 3p 5 [Ar]4s 2 4p 5 [Kr]5s 2 5p 5 Атомный радиус, нм 0,039 0,073 0,085 0,104 Электроотрицательность 4,00 3,20 3,00 2,70 Типичные СО -1, 0 -1, 0, +1, +3, +5, +7
Слайд 19
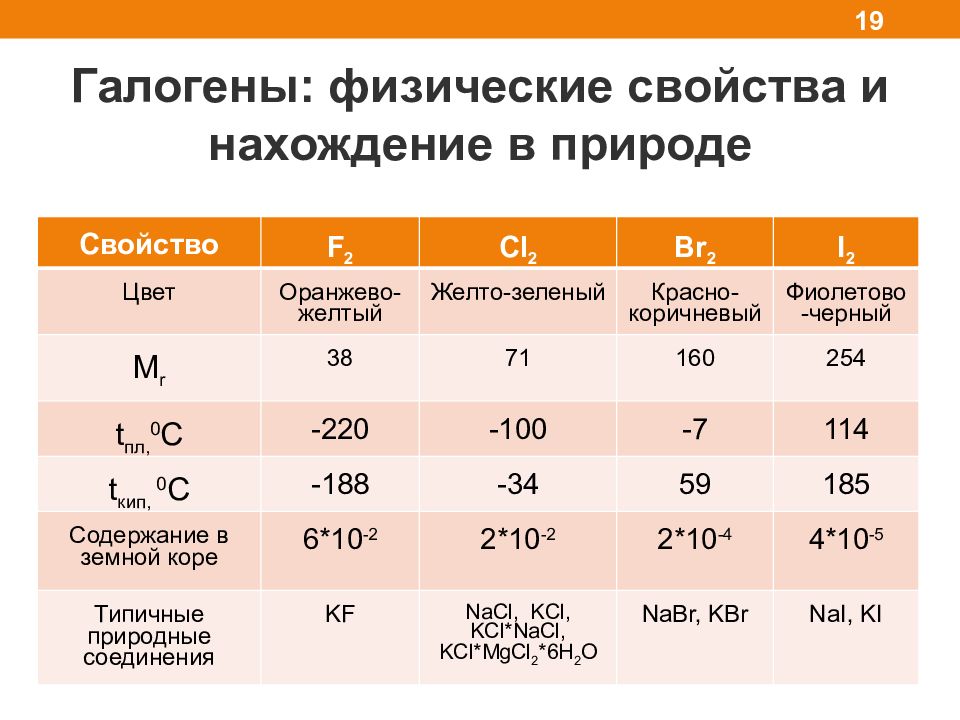
Галогены: физические свойства и нахождение в природе 19 Свойство F 2 Cl 2 Br 2 I 2 Цвет Оранжево-желтый Желто-зеленый Красно-коричневый Фиолетово-черный M r 38 71 160 254 t пл, 0 С -220 -100 -7 114 t кип, 0 С -188 -34 59 185 Содержание в земной коре 6*10 -2 2*10 -2 2*10 -4 4*10 -5 Типичные природные соединения KF NaCl, KCl, KCl*NaCl, KCl*MgCl 2 *6H 2 O NaBr, KBr NaI, KI
Слайд 20
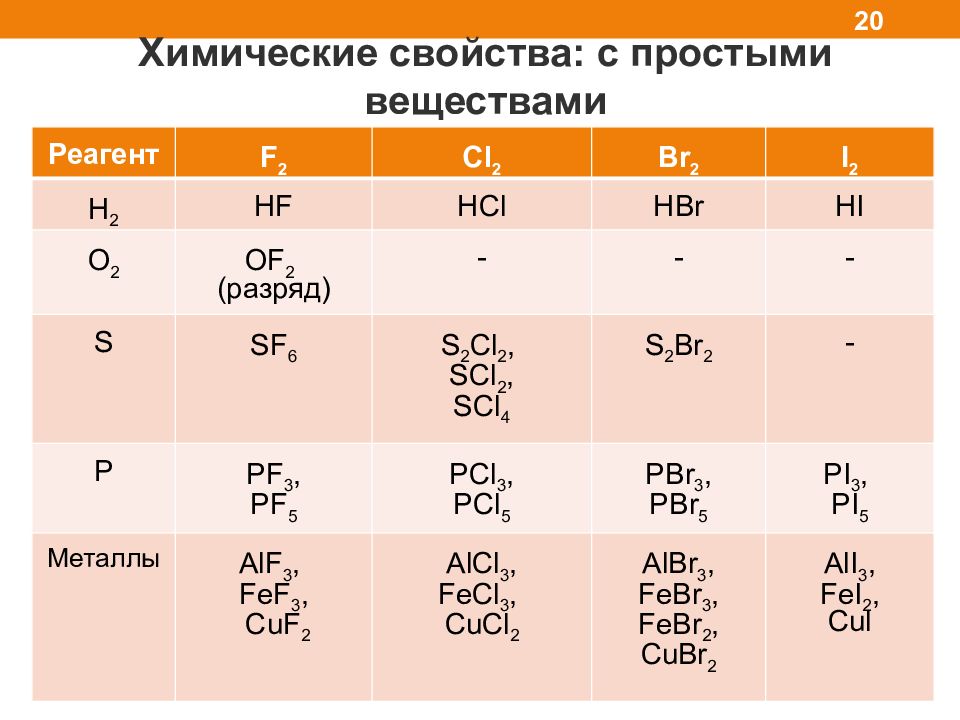
Химические свойства: с простыми веществами 20 Реагент F 2 Cl 2 Br 2 I 2 H 2 HF HCl HBr HI O 2 OF 2 ( разряд) - - - S SF 6 S 2 Cl 2, SCl 2, SCl 4 S 2 Br 2 - P PF 3, PF 5 PCl 3, PCl 5 PBr 3, PBr 5 PI 3, PI 5 Металлы AlF 3, FeF 3, CuF 2 AlCl 3, FeCl 3, CuCl 2 AlBr 3, FeBr 3, FeBr 2, CuBr 2 AlI 3, FeI 2, Cul
Слайд 22
Взаимодействие со сложными веществами 22 Реагент Уравнение Щелочи Хлор, бром: Hal 2 + 2 KOH = KHal + KHalO + H 2 O 0 0 С 3 Hal 2 + 6 KOH = 5 KHal + KHalO 3 + 3 H 2 O 60 0 С Йод: 3 l 2 + 6 KOH = 5 Kl + KlO 3 + 3 H 2 O Галогениды Cl 2 + 2 KBr = 2KCl + Br 2 Cl 2 + 2 KI = 2KCl + I 2 Br 2 + 2 KI = 2KBr + I 2 Оксиды Cl 2 + MgO = MgCl 2 + O 2 SiO 2 + 2F 2 = SiF 4 + O 2 Окислители 3 l 2 + 10 HNO 3( конц) = 6HlO 3 + 10NO 2 + 2H 2 O I 2 + 5Cl 2 +6H 2 O = 2HIO 3 + 10HCl Восстановители 3 Br 2 + S +4H 2 O = 6HBr + H 2 SO 4 3 Cl 2 + 3H 2 O 2 = 2HCl + 2H 2 O + O 2
Слайд 23
Получение галогенов 23 Способ Уравнение Окисление галогенидов 2CaCl 2 + 2SiO 2 +O 2 = 2CaSiO 3 + 2Cl 2 MnO 2 +2H 2 SO 4 +2KI=I 2 +MnSO 4 +2H 2 O+K 2 SO 4 Cl 2 + 2 NaBr = 2NaCl + Br 2 Cl 2 + 2 NaI = 2NaCl + I 2 Окисление HHal 16HCl+2KMnO 4 = 5Cl 2 +2MnCl 2 +2KCl+ 8H 2 O Электролиз растворов солей 2NaCl + 2H 2 O = 2NaOH + H 2 + Cl 2 Электролиз расплавов солей 2NaCl = 2Na + Cl 2 KF = F 2 + 2K (857 0 C) KF*2HF = H 2 + F 2 + KF (100 0 C)
Слайд 24
Соединения галогенов 24 H Н al – бесцветные газы, хорошо растворимы в воде 1 V H 2 O – 5 07 V HCl или 612 V HBr (н.у.) Водные растворы H Н al – сильные кислоты - неокислители В ряду HF → HCl → HBr → HI сила кислот ↑ Получение Способ Уравнение Прямой синтез H 2 + Hal 2 = 2HHal Вытеснение из солей NaCl+H 2 SO 4 (75-80 %) = NaHSO 4 +HCl↑ NaCl+NaHSO 4 = Na 2 SO 4 +HCl↑ 530 0 С Гидролиз галогенидов неметаллов PHal 3 + 3H 2 O = H 3 PO 3 + 3HHal↑
Слайд 25
Свойства HHal 25 Способ Уравнение C металлами (до H) Zn + 2HCl = ZnCl 2 + H 2 Fe + 2HCl = FeCl 2 + H 2 С аммиаком NH 3 + HCl = NH 4 Cl С основаниями Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O С основными оксидами CaO + 2HCl = CaCl 2 + H 2 O C окислителями 2 HBr + 3H 2 SO 4( конц ) = Br 2 + SO 2 + 2H 2 O 8 HI + 3H 2 SO 4( конц ) = 4I 2 + H 2 S + 4H 2 O 4H С l + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O Электролиз 2H С l = H 2 + Cl 2
Слайд 26
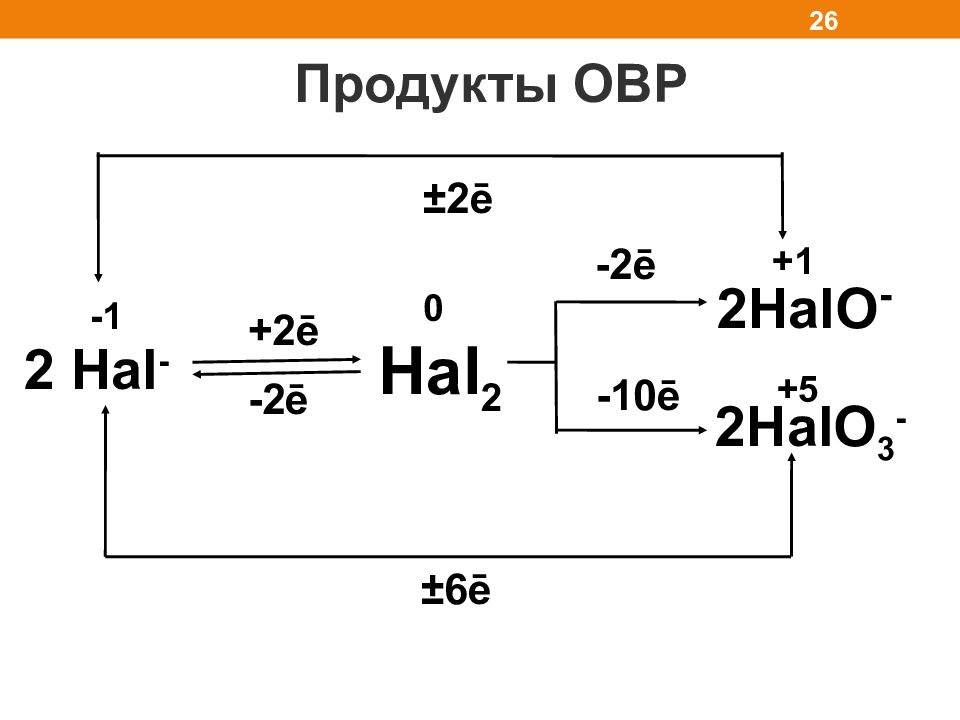
Продукты ОВР 26 2 Hal - -1 + 2ē -2ē Hal 2 2HalO - 2HalO 3 - 0 +5 +1 -2ē -10ē ± 2ē ± 6ē
Слайд 27
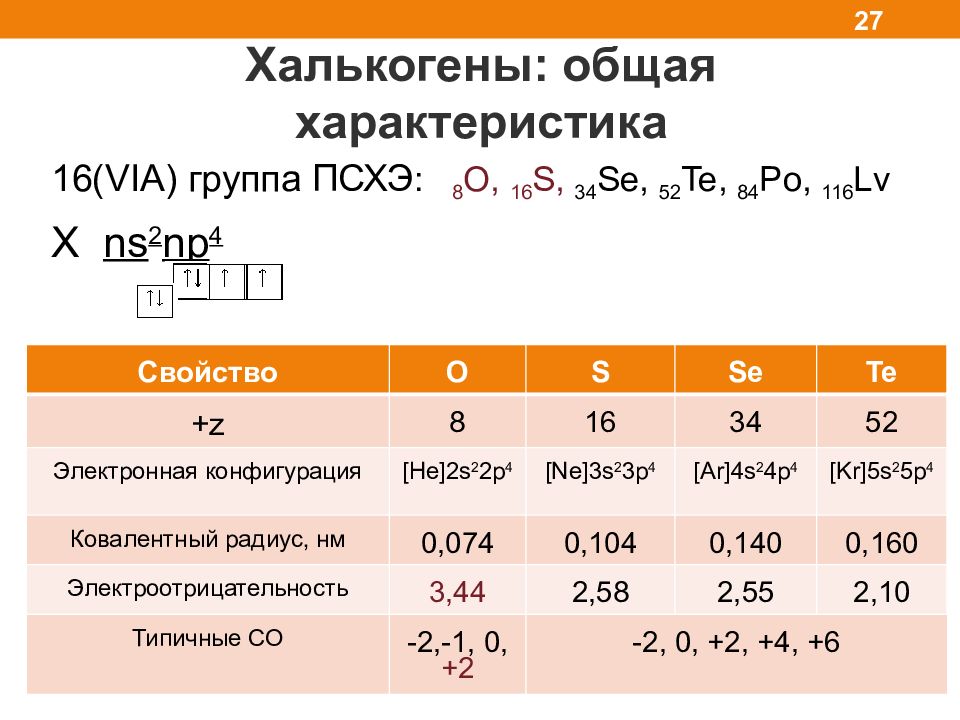
Халькогены: общая характеристика 27 16( VIA) группа ПСХЭ : 8 O, 1 6 S, 3 4 Se, 5 2 Te, 8 4 Po, 116 Lv X ns 2 np 4 Свойство O S Se Te +z 8 16 34 52 Электронная конфигурация [He]2s 2 2p 4 [Ne]3s 2 3p 4 [Ar]4s 2 4p 4 [Kr]5s 2 5p 4 Ковалентный радиус, нм 0,0 74 0,104 0,140 0,160 Электроотрицательность 3,44 2,58 2,55 2,10 Типичные СО -2,-1, 0, +2 -2, 0, +2, +4, +6
Слайд 28
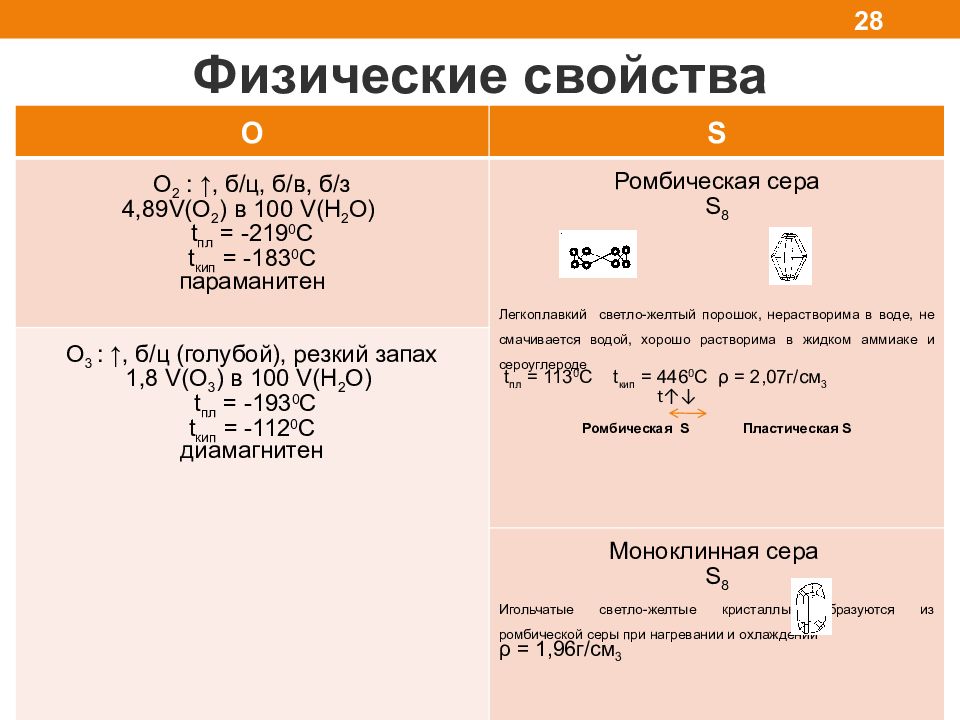
Физические свойства 28 O S O 2 : ↑, б/ц, б/в, б/з 4,89V(O 2 ) в 100 V(H 2 O) t пл = -2 1 9 0 С t кип = -183 0 С параманитен Ромбическая сера S 8 Легкоплавкий светло-желтый порошок, нерастворима в воде, не смачивается водой, хорошо растворима в жидком аммиаке и сероуглероде t пл = 113 0 С t кип = 446 0 С ρ = 2,07г/см 3 t ↑↓ Ромбическая S Пластическая S O 3 : ↑, б/ ц ( голубой ), резкий запах 1,8 V(O 3 ) в 100 V(H 2 O) t пл = -193 0 С t кип = -1 12 0 С диамагнитен Моноклинная сера S 8 Игольчатые светло-желтые кристаллы, образуются из ромбической серы при нагревании и охлаждении ρ = 1,96г/см 3
Слайд 29
Нахождение в природе 29 Кислород – основной элемент биосферы Сера Содержание серы в земной коре: 4,8*10 -3 % 1. Самородная сера 2. Сульфиды: халькопирит CuFeS 2, сфалерит ZnS 3. Сульфаты: гипс CaSO 4 *2H 2 O, мирабилит Na 2 SO 4 *10H 2 O 4. В виде сернистых соединений: нефть, нефтяные газы, природный газ
Слайд 30
Химические свойства кислорода и серы: взаимодействие с простыми веществами 30 Реагент О 2 S H 2 H 2 O (600 0 C) H 2 S (200 0 C) O 2 - SO 2 (280-360 0 C, примесь SO 3 ) Hal 2 OF 2 ( разряд) SF 6 S 2 Cl 2 (130 0 C ) SCl 2 (20 0 C ) N 2 NO ( разряд) - P P 2 O 5 ( ↑t) P 4 S 10, P 4 S n (n=3-7) C CO (600-700 0 C) CO 2 (1000 0 C) CS 2 (700-800 0 C ) M еталлы Al 2 O 3 Na 2 O 2 ( ↑t ) KO 2 Al 2 S 3 (150-200 0 C ) Na 2 S (130 0 C ) Na 2 S 4, Na 2 S 2 ( расплав, 100 0 C ) Не реагирует Hal 2 (- F 2 ), инертные газы, Au, Ag, платиновые металлы ( - Os ) Инертные газы, N 2, Se, Te, Au, I 2
Слайд 31
Химические свойства кислорода и серы: взаимодействие со сложными веществами 31 Реагент O 2 Гидроксиды металлов в промежуточных СО 4 С r(OH) 2 + O 2 + 2H 2 O = 4Cr(OH) 3 ↓ 4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 ↓ Соединения серы и азота в низших или промежуточных СО 2Na 2 SO 3 + O 2 = 2 Na 2 SO 4 4FeS 2 + 11O 2 = 8 SO 2 + 2Fe 2 O 3 Реагент S H 2 O 3S + 3H 2 O ↔ 2 H 2 S + H 2 SO 3 Щелочи 3S + 6NaOH = 2 Na 2 S + Na 2 SO 3 +3H 2 O Кислоты-окислители (конц.) S + 6HNO 3 = H 2 SO 4 + 6NO 2 +2H 2 O ( кип. ) S + 2H 2 SO 4 = 3SO 2 +2H 2 O ( кип. )
Слайд 32
Получение серы и кислорода 32 Способ Уравнение Сжижение воздуха Сжижение воздуха и последующая фракционная перегонка воздуха Электролиз воды 2H 2 O = 2H 2 + O 2 (электр. ток) Разложение пероксида водорода 2H 2 O 2 = 2H 2 О + O 2 Разложение солей 2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 (210-240 0 C) Способ Уравнение Самородная сера Излечение из подземных месторождений перегретым водяным паром и сжатым воздухом Сжигание сернистых соединений 2H 2 S + 3 O 2 = 2SO 2 + 2H 2 O ( избыток воздуха) 2H 2 S + SO 2 = 2H 2 O + 3S O 2 S
Слайд 33
Соединения серы. Сероводород 33 H 2 S – бесцветный газ, характерный неприятный запах 100 г H 2 O – 2,58 V H 2 S (0,1М насыщенный р-р) Водный раствор H 2 S – слабая двухосновная кислота H 2 S ↔ HS - + H + K а = 1,3*10 -7 HS - ↔ S 2- + H + K а = 7,1*10 -15 Получение Способ Уравнение Гидролиз Al 2 S 3 + 6H 2 O = 2Al(OH) 3 ↓ + 3 H 2 S↑ Вытеснение из солей FeS + 2HCl = FeCl 2 + H 2 S↑ Прямой синтез H 2 + S = H 2 S (в расплаве серы)
Слайд 34
Свойства H 2 S 34 Способ Уравнение C кислородом 2H 2 S + 3 O 2 = 2SO 2 + 2H 2 O ( избыток O 2 ) 2 H 2 S + O 2 = 2 S + 2H 2 O ( недостаток O 2 ) С аммиаком и основаниями 2NH 3 + H 2 S = (NH 4 ) 2 S NH 3 + H 2 S = NH 4 HS NH 3 *H 2 O + H 2 S = NH 4 HS + H 2 O С солями H 2 S + 2AgNO 3 = Ag 2 S↓ + 2HNO 3 H 2 S + PbCl 2 = PbS↓ + 2HCl С оксидами 2H 2 S + SO 2 = 2H 2 O + 3S ( жидкость Вакенродера) 2H 2 S + 4 SO 2 + 6 NaOH = 3Na 2 S 2 O 3 + 5H 2 O H 2 S + ZnO = ZnS + H 2 O (800-1000 0 C) С металлами H 2 S (влаж. ) + Zn = ZnS + H 2 (700-800 0 C) 2H 2 S + 2Na = 2NaHS + H 2 (150 0 C)
Слайд 35
Свойства H 2 S 35 Способ Уравнение С кислотами H 2 S + H 2 SO 4 ( конц) = 4SO 2 ↑ + 4H 2 O ( кип.) H 2 S + H 2 SO 4 ( конц) = S↓ + SO 2 ↑ + 2H 2 O (комн.) H 2 S + 8 HNO 3 ( конц) = H 2 SO 4 + 8NO 2 ↑+ 4H 2 O ( кип.) H 2 S + 2 HNO 3 ( конц) = S↓ + 2 NO 2 ↑+ 2 H 2 O ( холод.) C окислителями ( S, SO 2, H 2 SO 4, Na 2 S 2 O 3 ) H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCI H 2 S + l 2 = S↓ + 2HI ( в р-ре) 4H 2 S + 3PbO 2 = 3PbS +SO 2 ↑+ 4H 2 O 3H 2 S + 2KMnO 4 = 2MnO 2 +S↓+ 2H 2 O + 2KOH
Слайд 36
Соединения серы. Оксиды серы 36 SO 2 SO 3 ↑, б/ ц, удушливый запах 40 V(O 2 ) в 1 V(H 2 O) t пл = -75 0 С t кип = -1 0 0 С Белый, гигроскопичный порошок, при плавлении - подвижная жидкость. Образует несколько полиморфных модификаций, хорошо растворим в конц. H 2 SO 4, t пл = -17 0 С SO 3 +H 2 O = H 2 SO 4 + 90 кДж Получение Сжигание серы и сульфидов S + O 2 = SO 2 4FeS 2 + 11O 2 = 8 SO 2 + 2Fe 2 O 3 Каталитическое окисление SO 2 2SO 2 + O 2 ↔ 2SO 3 V 2 O 5, 400-500 0 C Разложение сульфитов кислотами Na 2 SO 3 +2H 2 SO 4 (70%) = 2NaHSO 4 + SO 2 + H2O
Слайд 37
Свойства SO 2 и сернистой кислоты 37 Способ Уравнение С водой SO 2 + H 2 O = H 2 SO 3 H 2 SO 3 ↔ H + + HSO 3 - K 1 = 1,3*10 -2 HSO 3 - ↔ H + + SO 3 2- K 2 = 6,2*10 -8 C основными оксидами, основаниями и аммиаком SO 2 + NaOH = NaHSO 3 SO 2 + 2NaOH = Na 2 SO 3 + H 2 O CaSO 3 + SO 2 + H 2 O = Ca(HSO 3 ) 2
Слайд 38
Свойства SO 2 и сернистой кислоты 38 Способ Уравнение C c олями CaSO 3 + SO 2 + H 2 O = Ca(HSO 3 ) 2 Na 2 CO 3 + 2SO 2 + H 2 O = NaHSO 3 + CO 2 ↑ Na 2 CO 3( конц ) + 2SO 2 = Na 2 SO 3 + CO 2 ↑ С кислородом 2SO 2 + O 2 ↔ 2SO 3 ( V 2 O 5, 400-500 0 C ) 2SO 2 + 2H 2 O + O 2 = 2H 2 SO 4 C окислителями SO 2 + I 2 + 2H 2 O + O 2 = 2HI + H 2 SO 4 5 SO 2 + 2 KMnO 4 + 2H 2 O=2MnSO 4 + 2KHSO 4 + H 2 SO 4 С восстановителями SO 2 + С = S + С O 2 ( 400-600 0 C ) SO 2 + 2 СО = S + 2С O 2 ( Al 2 O 3, 500 0 C ) SO 2 + 2H 2 S = 3S + 2 H 2 O SO 2 + 2H 2 = S + 2 H 2 O
Слайд 39
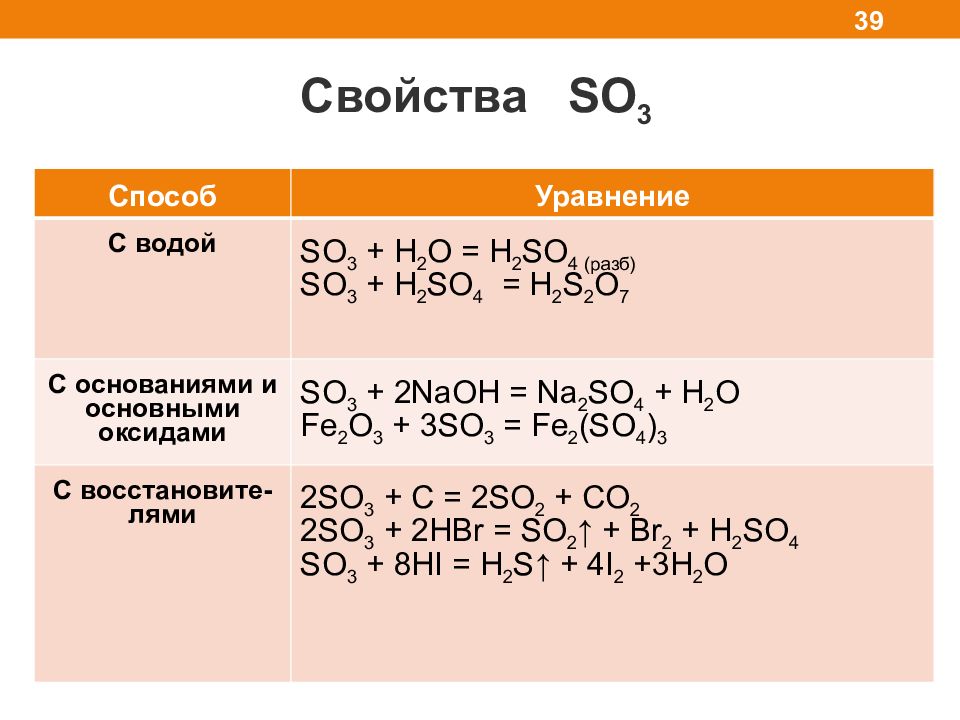
Свойства SO 3 39 Способ Уравнение С водой SO 3 + H 2 O = H 2 SO 4 ( разб ) SO 3 + H 2 SO 4 = H 2 S 2 O 7 C основаниями и основными оксидами SO 3 + 2NaOH = Na 2 SO 4 + H 2 O Fe 2 O 3 + 3SO 3 = Fe 2 (SO 4 ) 3 C восстановите- лями 2SO 3 + C = 2SO 2 + CO 2 2SO 3 + 2 HBr = SO 2 ↑ + Br 2 + H 2 SO 4 SO 3 + 8HI = H 2 S↑ + 4I 2 +3H 2 O
Слайд 40
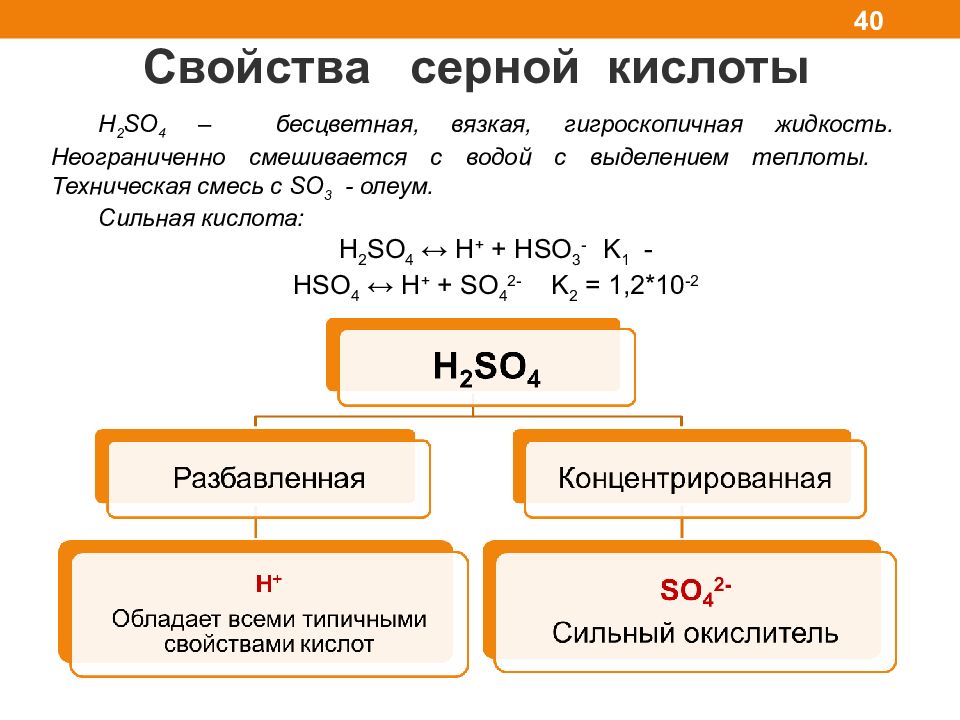
Свойства серной кислоты 40 H 2 SO 4 – бесцветная, вязкая, гигроскопичная жидкость. Неограниченно смешивается с водой с выделением теплоты. Техническая смесь с SO 3 - олеум. Сильная кислота: H 2 SO 4 ↔ H + + HSO 3 - K 1 - HSO 4 ↔ H + + SO 4 2- K 2 = 1,2*10 - 2
Слайд 41
Свойства серной кислоты 41 Способ Уравнение C основаниями и основными оксидами H 2 SO 4 + NaOH = NaHSO 4 + H 2 O H 2 SO 4 + 2 NaOH = Na 2 SO 4 + 2 H 2 O H 2 SO 4 + NH 3 = NH 4 HSO 4 H 2 SO 4 + 2NH 3 = (NH 4 ) 2 SO 4 + H 2 O H 2 SO 4 + CuO = CuSO 4 + H 2 O С солями H 2 SO 4 + Ba(NO 3 ) 2 = BaSO 4 ↓ + 2HNO 3 H 2 SO 4 + Na 2 CO 3 = Na 2 SO 4 + CO 2 ↑ + 2H 2 O H 2 SO 4 + NaCl ( крист ) = NaHSO 4 + HCl↑ (50 0 C) H 2 SO 4 + 2NaCl ( крист ) = Na 2 SO 4 + 2HCl↑ ( кип. ) H 2 SO 4( конц) + Na 2 SO 4 = 2NaHSO 4 С металлами до Н Zn + H 2 SO 4 (разб) = ZnSO 4 + H 2 ↑
Слайд 42
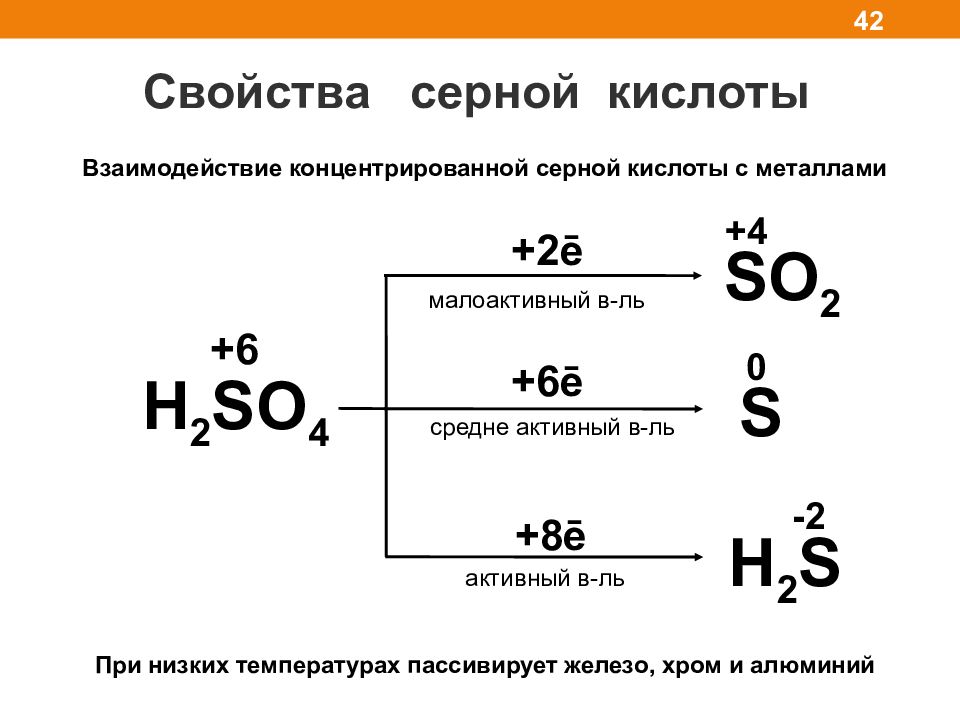
Свойства серной кислоты 42 Взаимодействие концентрированной серной кислоты с металлами H 2 SO 4 SO 2 +4 + 2ē +6 ē - 2 S H 2 S малоактивный в-ль средне активный в-ль активный в-ль +8 ē 0 +6 При низких температурах пассивирует железо, хром и алюминий
Слайд 43
Свойства серной кислоты 43 Способ Уравнение C неметаллами 2 H 2 SO 4 + S = 3SO 2 + H 2 O 2H 2 SO 4 + C = 2SO 2 + CO 2 + 2 H 2 O 6H 2 SO 4 + 4P = 4H 3 PO 3 + 6SO 2 С восстановите-лями H 2 SO 4 + H 2 S = S + SO 2 + 2H 2 O 3H 2 SO 4 + 2KBr = SO 2 + Br 2 + 2H 2 O + 2KHSO 4 5H 2 SO 4 + 8Kl = H 2 S + 4l 2 + 4H 2 O +4K 2 SO 4
Слайд 44
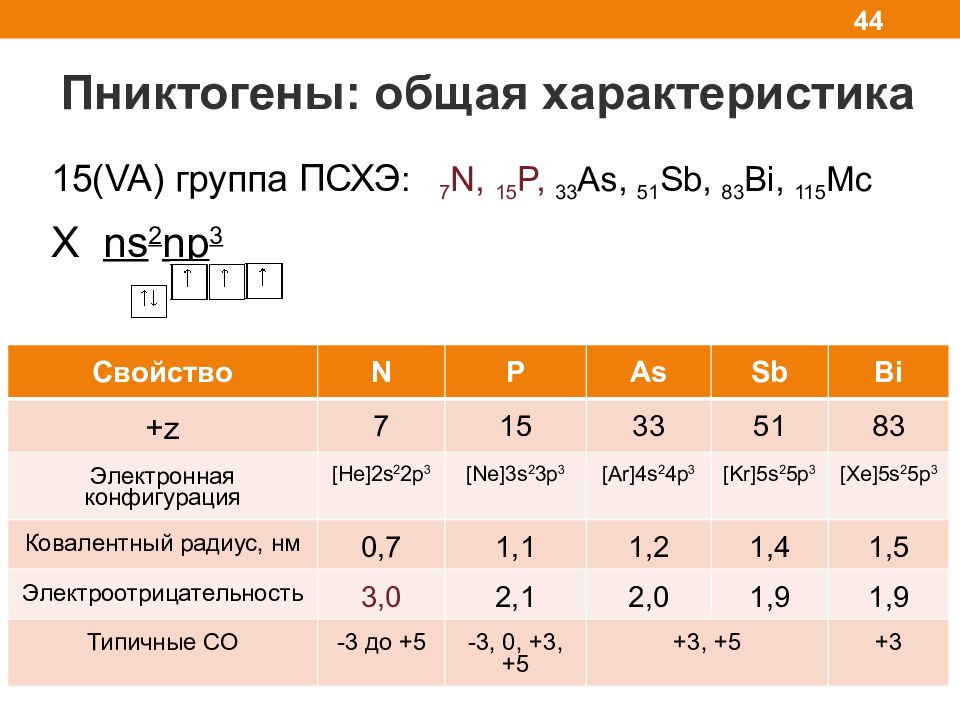
Пниктогены: общая характеристика 44 15( VA) группа ПСХЭ : 7 N, 1 5 P, 3 3 As, 5 1 Sb, 8 3 Bi, 115 Mc X ns 2 np 3 Свойство N P As Sb Bi +z 7 15 33 51 83 Электронная конфигурация [He]2s 2 2p 3 [Ne]3s 2 3p 3 [Ar]4s 2 4p 3 [Kr]5s 2 5p 3 [Xe]5s 2 5p 3 Ковалентный радиус, нм 0, 7 1,1 1, 2 1, 4 1,5 Электроотрицательность 3, 0 2, 1 2, 0 1, 9 1,9 Типичные СО - 3 до + 5 -3, 0, +3, +5 +3, +5 +3
Слайд 45
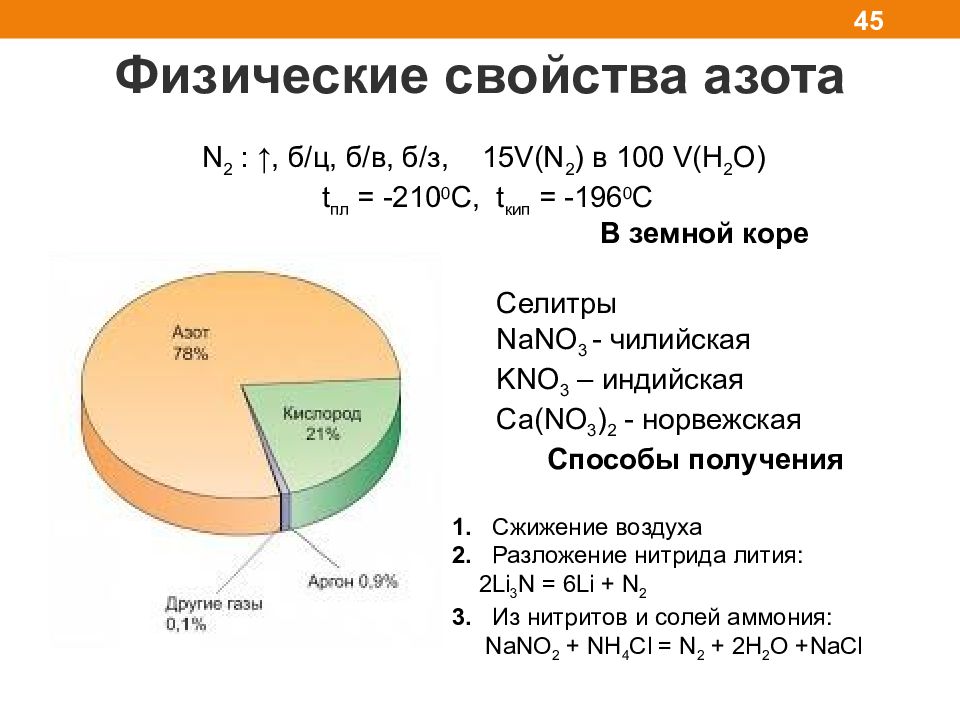
Физические свойства азота 45 N 2 : ↑, б/ц, б/в, б/з, 15V(N 2 ) в 100 V(H 2 O) t пл = -2 10 0 С, t кип = -196 0 С Способы получения 1. Сжижение воздуха 2. Разложение нитрида лития: 2Li 3 N = 6 Li + N 2 3. Из нитритов и солей аммония: NaNO 2 + NH 4 Cl = N 2 + 2H 2 O +NaCl В земной коре Селитры NaNO 3 - чилийская KNO 3 – индийская Ca(NO 3 ) 2 - норвежская
Слайд 47
Получение фосфора 47 Содержание в земной коре : 0,04 атомных % (0,1 масс. %) Минералы: 1) Апатиты: Гидроксоапатит Ca 5 (PO 4 ) 3 OH Фторапатит Ca 5 (PO 4 ) 3 F 2) Фосфорит Ca 3 (PO 4 ) 2 Способы получения 1. Восстановление фосфатов коксом : 2 Ca 3 (PO 4 ) 2 + 6 SiO 2 +10C = P 4 + 6CaSiO 3 + 10CO ↑ ( электропечь, 1500 0 C) 2. Восстановление метафосфорной кислоты: 4HPO 3 + 12C = P 4 + 2H 2 ↑ + 12CO↑
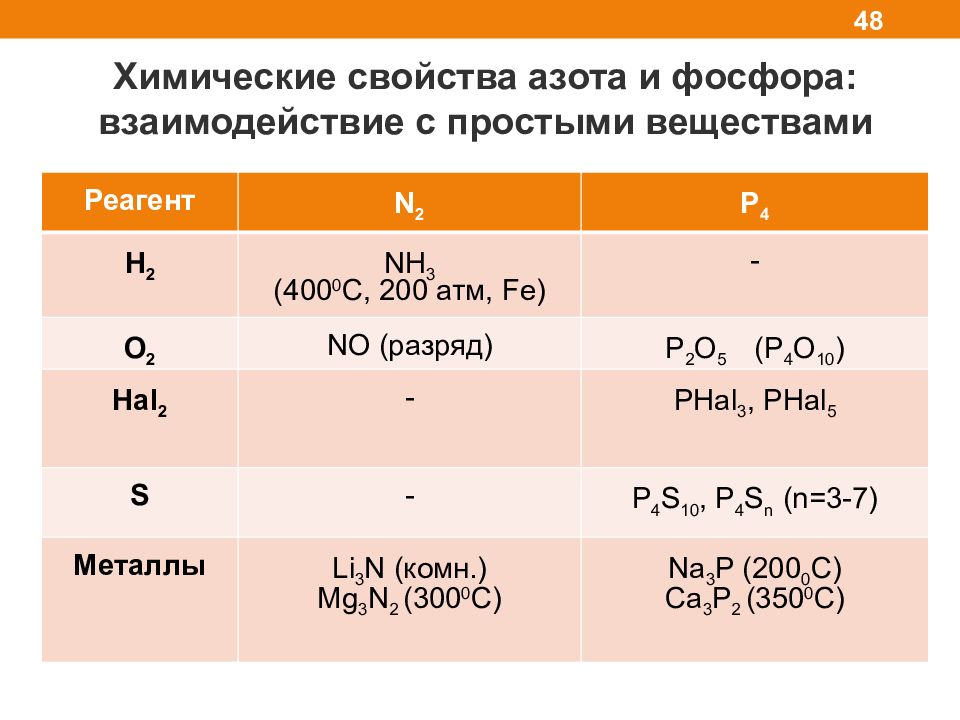
Слайд 48
Химические свойства азота и фосфора: взаимодействие с простыми веществами 48 Реагент N 2 P 4 H 2 NH 3 (400 0 C, 200 атм, Fe) - O 2 NO ( разряд) Р 2 O 5 (P 4 O 10 ) Hal 2 - PHal 3, PHal 5 S - P 4 S 10, P 4 S n (n=3-7) M еталлы Li 3 N ( комн.) Mg 3 N 2 (300 0 C) Na 3 P (200 0 C ) Ca 3 P 2 (350 0 C)
Слайд 49
Взаимодействие со сложными веществами 49 Реагент Р 4 Вода 2Р( красн.) + 8 H 2 O = 2 H 3 PO 4 + 5 H 2 (700 0 C, Pt/Cu) Р 4 + 6 H 2 O = 3 H 3 PO 2 + РН 3 ( рН > 7) Кислоты - оксилители 6H 2 SO 4 ( конц) + P 4 = 4 H 3 PO 3 + 6SO 2 5HNO 3 ( конц) + P ( красн) = 4 H 3 PO 4 + 5NO 2 + H 2 O ( кип.) Щелочи Р 4 + 3 KOH ( конц ) + 3 H 2 O = 3 KH 2 PO 2 + РН 3 ( кип. )
Слайд 50
Водородные соединения азота и фосфора 50 NH 3 и РН 3 – бесцветные газы с резким запахом NH 3 t пл = -78 0 C РН 3 t пл = -134 0 C t кип = -33 0 C t кип = -88 0 C 1 V H 2 O – 1200 V NH 3 (н.у.) 100 V H 2 O – 26 V Р H 3 (н.у.) Получение Вещество Способ Аммиак Прямой синтез 3H 2 + N 2 = 2NH 3 (400-500 0 C, 10-300 атм, Fe) Ф. Габер Фосфор 1. Взаимодействие фосфора со щелочами Р 4 + 3 KOH ( конц) + 3 H 2 O = 3 KH 2 PO 2 + РН 3 ( кип. ) 2. Гидролиз фосфидов Ca 3 P 2 + 6H 2 O = 2PH 3 + 3Ca(OH) 2
Слайд 51
Свойства аммиака и фосфина 51 Способ Уравнение C водой NH 3 + H 2 O = NH 3 *H 2 O NH 3 + H 2 O = NH 4 + + O Н - К д = 1,8*10 -5 PH 3 + H 2 O ↔ PH 4 + + O Н - К д = 4 *10 - 28 С кислородом 4 NH 3 + 3O 2 = 2N 2 + 6H 2 O (горение в атм. О 2 ) 4 NH 3 + 5 O 2 = 4 N О + 6 H 2 O (800 0 С, Pt) PH 3 + 2O 2 = H 3 P О 4 С хлором и бромом 3 Cl 2 + 8 NH 3 = N 2 + 6 NH 4 Cl C металлами 2Li + 2 NH 3 = 2LiNH 2 + H 2 (220 0 C ) 3Mg + 2 NH 3 = 2Mg 3 N 2 + 3H 2 (600 0 C ) C оксидами металлов 2NH 3 + Al 2 O 3 = AlN + 3H 2 O (1000 0 C) 2NH 3 + 3CuO = Cu + N 2 + 3H 2 O (500 0 C) C оксидами неметаллов NH 3 + H 2 O + СО 2 = NH 4 HCO 3
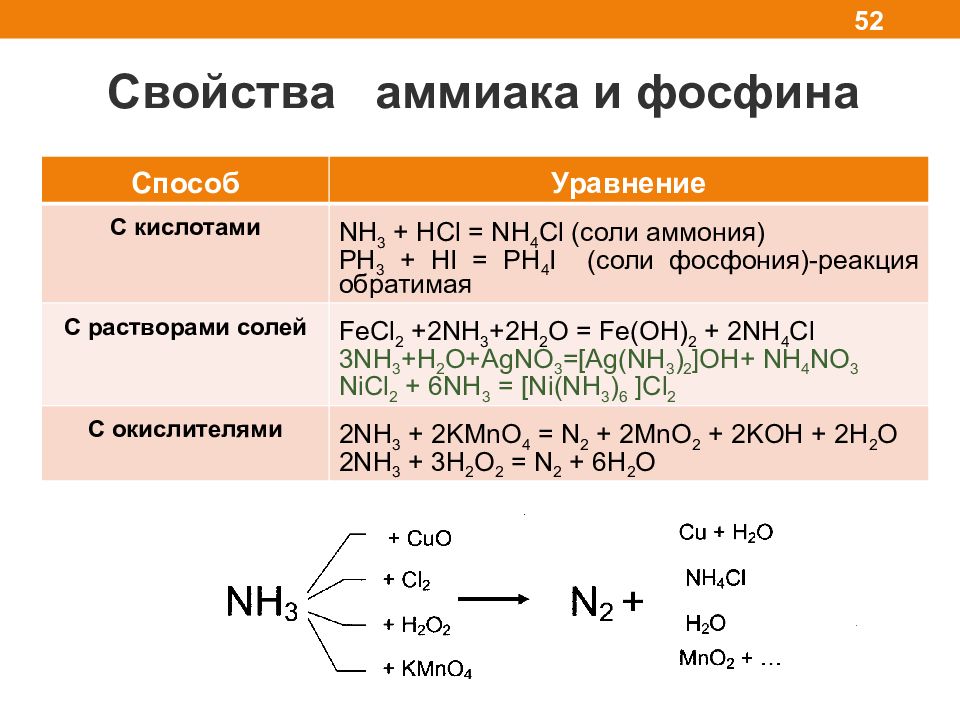
Слайд 52
Свойства аммиака и фосфина 52 Способ Уравнение С кислотами NH 3 + HCl = NH 4 Cl ( соли аммония) PH 3 + HI = PH 4 I (соли фосфония )-реакция обратимая С растворами солей FeCl 2 +2NH 3 +2H 2 O = Fe(OH) 2 + 2NH 4 Cl 3NH 3 +H 2 O+AgNO 3 =[Ag(NH 3 ) 2 ]OH+ NH 4 NO 3 NiCl 2 + 6NH 3 = [Ni(NH 3 ) 6 ]Cl 2 C окислителями 2 NH 3 + 2 KMnO 4 = N 2 + 2MnO 2 + 2KOH + 2H 2 O 2 NH 3 + 3H 2 O 2 = N 2 + 6H 2 O
Слайд 54
Свойства азотистой кислоты и нитритов 54 HNO 2 – существует только в растворах. Получение: Ba(NO 2 ) 2 + H 2 SO 4 = 2HNO 2 ↑+ BaSO 4 ↓ Свойства 1) Легко разлагается: 3HNO 2 = HNO 3 + 2NO↑ + H 2 O 2) Окислитель и восстановитель 2NaNO 2 + 2KI + 2H 2 SO 4 = I 2 + 2NO + K 2 SO 4 + Na 2 SO 4 + 2H 2 O 5KNO 2 + + 2KMnO 4 + 3H 2 SO 4 = 2MnSO 4 +5KNO 3 + K 2 SO 4 + 3H 2 O
Слайд 55
Свойства азотной кислоты 55 HNO 3 – бесцветная, летучая жидкость. При переливании на воздухе образует туман – «дымящая азотная кислота» (100%). В лаборатории используют 68% р-р. Получение: В промышленности 4 NH 3 + 5 O 2 = 4 N О + 6 H 2 O (800 0 С, Pt) 2NO + O 2 = NO 2 4NO 2 + O 2 + 2H 2 O = 4HNO 3 В лаборатории: NaNO 3 ( тв) + H 2 SO 4 ( конц) = HNO 3 ↑+ NaHSO 4 Сильная кислота: HNO 3 ↔ H + + NO 3 -
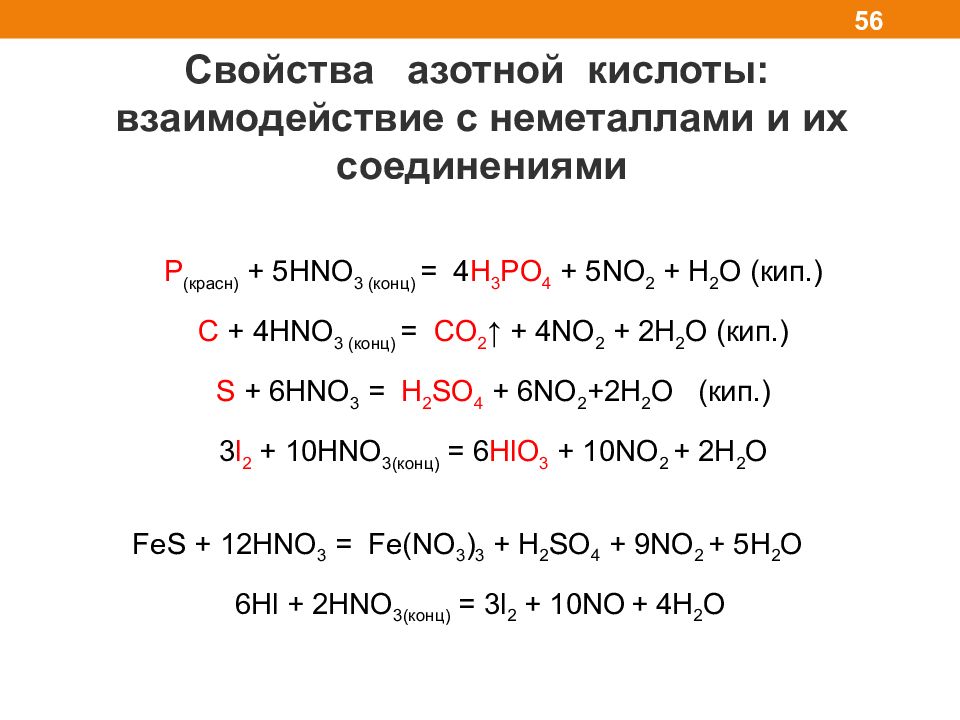
Слайд 56
Свойства азотной кислоты: взаимодействие с неметаллами и их соединениями 56 P ( красн) + 5HNO 3 ( конц) = 4 H 3 PO 4 + 5NO 2 + H 2 O ( кип.) C + 4HNO 3 ( конц) = CO 2 ↑ + 4NO 2 + 2H 2 O ( кип.) S + 6HNO 3 = H 2 SO 4 + 6NO 2 +2H 2 O ( кип. ) 3 l 2 + 10 HNO 3( конц) = 6 HlO 3 + 10NO 2 + 2H 2 O FeS + 12HNO 3 = Fe(NO 3 ) 3 + H 2 SO 4 + 9NO 2 + 5H 2 O 6Hl + 2HNO 3( конц) = 3l 2 + 10NO + 4H 2 O
Слайд 57
Свойства азотной кислоты: взаимодействие с металлами 57 Cu + 4 HNO 3 (60-68%) = Cu(NO 3 ) 2 + 2NO 2 + 2 H 2 O ( Mg, Zn, Hg ) Cr, Al, Fe - пассивируются (оксидная пленка и низкая растворимость нитратов в концентрированной азотной кислоте) 3Cu + 8HNO 3 ( <60% ) = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O Fe + 4 HNO 3 (30%) = Fe(NO 3 ) 3 + NO + 2H 2 O 4Zn + 10HNO 3 ( 10 %) = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O ( Mg ) 5Zn + 12HNO 3 ( 10 %) = 5Zn(NO 3 ) 2 + N 2 + 6H 2 O ( Mn, Mg ) 5 Fe + 12HNO 3 (5%) = 5Fe(NO 3 ) 2 + N 2 + 6H 2 O 4Zn + 10HNO 3 (3 -5 %) = Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O ( Al, Sn, Fe )
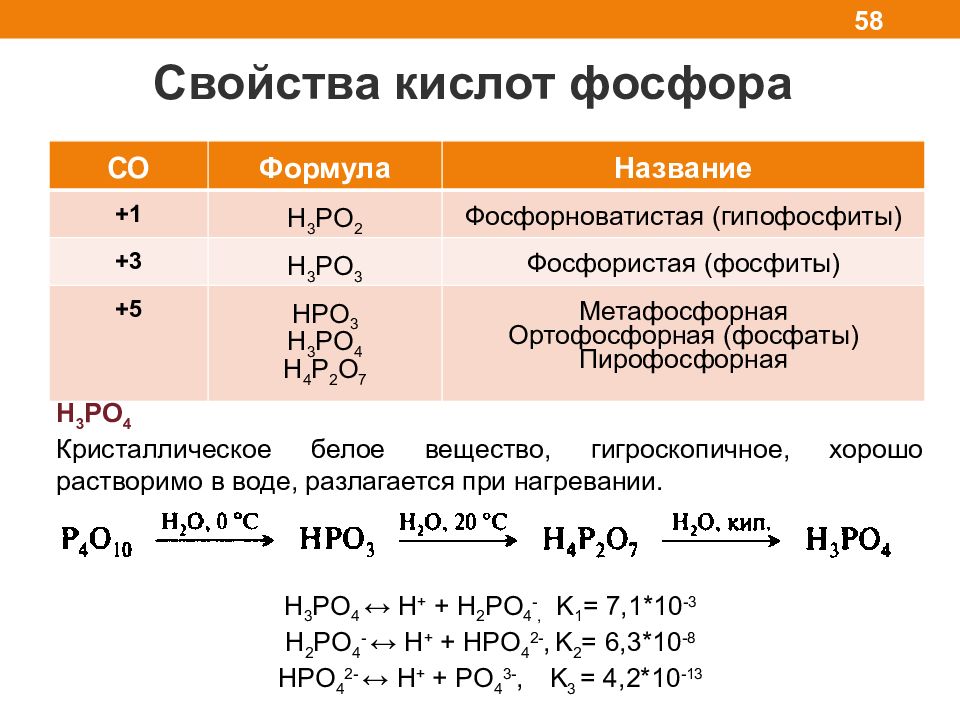
Слайд 58
Свойства кислот фосфора 58 6NO 2 +2H 2 O ( кип. СО Формула Название +1 H 3 PO 2 Фосфорноватистая (гипофосфиты) +3 H 3 PO 3 Фосфористая (фосфиты) +5 HPO 3 H 3 PO 4 H 4 P 2 O 7 Метафосфорная Ортофосфорная (фосфаты) Пирофосфорная H 3 PO 4 Кристаллическое белое вещество, гигроскопичное, хорошо растворимо в воде, разлагается при нагревании. H 3 PO 4 ↔ H + + H 2 PO 4 -, K 1 = 7,1*10 -3 H 2 PO 4 - ↔ H + + HPO 4 2-, K 2 = 6,3*10 -8 HPO 4 2- ↔ H + + PO 4 3-, K 3 = 4,2*10 -13
Слайд 59
Химические свойства ортофосфорной кислоты 59 6NO 2 +2H 2 O ( кип. Реагент Уравнение Щелочи MH 2 PO 4 H 3 PO 4 M 2 HPO 4 M 3 PO 4 Металлы 3 Mg + 2 H 3 PO 4 = Mg 3 (PO 4 ) 2 ↓ + H 2 ↑ Оксиды металлов 3 ZnO + 2 H 3 PO 4 = Zn 3 (PO 4 ) 2 ↓ + 3H 2 O Соли 3AgNO 3 + H 3 PO 4 = Ag 3 PO 4 ↓ + 3HNO 3
Слайд 60
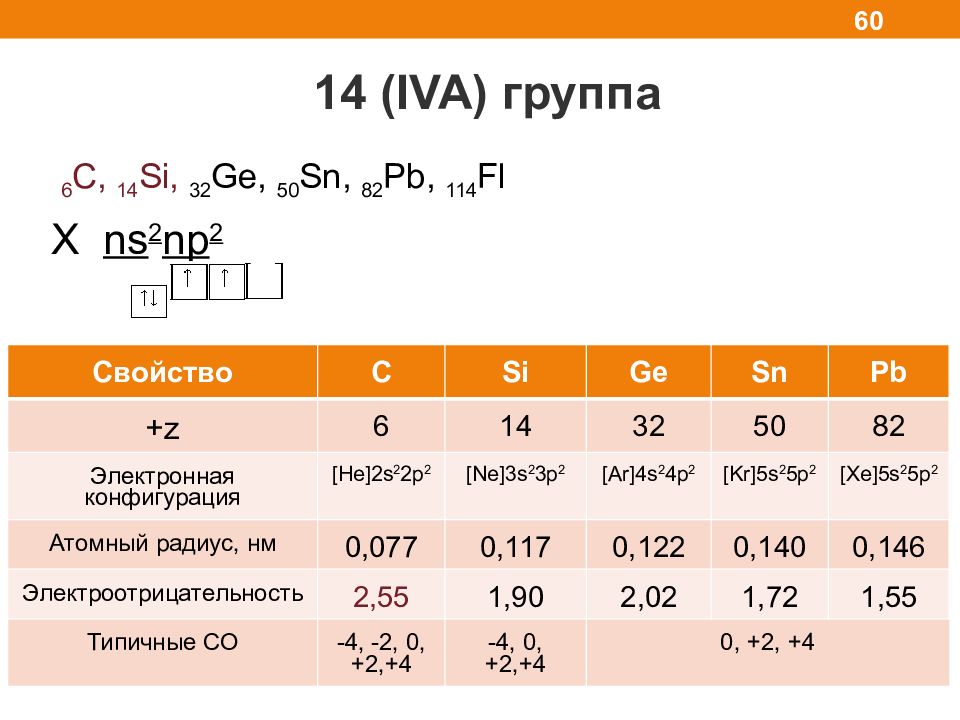
14 ( IVA) группа 60 6 С, 1 4 Si, 3 2 Ge, 5 0 Sn, 8 2 Pb, 114 Fl X ns 2 np 2 Свойство С Si Ge Sn Pb +z 6 14 32 50 82 Электронная конфигурация [He]2s 2 2p 2 [Ne]3s 2 3p 2 [Ar]4s 2 4p 2 [Kr]5s 2 5p 2 [Xe]5s 2 5p 2 Атомный радиус, нм 0,077 0,117 0,122 0,140 0,146 Электроотрицательность 2,55 1,90 2,02 1,72 1,55 Типичные СО -4, -2, 0, +2,+4 -4, 0, +2,+4 0, +2, +4
Слайд 61
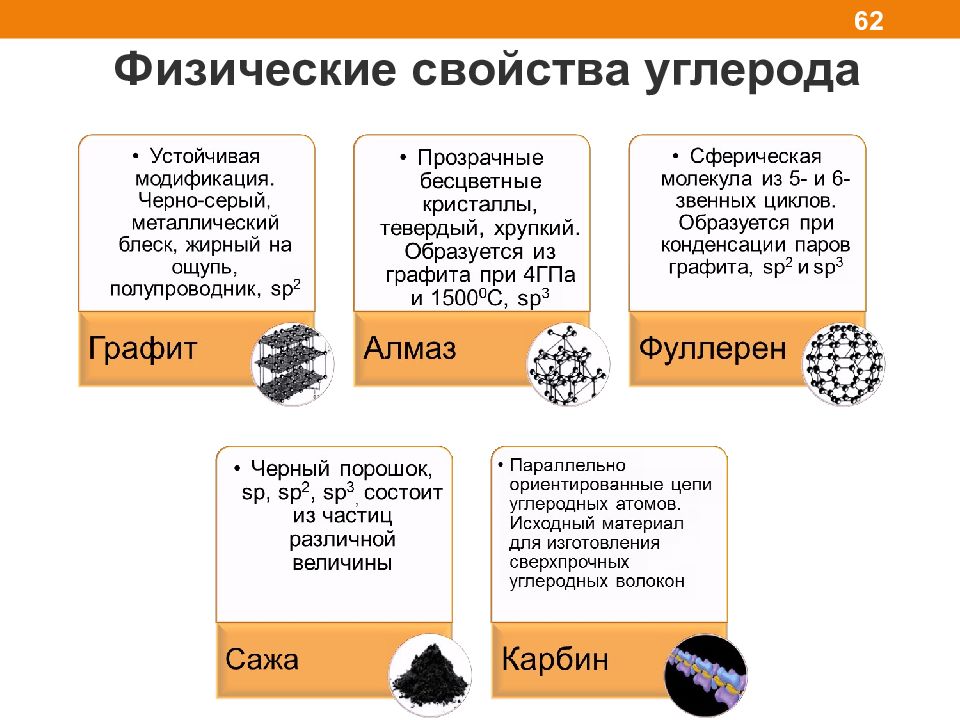
Углерод: нахождение в природе 61 По содержанию в земной коре – на 17 месте
Слайд 63
Кремний: нахождение в природе, физические свойства, получение 63 По содержанию в земной коре – на 2 месте (27,5%). (кварц, силикаты и алюмосиликаты) 1. Восставленные из кварца или тетрахлорида кремния SiO 2 + 2C = Si + 2CO SiCl 4 + 2Zn = Si + 2ZnCl 2 2. Разложение силана SiH 4 = 2H 2 + Si ( 400-500 0 C)
Слайд 64
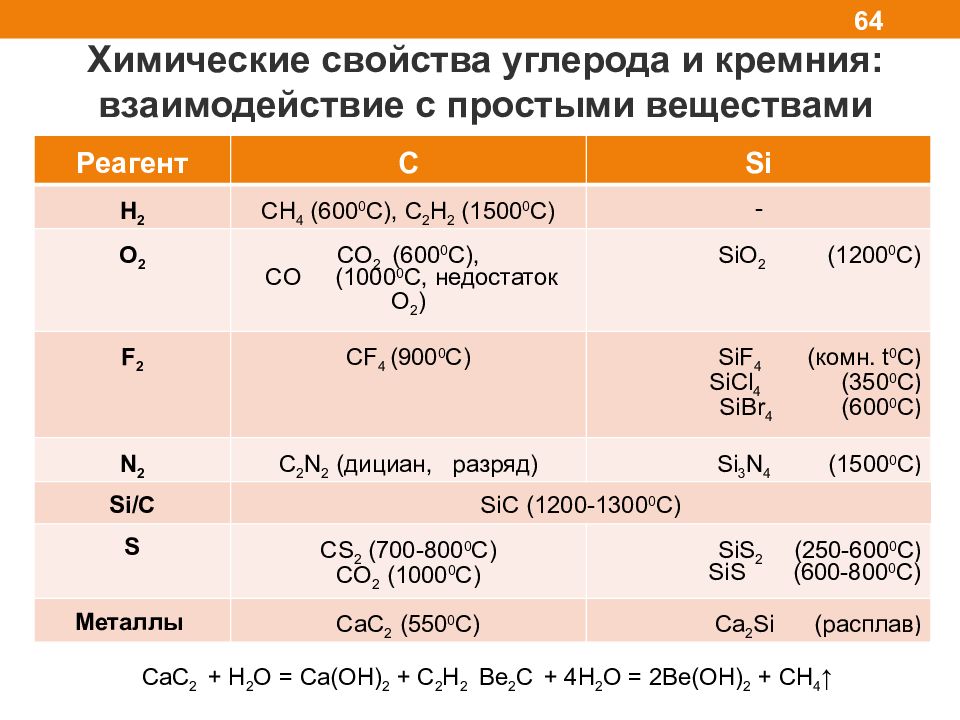
Химические свойства углерода и кремния: взаимодействие с простыми веществами 64 Реагент C Si H 2 СН 4 (600 0 C), С 2 Н 2 (1500 0 С) - O 2 CO 2 (600 0 C), CO (1000 0 C, недостаток О 2 ) SiO 2 (1200 0 C) F 2 С F 4 ( 900 0 С) SiF 4 ( комн. t 0 C ) SiCl 4 (350 0 C ) SiBr 4 (600 0 C ) N 2 C 2 N 2 ( дициан, разряд) Si 3 N 4 (1500 0 C ) Si/C SiC (1200-1300 0 C) S CS 2 (700-800 0 C) CO 2 (1000 0 C) SiS 2 (250-600 0 C ) SiS (600-800 0 C) M еталлы CaC 2 (550 0 C) Ca 2 Si ( расплав ) CaC 2 + H 2 O = Ca(OH) 2 + C 2 H 2 Be 2 C + 4H 2 O = 2Be(OH) 2 + CH 4 ↑
Слайд 65
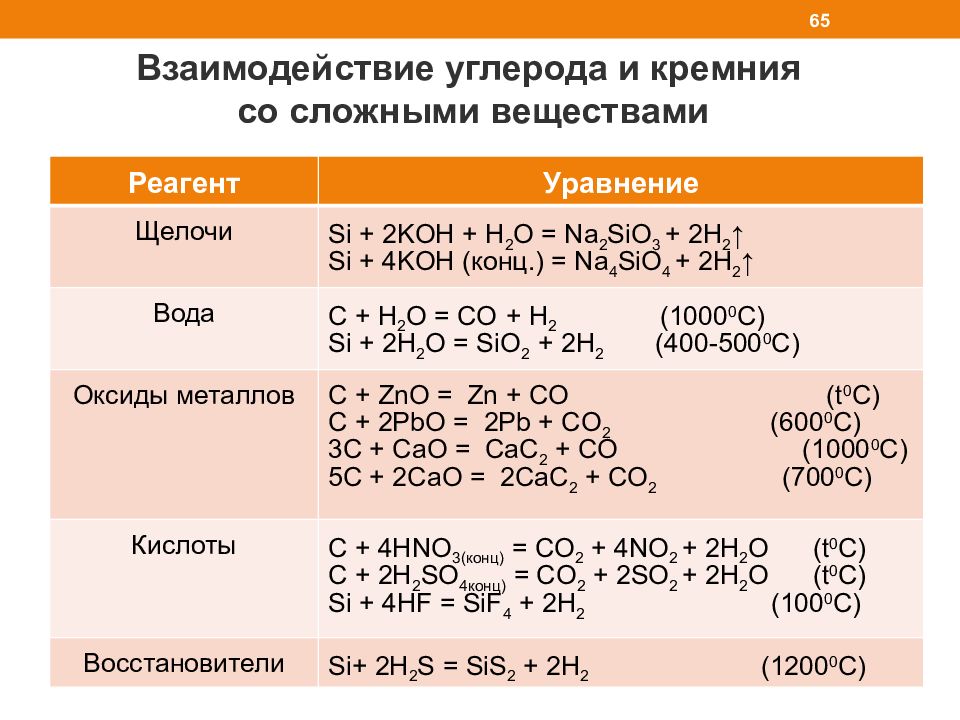
Взаимодействие углерода и кремния со сложными веществами 65 Реагент Уравнение Щелочи Si + 2KOH + H 2 O = Na 2 SiO 3 + 2H 2 ↑ Si + 4KOH ( конц.) = Na 4 SiO 4 + 2H 2 ↑ Вода C + H 2 O = CO + H 2 (1000 0 С) Si + 2H 2 O = SiO 2 + 2H 2 ( 4 00 -500 0 С) Оксиды металлов C + ZnO = Zn + CO ( t 0 С) C + 2PbO = 2Pb + CO 2 ( 6 00 0 С) 3C + CaO = CaC 2 + CO (1000 0 С) 5C + 2CaO = 2CaC 2 + CO 2 ( 7 00 0 С) Кислоты С + 4 HNO 3( конц) = С O 2 + 4 NO 2 + 2H 2 O ( t 0 С) С + 2H 2 SO 4 конц) = С O 2 + 2SO 2 + 2H 2 O ( t 0 С) Si + 4HF = SiF 4 + 2H 2 ( 100 0 С) Восстановители Si+ 2H 2 S = SiS 2 + 2H 2 (1200 0 C)
Слайд 66
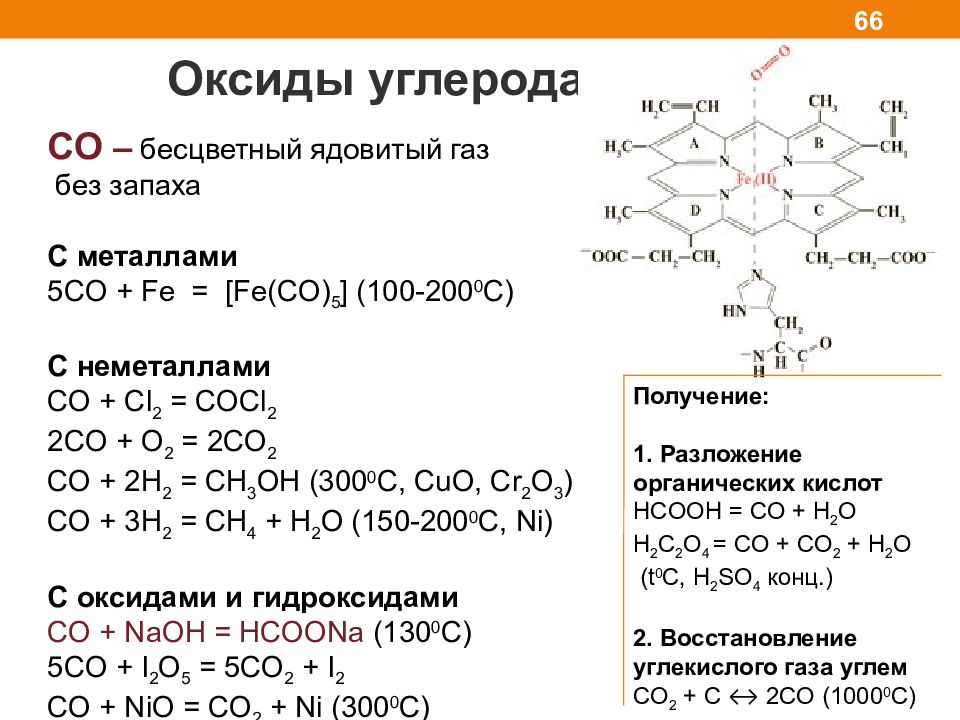
Оксиды углерода 66 CO – бесцветный ядовитый газ без запаха C металлами 5CO + Fe = [Fe(CO) 5 ] (100-200 0 C) С неметаллами С O + Cl 2 = COCl 2 2 С O + O 2 = 2CO 2 С O + 2H 2 = CH 3 OH (300 0 C, CuO, Cr 2 O 3 ) С O + 3H 2 = CH 4 + H 2 O (150-200 0 C, Ni) С оксидами и гидроксидами CO + NaOH = HCOONa (130 0 C) 5CO + I 2 O 5 = 5CO 2 + I 2 С O + NiO = С O 2 + Ni (300 0 С) Получение: 1. Разложение органических кислот HCOO Н = СО + H 2 O H 2 C 2 O 4 = СО + CO 2 + H 2 O (t 0 C, H 2 SO 4 конц. ) 2. Восстановление углекислого газа углем CO 2 + С ↔ 2 CO (1000 0 С)
Слайд 67
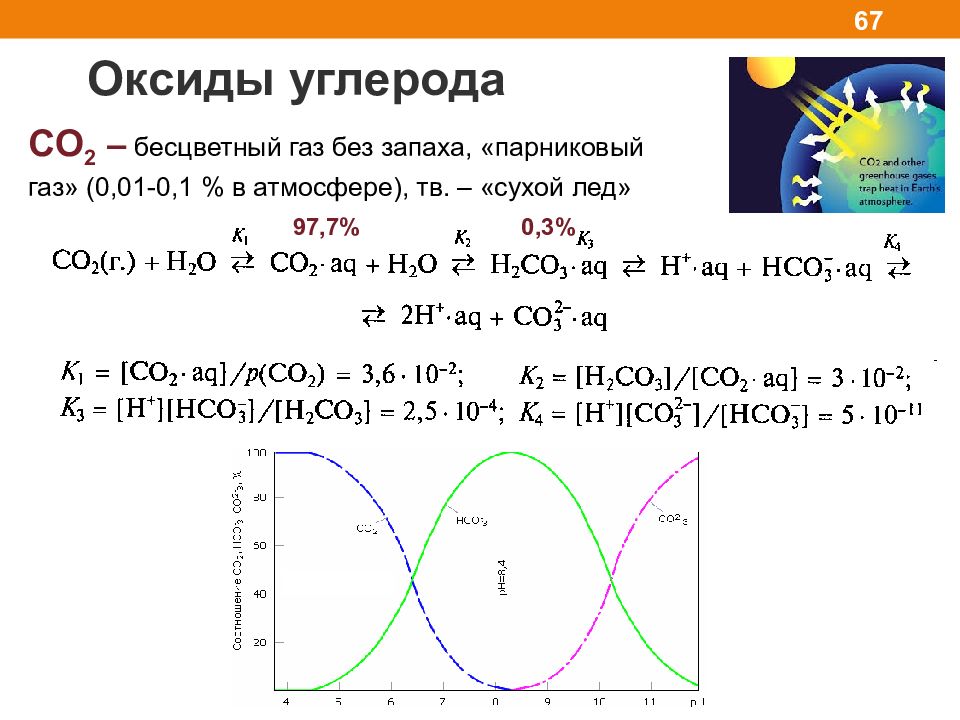
Оксиды углерода 67 CO 2 – бесцветный газ без запаха, «парниковый газ» (0,01-0,1 % в атмосфере), тв. – «сухой лед» 97,7% 0,3%
Слайд 68
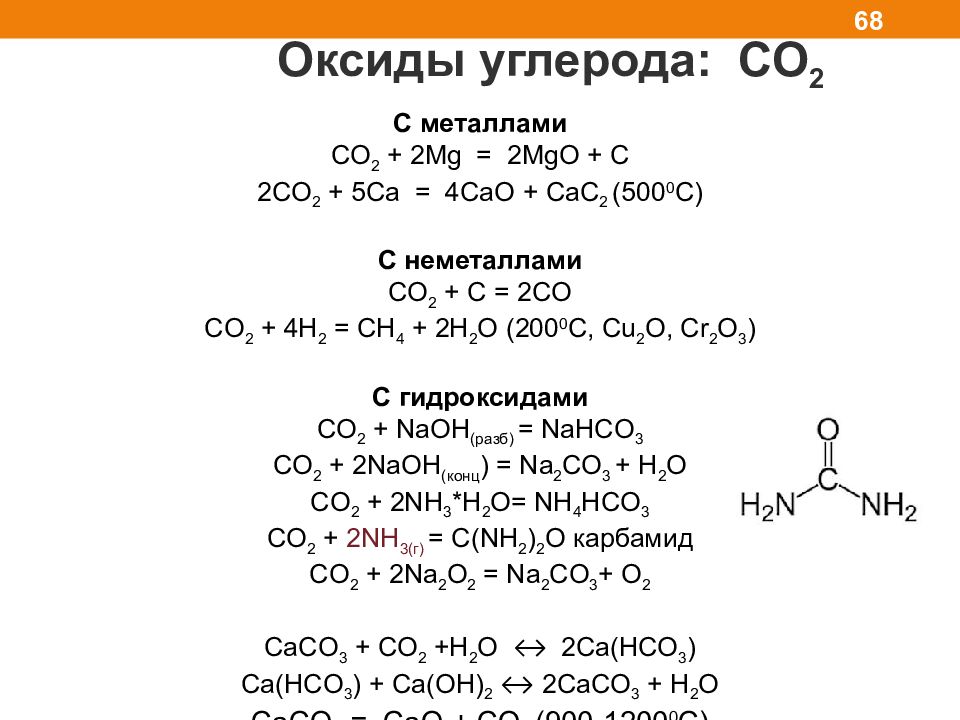
Оксиды углерода: СО 2 68 C металлами CO 2 + 2Mg = 2MgO + C 2CO 2 + 5 С a = 4CaO + CaC 2 (500 0 C) С неметаллами С O 2 + C = 2CO С O 2 + 4H 2 = CH 4 + 2H 2 O (200 0 C, Cu 2 O, Cr 2 O 3 ) С гидроксидами CO 2 + NaOH ( разб) = NaHCO 3 CO 2 + 2NaOH (конц ) = Na 2 CO 3 + H 2 O CO 2 + 2NH 3 * H 2 O= NH 4 HCO 3 CO 2 + 2NH 3 ( г) = С( NH 2 ) 2 O карбамид CO 2 + 2Na 2 O 2 = Na 2 CO 3 + O 2 CaCO 3 + CO 2 +H 2 O ↔ 2Ca(HCO 3 ) Ca(HCO 3 ) + С a ( OH ) 2 ↔ 2CaCO 3 + H 2 O С aCO 3 = CaO + CO 2 (900-1200 0 C)
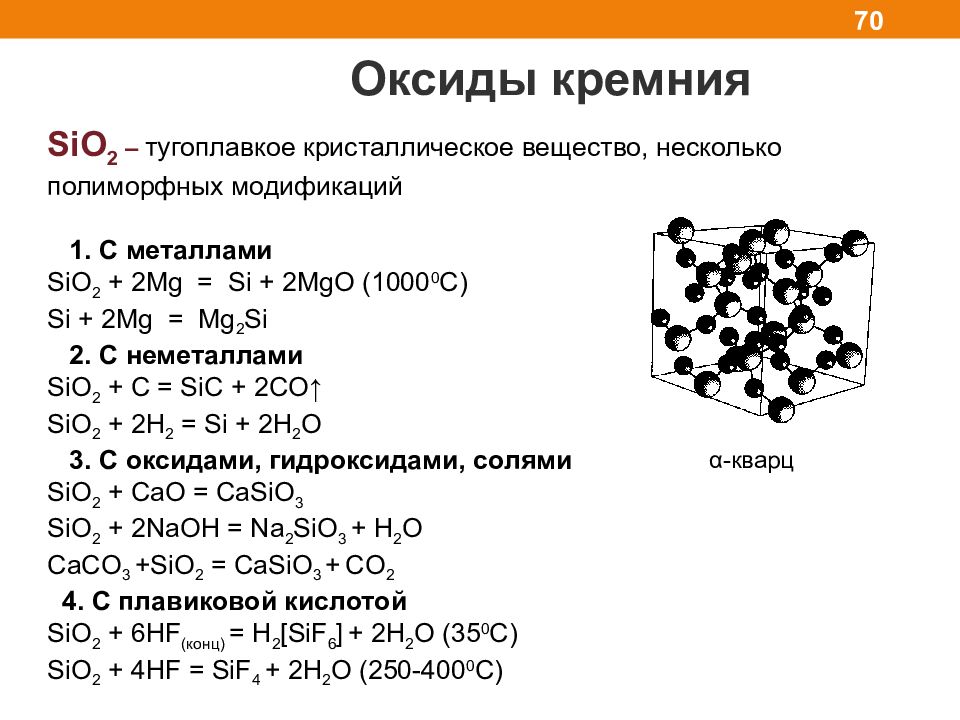
Слайд 70
Оксиды кремния 70 SiO 2 – тугоплавкое кристаллическое вещество, несколько полиморфных модификаций 1. C металлами SiO 2 + 2Mg = Si + 2MgO (1000 0 C) Si + 2Mg = Mg 2 Si 2. С неметаллами SiO 2 + C = SiC + 2CO↑ SiO 2 + 2H 2 = Si + 2H 2 O 3. С оксидами, гидроксидами, солями SiO 2 + CaO = CaSiO 3 SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O CaCO 3 +SiO 2 = CaSiO 3 + CO 2 4. С плавиковой кислотой SiO 2 + 6 HF ( конц) = H 2 [SiF 6 ] + 2H 2 O ( 35 0 C) SiO 2 + 4HF = SiF 4 + 2H 2 O ( 250-400 0 C) α - кварц
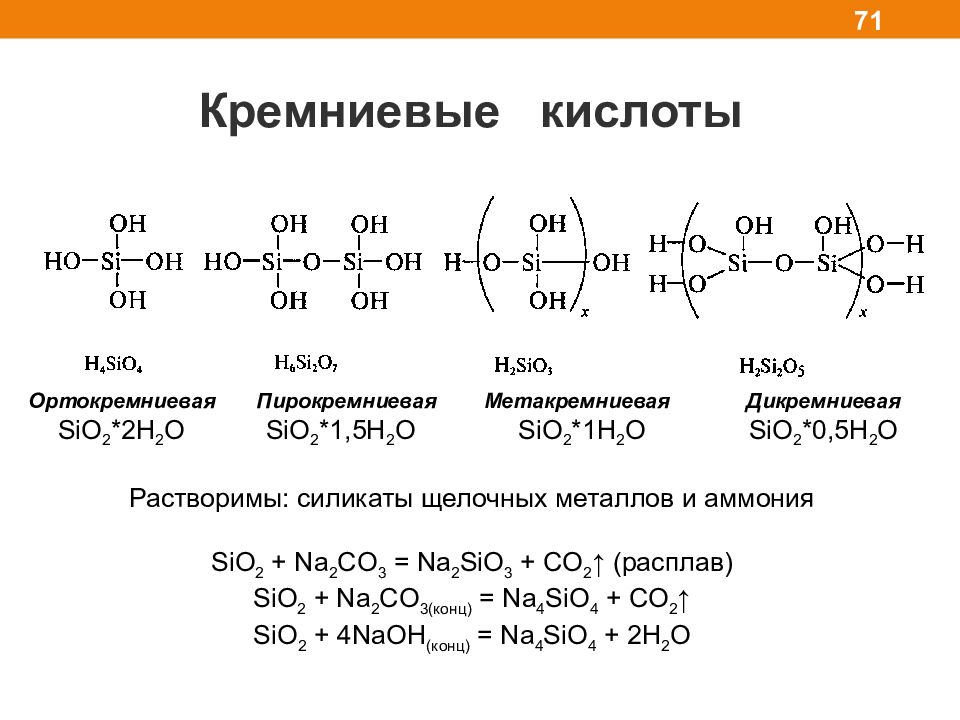
Слайд 71
Кремниевые кислоты 71 Ортокремниевая Пирокремниевая Метакремниевая Дикремниевая SiO 2 *2H 2 O SiO 2 *1,5H 2 O SiO 2 *1H 2 O SiO 2 *0,5H 2 O Растворимы: силикаты щелочных металлов и аммония SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2 ↑ ( расплав) SiO 2 + Na 2 CO 3 (конц) = Na 4 SiO 4 + CO 2 ↑ SiO 2 + 4NaOH (конц) = Na 4 SiO 4 + 2H 2 O
Слайд 72
. Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций. Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций. Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли. Напишите уравнения описанных реакций. Газ, выделившийся при нагревании твердой поваренной соли с концентрированной серной кислотой, пропустили через раствор перманганата калия. Газообразный продукт реакции поглотили холодным раствором едкого натра. После добавления в полученный раствор йодоводородной кислоты появляется резкий запах и раствор приобретает тёмную окраску.Напишите уравнения описанных реакций.
Слайд 73
Негашеную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при нагревании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение. Напишите уравнения описанных реакций. 2. Силицид магния обработали раствором хлороводородной кислоты и выделяющийся газ сожгли. Твердый продукт реакции смешали с кальцинированной содой, смесь нагрели до плавления и выдержали некоторое время. После охлаждения продукт реакции (используется под названием «жидкое стекло») растворили в воде и обработали раствором серной кислотой. Напишите уравнения описанных реакций. 3. Одно из веществ, образующихся при сплавлении оксида кремния с магнием, растворяется в щелочи. Выделяющийся газ ввели в реакцию с серой, а продукт их взаимодействия обработали хлором. Напишите уравнения описанных реакций. 4. Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой, и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
Слайд 74
. Твердое вещество, образующееся при взаимодействии сернистого газа и сероводорода, при нагревании взаимодействует с алюминием. Продукт реакции растворили в разбавленной серной кислоте и в образовавшийся раствор добавили поташ. Напишите уравнения описанных реакций. Раствор средней соли, образующейся при пропускании сернистого газа через раствор щелочи, на длительное время оставили на воздухе. Твердое вещество, образующееся после выпаривания раствора, смешали с коксом и нагрели до высокой температуры. При добавлении к твердому продукту реакции соляной кислоты выделился газ с запахом тухлых яиц.Напишите уравнения описанных реакций. Сернистый газ растворили в воде и раствор нейтрализовали, добавляя едкий натр. В образовавшийся раствор добавили перекись водорода и после окончания реакции ─ серную кислоту.Напишите уравнения описанных реакций. Несколько гранул цинка внесли в сосуд с концентрированной серной кислотой. Выделяющийся газ пропустили через раствор ацетата свинца ( II ), осадок отделили, подвергли обжигу и образовавшийся газ ввели во взаимодействие с водным раствором перманганата калия. Напишите уравнения описанных реакций.
Слайд 75
. 1. Фосфид кальция обработали соляной кислотой. Выделившийся газ сожгли в закрытом сосуде, продукт горения полностью нейтрализовали раствором гидроксида калия. К полученному раствору прилили раствор нитрата серебра. Напишите уравнения описанных реакций. 2. Ортофосфат кальция прокалили с углем и речным песком. Образовавшееся при этом белое светящееся в темноте вещество сожгли в атмосфере хлора. Продукт этой реакции растворили в избытке гидроксида калия. К полученной смеси прилили раствор гидроксида бария. Напишите уравнения описанных реакций. 3. Простое вещество, полученное при нагревании смеси фосфата кальция с коксом и оксидом кремния, растворяется в растворе едкого кали. Выделяющееся газообразное вещество сожгли, продукты горения собрали и охладили, а в полученный раствор добавили нитрат серебра. Напишите уравнения описанных реакций. 4. Смесь ортофосфата кальция, кокса и песка нагрели в электрической печи. Один из продуктов этой реакции может самовоспламеняться на воздухе. Твердый продукт горения этого вещества при нагревании растворили в воде и через полученный раствор пропустили газообразный аммиак. Напишите уравнения описанных реакций.
Последний слайд презентации: НЕМЕТАЛЛЫ 1 кхн Айсувакова О.П., ОГПУ
. Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.Напишите уравнения описанных реакций. Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделилось простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций. Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганатом калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций.