Слайд 2: Рекомендуемая литература 1 семестр
1. Угай Я.А. Общая и неорганическая химия : учеб. для стедентов вузов / Я.А. Угай. - 5-е изд., стер. - М. : Высш. шк., 2007. 527 с. 2. Ахметов, Н.С. Общая и неорганическая химия : учеб. для студ. вузов / Н.С. Ахметов.— Изд. 7-е, стер. — М. : Высшая школа, 2008. 743 с. 3. Неорганическая химия: в 3 т.. / Под.ред. Ю.Д. Третьякова / М.: Из.центр «Академия», 2004 г. 4. Алехина, О.В. Неорганическая химия: вопросы и задания. Часть1. : учеб пособие : в 2 ч. / О.В. Алехина.— Тамбов : Издат. дом ТГУ им. Г.Р. Державина, 2013. 37 с. 5. Комплексные соединения: учебно-методическое пособие/ составители: О.В. Алехина, А.В. Малин. – Тамбов: Изд-во: Издательский дом ТГУ им. Г.Р. Державина, 2015. – 67 с.
Слайд 3: Интернет- ресурсы
http://www.xumuk.ru/encyklopedia/ - химическая энциклопедия на сайте «Химик.ру» http://www.xumuk.ru/nekrasov/ - электронная версия учебника «Некрасов Б.В. Основы общей химии» http://students.chemport.ru/ - Сайт студентов химического факультета МГУ http://nobelprize.org/nobel_prizes/chemistry/laureates/ – Нобелевские лауреаты, в том числе по химии. http://www.chem.msu.su/rus/history/element/welcome.html – материалы книги Н.А. Фигуровского «Открытие элементов и происхождение их названий». http://www.mendeleev.icape.ru/ – совместный проект Музея-архива Д.И. Менделеева и лаборатории информационных систем филологического факультета СПбГУ. http://www.hij.ru/ - Интернет-версия популярного журнала "Химия и жизнь".
Слайд 4: 1 с еместр
Основные химические понятия и стехиометрические законы Строение атома. Периодический закон. и периодическая система Д.И. Менделеева. Периодические функции. Химическая связь. Комплексные соединения. Энергетика химических реакций. Скорость реакций. Химическое равновесие. Растворы. Теория электролитической диссоциации. Окислительно-восстановительные процессы.
Слайд 6
Широко распростирает химия руки свои в дела человеческие. Куда ни посмотрим, куда не оглянемся, - всюду бросаются перед очами нашими успехи ее приложения. М.В. Ломоносов, 1749 г.
Слайд 7
Химия – наука о веществах, их составе и внутреннем строении, о превращениях одних веществ в другие (о химических реакциях ) и явлениях, сопровождающих эти превращения. В химии понятие вещества более узкое, а именно, вещество – это любая совокупность атомов и молекул.
Слайд 8: Атомно-молекулярное учение
Существуют вещества с молекулярным и немолекулярным строением. 2. Молекула - это самая маленькая частица вещества, которая сохраняет его химические свойства. 3. Между молекулами существуют промежутки, размеры которых зависят от агрегатного состояния и температуры.
Слайд 9: Атомно-молекулярное учение
4. Молекулы находятся в непрерывном движении. 5. Между молекулами существуют силы взаимного притяжения и отталкивания. 6. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении. Атомно-молекулярное учение
Слайд 10: Атомно-молекулярное учение
7. Атомы – это мельчайшие химически неделимые частицы. 8. Атомы одного вида отличаются от атомов другого вида массой и свойствами. Каждый отдельный вид атомов называется химическим элементом. 9. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомно-молекулярное учение
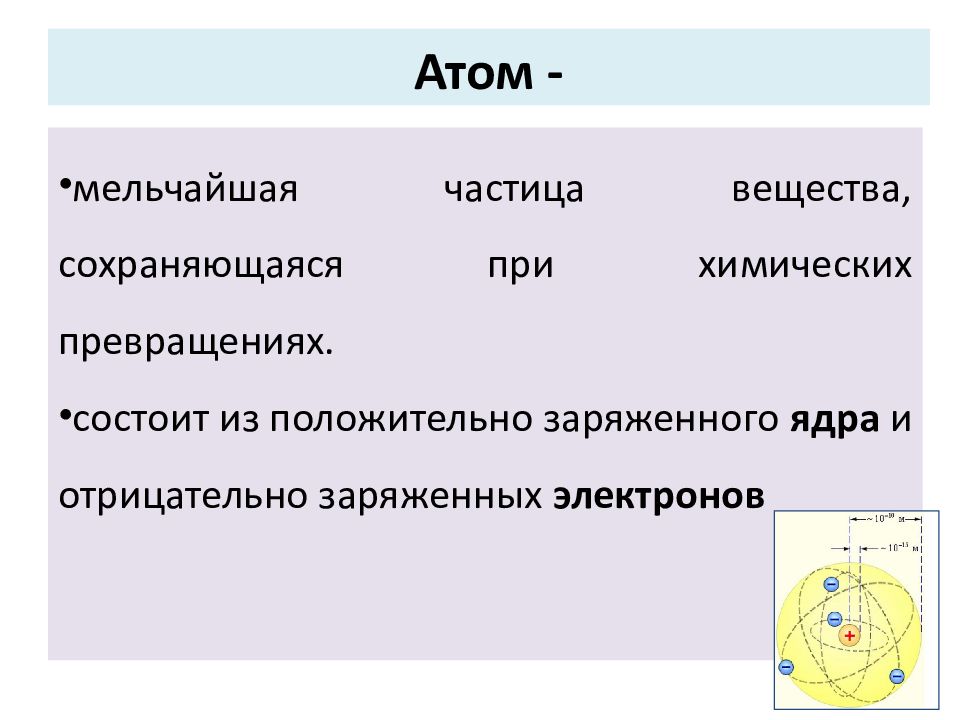
Слайд 11: Атом -
мельчайшая частица вещества, сохраняющаяся при химических превращениях. состоит из положительно заряженного ядра и отрицательно заряженных электронов
Слайд 13
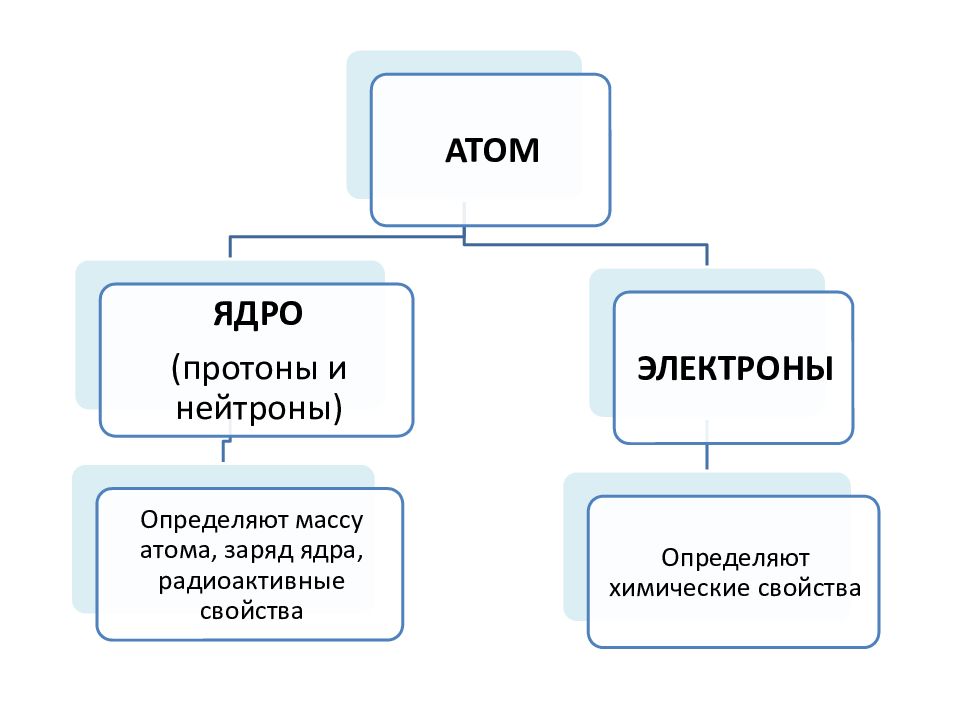
Неизменяющимся в химических реакциях является заряд ядра атома Z. Все атомы с одинаковым Z относятся к одному химическому элементу. химический элемент - это вид атомов с определенным зарядом ядра.
Слайд 15
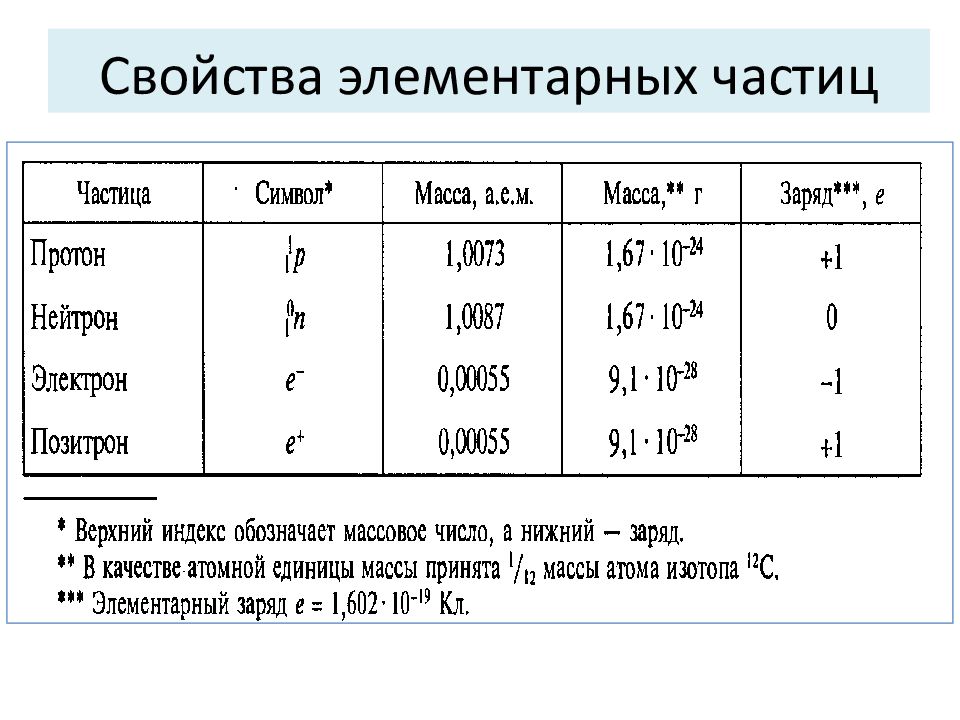
Суммарное число 1 р и 1 n не сильно отличается от массы всего атома (в а.е.м.) и называется массовым числом (А). НУКЛИД - вид атомов химического элемента с определенным значением массового числа. А= Z + N, где Z – число протонов (оно же – заряд ядра в единицах заряда электрона, оно же – порядковый номер химического элемента), N – число нейтронов в ядре. 12 С, 16 О, 18 О, 235 U
Слайд 16
Простые вещества - это вещества, образованные из атомов одного элемента Сложные вещества (или химические соединения) - это вещества, образованные атомами разных элементов. Они могут иметь как постоянный состав (стехиометрические соединения или дальтониды ), так и состав, меняющийся в некоторых пределах (нестехиометрические соединения или бертоллиды ).
Слайд 17: Аллотропия
Аллотропия - Это явление, когда многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. образовавшиеся вещества аллотропными видоизменениями или модификациями. Явление аллотропии вызывается двумя причинами: различным числом атомов в молекуле, например кислород О 2 и озон О 3 ; образованием различных кристаллических форм, например алмаз, графит и карбин.
Слайд 18: Единицы измерения атомных и молекулярных масс. Моль. Молярная масса
атомная единица массы ( а.е.м.) - 1/12 массы нуклида углерода 12 C а.е.м. составляет 1,66043 * 10 - 27 кг (1,66043 * 10 - 24 г) изотопы - разновидности атомов одного и того же химического элемента, отличающиеся друг от друга атомной массой. Природный кислород состоит из изотопов 16 О (99,76 %), 17 О (0,04 %) и 18 О (0,2 %)
Слайд 19
Безразмерное число, показывающее, во сколько раз масса данного атома, молекулы больше 1 а.е.м., называется относительной атомной ( A r ), относительной молекулярной ( M r ). Mr численно равна сумме Ar всех атомов, входящих в состав молекулы вещества: Mr (Н 2 О) = 2 · Ar (Н) + Ar (О) = 2 ·1 + 16 ≈ 18
Слайд 20: Единицы измерения атомных и молекулярных масс. Моль. Молярная масса
Моль — количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в 12 г углерода-12 ( 12 С). Масса одного моля вещества, выраженная в граммах, называется его молярной массой (М, г/моль). М (Н 2 О) = m (1 молекулы Н 2 О)· N A = 2,99 10 -26 кг · 6,02· 10 23 1 / моль = 0,018 кг/моль = 18 г/моль. M численно равна М r или М = m / n, где m - масса вещества, n - число моль вещества (количество вещества). Единицы измерения атомных и молекулярных масс. Моль. Молярная масса.
Слайд 21: Стехиометрические законы
Стехиометрия – раздел химии, изучающий количественные (массовые, объемные, по числу частиц) соотношения между реагирующими веществами, а также между химическими элементами в составе веществ. Основными стехиометрическими законами являются Закон сохранения массы (М. В. Ломоносов, 1748 г.) Закон постоянства состава (Л. Пруст, 1799 г.) Закон эквивалентов (И. Рихтер, 1792 г.) Закон кратных отношений (Дж.Дальтон, 1802 г.). Закон простых объемных отношений (второй закон Гей-Люссака, 1808 г.) Закон Авогадро ( 1811 г. )
Слайд 22: Закон сохранения массы веществ
масса веществ, которые вступают в химическую реакцию, равна массе веществ, которые образуются и результате реакции 1787 г. 1748 г.
Слайд 24: Закон постоянства состава
1799 г. Жозеф Луи Пруст Всякое чистое вещество имеет постоянный состав, который не зависит от способа получения этого вещества.
Слайд 26: Закон постоянства состава
Дальтониды – соединения постоянного состава (в честь англ. физика и химика Дж. Дальтона) Бертоллиды – соединения переменного состава, зависящие от способа и условий получения (в честь франц. химика Бертолле) Закон постоянства состава
Слайд 27: Закон постоянства состава
Состав дальтонидов выражается простыми формулами с целочисленными индексами, например Н 2 О, HCl, СН 4, С 6 Н 6. Состав бертоллидо в изменяется, они имеют дробные индексы. Так, оксид титана ( II ) в действительности имеет состав от Ti О 0,7 до Ti О 1,3, а состав оксида титана ( IV ) изменяется от Ti О 1,9 до Ti О 2,0 (в зависимости от условий синтеза). Бертоллиды распространены среди оксидов, гидридов, сульфидов, силицидов, нитридов, карбидов и других неорганических соединений, имеющих кристаллическую структуру. Закон постоянства состава
Слайд 28: Современная формулировка закона постоянства состава :
Состав соединений молекулярной структуры, т.е. состоящих из молекул, является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной, и металлической решеткой) не является постоянным и зависит от условий получения.
Слайд 29
Если два элемента образуют друг с другом несколько молекулярных соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Слайд 31: Закон Авогадро
В равных объемах любых газов при одинаковых условиях (Р, Т) содержится равное число молекул
Слайд 33: Объединенный газовый закон
p 0, V 0, T 0 – давление, объем и температура при н.у. ( T 0 = 273К, p 0 = 101,325 кПа или 760 мм.рт.ст.). Объединенный газовый закон
Слайд 34: Уравнение состояния идеального газа Уравнение Менделеева- Клапейрона
В Международной системе измерений (СИ) R = 8,314 Па ⋅ м 3 / моль ⋅ К (Дж/моль · К). Для внесистемных единиц измерения давления и объема величина R имеет значения R = 62400 мм рт. ст. ⋅ мл / моль ⋅ К ; R = 1,99 кал / моль·К. R = 0,082 атм ⋅ л / моль ⋅ К ;
Слайд 37: Расчет относительной плотности газов по водороду (1856 году Д. И. Менделеев)
Относительная молекулярная масса водорода, поэтому относительную плотность газа по водороду рассчитывают по формуле D H2 = Mr ( газа ) / 2
Слайд 38: Закон эквивалентов (Рихтер, 1792 г.)
Вещества взаимодействуют между собой в количествах, соответствующих их эквивалентам. или Массы веществ, вступающих в реакцию и образующихся в результате реакции пропорциональны молярным массам их химических эквивалентов. m 1 / m 2 = M э1 / M э2
Слайд 39: Закон эквивалентов
Эквивалент - реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях
Слайд 40
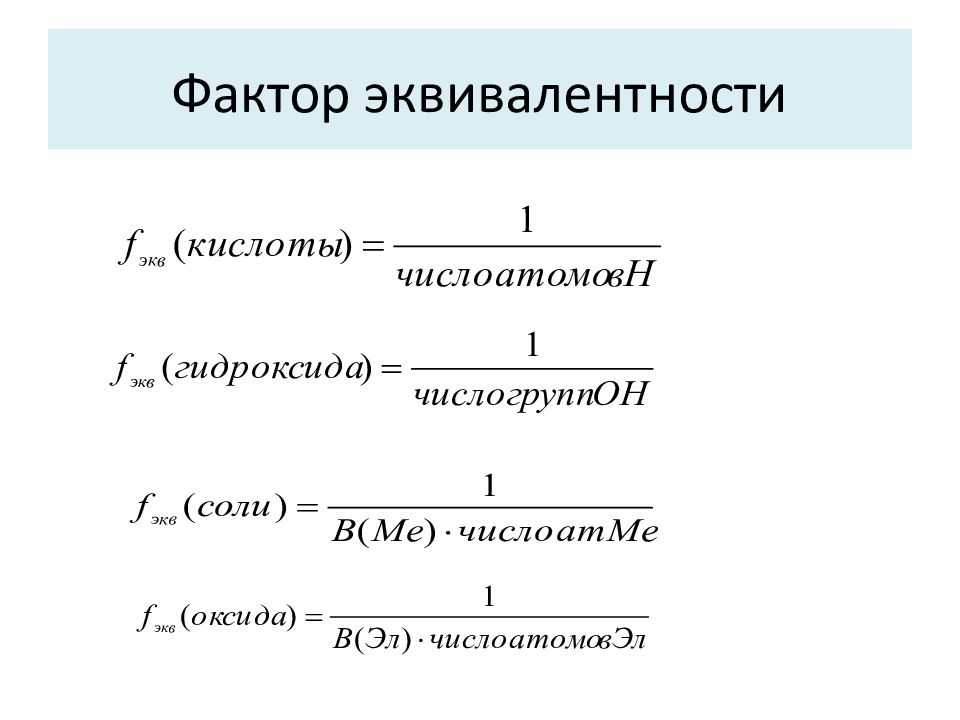
Фактор эквивалентности ( f экв ) – число, указывающее, какая доля реальной или условной частицы, эквивалента одному иону Н + в кислотно-основных взаимодействиях или одному электрону в окислительно-восстановительных реакциях. f экв величина безразмерная, равен или меньше единицы. Масса одного эквивалента вещества – эквивалентная масса (М Э ). Как и молярная масса, эквивалентная масса выражается в г/моль. М Э = f экв ·М
Слайд 41
При протекании реакции обмена, например: 3 NaOH + H 3 PO 4 = Na 3 PO 4 + 3 H 2 O Каждая реагирующая частица H 3 PO 4 эквивалентна трем условным частицам NaOH. Можно записать иначе: NaOH + 1/3 H 3 PO 4 = 1/3 Na 3 PO 4 + H 2 O т.е. количества реагирующих веществ будут эквивалентны, когда n ( NaOH ) = n (1/3 H 3 PO 4 ), где 1/3 H 3 PO 4 – новая условная частица. f э( H 3 PO 4 ) = 1/3
Слайд 43
Окислительно-восстановительный эквивалент используется при окислительно-восстановительных реакциях, где обязательно присутствует окислитель и восстановитель. f экв (окислителя) = 1/ число принятых электронов f экв (восстановителя) = 1/ число отданных электронов
Слайд 44
Понятие объемный эквивалент используется в случае газовых систем. Эквивалент определяется по кислороду, водороду или любому другому участнику реакции, эквивалент которого известен. Эквивалентный объем – объем, который занимает при данных условиях 1 моль эквивалент рассматриваемого вещества. Так, при н.у: V э (Н 2 ) = 11,2 л, V э (О 2 ) = 5,6 л.