Слайд 2: Вопросы
1.Барьерфиксирующая функция кожи и слизистых оболочек (бактерицидные свойства: слизь мерцательного эпителия, лизоцим, желудочный сок) 2.Нормальная микрофлора организма (антагонист патогенной микрофлоры); 3. Гуморальные факторы Система комплемента Растворимые рецепторы для патогенов Белки сыворотки крови Антимикробные пептиды Интерфероны 4. Клеточные факторы: Система мононуклеарных фагоцитов Фагоцитоз (виды, этапы) Характеристика естественных (натуральных) киллеров
Слайд 3: Иммунитет
Иммунитет – это способ защиты организма от генетически чужеродных веществ – антигенов экзогенного и эндогенного происхождения, направленный на поддержание и сохранение гомеостаза, структурной и функциональной целостности организма, биологической (антигенной) индивидуальности каждого организма и вида в целом.
Слайд 4: Врожденный иммунитет
Врожденный (видовой, генетический, конституциональный, естественный, неспецифический) иммунитет – это выработанная в процессе филогенеза, передающаяся по наследству, присущая всем особям данного вида устойчивость к инфекционным агентам (или антигенам).
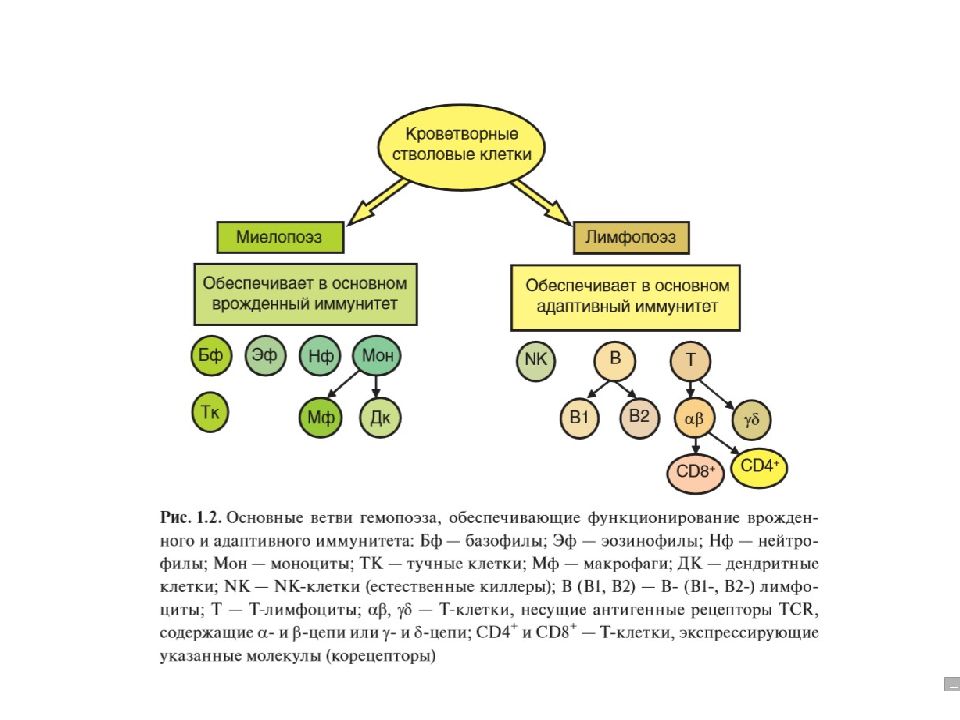
Слайд 5: Врожденный иммунитет
Иммунные процессы осуществляются клетками костномозгового происхождения, относящимися к двум кроветворным линиям — миелоидной и лимфоидной. Миелоидные клетки «отвечают» за реакции врожденного, лимфоидные — преимущественно за реакции адаптивного и только частично — врожденного иммунитета. Врожденный иммунитет реализуется клетками (преимущественно фагоцитами), практически не нуждающимися в межклеточных контактах и коммуникациях. Они широко распределены по организму; особенно богаты ими барьерные ткани.
Слайд 7: Врожденный иммунитет
Распознав патоген, макрофаги активируются и начинают выделять активные белковые вещества — провоспалительные цитокины, способствующие дальнейшей активации клеток врожденного иммунитета. При этом цитокины выполняют 2 основные функции: 1) вовлечение в защитную реакцию других клеток (эпителиальных, эндотелиальных, дендритных) без обязательного их контакта с патогеном (хотя эти клетки также могут распознавать патоген и реагировать на него непосредственно); 2) « организация» эмиграции лейкоцитов из кровотока в очаг воспаления. Это важно, т.к., содержание макрофагов и других эффекторных клеток в месте проникновения патогена невелико и достаточно только для запуска реакции. Приток лейкоцитов из крови способствует реализации полноценной местной защитной реакции с участием факторов врожденного иммунитета.
Слайд 8: Врожденный иммунитет
Сначала в очаг воспаления поступают наиболее мобильные лейкоциты — нейтрофилы, обладающие высоким защитным потенциалом, реализуемым главным образом в виде фагоцитоза. Затем мигрируют моноциты, дифференцирующиеся в макрофаги, которые, помимо фагоцитоза, выполняют регуляторные функции, стимулируют пролиферацию клеток. Одновременно вовлекаются вспомогательные гуморальные факторы: происходит активация системы комплемента, синтезируются белки острой фазы, выделяются бактерицид- ные вещества. При вирусной инфекции патоген распознают в основном плазмоцитоидные дендритные клетки и естественные киллеры (при этом происходит их активация).
Слайд 9: Врожденный иммунитет
Помимо классических факторов врожденного иммунитета, в ответ на проникновение патогена активируются другие факторы первой линии защиты. К ним относят лимфоидные клетки — NK, γδТ-клетки, В1-л, последние продуцируют полиспецифические антитела с низким сродством к антигену. Однако, взаимодействуя с патогеном, эти антитела активируют каскад комплемента. Посредством комплемента антитела могут вовлекать в иммунные реакции фагоциты. NK — ранний источник интерферона γ, усиливающего активацию макрофагов.
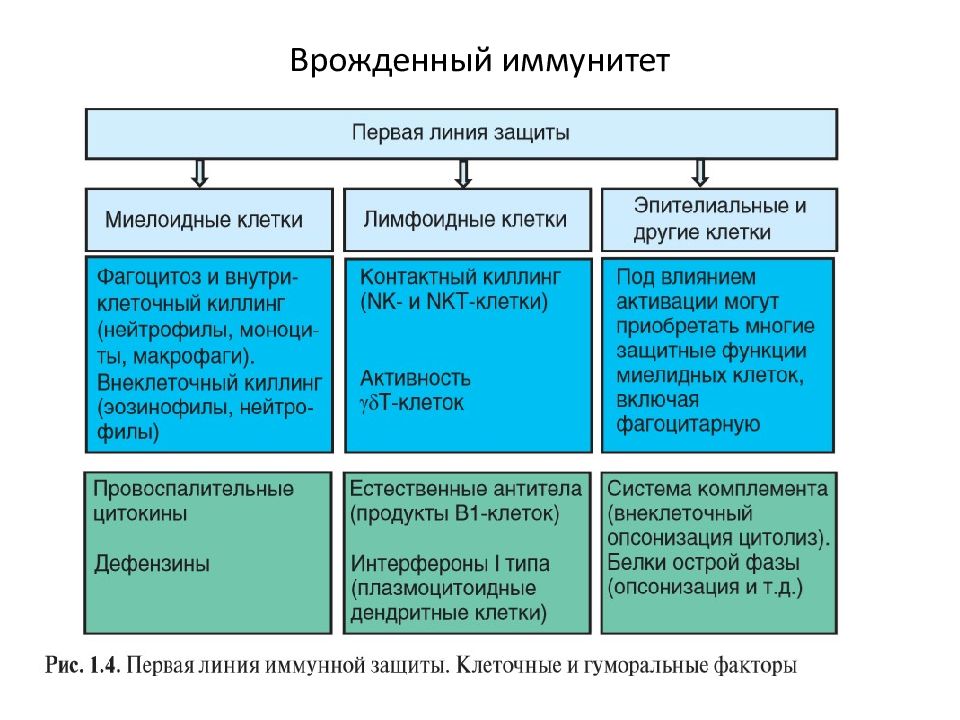
Слайд 12: Факторы врожденного иммунитета
Барьерфиксирующая функция кожи и слизистых (нормальная микрофлора, лизоцим, колонизационная резистентность) Гуморальные факторы защиты ( система комплемента, растворимые рецепторы к поверхностным структурам микроорганизмов ( pattern- структуры), антимикробные пептиды, интерфероны) Клеточные факторы защиты (нейтрофилы, макрофаги, дендритные клетки, эозинофилы, базофилы, естественные киллеры-ЕК)
Слайд 13: Барьеры кожи и слизистых
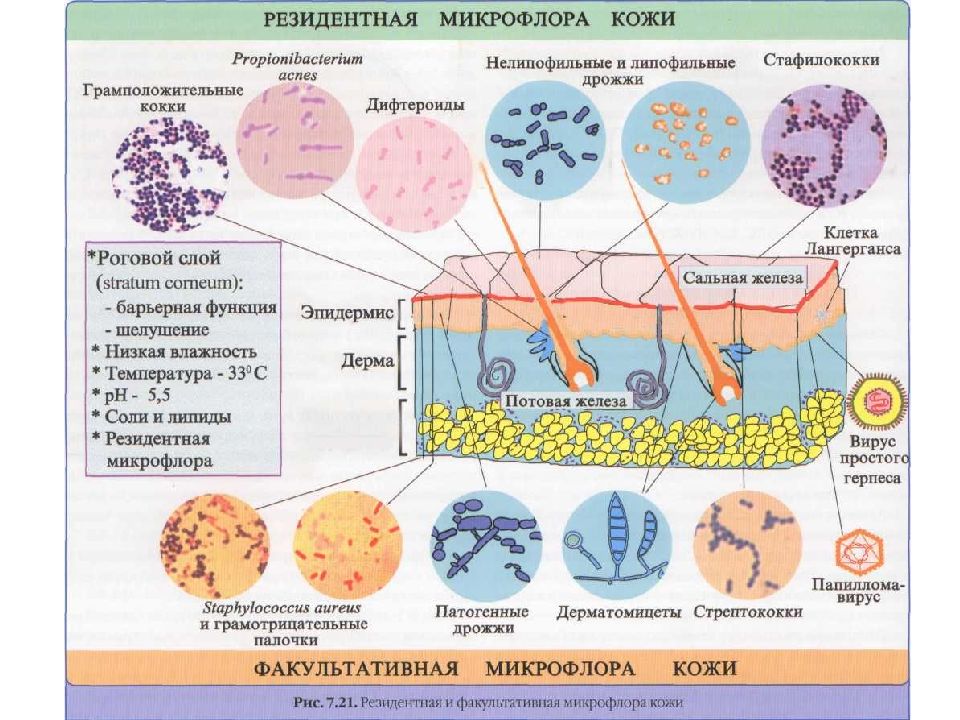
Кожа. Кератиноциты рогового слоя – это погибшие клетки, устойчивые к агрессивным химическим соединениям. На их поверхности отсутствуют рецепторы для адгезивных молекул микроорганизмов (исключение S.aureus, Pr.acnae, I.pestis) Продукты потовых и сальных желез : молочная кислота, ферменты, жирные кислоты, антибактериальные пептиды. Клетки Лангерганса и клетки Гринстейна (отросчатые эпидермоциты). Имеют миелоидное происхождение и относятся к дендритным клеткам. По функции эти клетки являются оппозитными (тормозит один клон клеток другой). Клетки Лангерганса – АПК (индуцируют иммунный ответ). Клетки Гринстейна продуцируют цитокины, подавляющие иммунные реакции в коже. Резидентная микрофлора кожи
Слайд 15: Барьеры кожи и слизистых
Слизистые М-клетки – система облегченного транспорта Аг к ИКК, транслокация бактерий и вирусов через эпителиальный барьер. Ассоциация эпителиоцитов с лимфоидной тканью (слизистая респираторного тракта, ЖКТ и моче-половой системы). Резидентная микрофлора – колонизационная резистентность.
Слайд 16: Колонизационная резистентность покровного эпителия
Нормальная микрофлора Муцин – экранирует сайты адгезии и делает недоступными для бактерий. Фагоцитирующие клетки и продукты их дегрануляции – продукты лизосом (лизоцим, пероксидаза, лактоферрин, дефензины, токсичные метаболиты кислорода, азота) Химические и механические факторы –секреты слизистых. Целенаправленные движения – перистальтика кишечника,реснички мерцательного эпителия. Секреторные IgA
Слайд 17: Гуморальные факторы
Система комплемента Растворимые рецепторы для патогенов Антимикробные пептиды Семейство интерферонов
Слайд 18: Система комплемента
Система комплемента - многокомпонентная полиферментная самосорбирующаяся система сывороточных белков, которые в норме находятся в неактивном состоянии. Комплемент является компонентом многих иммунологических реакций, направленных на освобождение организма от микробов и других чужеродных клеток и антигенов.
Слайд 19
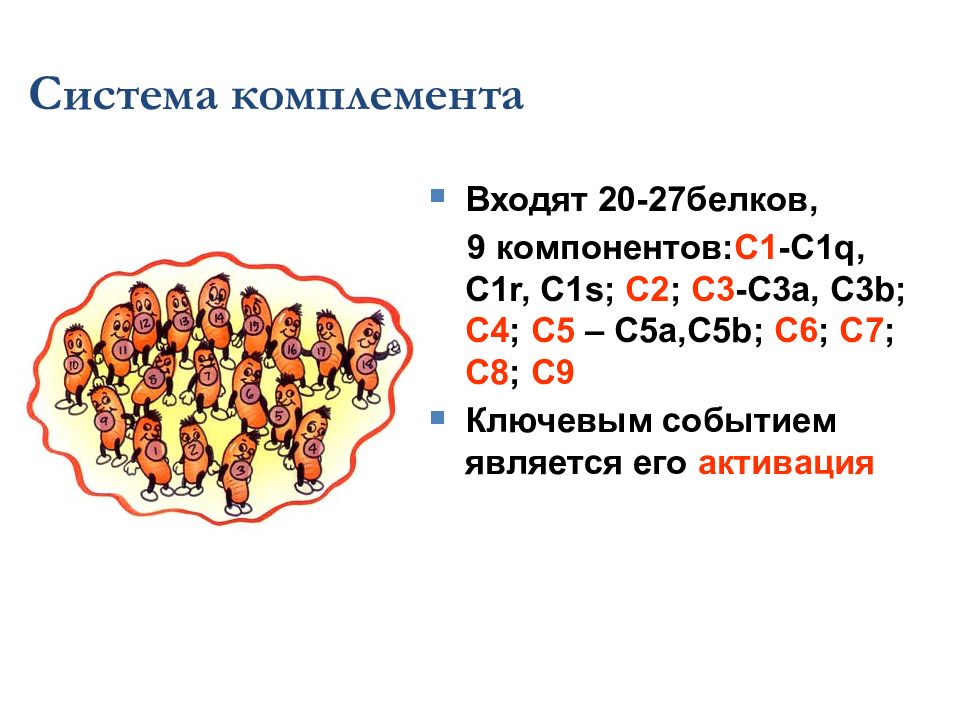
Система комплемента Входят 20 -27 белков, 9 компонентов: C1 -C1q, C1r, C1s; C2 ; C3 -C3a, C3b; C4 ; C5 – C5a,C5b; C6 ; C7 ; C8 ; C9 Ключевым событием является его активация
Слайд 20: Биологические эффекты активации комплемента
Образование мембрано-атакующего комплекса (С5,6,7,8,9) и лизис клеток. С3а-, С4а-и С5а – компоненты являются анафилотоксинами, индуцируют дегрануляцию тучных клеток и базофилов (медиторы воспаления). С5а- хемоаттрактант для фагоцитов. С3в- и С4в – опсонины, повышают адгезию иммунных комплексов с мембранами макрофагов, нейтрофилов и эритроцитов, усиливают фагоцитоз.
Слайд 21: Пути активации системы комплемента
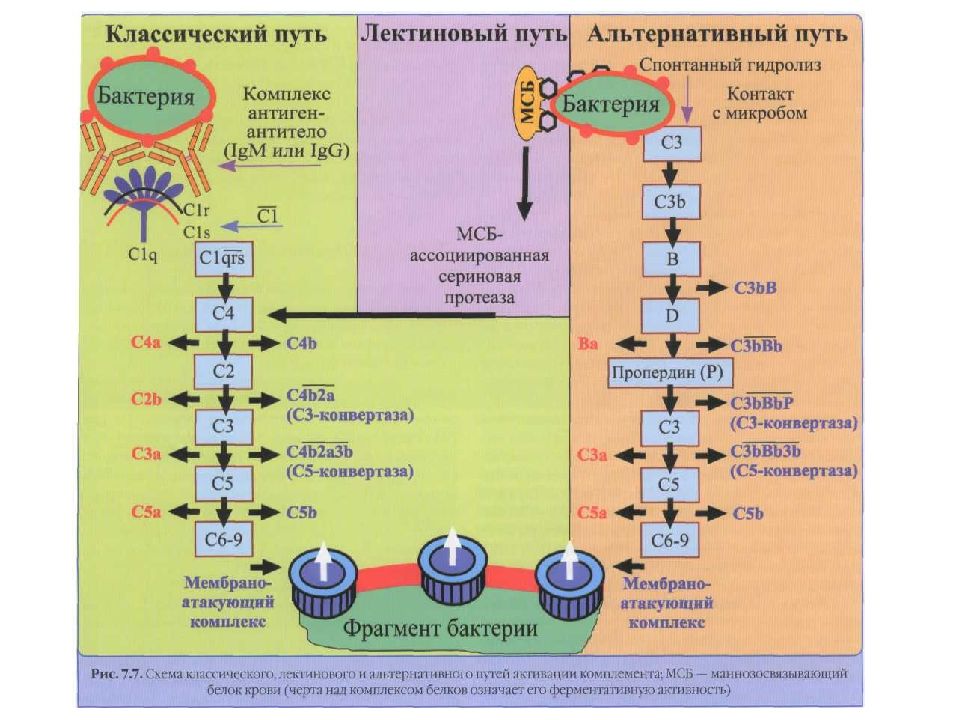
Классический – активатор комплекс Аг+Ат Лектиновый – маннан связывающий протеин (лектин) Альтернативный – активатор ЛПС и пептидогликан клеточной стенки ГОБ, вирусы связываются с белками B,D – протеины, Р – пропердин. Активация комплемента протекает в присутствии ионов Са и Mg.
Слайд 24
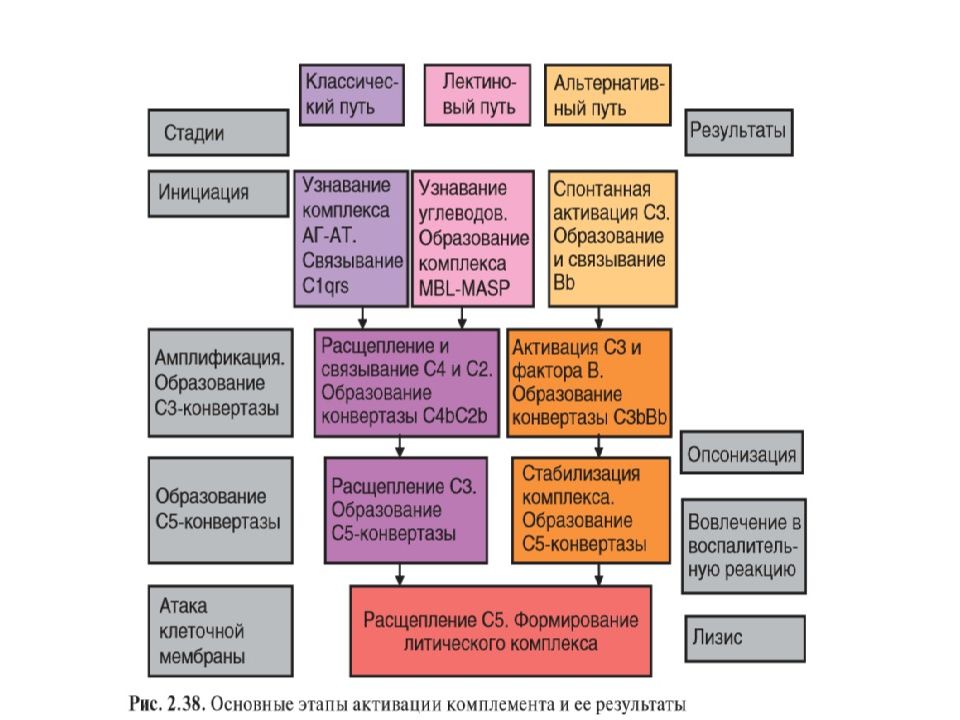
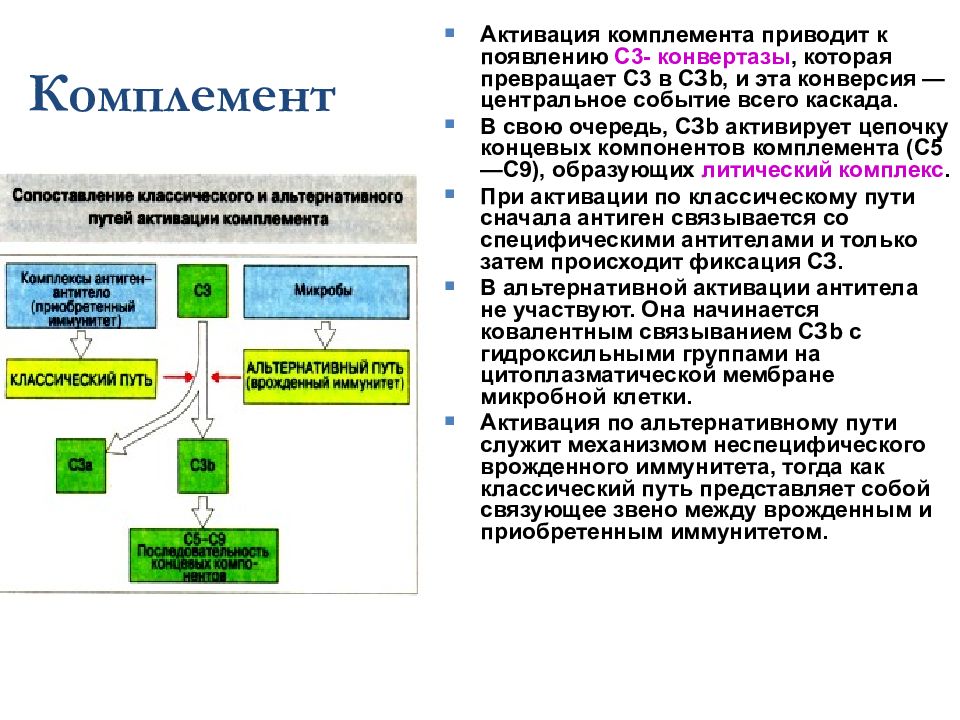
Комплемент Активация комплемента приводит к появлению С3- конвертазы, которая превращает С3 в СЗ b, и эта конверсия — центральное событие всего каскада. В свою очередь, СЗ b активирует цепочку концевых компонентов комплемента (С5—С9), образующих литический комплекс. При активации по классическому пути сначала антиген связывается со специфическими антителами и только затем происходит фиксация СЗ. В альтернативной активации антитела не участвуют. Она начинается ковалентным связыванием СЗ b с гидроксильными группами на цитоплазматической мембране микробной клетки. Активация по альтернативному пути служит механизмом неспецифического врожденного иммунитета, тогда как классический путь представляет собой связующее звено между врожденным и приобретенным иммунитетом.
Слайд 25
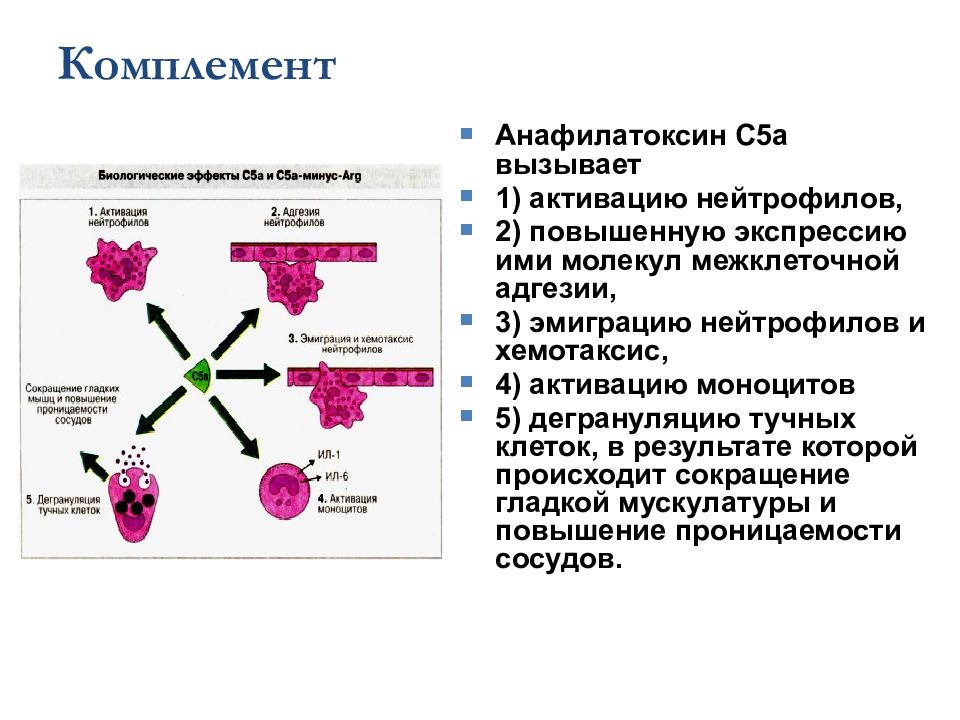
Комплемент Анафилатоксин С5а вызывает 1) активацию нейтрофилов, 2) повышенную экспрессию ими молекул межклеточной адгезии, 3) эмиграцию нейтрофилов и хемотаксис, 4) активацию моноцитов 5) дегрануляцию тучных клеток, в результате которой происходит сокращение гладкой мускулатуры и повышение проницаемости сосудов.
Слайд 26
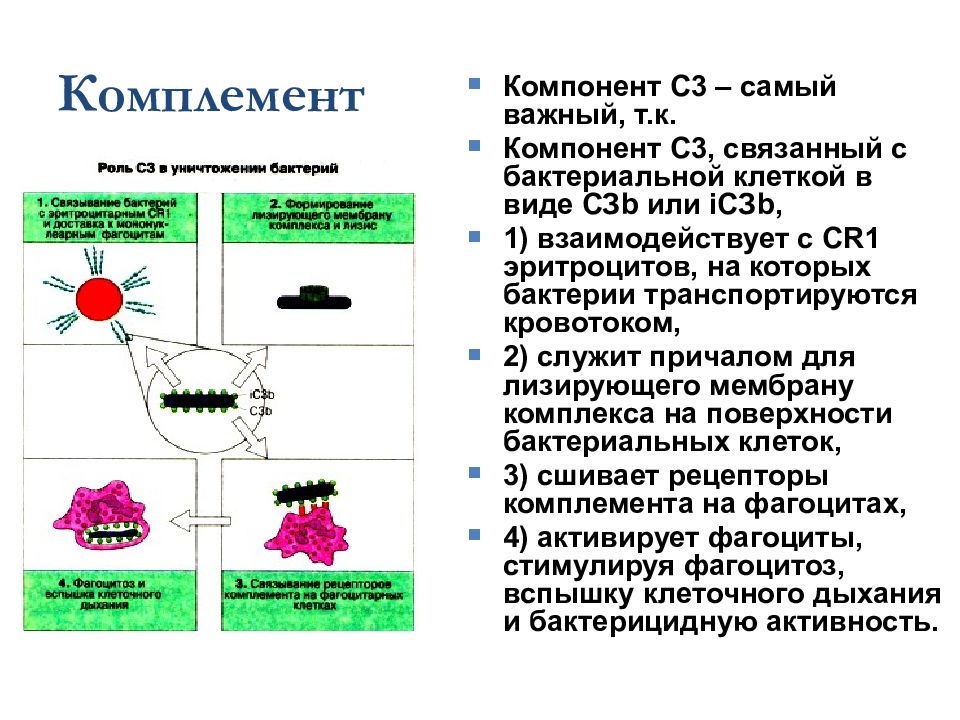
Комплемент Компонент С3 – самый важный, т.к. Компонент С3, связанный с бактериальной клеткой в виде СЗ b или i СЗ b, 1) взаимодействует с С R1 эритроцитов, на которых бактерии транспортируются кровотоком, 2) служит причалом для лизирующего мембрану комплекса на поверхности бактериальных клеток, 3) сшивает рецепторы комплемента на фагоцитах, 4) активирует фагоциты, стимулируя фагоцитоз, вспышку клеточного дыхания и бактерицидную активность.
Слайд 27
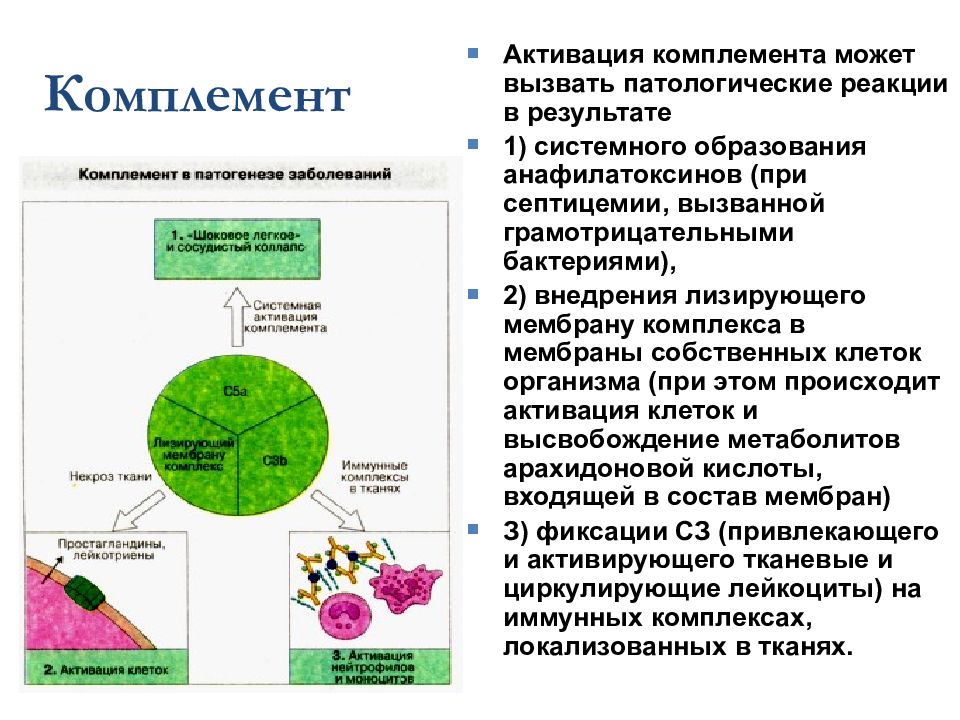
Комплемент Активация комплемента может вызвать патологические реакции в результате 1) системного образования анафилатоксинов (при септицемии, вызванной грамотрицательными бактериями), 2) внедрения лизирующего мембрану комплекса в мембраны собственных клеток организма (при этом происходит активация клеток и высвобождение метаболитов арахидоновой кислоты, входящей в состав мембран) З) фиксации СЗ (привлекающего и активирующего тканевые и циркулирующие лейкоциты) на иммунных комплексах, локализованных в тканях.
Слайд 28: Растворимые рецепторы для патогенов
Белки крови связывающиеся с различными липидными и углеводными структурами микробной клетки (р attern -структурами). Обладают свойствами опсонинов и активируют комплемент. Белки острой фазы : С-реактивный белок – связывается с С-полисахаридом бактерий и усиливает фагоцитоз и активацию С1 g фракции комплемента (классический путь).синтез в печени и нарастает в ответ на ИЛ-6. Сывороточный амилоид Р близок к действию СРБ. Маннозосвязывающий лектин активирует С по лектиновому пути, опсонин, синтезируется в печени. Белки сурфактанта легких – коллектин. Обладает опсонином в отношении гриба Pneumocystis carinii Белки острой фазы, связывающие железо – трансферрин, гаптоглобин, гемопексин. Препятствуют размножению бактерий, нуждающихся в этих элементах.
Слайд 29: Белки сыворотки крови
Пропердин – гамма-глобулин нормальной сыворотки. Активация комплемента по альтернативному пути Фибронектин – белок плазмы и тканевых жидкостей, синтезируется макрофагами. Обеспечивает опсонизацию, экранирует дефекты эндотелия, препятствует тромбообразованию. Бета- лизины – белки сыворотки крови, синтезируются тромбоцитами. Повреждение ЦПМ бактериальной клетки
Слайд 30: Антимикробные пептиды
Дефензины и кателицидины –пептиды, обладающие антимикробной активностью. Образуются эукариотическими клетками,содержат 13-18 аминокислот. Известно около 500 разновидностей. синтезируются макрофагами и нейтрофилами( α -дефензины) а также эпителиальными клетками кишечника, легких, мочевого пузыря.
Слайд 31: Антимикробные пептиды
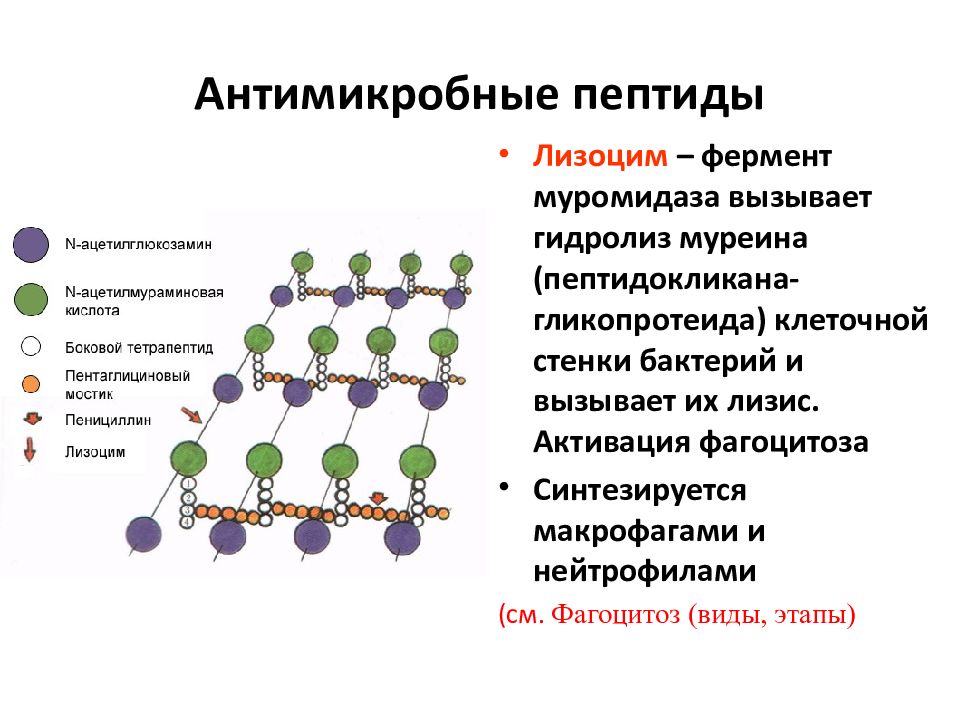
Лизоцим – фермент муромидаза вызывает гидролиз муреина ( пептидокликана - гликопротеида) клеточной стенки бактерий и вызывает их лизис. Активация фагоцитоза Синтезируется макрофагами и нейтрофилами (см. Фагоцитоз (виды, этапы)
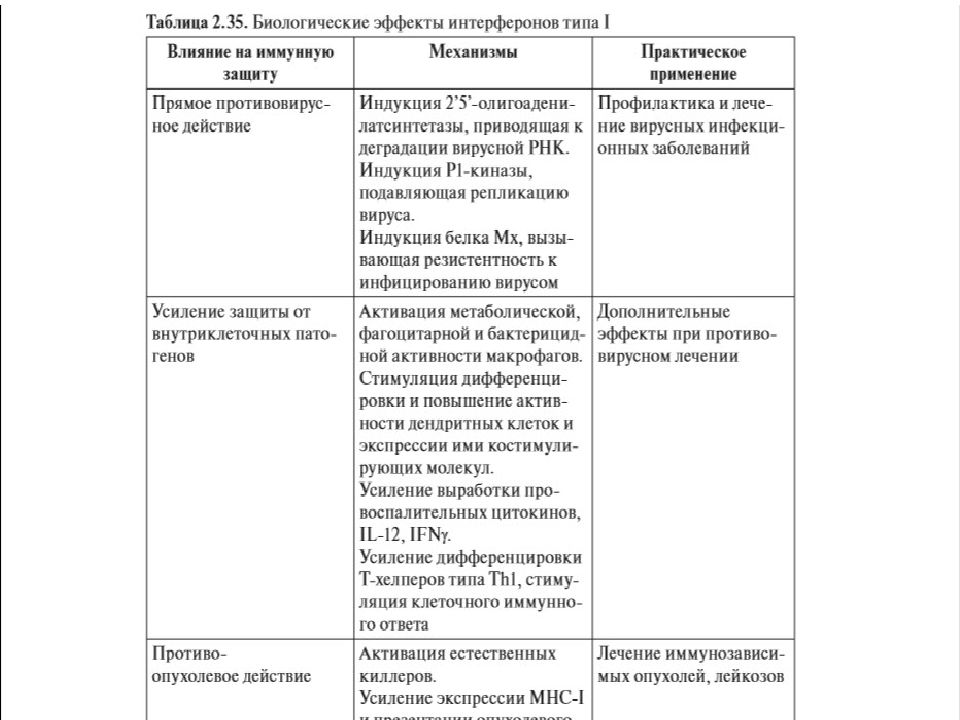
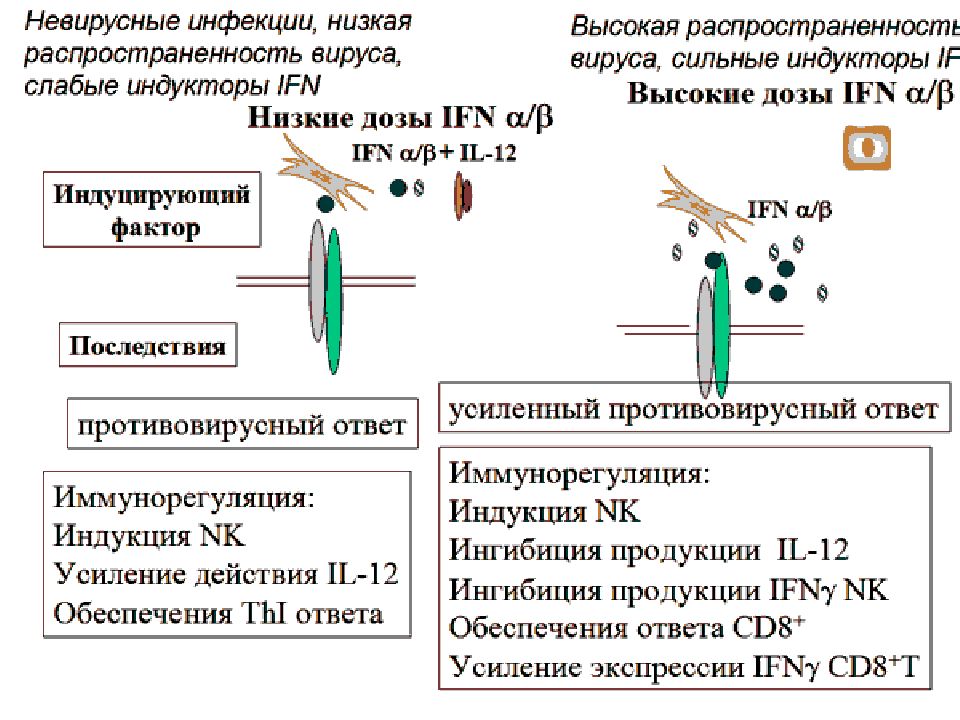
Слайд 32: Семейство интерферонов
Интерферон –открыт в 1957 г Айзексом и Линдеманом при изучении интерференции вирусов (лат. i nter - между, ferens - несущий). Интерференция – явление когда ткань инфицированная одним вирусом становится устойчивой к заражению другим вирусом, устойчивость вызывается белком продуцируемым этими клетками. Интерферон –гликопротеид.
Слайд 33: Интерфероны
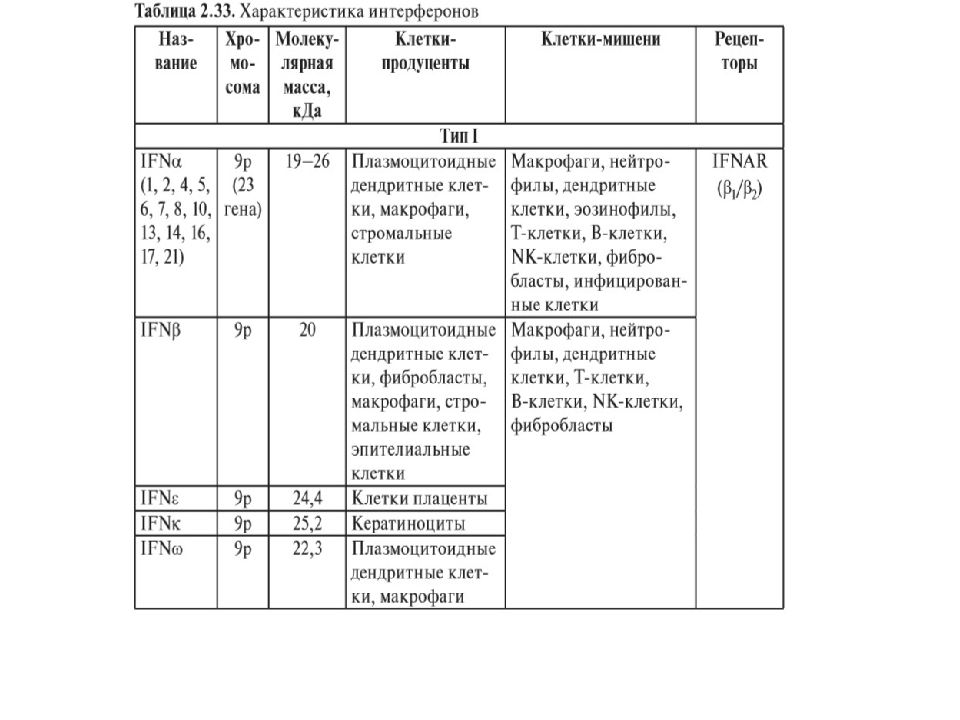
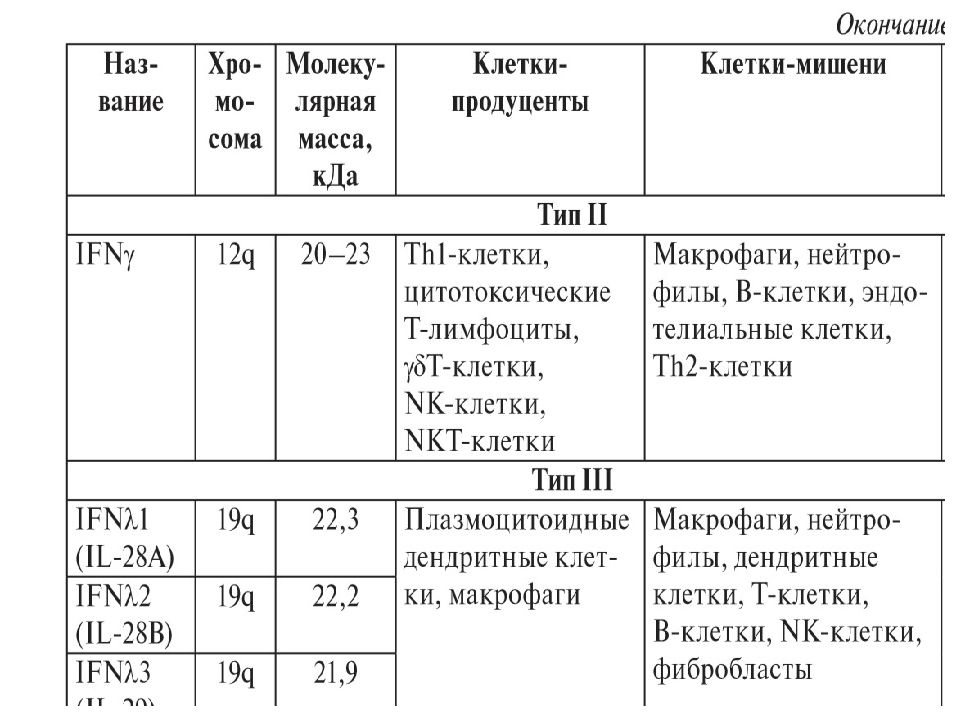
В настоящее время выделяют у человека — 9 видов интерферонов, обозначаемых греческими буквами. По способности взаимодействовать с 3 типами рецепторов их объединяют в 3 семейства. Больше всего видов принадлежит к интерферонам I типа: IFNα, IFNβ, IFNδ, IFNε, IFNκ, IFNτ, IFNω. Тип II, ранее обозначавшийся как иммунный интерферон, включает единственный член — IFNγ. Описанный недавно тип III содержит 3 представителя — λ1, λ2 и λ3, называемые также IL-29, IL-28А и IL-28В соответственно. IFNα имеет 13 разновидностей, обозначаемых цифрами (1, 2, 4–8, 10, 13, 14, 16, 17, 21) или латинскими буквами.
Слайд 36
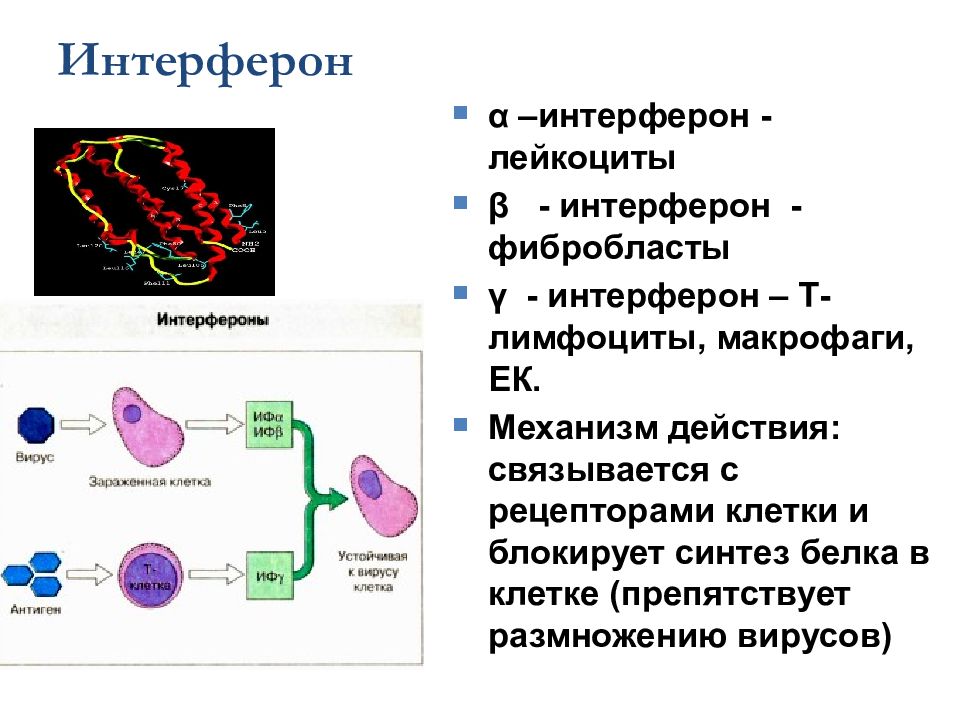
Интерферон α –интерферон - лейкоциты β - интерферон - фибробласты γ - интерферон – Т-лимфоциты, макрофаги, ЕК. Механизм действия: связывается с рецепторами клетки и блокирует синтез белка в клетке (препятствует размножению вирусов)
Слайд 39: Интерфероны
II тип включает γ -интерферон – продуцируется Т-лимфоциты и ЕК после Аг стимуляции.
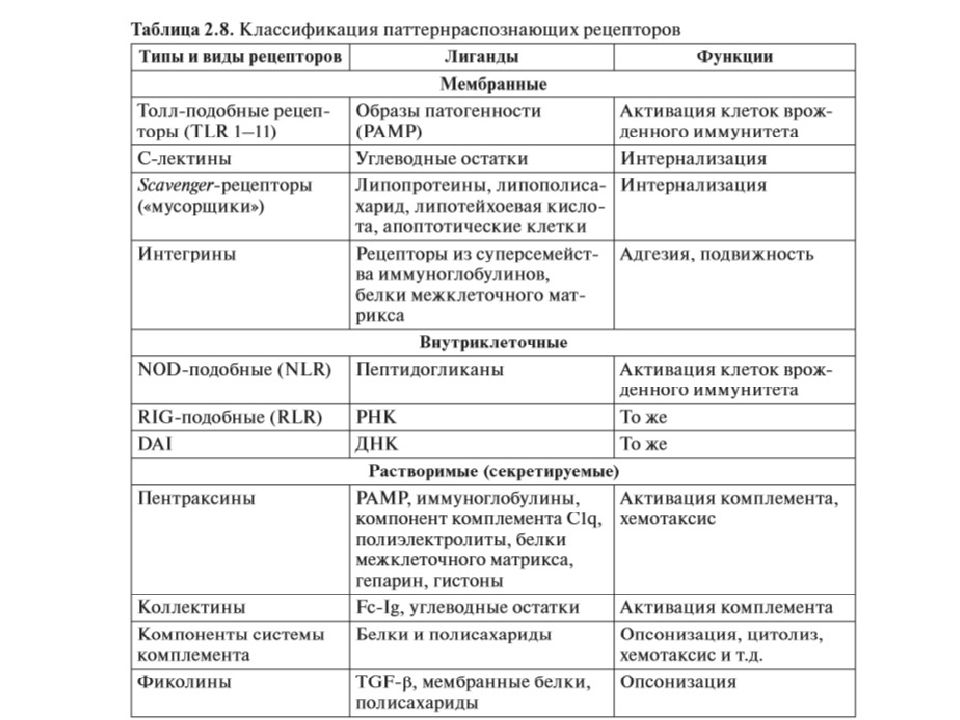
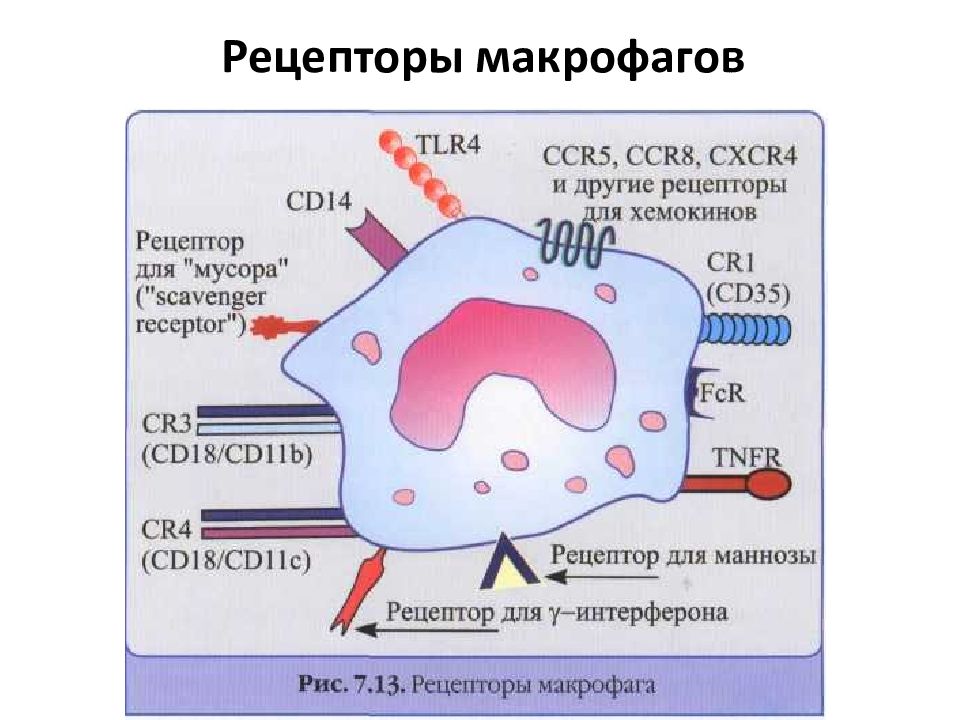
Слайд 42: Рецепторы макрофагов
TLR (Tool-like receptor) – Tool -подобные рецепторы семейство мембранных гликопротеидов (11 типов). Взаимодействие данных рецепторов с лигандами запускает транскрипцию генов провоспалительных цитокинов и ко-стимулирующих молекул, обеспечивающих миграцию, адгезию, фагоцитов и представление Аг лимфоцитам. Маннозо-фукозные рецепторы распознают углеводные компоненты бактерий Рецепторы для мусора – связывание фосфолипидных мембран и компонентов собственного разрушения клеток. Фагоцитоз поврежденных и умирающих клеток. Рецепторы для С3в- и С4в- комплемента Рецепторы для Fc -фрагментов IgG эффект опсонизации Рецепторы для цитокинов, хемокинов, гормонов, лейкотриенов, простагландинов и т.п. взаимодействие с лимфоцитами и реагирование на любые изменения внутренней среды организма
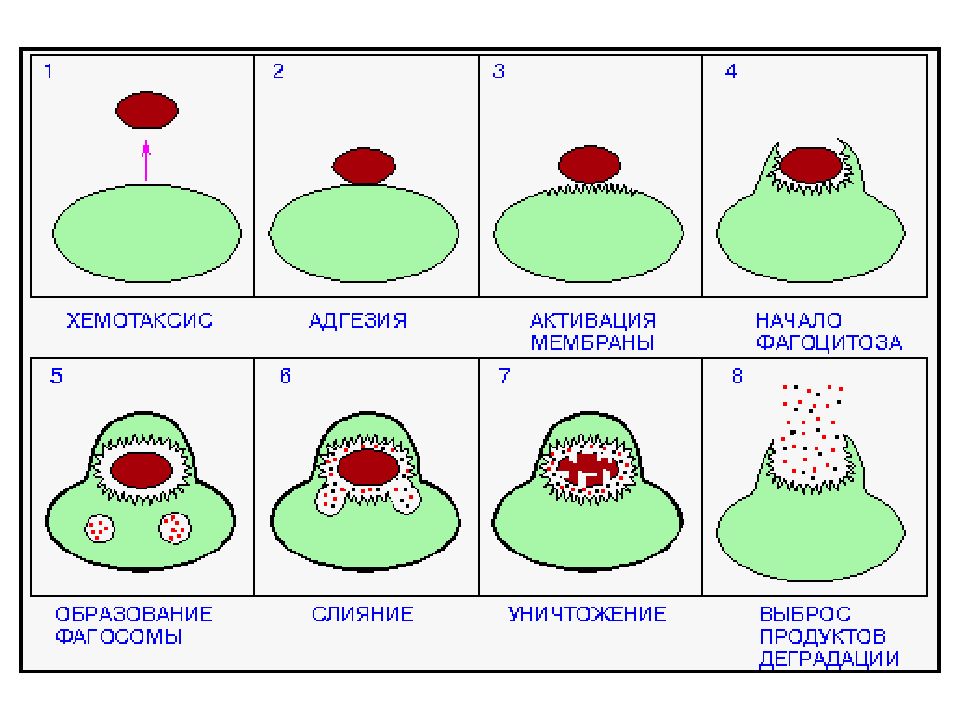
Слайд 44: Этапы фагоцитоза
Активация и хемотаксис Адгезия (прикрепление) частиц к поверхности фагоцита Активация мембраны и поглощение частиц, их погружение в цитоплазму и формирование фагосомы Образование фаголизосомы Внутриклеточный киллинг и переваривание, выброс продуктов деградации: активация лизосомальных гранул (кислороднезависимая бактерицидность); усиление потребления кислорода и глюкозы – окислительный взрыв с образованием токсических метаболитов кислорода и азота (перекись водорода, супероксиданион кислорода, гипохлорная кислота, пироксинитрит) – кислородзависимая система бактерицидности.
Слайд 46: Хемотаксис - направленное движение фц к объекту. Клетка становится поляризованной: нити цитоскелета и органеллы ориентированы в направлении источника хемотаксических сигналов, а мембранные молекулы, необходимые для осуществления фагоцитоза, локализованы на полюсе клетки, обращенном к мишени
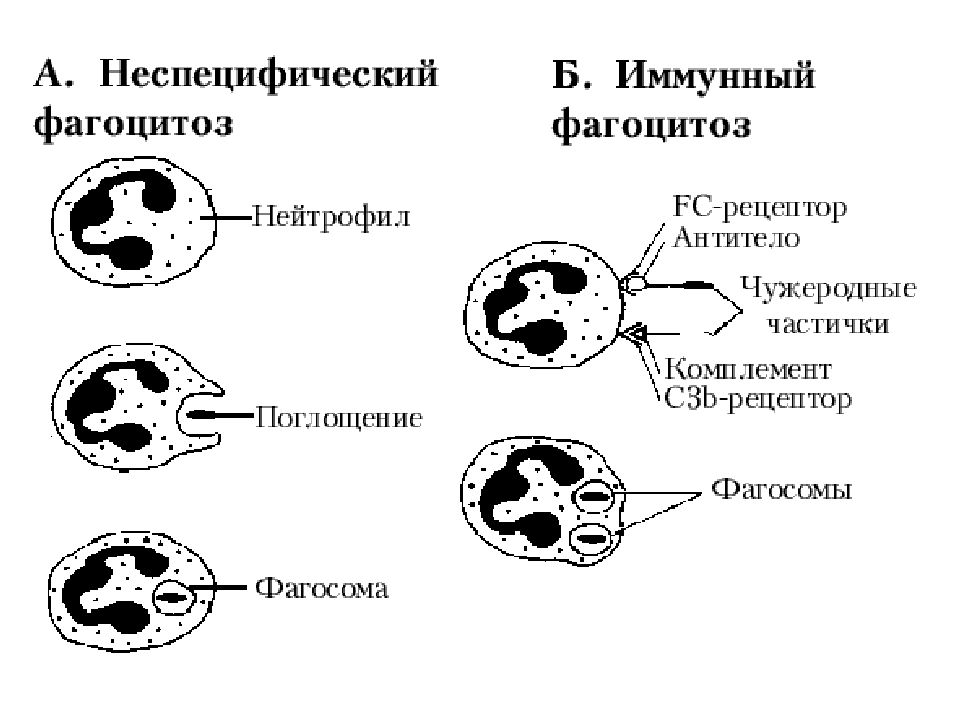
Адгезия - обязательным условием адгезии фц служит распознавание объекта фагоцитоза. Механизмы распознавания разнообразны и принципиально различаются в случаях фагоцитоза опсонизированного и неопсонизированного объектов. Рецепторы, вовлекаемые в процесс фагоцитоза: маннозный, для апоптических клеток, мусорщик ( без опсонизации), Fc γ R, CR (с опсонизацией).
Слайд 47: В отсутствие опсонизации молекулярное распознавание
необходимое для прилипания фагоцитов к клеткам-мишеням, осуществляется рецепторами мусорщики, физиологически предназначенные для элиминации липопротеинов и кокков. Вторая группа участвует в элиминации апоптотических клеток. Распознавание фц предварительно опсонизированных клеток типично для инфекционных процессов. Существует 2 варианта опсонизации: IgG и фрагмент С3-компонента. Часто оба фактора опсонизируют клетку совместно. Опсонизация компонентами комплемента более распространена,т.к. активация комплемента возможна без участия антител (альтернативный и лектиновый пути) или с участием антител, для которых на фагоцитах нет рецепторов (IgM). При распознавании рецепторами своих лигандов происходит сближение фагоцитов с их мишенями, обычно закрепляемое молекулами адгезии.
Слайд 48: Активация мембраны и поглощение частиц, их погружение в цитоплазму и формирование фагосомы
Распознавание мишеней фагоцитоза через различные мембранные рецепторы фагоцитов приводит к запуску процессов активации — погружению и последующему разрушению частицы. На начальных стадиях события происходят на обращенном к мишени участке поляризованной клетки, где должна сформироваться фагоцитарная чаша. На поверхности патогена фиксировано несколько молекул антител. Они обусловливают объединение Fc-рецепторов в кластеры в результате перекрестного сшивания. Это приводит к активации прилежащих к цитоплазматической части рецепторов тирозинкиназ семейства Src.
Слайд 49: продолжение
Следующий этап активации направлен на образование продуктов, участвующих в полимеризации актина — процесс, на котором основан фагоцитоз. Нити актина окружают основание формирующейся фагоцитарной чаши. За их адгезию к мембране в этих участках отвечают белки семейства MARCKS (Myristoylated alanine-rich C kinase substrate), активируемые протеинкиназой С. Полимеризация актина в сочетании с погружением частиц составляет основу формирования фагоцитарной чаши и исходной позиции следующего этапа фагоцитоза. Существуют различия процесса погружения частицы в зависимости от того, какие рецепторы участвуют в ее распознавании. При FcγR-зависимом фагоцитозе в захвате объекта участвуют псевдоподии, тогда как при комплемент-зависимом фагоцитозе частица погружается в клетку без их формирования.
Слайд 50: продолжение
Погружение частицы обусловлено сокращением нитей актина, сконцентрированных вокруг фагоцитарной чаши. Погружение формирующейся фагосомы в клетку завершается смыканием над ней мембраны, подобно застежке-молнии, после этого нити актина исчезают из окружения фагосомы. Процесс разборки актиновых нитей зависит от Са2+ и одновременно актиновые филаменты формируют нити, отходящие от фагосомы внутрь клетки, и их сокращение перемещает фагосому в глубь цитоплазмы.
Слайд 51: продолжение
Сразу фагосома не несет бактерицидных веществ и ферментов. Перемещаясь внутрь клетки, фагосома проходит процесс созревания, основу которого составляют множественные акты слияния с фагосомой различных гранул, привносящих в нее эффекторные молекулы. Показатель созревания — смена мембранных маркеров фагосом. Другие показатели созревания — закисление содержимого и изменение спектра ферментов, содержащихся в фаголизосомах. При созревании фагосомы претерпевают изменения, характерные для эндосом в целом. Слияние гранул стимулируется повышением уровня внутриклеточного Са 2+.
Слайд 52: продолжение
Решающий вклад в созревание фагосом и обретение ими способности убивать и расщеплять поглощенные объекты вносят лизосомы. Слияние фагосомы и лизосомы рассматривают как момент формирования фаголизосомы. В нейтрофилах источник бактерицидных веществ и ферментов для фагосомы — специализированные лизосомоподобные гранулы — специфические (нейтральные, раньше всего сливающиеся с фагосомами), азурофильные (кислые, сливающиеся с фагосомами позже), желатиназные и секреторные гранулы.
Слайд 53: продолжение
По мере последовательного вливания в фаголизосому содержимого различных гранул изменяется рН, возрастает ее бактрицидный потенциал и способность разрушать. Последовательность вовлечения различных гранул в формирование фаголизосомы зависит от порогового уровня их чувствительности к ионам Са2+: он выше для азурофильных гранул, чем для специфических, поэтому азурофильные гранулы позже сливаются с фагосомами. Сначала проявляют свою активность ферменты с нейтральным оптимумом действия, поступающие из специфических гранул, а по мере закисления среды мобилизуются ферменты азурофильных гранул.
Слайд 54: продолжение
Сформированная фаголизосома — клеточная органелла, специализиро- ванная для осуществления киллинга и расщепления фагоцитированных корпускулярных объектов.
Слайд 55: Внутриклеточный киллинг и переваривание, выброс продуктов деградации
Киллинг происходит в фаголизосомах фагоцитов. Фаголизосомы содержат факторы, разрушающие микроорганизмы. Выделяют несколько групп таких факторов: кислородзависимые факторы: активные формы кислорода; галоидсодержащие соединения; азотистые метаболиты кислород- и оксид азота-независимые факторы: факторы, обусловливающие локальное закисление; бактрицидные пептиды; катионные белки; ферменты; конкурентные ингибиторы метаболизма.
Слайд 57: продолжение
В обеспечении киллинга фагоцитированных микроорганизмов наиболее важна роль производных кислорода. Главное событие в образовании кислородзависимых бактерицидных факторов — кислородный взрыв — быстрое (реализуемое за секунды) и высокопродуктивное осуществление цепи реакций, приводящих к образованию активных форм кислорода. Активные формы кислорода включают высокореактивные свободные радикалы, ионы кислорода и кислородсодержащих химических групп. Образование активных форм кислорода катализируется ферментом NADPH-оксидазой (оксидазой фагоцитов (Phоx). Нейтрофиллы обеспечивают данный килинг внеклеточных паразитов.
Слайд 59: Оксид азота и его производные
Активные формы азота образуются при окислении аргинина с его превращением в цитруллин. Известно 2 пути превращения аргинина, один из которых катализируется аргиназой и приводит к образованию орнитина. Продукты другого пути, катализируемого NO-синтазой, — цитруллин и оксид азота. Известно 3 изоформы NO-синтазы, из которых эпидермальная и нейрональная экспрессируются спонтанно в соответствующих клетках, а макрофагальная NO-синтаза является индуцибельной ( iNOS ). Именно макрофагальная изоформа ответственна за образование активных форм азота в фагоцитах. Основной индуктор iNOS — IFNγ ; этот фактор вносит важный вклад в усиление микробицидной активности макрофагов.
Слайд 60: продолжение
Основные продуценты активных форм азота — моноциты/макрофаги. Хотя нейтрофилы также способны синтезировать некоторое количество оксида азота. К активным формам азота наиболее чувствительны внутриклеточные патогены — микобактерии, грибы, простейшие. Поскольку образование оксида азота возможно вне фагосом в цитозоле, он действует не только на фагоцитируемые микроорганизмы, но и на вирусы, Mycobacterium tuberculosis, грибы и простейшие. Оксид азота обладает также тумороцидным эффектом.
Слайд 61: Факторы бактерицидности, не зависящие от кислорода и оксида азота
Закисление среды фаголизосомы оказывает бактериостатическое и бактерицидное действие, поскольку при значениях рН, близких к 4,5, снижается электростатический потенциал клеток микроорганизмов, что приводит к нарушению поступления в них питательных веществ. Кроме того, кислая среда способствует активации большинства ферментов (особенно из азурофильных гранул), обладающих бактерицидной и бактериолитической активностью. Продукты, выделяющиеся при разрушении микроорганиз- мов, усиливают закисление.
Слайд 62: продолжение
Ферменты. Общее число ферментов, выявляемых в фаголизосомах — более 60. Азурофильные гранулы доставляют в фаголизосомы широкий набор кислых гидролаз и других ферментов, активных при кислых значениях рН: миелопероксидазу, β-глюкуронидазу, кислую глицерофосфатазу, а также гликозидазы. Азурофильные гранулы — дополнительный источник лизоцима и лактоферрина. Из азурофильных гранул в фаголизосому поступают также нейтральные протеазы, объединяемые в группу серпроцидинов, — еще одних представителей катионных белков. Большинство сосредоточенных в фаголизосомах ферментов участвуют в расщеплении убитых микроорганизмов.
Слайд 63: продолжение
Катионные белки В составе катионных белков преобладают щелочные аминокислотные остатки (что и определяет их катионность). Среди катионных белков есть как обладающие ферментативной активностью (лизоцим и серпроцидины-катепсин, эластаза, азуроцидин, протеиназа), так и конкурентные белки, бактерицидное действие которых основано на связывании жизненно важных для патогенов веществ (лактоферрин, витамин В12-связывающий фактор, BPI- белки повышающие проницаемость бактериальной стенки).
Слайд 64: продолжение
Бактерицидные пептиды или антибиотические — наиболее интенсивно изучаемые бактерицидные факторы многоклеточных. Выделяют несколько групп бактерицидных пептидов, из которых наиболее известны дефензины и кателицидины. Дефензины — катионные пептиды- важный компонент фаголизосом нейтрофилов, легочных макрофагах, в эпителии ЖКТ, эпителии дыхательных путей. Кателицидины - пептиды, гомологичные кателину. В нейтрофилах человека присутствует 1 вариант кателицидинов — LL-37. Бактерицидные пептиды проявляют антибактериальную, антимикотическую и антивирусную активность. Их бактерицидность связана с особенностями их строения. Взаимодействие дефензинов с клетками микроорганизмов не зависит от рецепторов и обусловлено электростатическими взаимодействиями положительно заряженных остатков собственных аминокислот с отрицательно заряженными группами (в составе пептидогликанов, ЛПС и др.) на поверхности патогенов.
Слайд 65: Дегрануляция
Заключительный этап фагоцитоза. Ее следствия — попадание содержимого фаголизосом в межклеточное пространство. За счет сокращения нитей актомиозина фаголизосомы транспортируются по каркасу из микротрубочек к клеточной мембране и сливаются ней. Сигналом к секреции служит повышение уровня внутриклеточного Са2+. Секреция контрoлируются ГуанинТизинФазами семейства Rab. Экзоцитоз гранул нейтрофилов может быть спровоцирован действием некоторых ферментов. Ключевую роль во взаимном распознавании мембран играют белки семейства SNARE. Такое распознавание — обязательное условие дегрануляции. В дегрануляцию специфические гранулы и фаголизосомы, образованные с их участием, вовлекаются раньше азурофильных гранул.
Слайд 66: продолжение
Содержимое гранул попадает в нейтральную внеклеточную среду, т.е. в благоприятные условия для проявления активности ферментов и других факторов, содержащихся в специфических гранулах. Азурофильные гранулы содержат ферменты с оптимумом действия в кислой среде, создающейся лишь на пике воспа- лительной реакции. На этом этапе в окружении нейтрофилов оказываются лизоцим и щелочная фосфатаза. Однако по мере прогрессирования воспаления повышается вклад в дегрануляцию азурофильных гранул и в межклеточной среде воспалительного очага происходит накопление кислых гидролаз и активных форм кислорода.
Слайд 67: продолжение
Все перечисленные факторы задействованы в защите против микроорганизмов. Активные формы кислорода и галоидсодержащие соединения проявляют свой бактерицидный эффект во внеклеточной среде. Лизоцим, катионные протеазы (катепсин G, азуроцидин, эластаза), лактоферрин оказывают более сильное антипатогенное действие. Однако эффективность этой защиты во внеклеточном пространстве значительно ниже, чем внутри клетки, где факторы действуют в более высокой концентрации и в тесном контакте друг с другом. Важно отметить, что во внеклеточном пространстве большинство этих факторов проявляет цитотоксическое действие в отношении собственных клеток организма. Продукты дегрануляции и некротической гибели нейтрофилов вызывают «расплавление» тканей в очаге воспаления и образование гноя.
Слайд 68: продолжение
В то же время ферменты, особенно протеазы, выделяемые из гранул нейтрофилов, вносят существенный вклад в формирование вазоактивных пептидов, играющих важную роль в развитии сосудистой реакции при воспалении. Так, кислые и нейтральные протеазы участвуют в образовании кининов, влияющих на сократимость и проницаемость мелких сосудов. Сериновая протеаза, производимая нейтрофилами, катализирует превращение ангиотензиногена в ангиотензин II, вызывающий сужение крупных сосудов, что приводит к повышению кровяного давления. Катионные белки обусловливают высвобождение вазоактивных пептидов и гистамина из тучных клеток и тромбоцитов и вызывают агрегацию последних. Некоторые протеазы способны расщеплять факторы комплемента С3 и С5 с образованием С3а и С5а, играющих важную роль в развитии воспаления.
Слайд 69: продолжение
Некоторые вазоактивные пептиды уже содержатся в гранулах нейтрофилов, а при дегрануляции происходит их высвобождение. Нейтрофилы, завершившие процесс фагоцитоза, погибают (чаще путем апоптоза). Тканевые нейтрофилы быстро подвергаются апоптозу и без осуществления фагоцитарной реакции; фагоцитоз только ускоряет этот процесс. Причина апоптоза в этом случае — повышение проницаемости митохондрий для цитохрома с и фактора Аро-1, формирующих апоптосому, в которой происходит активация каспазы 9. В процессе апоптоза на поверхности нейтрофилов появляется фосфатидилсерин и другие молекулы, распознаваемые мембранными рецепторами макрофагов, что приводит к фагоцитозу апоптотирующих нейтрофилов. Т.О. макрофаги очищают территорию после фагоцитоза. При активации макрофагов в них происходит образование антиапоптотического фактора BCL-2, поэтому они не подвергаются апоптозу после завершения фагоцитоза.
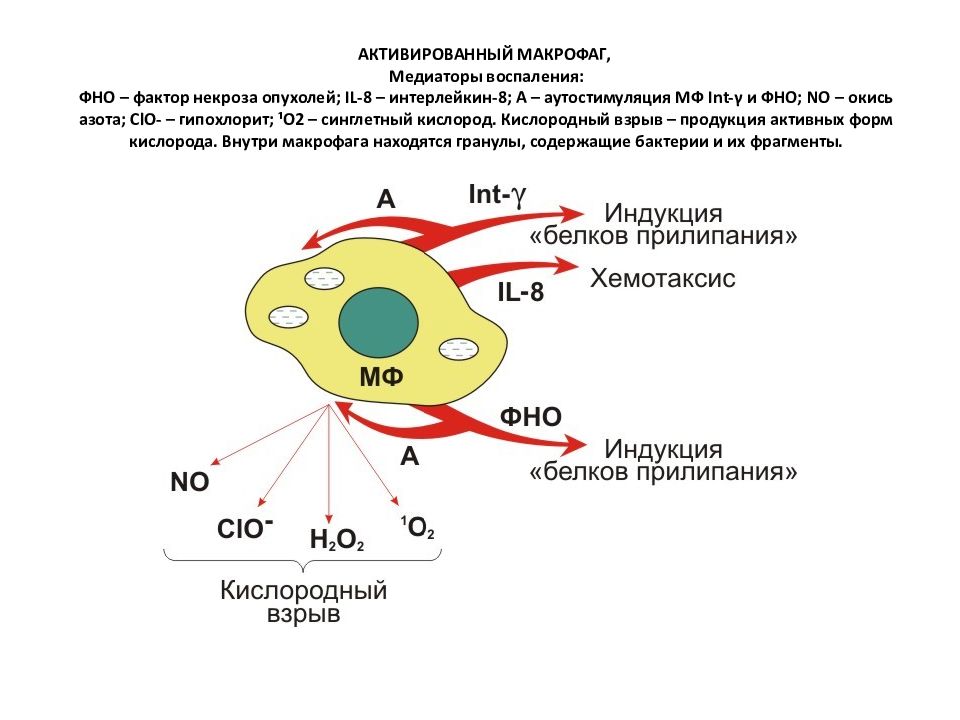
Слайд 72: АКТИВИРОВАННЫЙ МАКРОФАГ, Медиаторы воспаления: ФНО – фактор некроза опухолей; IL-8 – интерлейкин-8; А – аутостимуляция МФ Int-γ и ФНО; NO – окись азота; ClO- – гипохлорит; ¹О2 – синглетный кислород. Кислородный взрыв – продукция активных форм кислорода. Внутри макрофага находятся гранулы, содержащие бактерии и их фрагменты
Слайд 74: Воспаление
Сложный комплексный процесс, который складывается из трех взаимосвязанных реакций — альтерации (повреждения), экссудации и пролиферации. Стадия альтерации (повреждения) — это начальная, пусковая стадия воспаления, характеризующаяся повреждением тканей. Она включает разнообразные изменения клеточных и внеклеточных компонентов в месте действия повреждающего фактора. Стадия экссудации - возникает в разные сроки вслед за повреждением клеток и тканей в ответ на действие медиаторов воспаления: плазменных медиаторов, возникающих при активации трех систем крови — кининовой, комплементарной и свертывающей. Продуктивная (пролиферативная) стадия завершает воспаление. Уменьшается гиперемия воспаленной ткани и интенсивность эмиграции лейкоцитов.
Слайд 75: Воспаление
Воспаление сложный процесс, инициируемый повреждением тканей, которое вызвано эндогенными и экзогенными факторами – механическими, физическими, химическими, биологическими. Защитная реакция организма против повреждения и инфекции. Признаки воспаления- боль, покраснение, повышение температуры. Боль- вызывается увеличением диаметра сосудов, что приводит к усилению кровотока, повышается температура, появляется краснота
Слайд 76: Воспаление
Далее уменьшение скорости тока крови и экспрессия молекул адгезии, вызванная цитокинами и кининами, способствует связыванию циркулирующих лейкоцитов. Что способствует проникновению лейкоцитов в ткани и привлечение нейтрофилов, моноцитов к месту воспаления. В местных кровеносных сосудах происходит повышение их проницаемости. Далее – отек, сопутствующее воспаление и усиление боли
Слайд 77: Воспаление
За несколько минут после повреждения, начинается воспалительный процесс- происходит активация протеинов (белки острой фазы воспаления) и кинины, которые запускают местные и системные реакции Функции кининов- действуют на гладкую мускулатуру и вызывают сокращение мышц, действуют на аксоны - блокируя нервные импульсы, действует на брадикинин- проницаемость сосудов увеличивается и повышается экспрессия молекул адгезии.
Слайд 78: Воспаление
Кинины- сильные нервные стимуляторы, отвечают за боль, зуд, связанную с воспалением. Активированные кинины инактивируются протеазами во время локализованных реакций. Вслед за повреждение кровеносных сосудов активируются ферменты плазмы, образуя коагуляционный каскад. Он формирует физический барьер –сгусток, который препятствует поступлению микробов в кровоток.
Слайд 79: Воспаление
Далее системная воспалительная реакция включает появлению лихорадку, увеличение продукции лейкоцитов, усиленный синтез гидрокортизона и адренокортикотропного гормона. С-реактивный белок-связывается с мембраной бактерий и активирует систему С. Цитокины – играют важную роль в воспалительной реакции. Ил-1,2, ФНО вовлекают в процесс молекулы адгезии на стенках эндотелиальных клеток сосудов, к которым прикрепляются моноциты, лимфоциты перед тем как выйти из сосуда в поврежденную ткань. Эти цитокины вызывают коагуляцию и увеличение проницаемости сосудов. Ил-8, ИнФгамма –повышают хемотаксис, усиливают фагоцитоз.
Слайд 80: Воспаление
Все эти эффекты приводят к скоплению жидкости (отек) и лейкоцитов в поврежденных участках, что усиливает реакцию перемещения и высвобождения из скопившихся клеток биологически активных соединений, привлекая и активируя еще больше фагоцитирующих клеток, которые участвуют в разрушении и выведении агрессора. Многие вещества, активированные во время воспалительной реакции, участвуют в восстановлении поврежденных тканей. Многие клетки уничтожаются, макрофаги фагоцитируют остатки и воспаление уменьшается. Ткань восстанавливаеся или образуется рубцовая ткань
Слайд 81: Естественные киллеры
довольно крупные (10–12 мкм в диаметре) лимфоциты с азурофильной зернистостью в цитоплазме. Главное отличие NK-клеток от других лимфоцитов — отсутствие антигенспецифических рецепторов, кодируемых генами, перестраиваемыми в процессе дифференцировки клеток. С этим связано отсутствие клональной структуры популяции NK - они идентичны по строению их ключевых рецепторов. Основные маркеры комбинация молекул CD56 и CD16. СD56 — молекула гомофильной адгезии; она экспрессирована на нервных и мышечных клетках, некоторых Т-л. CD16 — низкоаффинный Fc-рецептор FcγRIII, представленный на нейтрофилах и моноцитах. Ни один из этих двух маркеров не специфичен для NK-клеток.
Слайд 82: Естественные киллеры
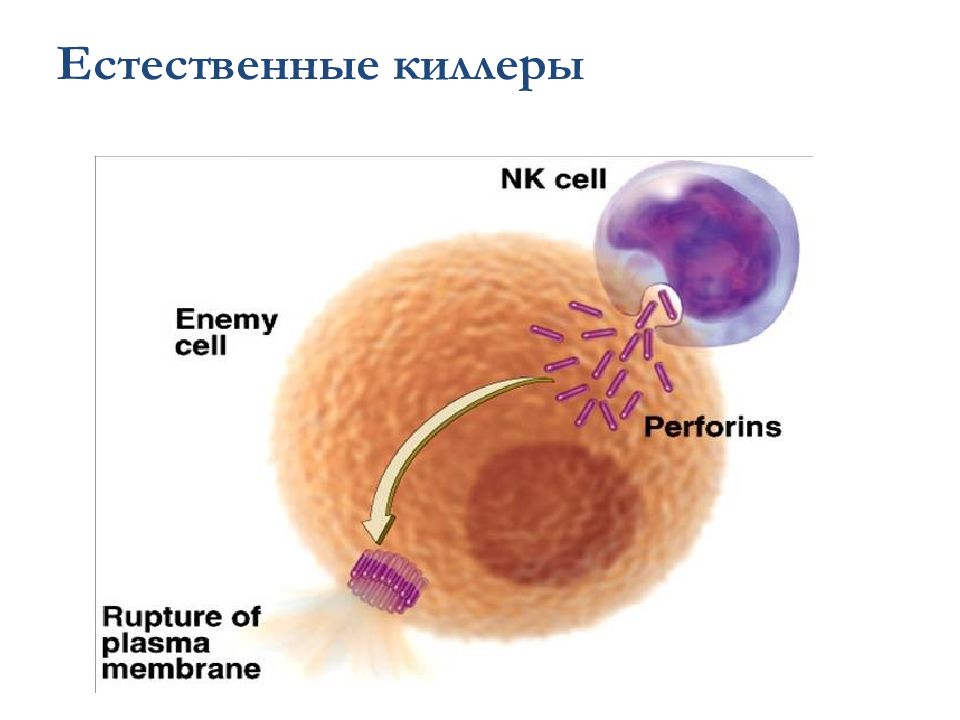
NK имеют цитоплазматические азурофильные гранулы – по генезу это разновидность лизосом, хотя и имеют некоторые черты секреторных везикул. Величина гранул варьирует от 100 до 500 нм. Перфорин, гранзимы и гранулолизин — основные компоненты гранул NK, связанные с их цитолитической функцией. Перфорин — белок с молекулярной массой 66–70 кДа. Это структурный аналог терминального компонента комплемента С9. Перфорин способен полимеризироваться в гидрофобном окружении и формировать поры в мембране клетки-мишени. Гранзимы — сериновые протеазы.
Слайд 83: Естественные киллеры
Выделяют несколько разновидностей гранзимов (А, В, С), из которых гранзим В, проникающий в клетку-мишень через перфориновые поры, индуцирует ее апоптоз. Гранулизины содержатся только в зрелых гранулах в связанной с липидами форме. Помимо перфорина и гранзимов гранулы NK содержат амины (гистамин, серотонин), протеогликаны (хондроитинсульфат, гепарин), а также катехоламины (адреналин, норадреналин), ферменты (катепсины, химотрипсиноподобные протеазы, кислые фосфатазы) и ряд пептидных гормонов.
Слайд 84: Естественные киллеры
Выделяют 2 субпопуляции NK, различающиеся соотноше - нием мембранных маркеров и функциями: CD56hi CD16- и CD56lo CD16+ клетки (значки hi и lo — соответственно, высокий и низкий уровень экспрессии маркера). Субпопуляция NK- слабо экспресирующая CD56, преобладает в кровотоке (90–95%, против 5–10% CD56hi клеток), однако в печени, эндометрии матки и децидуальной оболочке плода преобладают CD56hi естественные киллеры. CD56hi клетки преобладают также в лимфатических узлах, составляя 75% от числа NK-клеток. Различия между субпопуляциями NK-клеток связаны не только с особенностями мембранного фенотипа, но и с их функциями. CD59lo CD16+ клетки обладают выраженной цитотоксической активностью и относительно слабо секретируют цитокины, тогда как CD56hi CD16- клетки — активные продуценты IFNγ и других цитокинов ( TNFα и β, GM-CSF, IL-10), но проявляют слабую киллерную активность.
Слайд 85: Естественные киллеры
Только CD56hi CD16- NK экспрессируют α-цепь рецептора IL-2, т.е. несут высокоаффинный рецеп- тор для этого цитокина. Именно поэтому in vitro CD56hi CD16- NK интенсивно пролиферируют в ответ на IL-2. Рецептор IL-2 CD59lo CD16+ естественных киллеров состоит из β- и γ-цепей и обладает промежуточной аффинностью. Именно поэтому эти клетки слабо пролиферируют и только при действии высоких концентраций IL-2. Таким образм, CD59lo CD16+ клетки можно охарактеризовать как эффекторные, а CD56hi CD16- — как регуляторные NK-клетки. В настоящее время преобладает мнение, что CD59lo CD16+ клетки представляют терминальную, а CD56hi CD16- клетки — промежуточную стадию развития NK-клеток.
Слайд 86: Естественные киллеры
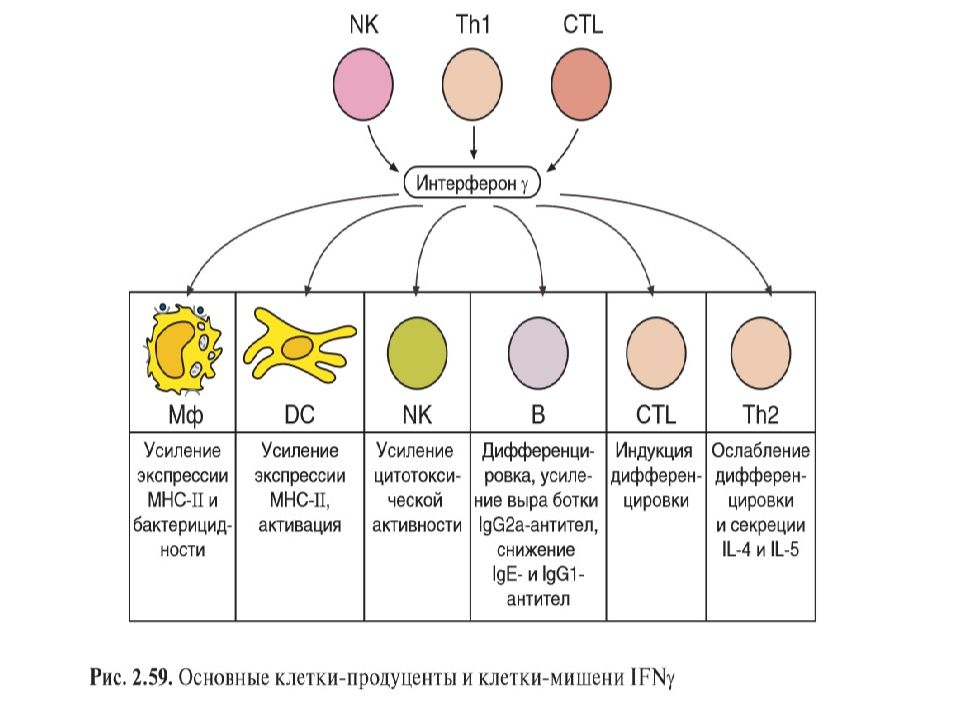
Наиболее важные функции NK — цитотоксическая активность в отношении измененных (трансформированных, инфицированных вирусами, подвергшихся действию стресса) клеток организма и секреция цитокинов (в первую очередь IFNγ), что играет важную роль в регуляции иммунных процессов. Эти свойства реализуются за счет поликлонального распознавания маркеров клеточного стресса в сочетании с контролем «свой–чужой» (по экспрессии клетками-мишенями молекул MHC-I).
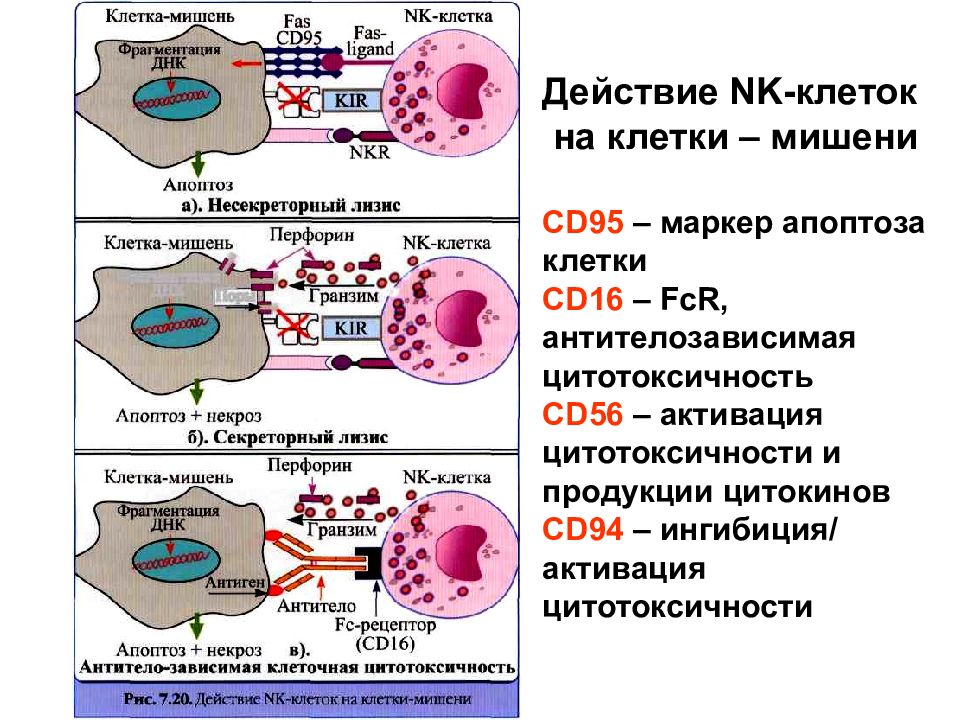
Слайд 87
Действие NK -клеток на клетки – мишени CD95 – маркер апоптоза клетки CD16 – FcR, антителозависимая цитотоксичность CD56 – активация цитотоксичности и продукции цитокинов CD94 – ингибиция/ активация цитотоксичности
Последний слайд презентации: Неспецифические факторы защиты Лекция 2. МБХ. 3 курс: Литература:
Основная и дополнительная литература Основная литература 1. Хаитов Р.М., Электронное издание на основе: Иммунология [Электронный ресурс] / Р.М. Хаитов - М. : ГЭОТАР-Медиа, 2016. - 496 с. - ISBN 978-5-9704-3842-8 - Режим доступа: http://www.studmedlib.ru/book/ISBN9785970438428.html 2. Ковальчук Л.В., Иммунология: практикум [Электронный ресурс] : учебное пособие / Под ред. Л.В. Ковальчука, Г.А. Игнатьевой, Л.В. Ганковской. - М. : ГЭОТАР-Медиа, 2015. - 176 с. - ISBN 978-5-9704-3506-9 - Режим доступа: http://www.studmedlib.ru/book/ISBN9785970435069.html 3. Зверев В.В., Медицинская микробиология, вирусология и иммунология: в 2 т. Том 1. [Электронный ресурс] : учебник / Под ред. В.В. Зверева, М.Н. Бойченко. - М. : ГЭОТАР-Медиа, 2016. - 448 с. - ISBN 978-5-9704-3641-7 - Режим доступа: http://www.studmedlib.ru/book/ISBN9785970436417.html 4. Зверев В.В., Медицинская микробиология, вирусология и иммунология. В 2 т. Том 2. [Электронный ресурс] : учебник / Под ред. В.В. Зверева, М.Н. Бойченко - М. : ГЭОТАР-Медиа, 2016. - 480 с. - ISBN 978-5-9704-3642-4 - Режим доступа: http://www.studmedlib.ru/book/ISBN9785970436424.html Дополнительная литература 1. Ярилин А.А., Иммунология [Электронный ресурс] / Ярилин А.А. - М. : ГЭОТАР-Медиа, 2010. - 752 с. - ISBN 978-5-9704-1319-7 - Режим доступа: http://www.studmedlib.ru/book/ISBN9785970413197.html 2. Хаитов Р.М., Иммунология. Атлас [Электронный ресурс] : учебное пособие / Хаитов Р.М., Ярилин А.А., Пинегин Б.В. - М. : ГЭОТАР-Медиа, 2011. - 624 с. - ISBN 978-5-9704-1858-1 - Режим доступа: http://www.studmedlib.ru/book/ISBN9785970418581.html 3. Хубутия М.Ш., Трансплантология [Электронный ресурс] : учебник / под ред. М.Ш. Хубутия. - М. : ГЭОТАР-Медиа, 2016. - 320 с. - ISBN 978-5-9704-3896-1 - Режим доступа: http://www.studmedlib.ru/book/ISBN9785970438961.html 4. Иммунология [Электронный ресурс]: журнал / под ред. академика РАН Р. М. Хаитова - №1- №5- М. : Медицина, 2015. - Режим доступа: http://www.studmedlib.ru/book/0206-49521.html 5.Рабочая тетрадь для самостоятельной работы студентов по специальности 30.05.01 Медицинская биохимия по дисциплине Общая и клиническая иммунология. Часть 1. Общая иммунология. (Электронный ресурс): методический материал / Л.П.Лисишникова (и др).- Архангельск: Изд-во Северного государственного медцинского университета, 2017.-156с. – Режим доступа: : http://lib.nsmu.ru/lib/.