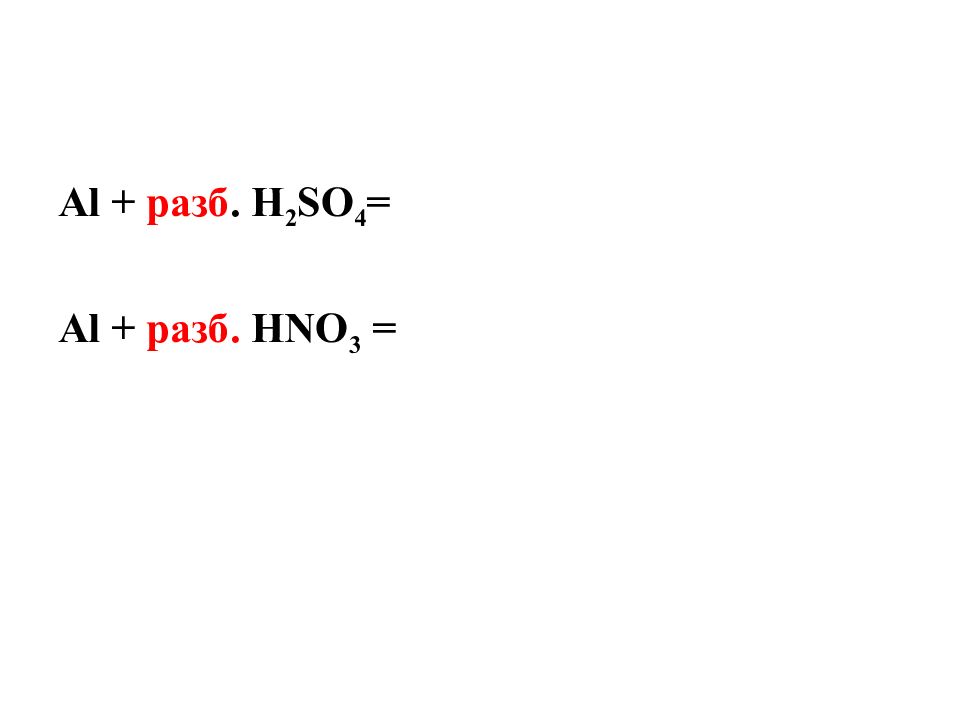Первый слайд презентации
Общая характеристика элементов IIIA-группы. Бор. Алюминий
Слайд 2: План лекции:
Общая характеристика элементов главной подгруппы III группы. Бор и его соединения. Алюминий и его соединения.
Слайд 4
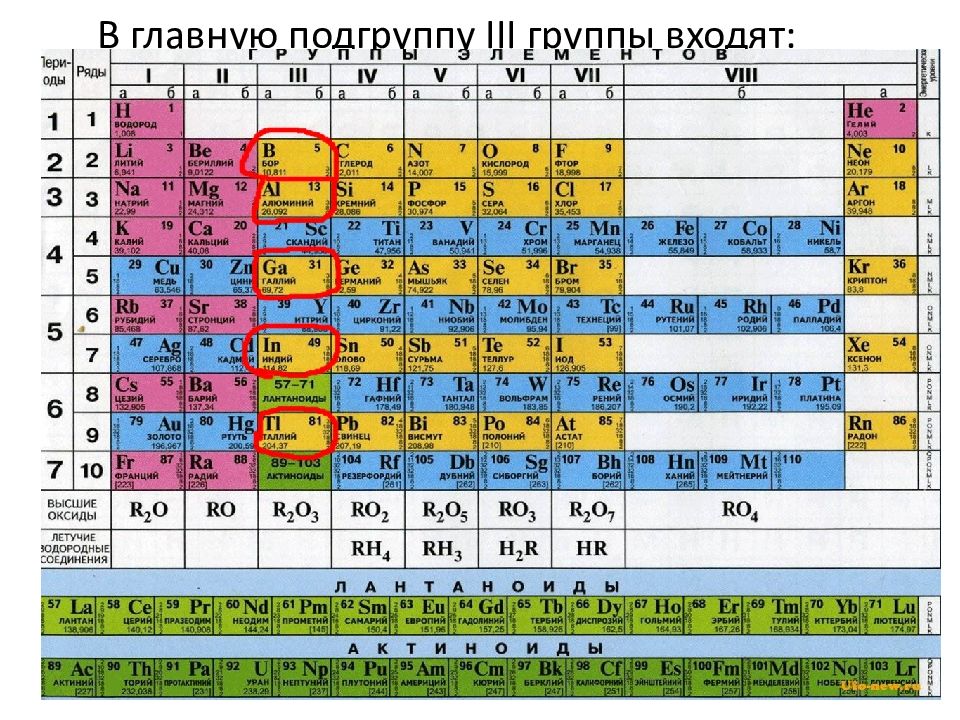
4 III группа Периодической системы К р -элементам III группы относятся бор, алюминий, галлий, индий и таллий : р - Элементы: В 1s 2 2s 2 2p 1 Al 2s 2 2p 6 3s 2 3p 1 Ga 3s 2 3p 6 3d 10 4s 2 4p 1 In 4s 2 4p 6 4d 10 5s 2 5p 1 Tl 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 6p 1
Слайд 5: Элементы III А-группы
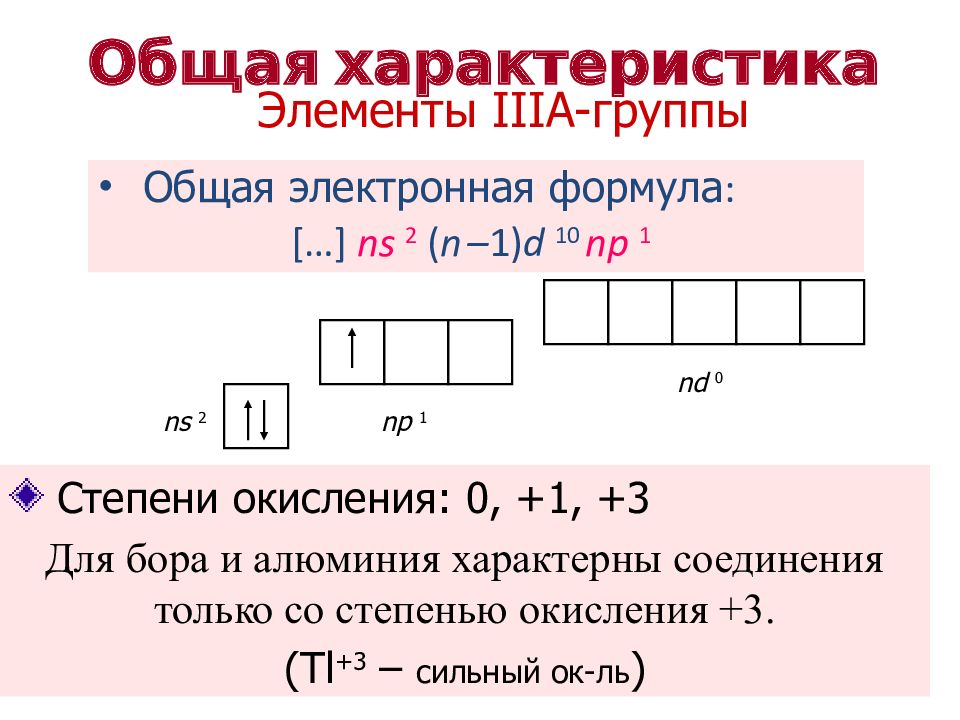
Общая электронная формула : […] ns 2 ( n – 1) d 10 np 1 Степени окисления: 0, + 1, + 3 Для бора и алюминия характерны соединения только со степенью окисления +3. (Tl +3 – сильный ок-ль ) ns 2 np 1 nd 0 Общая характеристика
Слайд 6: Элементы IIIA- группы
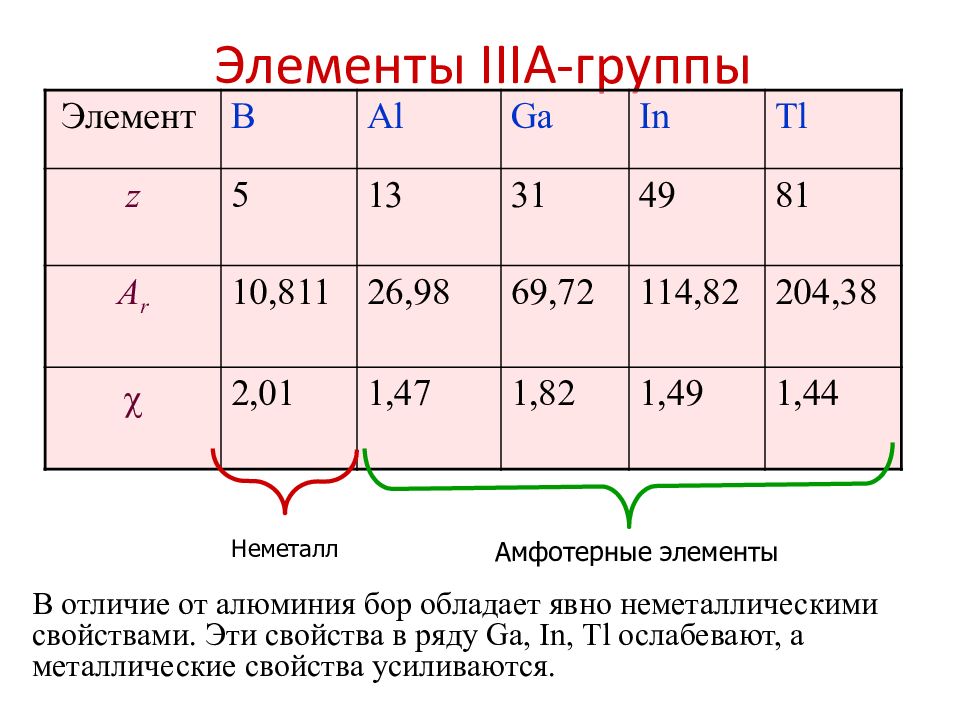
Элемент B Al Ga In Tl z 5 13 31 49 81 A r 10,811 26,98 69,72 114,82 204,38 2,01 1,47 1,82 1,49 1,44 Неметалл Амфотерные элементы В отличие от алюминия бор обладает явно неметаллическими свойствами. Эти свойства в ряду Gа, In, Тl ослабевают, а металлические свойства усиливаются.
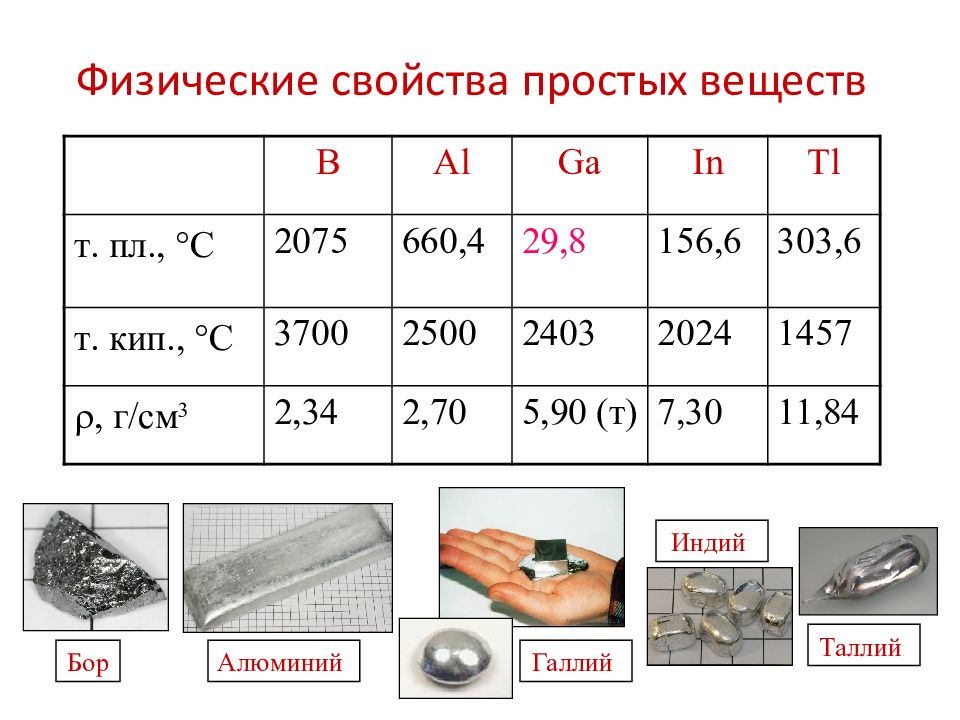
Слайд 7: Физические свойства простых веществ
B Al Ga In Tl т. пл., С 2075 660, 4 29, 8 156, 6 303,6 т. кип., С 3700 2500 2403 2024 1457 , г/см 3 2,34 2,70 5,90 (т) 7,30 11,84 Бор Алюминий Таллий Индий Галлий
Слайд 8: Галлий
Га́ллий мягкий пластичный металл серебристо-белого цвета с синеватым оттенком. Лёгкий металл.
Слайд 9: Индий
И́ндий ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета Индий
Слайд 10: Таллий
Та́ллий мягкий металл белого цвета с голубоватым оттенком. Относится к группе тяжёлых металлов. Сверхпроводник. На воздухе быстро тускнеет, покрываясь чёрной плёнкой оксида таллия Tl 2 O. Высокотоксичен
Слайд 11: Кислородные соединения Оксиды
Э 2 О 3 B Al Ga In Tl амфотерные кислотный кислотность увеличивается Оксид алюминия
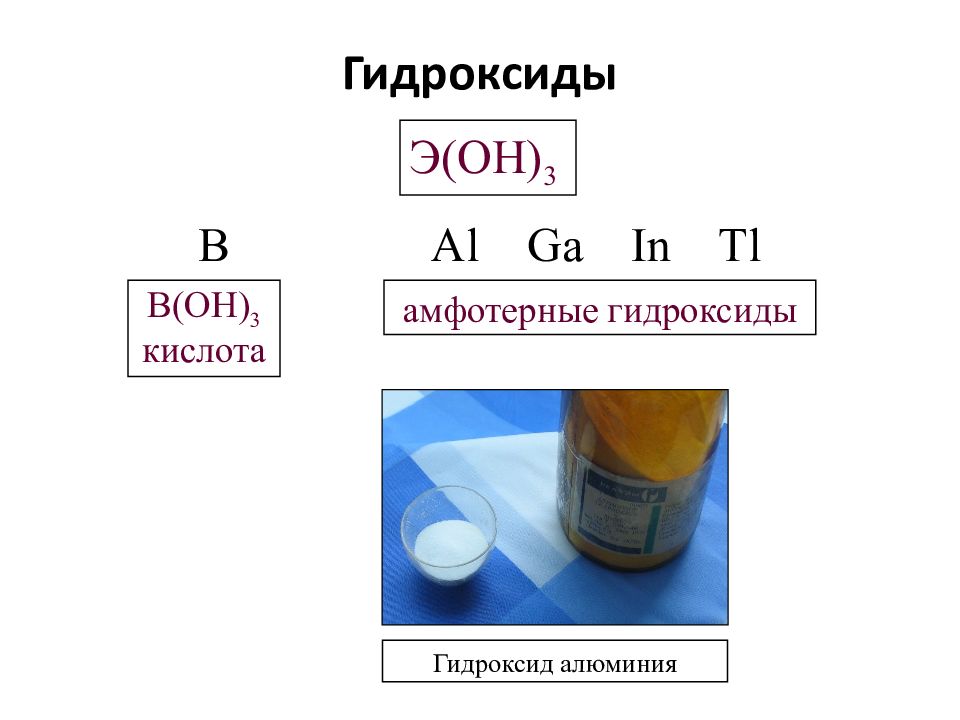
Слайд 12: Гидроксиды
Э( OH ) 3 B Al Ga In Tl B(OH) 3 кислота амфотерные гидроксиды Гидроксид алюминия
Слайд 13
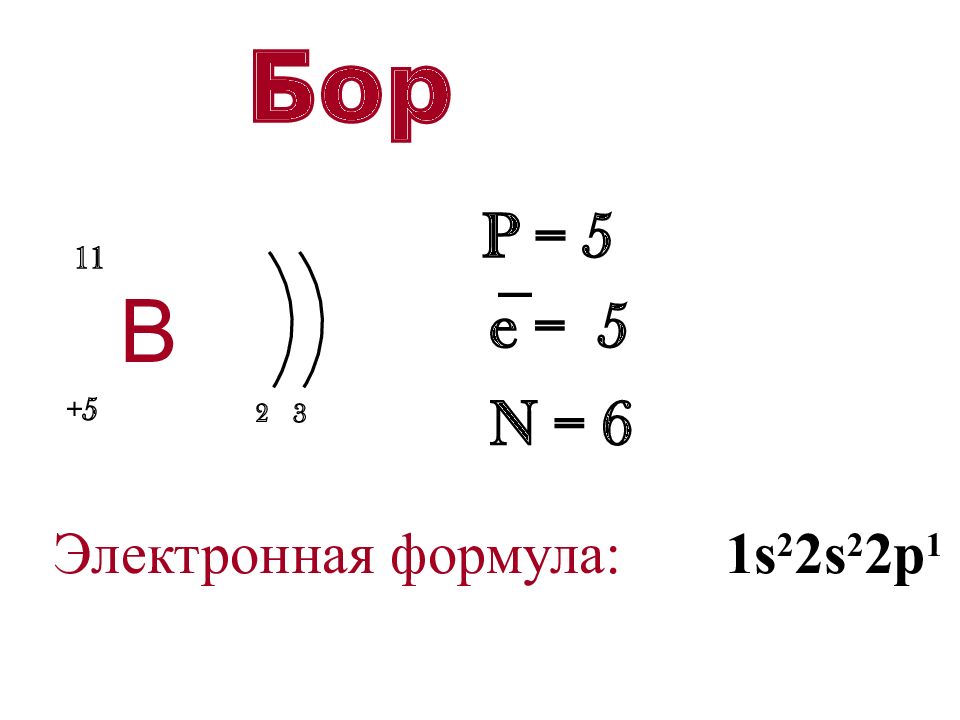
В 2 3 + 5 11 P = 5 e = 5 N = 6 − Электронная формула: 1s 2 2s 2 2p 1 Бор
Слайд 14: Бор
Кристаллы бора черного цвета, тугоплавкие, диамагнитны. В свободном состоянии бор - серое кристаллическое, либо тёмное аморфное вещество. По твердости он уступает только алмазу и нитриду бора.
Слайд 15
15 Химические свойства бора В обычных условиях кристаллический бор весьма инертен и непосредственно взаимодействует только со фтором. 2B + 3F 2 = 2BF 3 при нагревании (400-700 °С) окисляется кислородом, серой, хлором ( и др. галогенами ). 4B ( т ) + 3O 2 ( г ) = 2B 2 O 3 ( т ), 2B + 3Cl 2 = 2BCl 3 С водородом бор не взаимодействует.
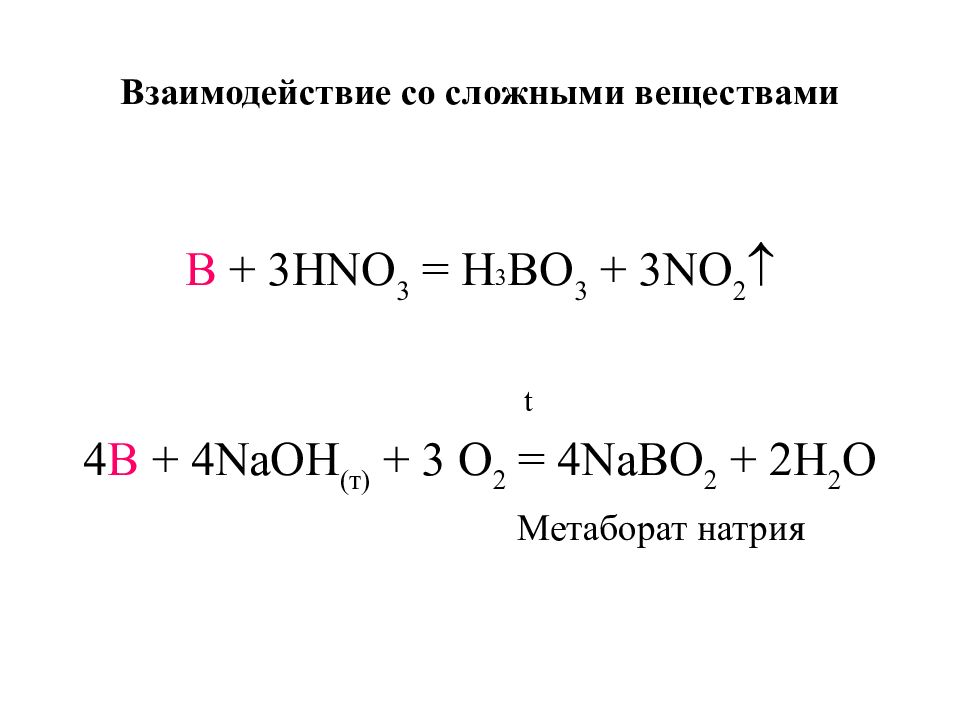
Слайд 16: Взаимодействие со сложными веществами
B + 3HNO 3 = Н 3 BO 3 + 3NO 2 t 4 B + 4NaOH ( т ) + 3 O 2 = 4NaBO 2 + 2H 2 O Метаборат натрия
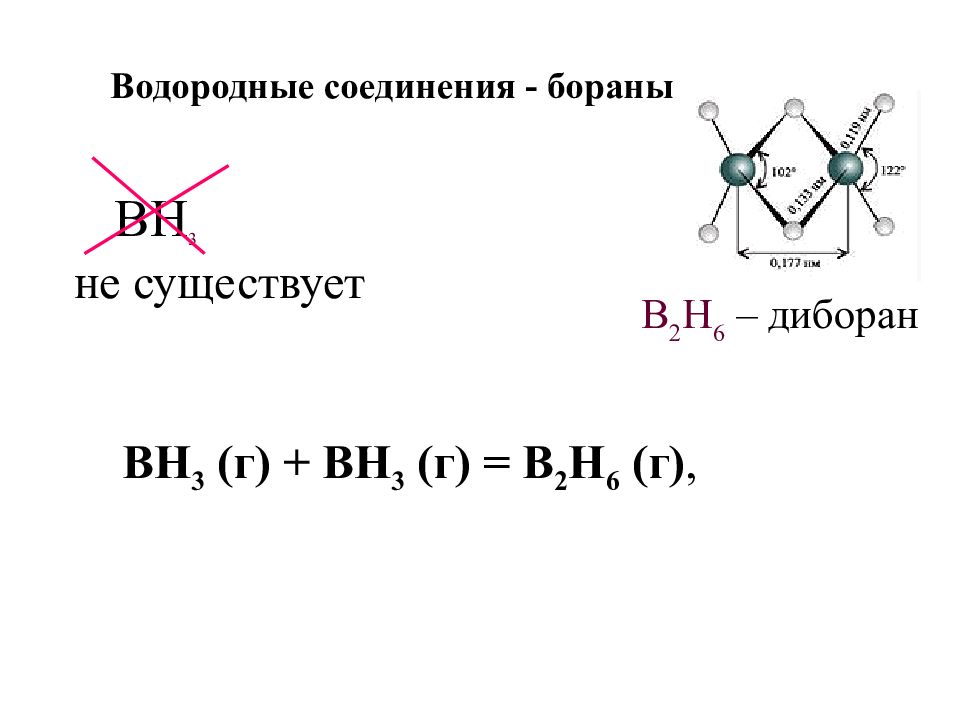
Слайд 17: Водородные соединения - бораны
BH 3 не существует B 2 H 6 – диборан В H 3 (г) + ВН 3 (г) = В 2 Н 6 (г),
Слайд 18
18 Бороводороды На воздухе самовоспламеняются В 2 Н 6 + 3О 2 = В 2 О 3 + 3Н 2 О + Q Гидриды бора разлагаются водой, спиртами и щелочами с выделением водорода. В 2 Н 6 + 6Н 2 О = 2Н 3 ВО 3 + 6Н 2 Большинство боранов имеет отвратительный запах и очень ядовиты!
Слайд 19: Оксид бора ( III ) В 2 O 3
19 Как кислотный оксид В 2 O 3 энергично взаимодействует с водой с образованием борной кислоты Н 3 В O 3. В 2 O 3 + 3Н 2 О = 2Н 3 В O 3
Слайд 21: Ортоборная кислота
21 В твердом состоянии Н 3 ВО 3 — чешуйки, жирные на ощупь. Ортоборная кислота — очень слабая, одноосновная. В отличие от обычных кислот ее кислотные свойства обязаны не отщеплению протона, а присоединению ОН - - ионов : B(OH) 3 + HOH = [B(OH) 4 ] - + H +
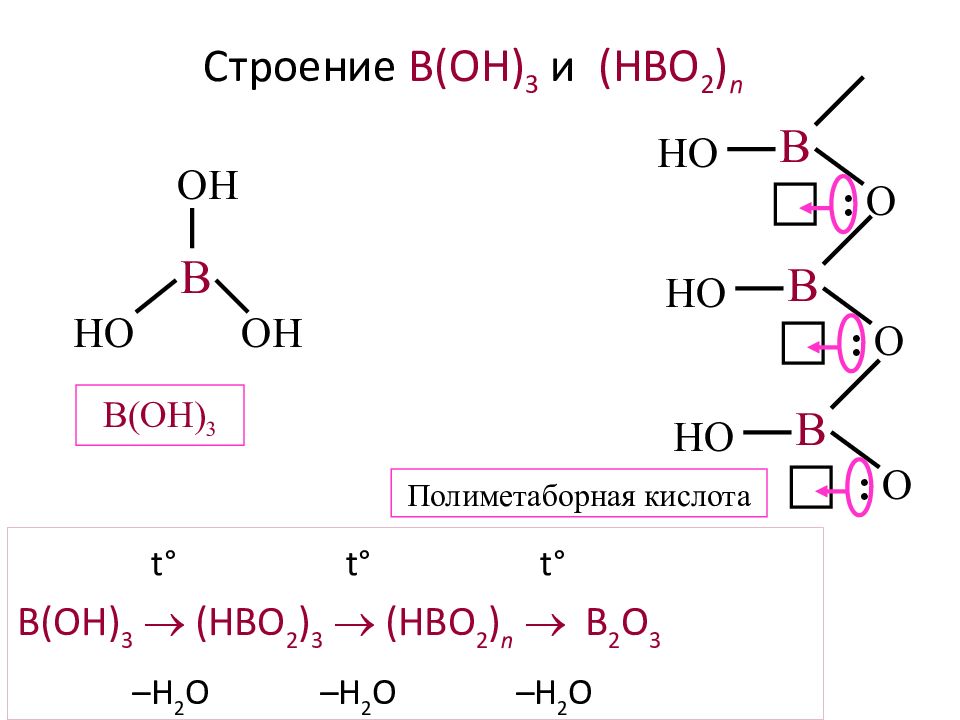
Слайд 22: Строение B(OH) 3 и (HBO 2 ) n
t° t° t° B(OH) 3 (HBO 2 ) 3 (HBO 2 ) n B 2 O 3 –H 2 O –H 2 O –H 2 O B OH HO OH B(OH) 3 B HO : O B HO : O B HO : O Полиметаборная кислота
Слайд 23
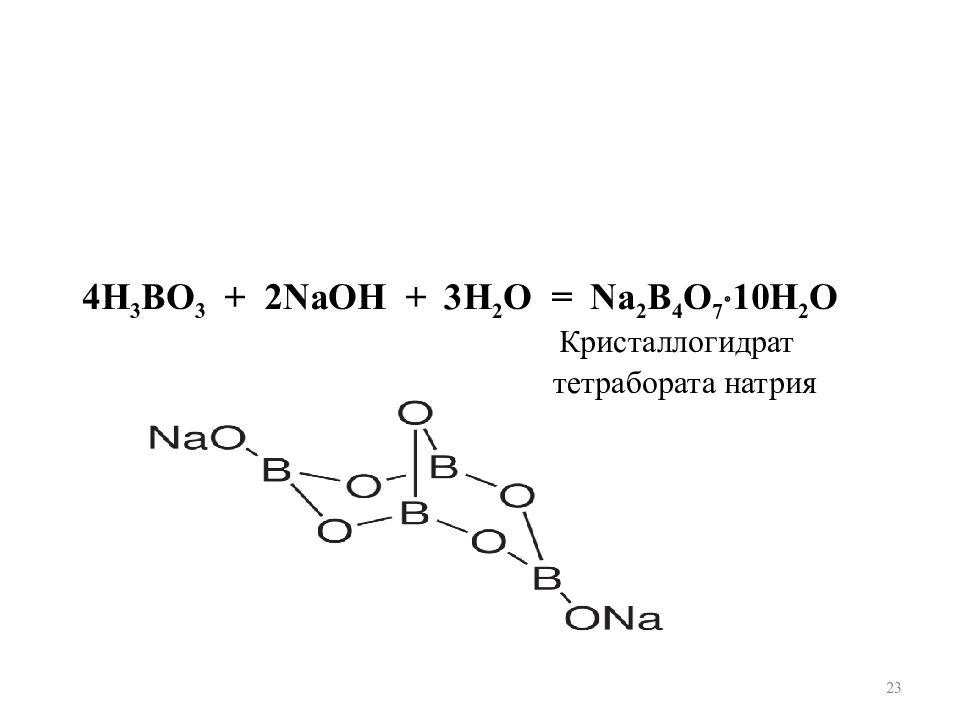
23 4Н 3 ВО 3 + 2 N аОН + 3Н 2 O = N а 2 В 4 О 7 10Н 2 O Кристаллогидрат тетрабората натрия
Слайд 24
24 При прокаливании буры с солями некоторых металлов образуются двойные высокомолекулярные полиметабораты — стекла, например: N аВО 2 С r (ВО 2 ) 3 — зеленый, 2 N аВО 2 Со(ВО 2 ) 2 — синий: Тетраборат натрия Na 2 B 4 O 7 · 10H 2 O ( бура )
Слайд 26
Алюминий Al 27 +13 0 2 8 3 P = 13 e = 13 N = 14 − 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 Электронная формула: 3 s 2 Al Al
Слайд 27: Нахождение в природе
Алюминий по распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов. Боксит - Al 2 O 3 (28-80%).
Слайд 28
Физические свойства мягкий, пластичный (легко вытягивается в проволоку и раскатывается в листы) легкий (с малой плотностью – 2,7 г/см 3 ) с высокой тепло- и электропроводностью легкоплавкий (температура плавления 660°C) серебристо-белый с характерным металлическим блеском
Слайд 29: ХИМИЧЕСКИЕ СВОЙСТВА
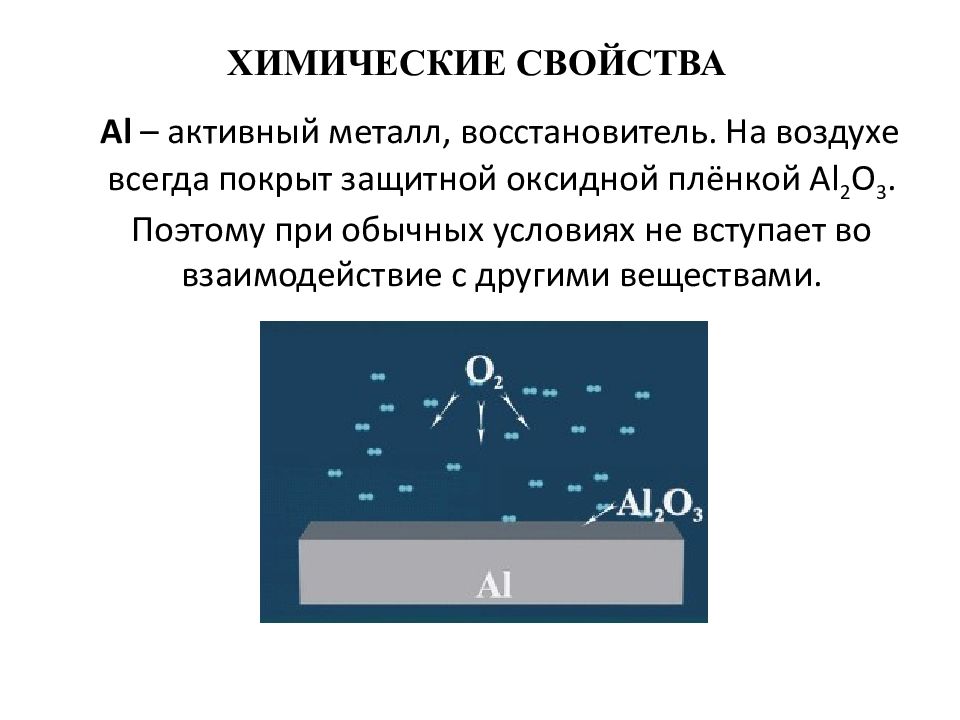
Al – активный металл, восстановитель. На воздухе всегда покрыт защитной оксидной плёнкой Al 2 O 3. Поэтому при обычных условиях не вступает во взаимодействие с другими веществами.
Слайд 31
с серой, образуя сульфид алюминия: Al + S = с азотом, образуя нитрид алюминия: Al + N 2 = с углеродом, образуя карбид алюминия: Al + С = с хлором, образуя хлорид алюминия: Al + Cl 2 = Химические свойства с кислородом, образуя оксид алюминия: Al + O 2 = Взаимодействие с простыми веществами:
Слайд 32
с серой, образуя сульфид алюминия: 2Al + 3S = Al 2 S 3 с азотом, образуя нитрид алюминия: 2Al + N 2 = 2AlN с углеродом, образуя карбид алюминия: 4Al + 3С = Al 4 С 3 с хлором, образуя хлорид алюминия: 2 Al + 3Cl 2 = 2AlCl 3 Химические свойства с кислородом, образуя оксид алюминия: 4Al + 3O 2 = 2Al 2 O 3 Взаимодействие с простыми веществами:
Слайд 33: Алюминий при обычных условиях не взаимодействует с концентрированными H 2 SO 4 и HNO 3
Слайд 35
2 Al + разб. 6 H 2 SO 4 = Al 2 (SO 4 ) 3 + 3 SO 2 + 6 H 2 O Al + разб. 4 HNO 3 = Al(NO 3 ) 3 + NO 2 + 2 H 2 O
Слайд 36
С концентрированной азотной и серной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли и продукта восстановления кислоты: 2Al + 6H 2 SO 4 = Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O; Al + 6HNO 3 = Al(NO 3 ) 3 + 3NO 2 + 3H 2 O.
Слайд 37
Взаимодействие со щелочами Алюминий – амфотерный металл, он легко реагирует со щелочами: в растворе : 2Al + 2NaOH + 6 H 2 O = 2Na[Al (OH) 4 ] + 3H 2 при сплавлении с образованием алюминатов: 2Al + 6KOH = 2KAlO 2 + 2K 2 O + 3H 2.
Слайд 38
38 Гидроксид алюминия (А l (ОН) 3 ) Полимерное соединение. Получаемый по обменной реакции гидроксид – студенистый белый осадок. А l 3+ + 3ОН - = А l (ОН) 3 Состав и структура осадка А1 2 О 3 n Н 2 О существенно зависят от условий получения и хранения.
Слайд 39
39 Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
Слайд 40
Современный метод получения алюминия Современный метод получения заключается в растворении оксида алюминия в расплаве криолита (гексафтороалюминат натрия Na 3 [AlF 6 ] ) с последующим электролизом с использованием коксовых или графитовых электродов.
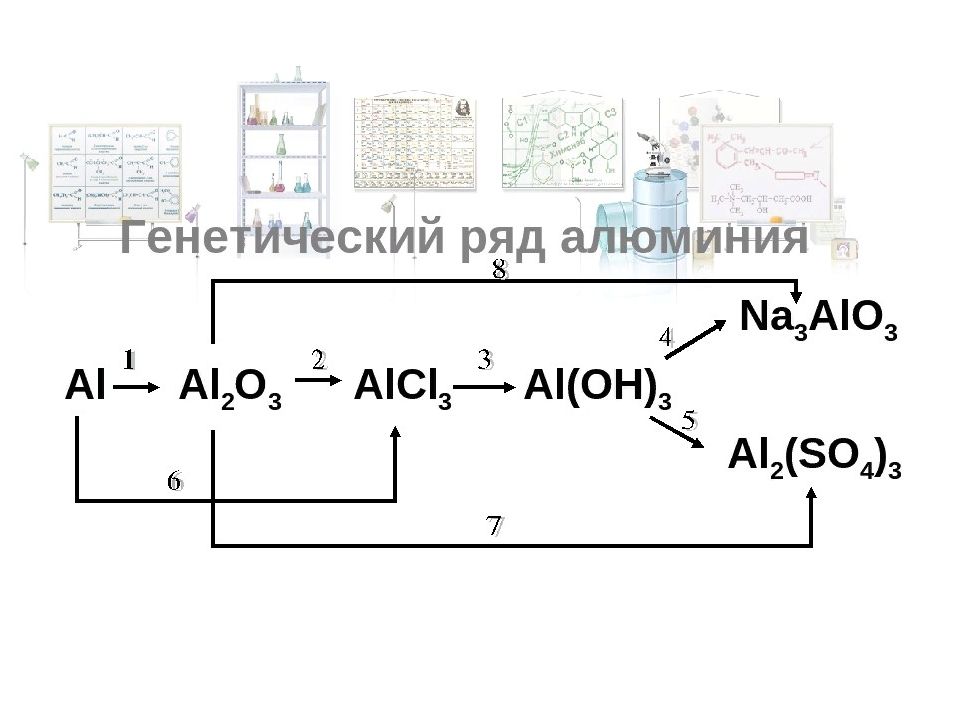
Слайд 41: Химические свойства гидроксида алюминия
1. Термическое разложение гидроксидов 2. Растворение в щелочах 3. Сплавление со щелочами
Слайд 42
ПРИМЕНЕНИЕ АЛЮМИНИЯ В Авиации Военная промышленность В Космической технике В Электротехнике В Судостроении В Строительстве В Автотранспорте В быту
Слайд 43: Использование соединений алюминия в медицине
АЛМАГЕЛЬ МААЛОКС Использование соединений алюминия в медицине алюминия гидроксид + магния гидроксид