Слайд 2: НЕМЕТАЛЛЫ - ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ,У КОТОРЫХ НА ПОСЛЕДНЕМ ЭНЕРГИТИЧЕСКОМ УРОВНЕ НАХОДИТСЯ ОТ 4 ДО 8 ЭЛЕКТРОНОВ
СЛОВАРЬ
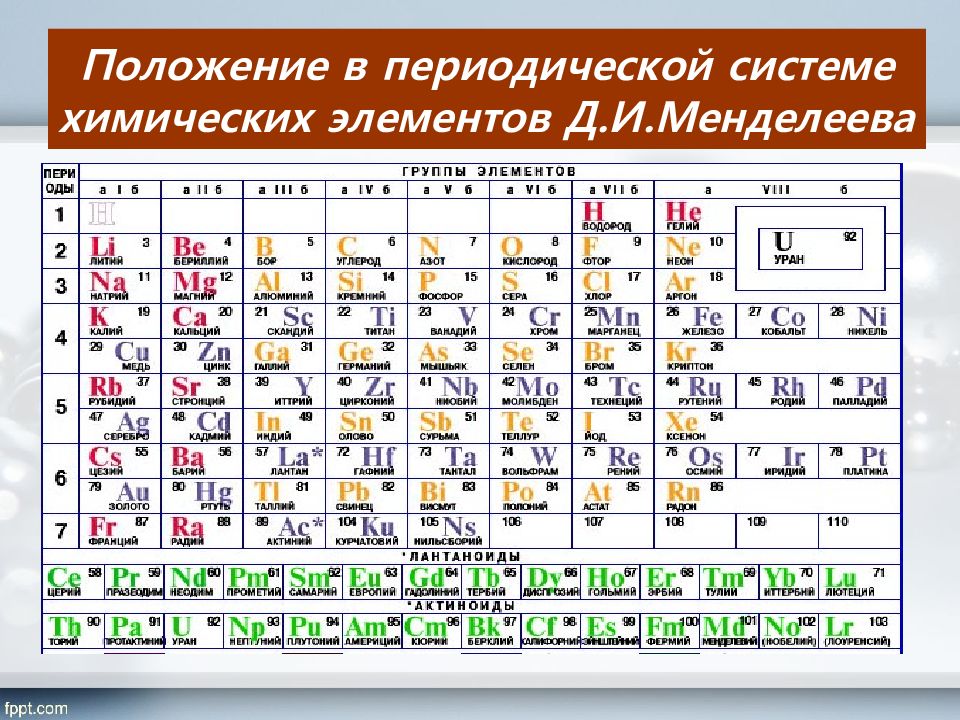
Слайд 3
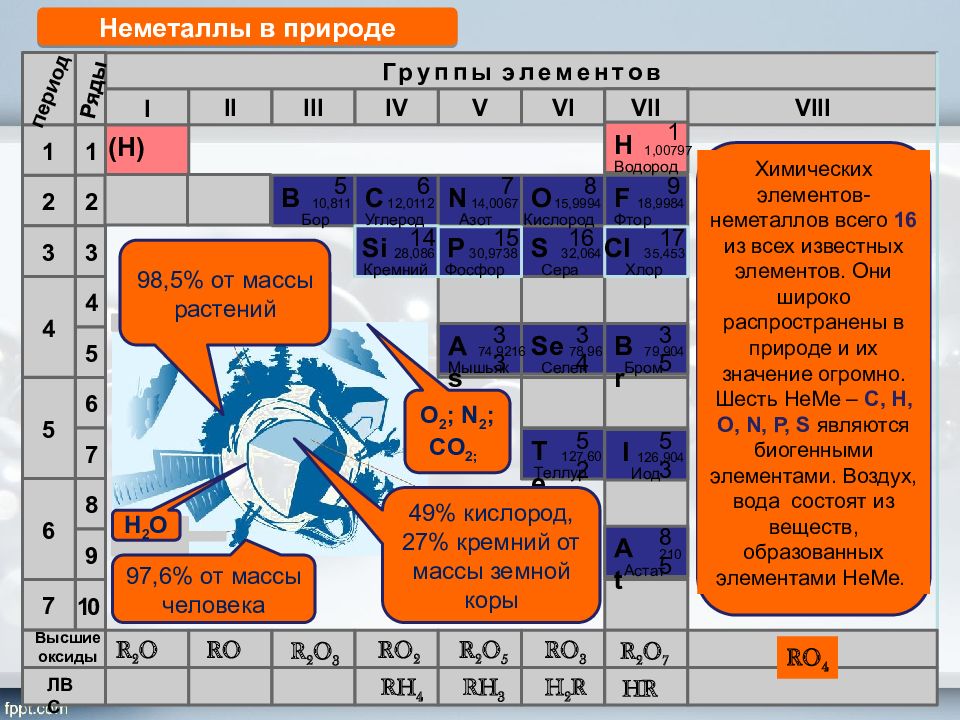
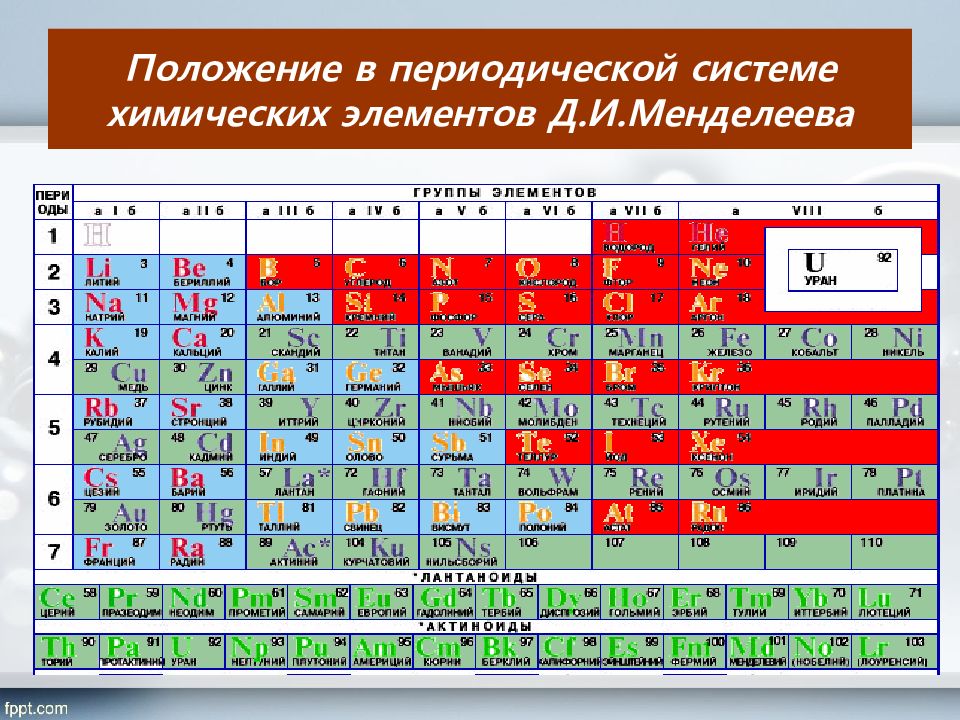
Периоды 2 1 3 4 5 6 7 1 2 8 4 3 9 5 6 7 II VI V III IV VIII Группы элементов VII Si 14 28,086 Кремний 30,9738 Р 1 5 Фосфор S 32,064 Сера 16 Cl 17 35,453 Хлор I 10 Ряды ( H ) N 15,9994 18,9984 С 12,0112 6 Бор 10,811 Углерод 5 В F 14,0067 Азот 7 8 O Кислород 9 Фтор Br 79,904 Бром 35 Н 1,00797 Водород 1 I 126,904 Иод 53 Se 78,96 Селен 34 At 210 Астат 85 Te 127,60 Теллур 52 As 74,9216 Мышьяк 33 R 2 O RO R 2 O 3 RO 2 R 2 O 5 RO 3 R 2 O 7 RH 4 RH 3 H 2 R HR Высшие оксиды ЛВС Неметаллы в природе 98,5% от массы растений 97,6% от массы человека 49% кислород, 27% кремний от массы земной коры RO 4 Химических элементов-неметаллов всего 16 из всех известных элементов. Они широко распространены в природе и их значение огромно. Шесть НеМе – С, Н, О, N, P, S являются биогенными элементами. Воздух, вода состоят из веществ, образованных элементами НеМе. O 2 ; N 2 ; CO 2; Н 2 О период
Слайд 8: Особенности атомного строения неметаллов
Небольшой атомный радиус На внешнем уровне 4-8 электронов Располагаются только в главных подгруппах Характерно высокое значение ЭО
Слайд 9: Электроотрицательность – это свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары (мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства)
H Si P C S Br Cl N O F у с и л е н и е ЭО
Слайд 11
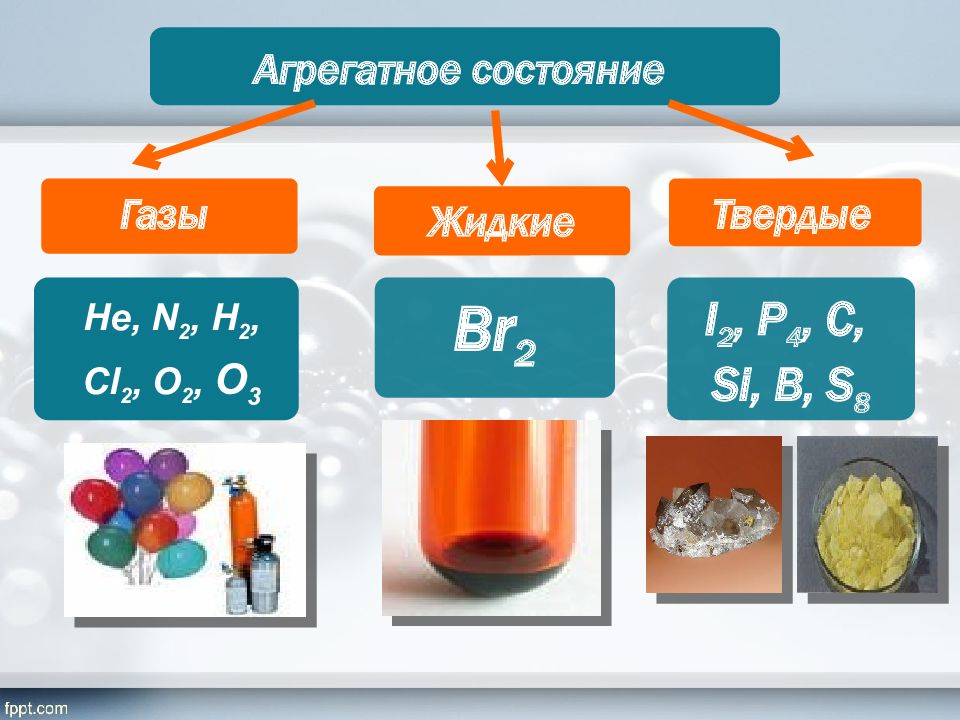
Агрегатное состояние Газы Не, N 2, Н 2, Cl 2, O 2, O 3 Жидкие Твердые Br 2 I 2, P 4, C, Si, B, S 8
Слайд 12: Цвет неметаллов
КРАСНЫЙ ЖЕЛТЫЙ ФИОЛЕТОВЫЙ ФОСФОР СЕРА ЙОД БЕСЦВЕТНЫЙ УГЛЕРОД
Слайд 14
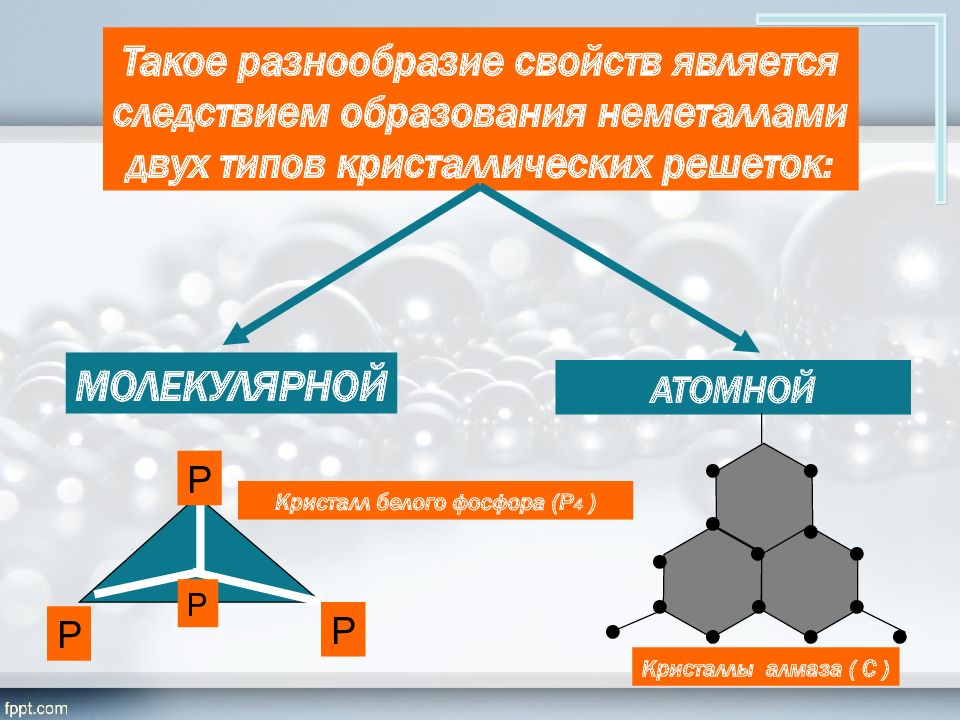
Такое разнообразие свойств является следствием образования неметаллами двух типов кристаллических решеток: МОЛЕКУЛЯРНОЙ АТОМНОЙ Р Р Р Кристалл белого фосфора (Р 4 ) ● Кристаллы алмаза ( С ) ● ● ● ● ● ● ● ● ● ● ● ● ● ● Р
Слайд 15
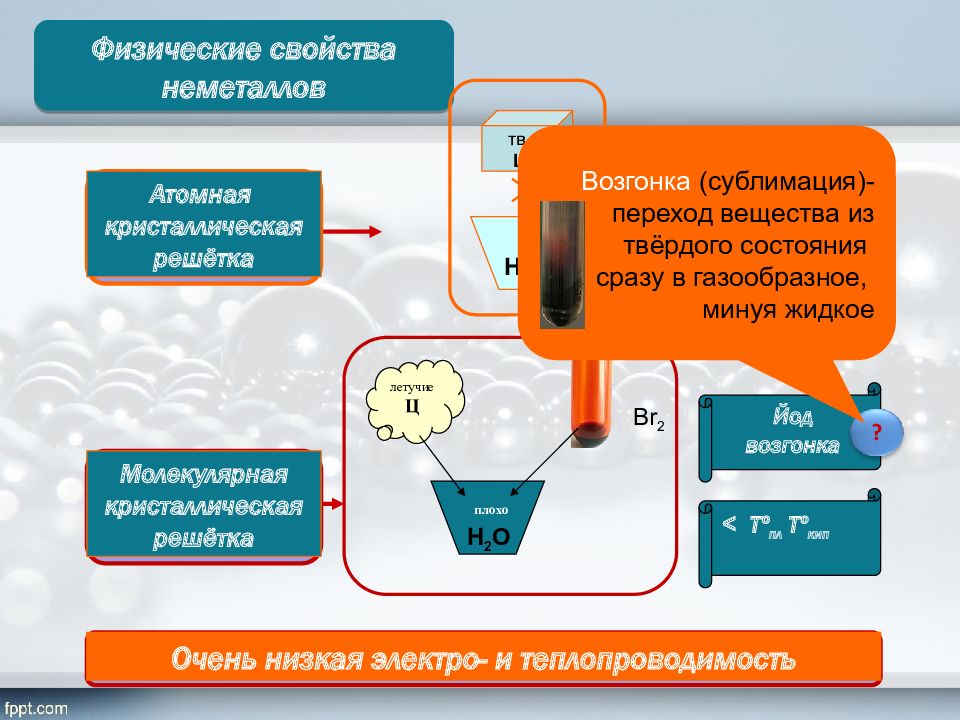
Физические свойства неметаллов > T º пл T º кип < T º пл T º кип Атомная кристаллическая решётка Молекулярная кристаллическая решётка тв. Ц летучие Ц плохо Br 2 Очень низкая электро- и теплопроводимость Йод возгонка ? Н 2 О Н 2 О Возгонка (сублимация)-переход вещества из твёрдого состояния сразу в газообразное, минуя жидкое
Слайд 16
Аллотро́пия (от др -греч. α λλος — «другой», τρο πος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм. словарь
Слайд 17: Причины аллотропии:
Разные типы кристаллических решеток (белый фосфор Р 4 – молекулярная, красный фосфор Р – атомная). Разная структура кристаллической решетки (алмаз – тетраэдрическая, графит – слоистая). Разный состав молекул аллотропных модификаций (О 2 и О 3 ).
Слайд 18
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропных модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор.
Слайд 19
Ромбическая (a - сера) - S 8 t° пл. = 113°C; ρ = 2,07 г/см 3. Наиболее устойчивая модификация. Моноклинная (b - сера) - S 8 темно-желтые иглы, t° пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую. Пластическая S n коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.
Последний слайд презентации: ОБЩАЯ ХАРАКТЕРИСТИКА НЕМЕТАЛЛОВ
Кислород- газ, без цвета, вкуса и запаха, плохо растворим в воде, в жидком состоянии светло-голубой, в твердом – синий, необходим для жизни. Озон - светло-синий газ, темно-голубая жидкость, в твердом состоянии темно-фиолетовый, имеет сильный запах, в 10 раз лучше, чем кислород, растворим в воде.