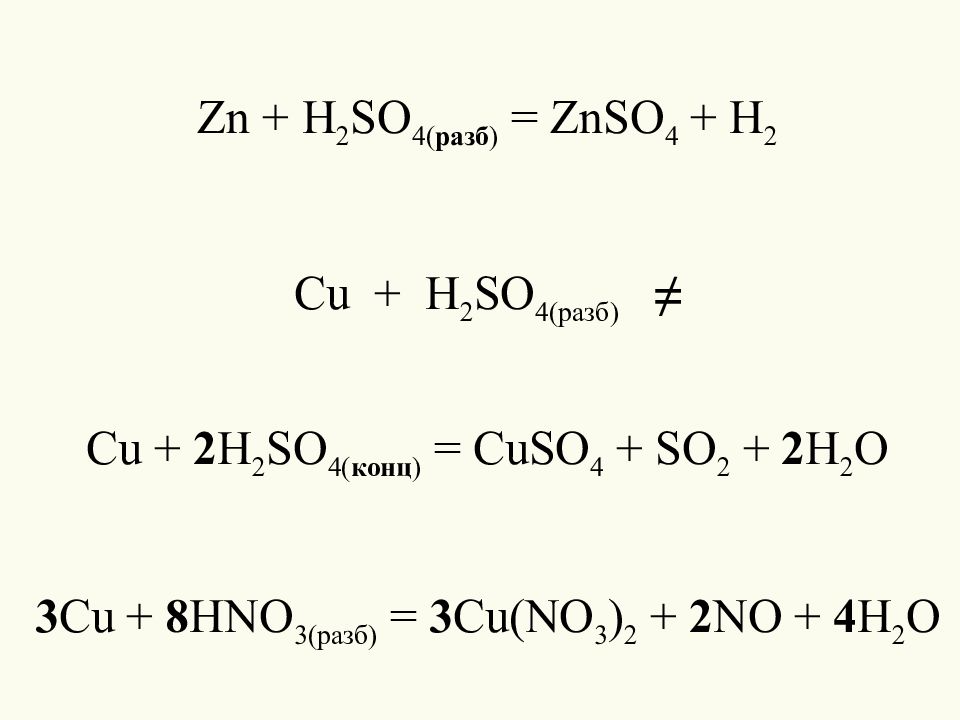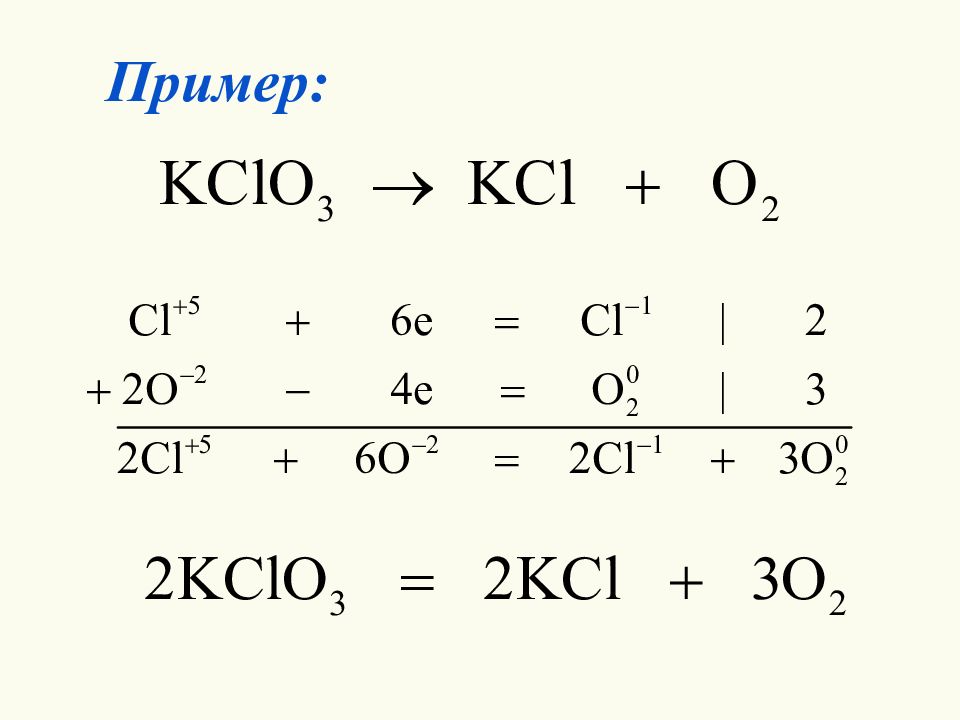Слайд 2: Классификация химических реакций
По числу и составу исходных веществ и продуктов реакции различают: – реакции присоединения NH 3 + HCl NH 4 Cl – реакции разложения 2 Cu ( NO 3 ) 2 2 CuO + 4 NO 2 + O 2 Cu ( OH ) 2 CuO + H 2 O – реакции обмена AgNO 3 + KCl AgCl + KNO 3 – реакции замещения 2 AgNO 3 + Cu 2 Ag + Cu ( NO 3 ) 2 По степени окисления реакции делят на: реакции без изменения степени окисления; реакции с изменением степени окисления.
Слайд 3
Степень окисления – условный заряд элемента в соединении, вызванный смещением валентных электронов к более электроотрица-тельному атому, или заряд иона элемента, вычисленный исходя из предположения, что молекула состоит только из ионов. Следует различать понятия « степень окисления » и « валентность ».
Слайд 4
Валентность – это свойство атомов присоединять или замещать определенное число атомов другого элемента. Количественно валентность определяется числом химических связей, образованных атомом.
Слайд 5
Окислительно - восстановительные реакции (ОВР) – химические реакции, при протекании которых изменяются степени окисления одного или нескольких элементов, входящих в состав реагирующих веществ.
Слайд 6: Любая ОВР состоит из процессов окисления и восстановления
Окисление – процесс отдачи частицей электронов. Частица (атом, молекула, ион), которая отдает электроны, называется восстановителем. ! !!
Слайд 7
Степень окисления атома - восстановителя повышается : Mg 0 – 2e – Mg +2 восстановитель ( окисляется )
Слайд 8: Важнейшие восстановители
Металлы в свободном состоянии : Mg, Fe, Cu и др. Соединения, содержащие элементы в их минимальной степени окисления : H 2 S, K Cl, N H 3 –2 –1 –3
Слайд 9
Восстановление – процесс присоединения электронов. Частица (атом, молекула, ион), которая присоединяет электроны, называется окислителем.
Слайд 10
Степень окисления атома - окислителя понижается : O 0 2 + 4 e – 2 O –2 окислитель ( восстанавливается )
Слайд 11: Важнейшие окислители
Простые вещества (образованы элементами VI -VII групп периодичес - кой системы) : O 2, F 2, Cl 2 Соединения, содержащие элементы в мак- симально положительной степени окисления : K Mn O 4, K 2 Cr 2 O 7, H N O 3, H 2 S O 4 ( конц.) +7 +6 +5 +6
Слайд 12
Атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть как окислителями, так и восстановителями, т.е. проявляют ОВ двойственность: Cl 2, S O 2, S O 3 2-, N O 2 +4 0 +4 +4
Слайд 13: Например:
H 2 S O 4 – окислитель (степень окисления серы +6 – высшая ) H 2 S O 3 – и окислитель, и восстановитель ( степень окисления серы +4 – промежуточная ) H 2 S – восстановитель (степень окисления серы –2 – низшая ).
Слайд 14
!!!ВНИМАНИЕ!!! Окислитель + ē, степень окисления ↓ Воссстановитель – ē, степень окисления ↑
Слайд 15: Классификация ОВР
1. Межмолекулярные: атомы окислителя и восстановителя находятся в составе разных молекул: 2Na I + Cl 2 = 2Na Cl + I 2 в-ль ок-ль 0 –1 0 –1
Слайд 16
2. Внутримолекулярные : окислитель и восстановитель в виде атомов разных элементов входят в состав одной и той же молекулы: 2 K I O 3 = 2K I + 3 O 2 ок-ль в-ль +5 0 –1 –2
Слайд 17
3. Реакции диспропорционирования : атомы одного и того же элемента в промежуточной степени окисления и окисляются (повышают степень окисления), и восстанавливаются (понижают степень окисления): Cl 2 + 2KOH = K Cl + K Cl O + H 2 O и ок-ль, и в-ль +1 0 –1
Слайд 18
На протекание ОВР могут оказывать воздействие следующие факторы : природа окислителя и восст-ля концентрация окислителя температура характер среды (кислая, нейтральная или щелочная).
Слайд 19
Zn + H 2 SO 4( разб ) = ZnSO 4 + H 2 Cu + H 2 SO 4( разб ) ≠ Cu + 2 H 2 SO 4( конц ) = CuSO 4 + SO 2 + 2 H 2 O 3 Cu + 8 HNO 3(p азб ) = 3 Cu(NO 3 ) 2 + 2 NO + 4 H 2 O
Слайд 20
Для составления полных молеку-лярных уравнений ОВР использу-ются два метода: метод электронного баланса ; метод ионно-электронного баланса.
Слайд 21
Метод электронного баланса – метод нахождения коэффициентов в уравнениях ОВР, при котором рассматривается обмен электронами между атомами, изменяющими свою степень окисления. Число электронов, отданных восста-новителем, равно числу электронов, полученных окислителем.
Слайд 23
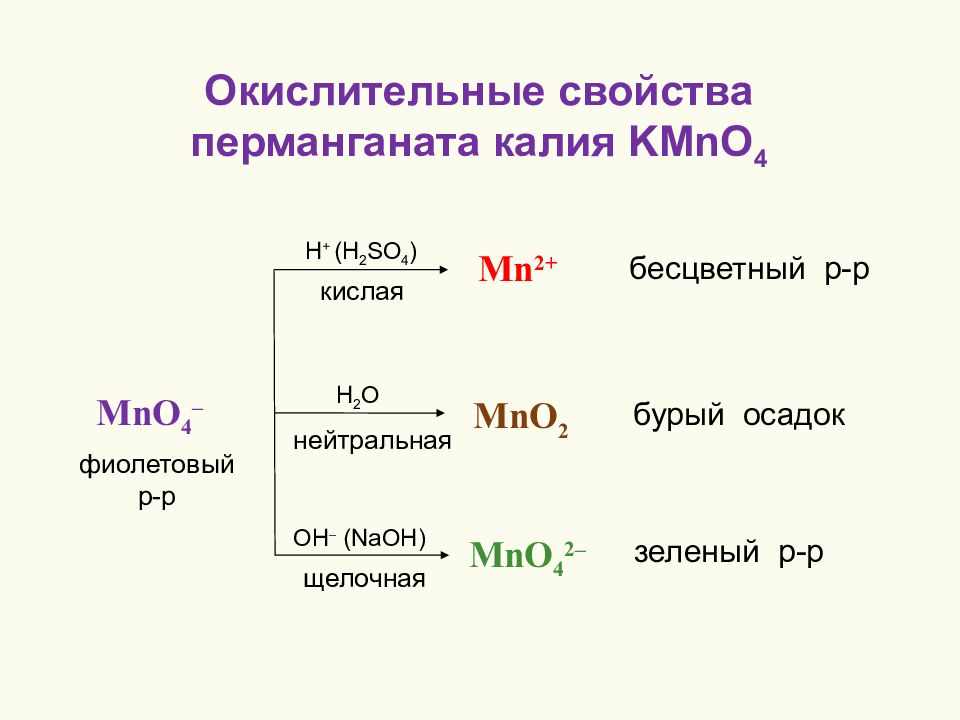
Окислительные свойства перманганата калия KMnO 4 Mn 2+ H + (H 2 SO 4 ) кислая бесцветный р-р OH – (NaOH) щелочная зеленый р-р H 2 O нейтральная бурый осадок MnO 4 – MnO 4 2– MnO 2 фиолетовый р-р