Первый слайд презентации: Презентация на тему: «Периодический закон и строение атома»
Масленников Иван Студент группы 214А
Слайд 2: Открытие Периодического закона
Одной из важнейших проблем теоретической химии XIX века была проблема систематизации химических элементов, число которых постоянно росло. Со времён античности и средних веков были известны 14 элементов, в XVIII веке к ним добавилось 20 новых элементов; к 1860 году число известных элементов возросло до шестидесяти. Важнейший вклад в систематизацию элементов внёс русский химик Дмитрий Иванович Менделеев. Дмитрий Иванович Менделеев смог найти объективную основу для классификации элементов – единственную достаточно достоверно известную тогда характеристику элемента – атомную массу (по терминологии того времени «атомный вес»).
Слайд 3
Расположив известные в то время 63 элемента в порядке возрастания их атомных масс, Менделеев обратил внимание на то, что в таком ряду через определенное число элементов их свойства периодически повторяются. Так, в рядах элементов обнаруживалось сходство между элементами. Расположив столбцами группы элементов, обнаруживающие сходство друг с другом, учитывая при этом не только физические и химические свойства соответствующих простых веществ, но также формулы их оксидов, гидридов и других соединений, Менделеев получил таблицу, выражающую периодичность изменения свойств элементов и их соединений – периодическую таблицу, в которой каждый элемент занимает определенное место.
Слайд 4
В 1871 году Д.И. Менделеев обнаружил фундаментальный закон природы, который теперь известен как Периодический закон. Согласно первоначальной формулировке этого закона, свойства элементов, а также свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины атомных масс элементов. С момента появления Периодического закона химия перестала быть описательной наукой. Закон позволил вести целенаправленный поиск новых, еще не открытых элементов. Атомные массы многих элементов, определенные до этого недостаточно точно, подверглись проверке и уточнению именно потому, что их ошибочные значения вступали в противоречие с Периодическим законом.
Слайд 5
На основе периодического закона Менделеев смог указать в системе места для еще неизвестных тогда 12 элементов, а также описать физические и химические свойства образуемых ими простых веществ и соединений. Еще при жизни Менделеева были открыты галлий, скандий и германий, свойства которых с большой точностью совпали с предсказанием Менделеева. Также на основе периодического закона Менделеевым были исправлены атомные массы некоторых элементов, например бериллия. С 1894 по 1898 год периодическая система пополнилась инертными газами: гелий, неон, аргон, криптон и ксенон. В настоящее время известно 118 химических элементов. Последние элементы получены в количестве всего нескольких атомов и практического значения не имеют. Тем не менее, периодическая система может быть расширена и дальше.
Слайд 7: Строение атома. Современная формулировка Периодического закона
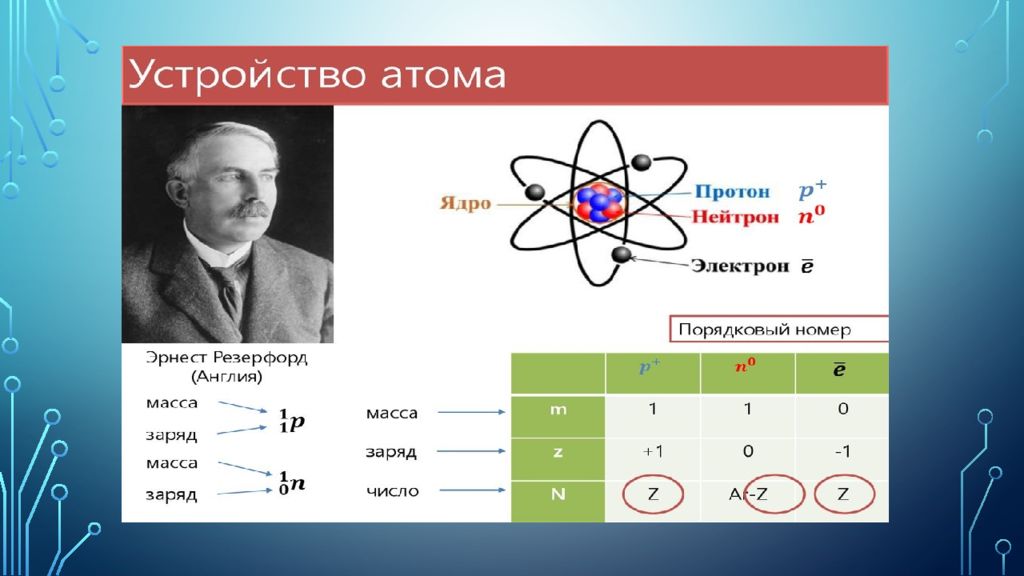
Открытие периодического закона стало предпосылкой к созданию в XX в. теории строения атома. В 1911 г. английский физик Эрнест Резерфорд предложил ядерную модель атома, согласно которой атом состоит из сравнительно небольшого положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и расположенных вокруг ядра электронов, составляющих электронную оболочку атома, которая занимает практически весь его объем. Были определены масса покоя и заряд электрона. Атом в целом электронейтрален, поскольку положительный заряд ядра компенсируется отрицательным зарядом эквивалентного числа электронов.
Слайд 8
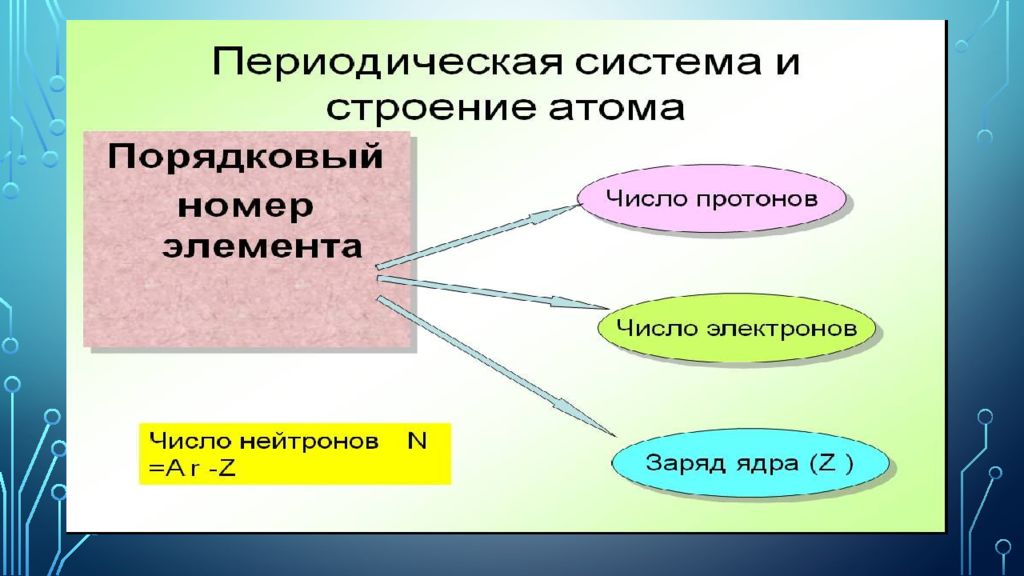
Позже, в 1913 г. английский физик Генри Мозли установил, что заряд ядра численно равен порядковому номеру элемента в периодической системе. Таким образом, заряд ядра атома – главная характеристика химического элемента. Химический элемент – это множество атомов с одинаковым зарядом ядра. Отсюда следует современная формулировка периодического закона: свойства элементов, а также свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядер их атомов.
Слайд 12
Протон- (от др.-греч. πρῶτος «первый»)— одна из трёх (вместе с нейтроном и электроном ) элементарных частиц, из которых построено обычное вещество. Протоны входят в состав атомных ядер ; порядковый номер химического элемента в таблице Менделеева равен количеству протонов в его ядре.
Слайд 14
Нейтрон - (от лат. neuter — ни тот, ни другой) — тяжёлая элементарная частица, не имеющая электрического заряда. Нейтрон является фермионом и принадлежит к группе барионов. Нейтроны и протоны являются двумя главными компонентами атомных ядер [8] ; общее название для протонов и нейтронов — нуклоны.
Слайд 15
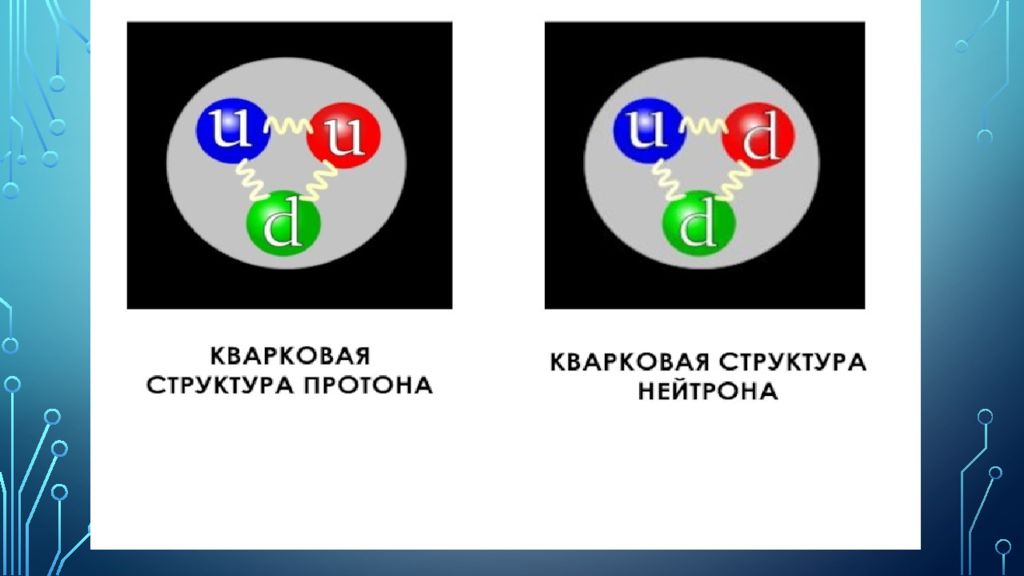
Кварк - элементарная частица и фундаментальная составляющая материи. Кварки объединяются в составные частицы, называемые адронами, наиболее стабильными из которых являются протоны и нейтроны, компоненты атомных ядер [6]. Всё обычно наблюдаемое вещество состоит из верхних кварков, нижних кварков и электронов. Из-за явления, известного как удержание цвета, кварки никогда не встречаются изолированно; их можно найти только внутри адронов, которые включают барионы (такие как протоны и нейтроны) и мезоны, или в кварк-глюонной плазме. По этой причине много информации о кварках было получено из наблюдений за адронами.
Слайд 17
Физический смысл порядкового номера, номера периода и номера группы. Атомный (порядковый) номер химического элемента равен числу протонов и электронов, заряду ядра. Номер периода равен числу заполняемых электронных слоёв. Номер группы (А) равен числу электронов на внешнем слое (валентных электронов).
Слайд 19
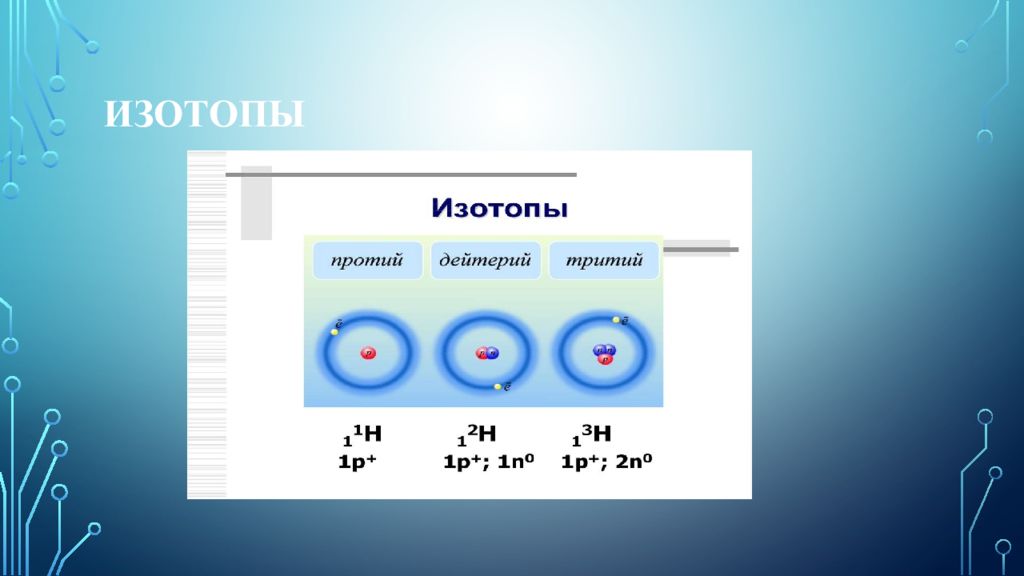
Изото́пы (от др.-греч. ἴσος «равный; одинаковый» + τόπος «место») — разновидности атомов (и ядер ) химического элемента, имеющие одинаковый атомный номер, но разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N ).
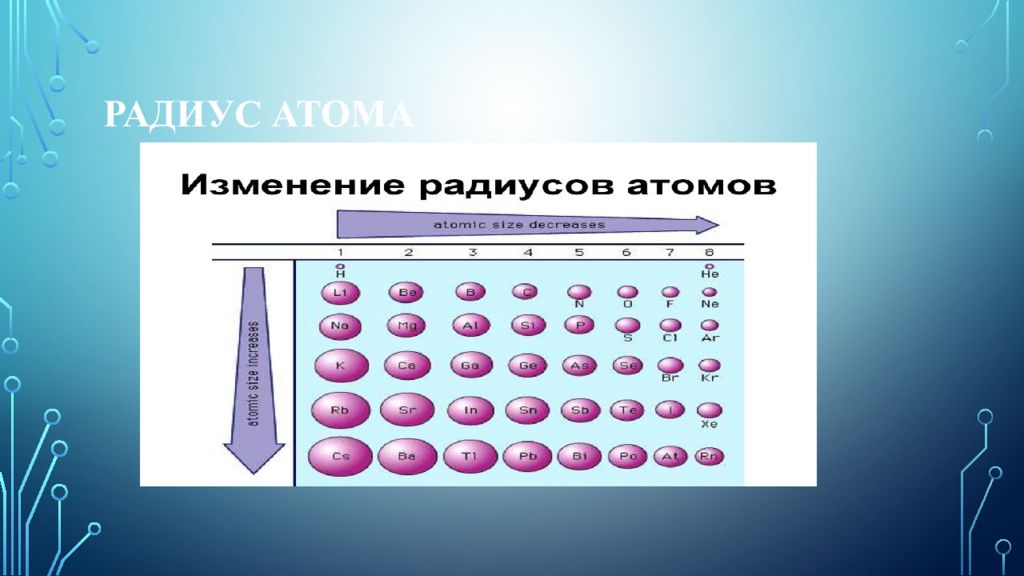
Слайд 21: РАДИУС АТОМА
Периодический характер изменения размеров атомов и ионов известен давно. Сложность здесь состоит в том, что из-за волновой природы электронного движения атомы не имеют строго определённых размеров. Так как непосредственное определение абсолютных размеров (радиусов) изолированных атомов невозможно, в данном случае часто используют их эмпирические значения. Их получают из измеренных межъядерных расстояний в кристаллах и свободных молекулах, разбивая каждое межъядерное расстояние на две части и приравнивая одну из них к радиусу первого (из двух связанных соответствующей химической связью) атома, а другую — к радиусу второго атома. При таком разделении учитывают различные факторы, включая природу химической связи, степени окисления двух связанных атомов, характер координации каждого из них и т. Д. Таким способом получают так называемые металлические, ковалентные, ионные и ван-дер-ваальсовы радиусы. Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов; их находят по межъядерным расстояниям в твёрдых или жидких веществах, где атомы находятся в непосредственной близости друг от друга (например, атомы Ar в твёрдом аргоне или атомы N из двух соседних молекул N 2 в твёрдом азоте), но не связаны между собой какой-либо химической связью.
Слайд 22
Но, очевидно, лучшим описанием эффективных размеров изолированного атома является теоретически рассчитанное положение (расстояние от ядра) главного максимума зарядовой плотности его наружных электронов. Это так называемый орбитальный радиус атома. Периодичность в изменении значений орбитальных атомных радиусов в зависимости от порядкового номера элемента проявляется довольно отчётливо (см. рис. 4), и основные моменты здесь состоят в наличии очень ярко выраженных максимумов, приходящихся на атомы щелочных металлов, и таких же минимумов, отвечающих благородным газам. Уменьшение значений орбитальных атомных радиусов при переходе от щелочного металла к соответствующему (ближайшему) благородному газу носит, за исключением ряда Li — Ne, немонотонный характер, особенно при появлении между щелочным металлом и благородным газом семейств переходных элементов (металлов) и лантаноидов или актиноидов. В больших периодах в семействах d- и f- элементов наблюдается менее резкое уменьшение радиусов, так как заполнение орбиталей электронами происходит в пред-предвнешнем слое. В подгруппах элементов радиусы атомов и однотипных ионов в общем увеличиваются.
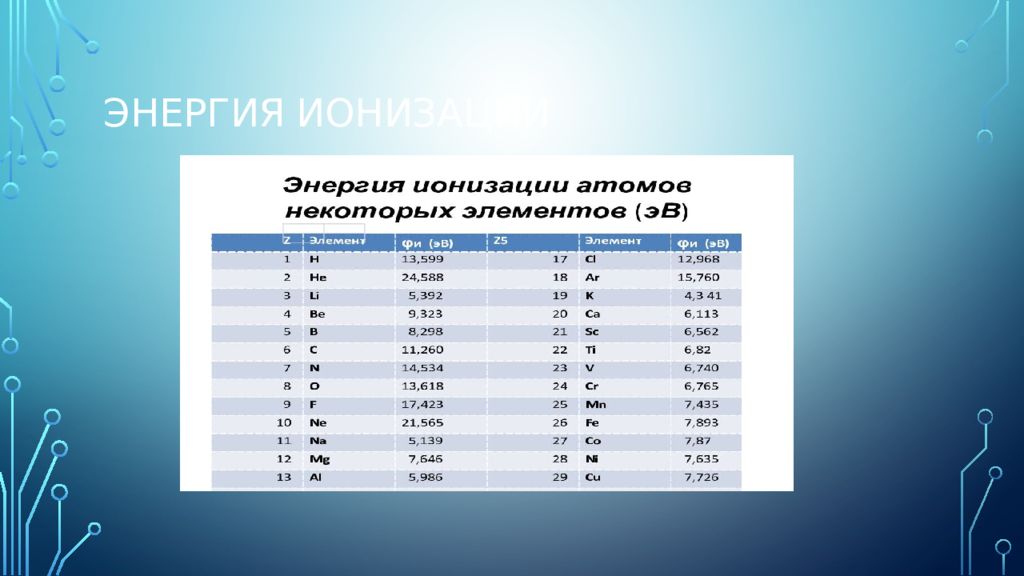
Слайд 24
Энергия ионизации (мера проявления металлических свойств) — это энергия, необходимая для отрыва электрона от атома. Чем больше электронов на внешнем электронном слое, тем больше энергия ионизации. С увеличением радиуса атома энергия ионизации уменьшается. Этим объясняется уменьшение металлических свойств в периодах слева направо и увеличение металлических свойств в группах сверху вниз. Цезий (Cs) — самый активный металл.
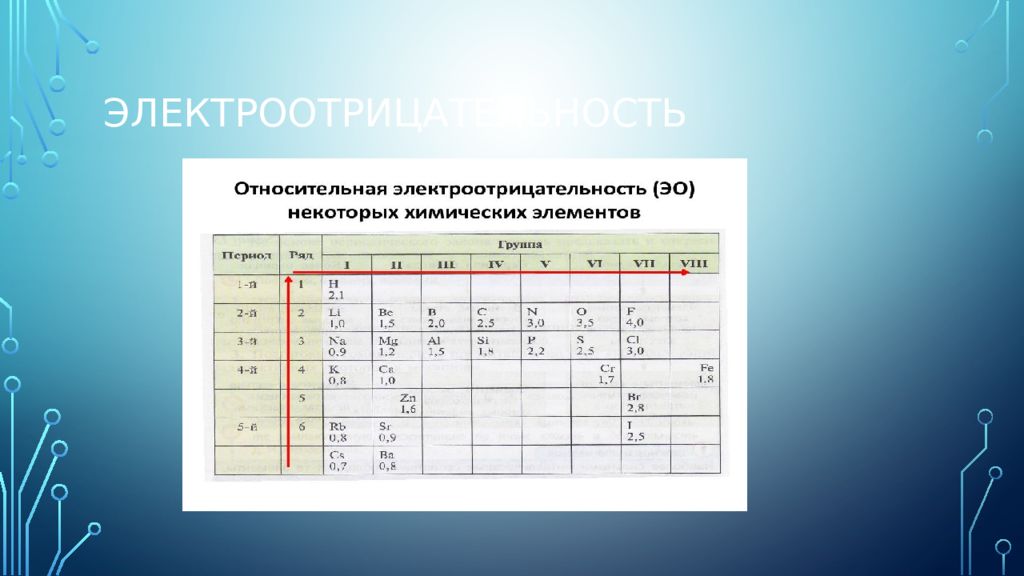
Слайд 26
Электроотрицательность — химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны от атомов других элементов. Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Значения их электро отрицательностей малы (χ ≤ 1). Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны. В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо), в каждой группе Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз). Элемент фтор F обладает наивысшей, а элемент цезий Cs - наименьшей электроотрицательностью среди элементов 1-6 периодов.