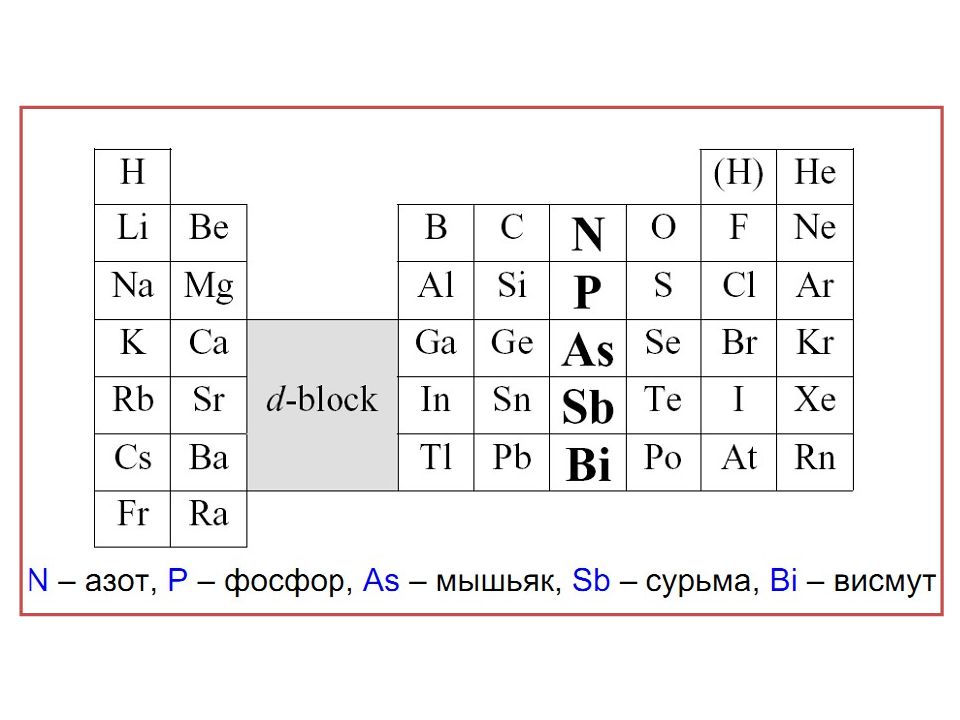
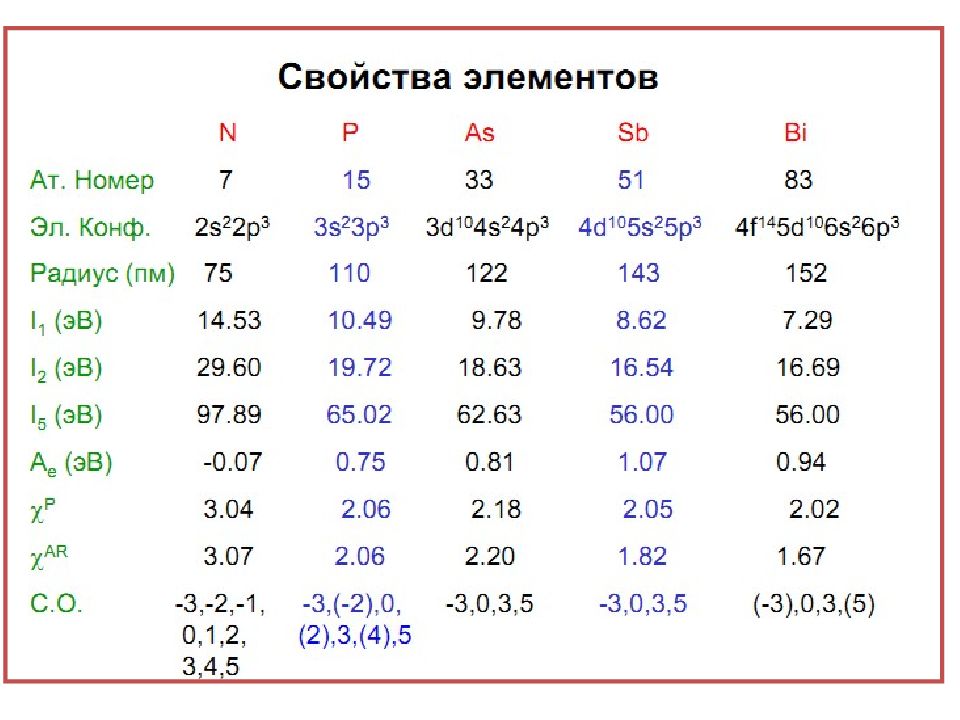
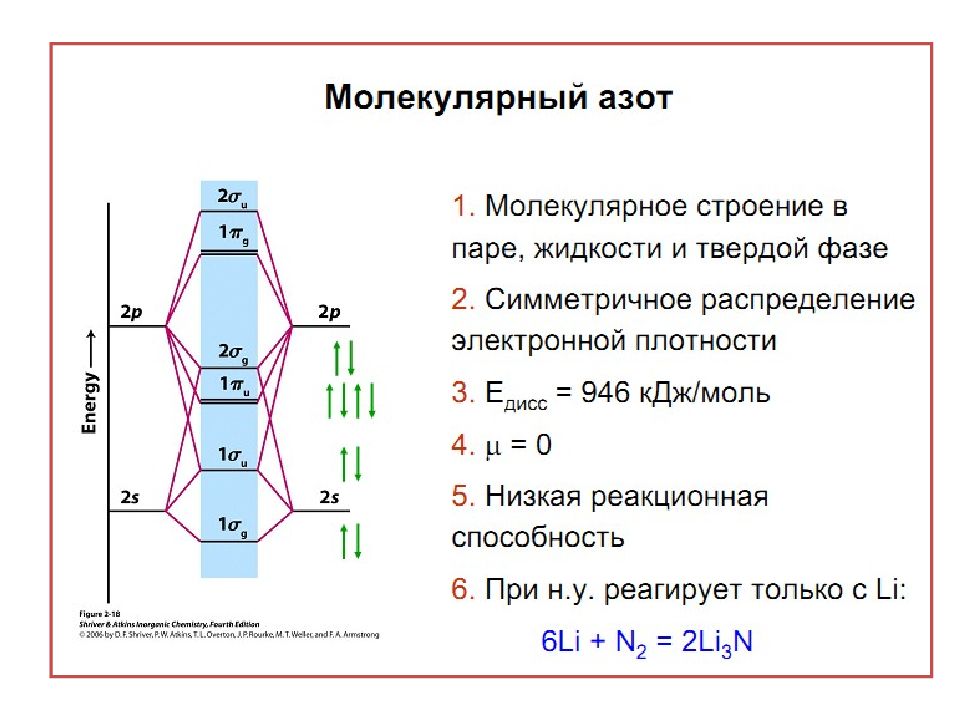
Слайд 5: Нахождение в природе
Азот простое вещество в атмосфере ( 78об.%); Природные минералы - чилийская селитра NaNO 3, калийная селитра К NO 3 ; Содержание в земной коре 2,5 10 -3 мас.% В виде аминокислот, нуклеиновых кислот в составе животных и растительных организмов.
Слайд 6: Нахождение в природе
ФОСФОР В земной коре в виде фосфатов (0,1 мас.%) Распространенные минералы: Апатиты : гидроксоапатит Фторапатит, фосфорит Нахождение в природе
Слайд 7: Нахождение в природе
Мышьяк, сурьм а и висмут встречаются в природе в основном в виде сульфидов: Аурипигмета As 2 S 3 реальгара As 4 S 4 Нахождение в природе
Слайд 8: Нахождение в природе
Сурьмяный блеск Висмутовый блеск (антимонит) Sb 2 S 3 (висмутит) Bi 2 S 3 Нахождение в природе
Слайд 12: НИТРИДЫ
Практическое значение имеют нитриды d -элементов типа М N ( TiN, CrN ), M 2 N ( Cr 2 N, Mo 2 N ) - отличаются высокой твердостью, тугоплавки, не разрушаются растворами кислот, устойчивы против окисления на воздухе
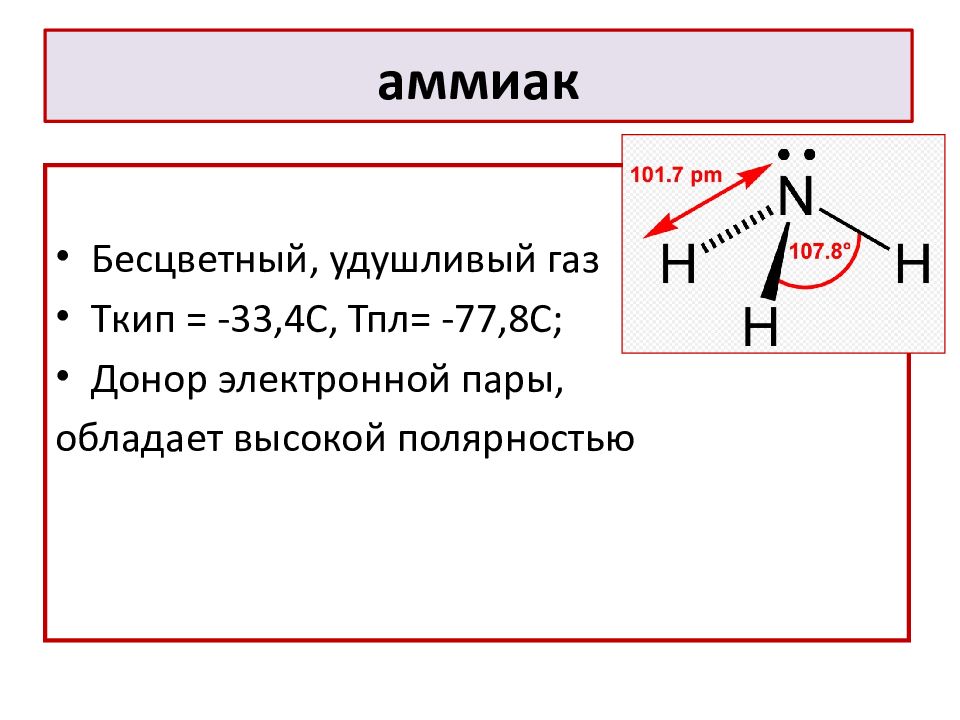
Слайд 13: аммиак
Бесцветный, удушливый газ T кип = -33,4С, Тпл= -77,8С; Донор электронной пары, обладает высокой полярностью
Слайд 15: аммиак
Хорошо растворяется в воде (20 С в 1 V H 2 O 700V NH 3 ) – образуется водородная связь между молекулами NH 3 и H 2 O. аммиак
Слайд 16: аммиак
NH 3 – восстановитель Горит голубоватым пламенем: В других условиях : аммиак (При нагревании)
Слайд 17: аммиак
Наличие свободной sp 3 – гибридной электронной пары в аммиаке обусловливает его высокие донорные свойства – способность реагировать с кислотами: А также образовывать комплексные соединения – аммиакаты : аммиак
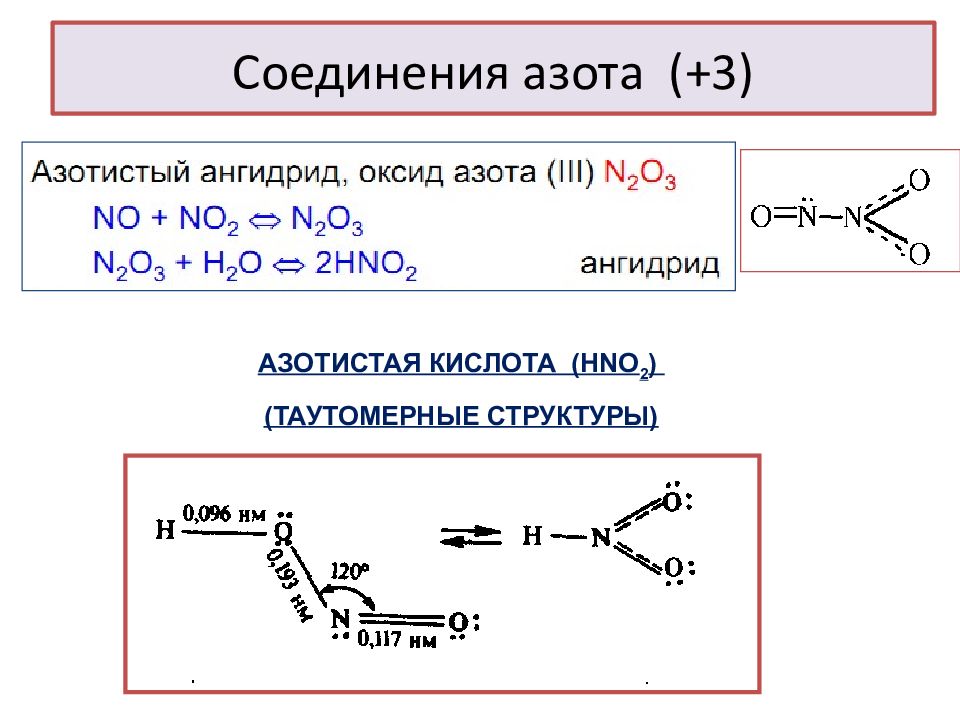
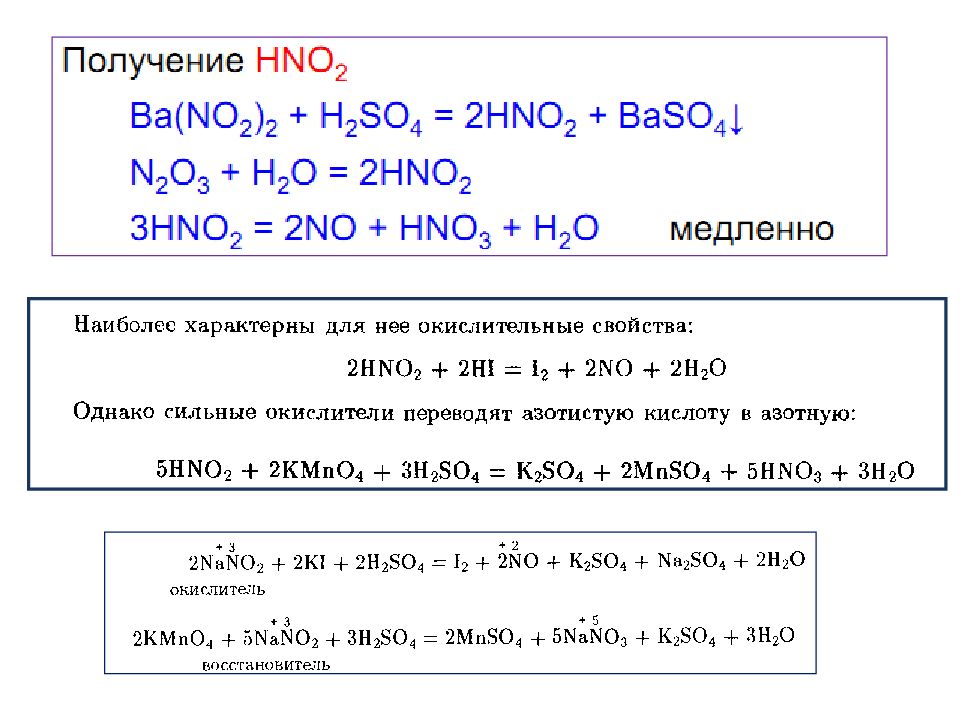
Слайд 24: Соединения азота (+3)
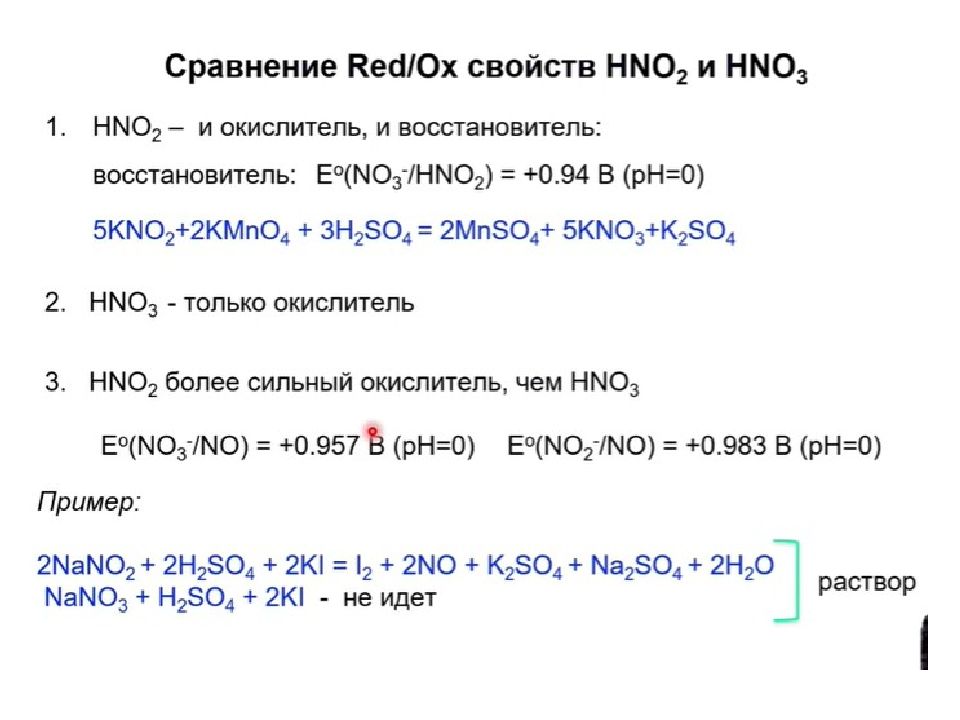
АЗОТИСТАЯ КИСЛОТА (Н NO 2 ) (ТАУТОМЕРНЫЕ СТРУКТУРЫ)
Слайд 26: Соединения азота (+5)
N 2 O 5 - Оксид азота ( V ) HN 3 – азотистоводородная кислота NON (N 2 O) – оксонитрид азота HNO 3 (азотная кислота), нитраты
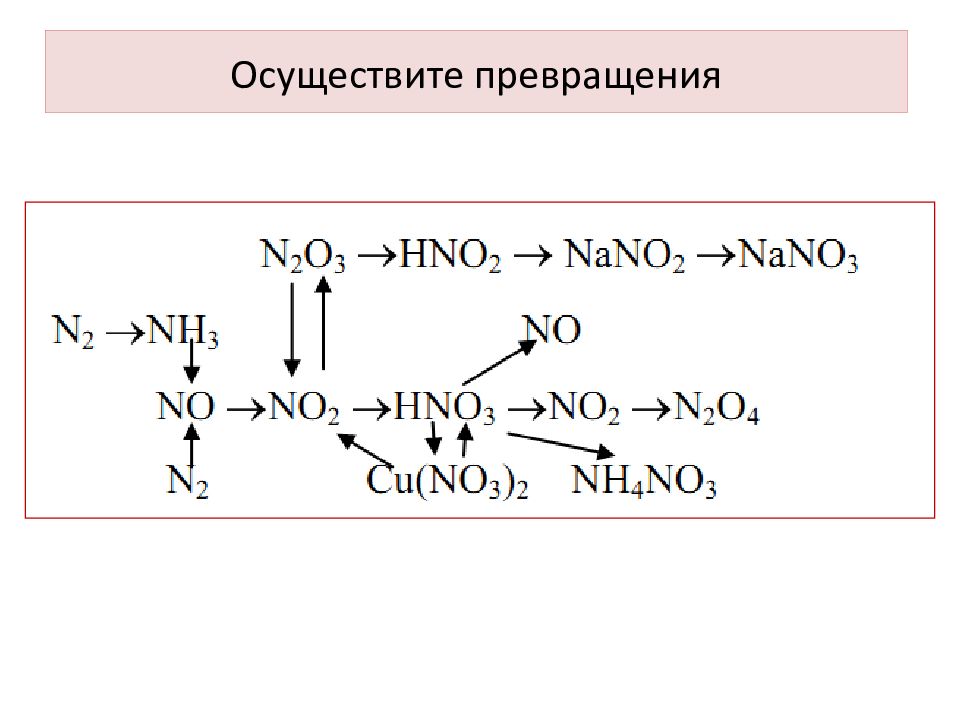
Слайд 28
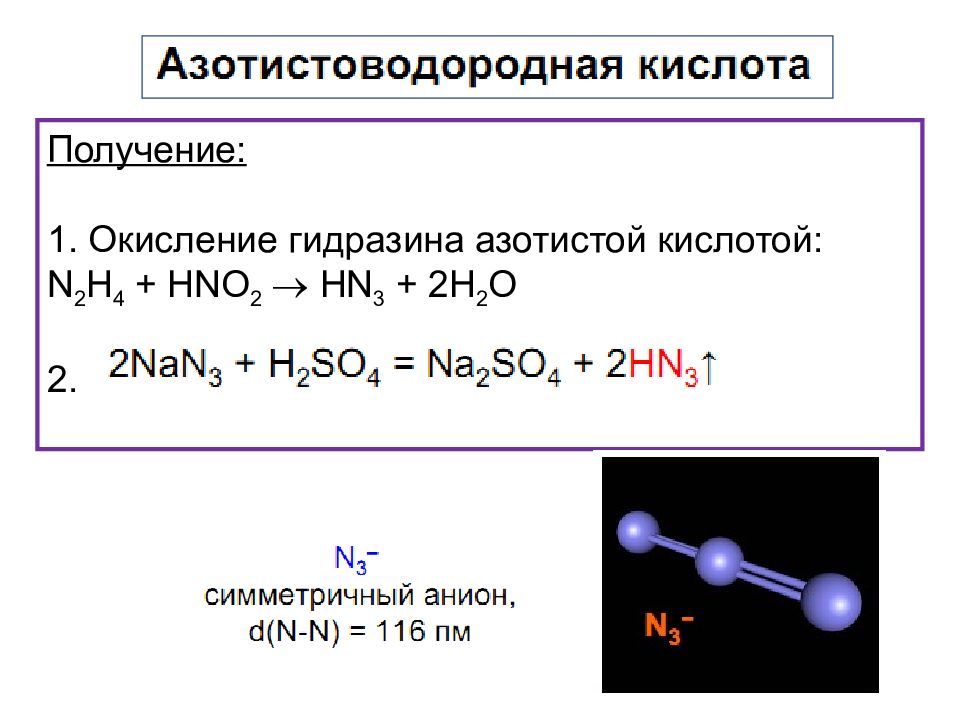
Получение: 1. Окисление гидразина азотистой кислотой: N 2 H 4 + HNO 2 Н N 3 + 2Н 2 О 2.
Слайд 29
В разбавленных растворах медленно диспропорционирует : Н N 3 + H 2 O NH 2 OH + 3 N 2 В безводном состоянии взрывается даже при сотрясении: 2Н N 3 H 2 + 3 N 2 Соли (азиды) щелочных и щелочно-земельных металлов при медленном нагревании устойчивы вплоть до плавления. Азиды тяжелых металлов легко взрываются при ударе: Pb ( N 3 ) 2 Pb +3 N 2
Слайд 30: NON (N 2 O) – оксонитрид азота ( V ), закись азота, «веселящий газ»
При нагревании N 2 O выше 700° С одновременно с реакцией разложения протекает его диспропорционирование :
Слайд 31: NON (N 2 O) – оксонитрид азота ( V ), закись азота, «веселящий газ»
Не взаимодействует с водой, формально ангидрид азотноватистой кислоты : Является окислителем (вспыхивает лучина, горит сера), восстанавливается водородом: При поджигании смеси- взрыв : Восстановительные свойства : NON (N 2 O) – оксонитрид азота ( V ), закись азота, «веселящий газ»
Слайд 32
При растворении в воде образуется азотная кислота: N 2 O 5 + H 2 O 2HNO 3
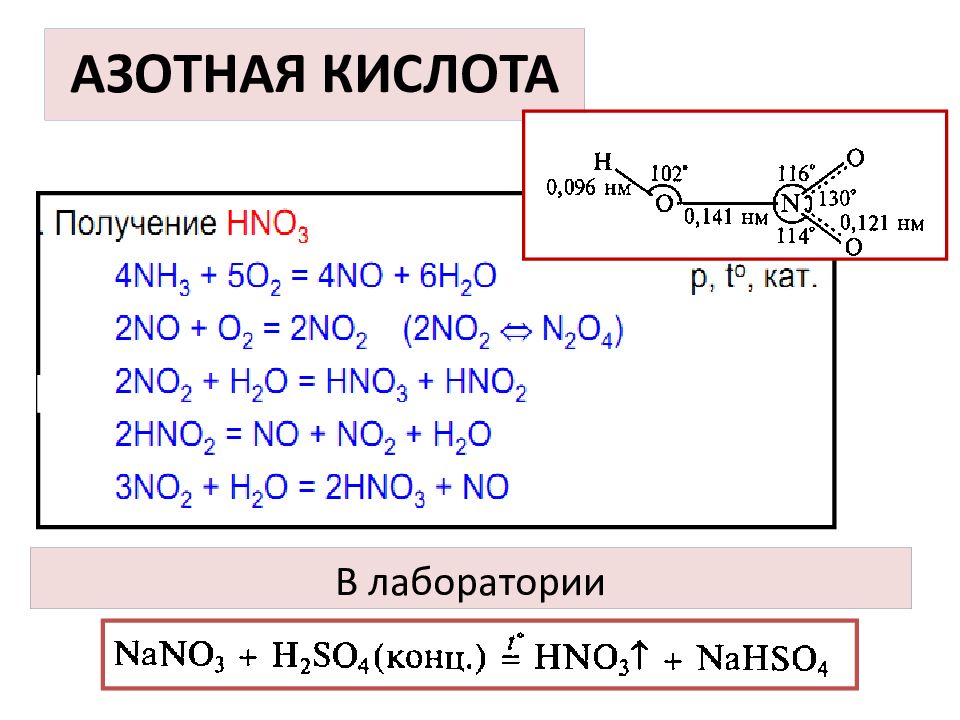
Слайд 35: АЗОТНАЯ КИСЛОТА
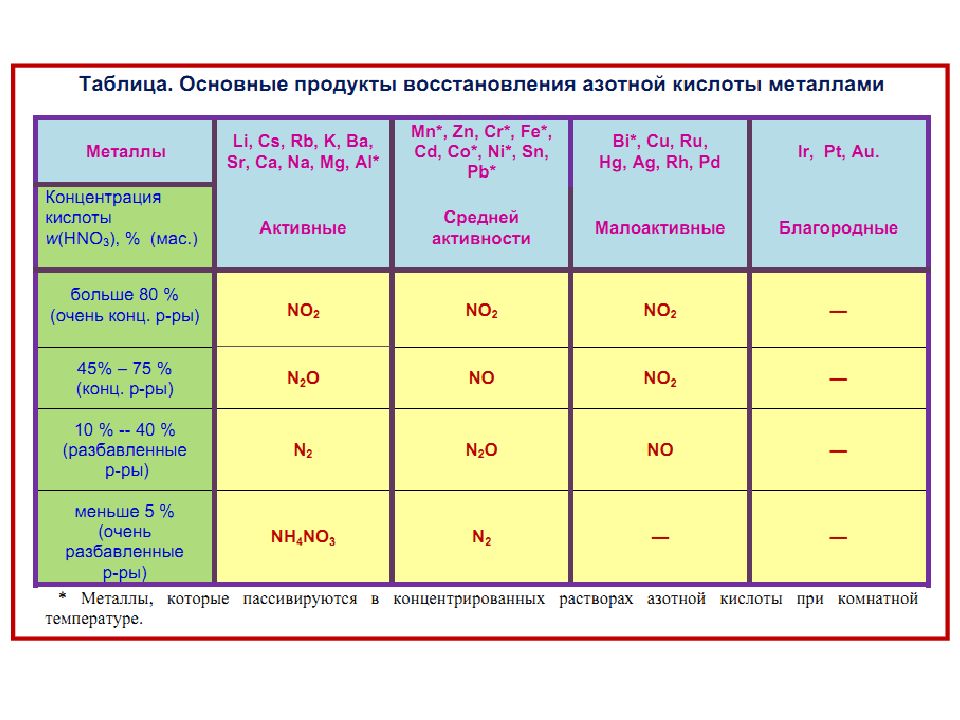
При взаимодействии азотной кислоты с металлами часто образуется сложная смесь продуктов, состав которой определяется, главным образом, природой металла и концентрацией кислоты. Чем активнее металл и чем более разбавлена кислота, тем сильнее протекает восстановление.
Слайд 36: Азотная кислота
Особенностью азотной кислоты является то, что азот, входящий в состав NO 3- имеет высшую степень окисления +5 и поэтому обладает сильными окислительными свойствами. Максимальное значение электродного потенциала для нитрат-иона равно 0,96 В, поэтому азотная кислота – более сильный окислитель, чем серная. Роль окислителя в реакциях взаимодействия металлов с азотной кислотой выполняет N 5+ Следовательно, водород H 2 никогда не выделяется при взаимодействии металлов с азотной кислотой (независимо от концентрации).
Слайд 38
Концентрированным считают раствор кислоты плотностью ρ > 1,25 кг/м 3, что соответствует концентрации > 40%. Независимо от активности металла реакция взаимодействия с HNO 3 (конц.) Реакция протекает по схеме: С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt), а ряд металлов (Al, Ti, Cr,Fe, Co, Ni) при низкой температуре пассивируются концентрированной азотной кислотой. Реакция возможна при повышении температуры.
Слайд 39
Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности металла, участвующего в реакции:
Слайд 44: Царская водка»
«Царская водка» (ранее кислоты называли водками) представляет собой смесь одного объема азотной кислоты и трех-четырех объемов концентрированной соляной кислоты, обладающую очень высокой окислительной активностью. Такая смесь способна растворять некоторые малоактивные металлы, не взаимодействующие с азотной кислотой. Среди них и «царь металлов» - золото.
Слайд 45
Такое действие «царской водки» объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила – NOCl: Хлор в момент выделения состоит из атомов. Атомарный хлор является сильнейшим окислителем, что и позволяет «царской водке» воздействовать даже на самые инертные «благородные металлы».
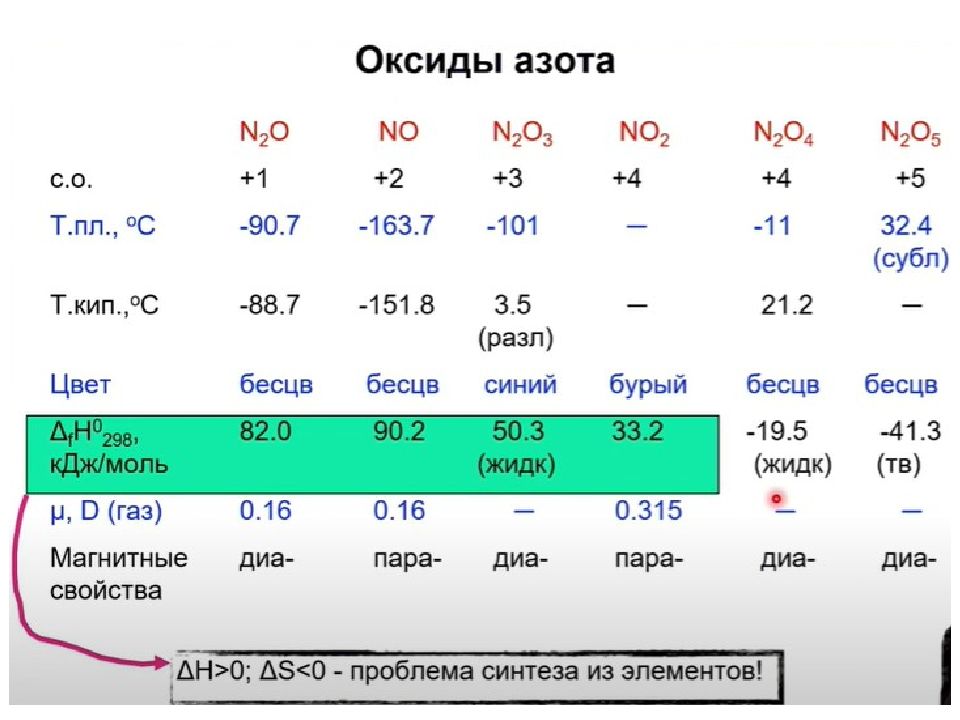
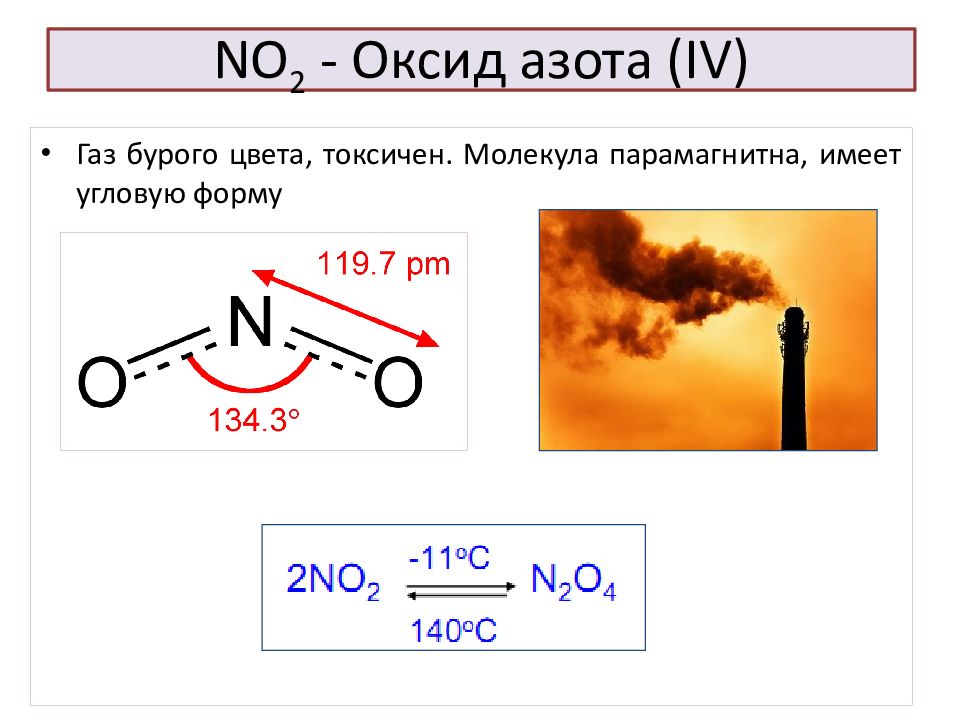
Слайд 49: NO 2 - Оксид азота ( IV )
Газ бурого цвета, токсичен. Молекула парамагнитна, имеет угловую форму
Слайд 50: Получение NO 2 :
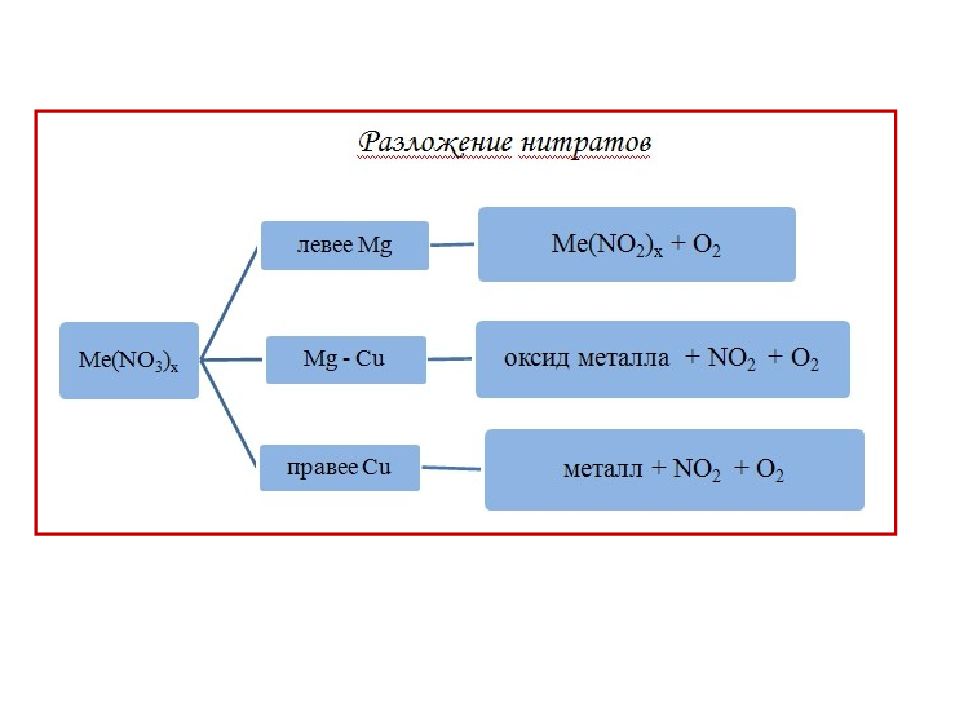
1) взаимодействие меди с горячей концентрированной азотной кислотой: 2) Термическое разложение нитратов тяжелых металлов: 3) при окислении NO кислородом:
Слайд 51
NO 2 – сильный окислитель, в его атмосфере горят многие вещества: NO 2 (мономер, димер) хорошо растворим в воде: Н NO 2 – неустойчива, при t : При пропускании смеси NO 2 и воздуха :