Первый слайд презентации: Применение Gammarus pulex в качестве тест-объекта биотестирования Выполнила: Кушниренко Д. 234М
Слайд 2: Gammarus pulex —
это мелкий ракообразный, принадлежащий к семейству гаммарида. Он широко распространен в пресноводных экосистемах Европы и Азии, обитающий в реках, ручьях и озерах. Длина тела Gammarus pulex обычно варьируется от 1 до 3 см, его тело имеет характерную вытянутую форму и покрыто жестким экзоскелетом. Этот вид играет важную роль в экосистемах, выполняя функции разложителя и являясь ключевым элементом в пищевых цепях. Самцы (15-20 мм) крупнее самок (10-15 мм). Gammarus pulex активно участвует в переработке Органического вещества, а также служит источником пищи для многих видов рыб и водоплавающих птиц. 2
Слайд 3: Общие сведения
Gammarus pulex л егко содержать и воспроизводить в лабораторных условиях; У ровень растворенного кислорода в воде является критически важным фактором для выживания этого ракообразного и составляет не менее 6 мг/л; П редпочитает нейтральные или слегка щелочные условия ( pH 6.5-8); Высокая чувствительность к широкому спектру естественных и искусственных токсикантов. Жизненный цикл: 1) Спаривание (8 дней). 2) Самка откладывает около 30 крупных темных яиц в обсемененную камеру. Развитие яиц (2-3 недели летом, 1,5 месяца зимой). 3) Из яиц выходят почти полностью развитые рачки, которые остаются в выводковой камере до первой линьки. Линька (каждые 6-7 дней летом, 16-18 дней зимой). 4) Половая зрелость (через 10 линек, примерно через 3 месяца). Молодь, вылупившаяся весной, достигает зрелости к осени. В умеренных широтах самки могут откладывать яйца несколько раз за сезон, в то время как на севере — один раз.
Слайд 4: Тест-функции Gammarus pulex как организма для биотестирования:
Выживаемость – процент особей, выживших после воздействия токсиканта. Поведенческая – оценка изменений в поведении, таких как активность, кормление и укрытие. Репродуктивная – изучение количества и жизнеспособности потомства при различной экспозиции к токсичным веществам, а также оценка времени размножения. Морфологическая – выявление физических изменений у особей Gammarus pulex под микроскопом, вызванных воздействием токсичных веществ. Биохимическая или антиоксидантная – тест на биомаркеры стресса, который заключается в измерении уровней определенных биомаркеров (например, антиоксидантных ферментов) в тканях ракообразных для определение биохимических изменений, связанных с воздействием загрязнителей. 4
Слайд 5: Оценка остроты токсичности хлорида кадмия для различных возрастных групп ракообразных Gammarus pulex, как культивируемых в лаборатории, так и собранных в полевых условиях. Использовано 20 особей Gammarus pulex из каждой возрастной группы (4,5-222,5 дней) и 20 особей из естественной среды. Ракообразные содержались в пластиковых контейнерах (0,2 литра) с нейлоновой сеткой для свободного прохождения растворов, при температуре 13 °C, корм — экскременты взрослых особей и кондиционированные листовые пластинки. После акклиматизации в резервуары добавлялись растворы хлорида кадмия в концентрациях: 0.00, 0.01, 0.03, 0.05, 0.10, 0.30 и 1.00 мг Cd /л. Смертность фиксировалась через 0.5, 1, 2, 4, 8, 12, 16 и 24 часа, а затем каждые 12 часов по отсутствию реакции на механическую стимуляцию. Результаты: • Разработан эффективный метод лабораторной культивации Gammarus pulex с выживаемостью более 70% молоди до половой зрелости за 130 дней. • Острая токсичность кадмия варьировала между возрастными группами: Молодь (1 день) показала LC50 = 0,019 мг Cd /л (в 250 раз ниже старшей группы — 4,7 мг Cd /л для 220-дневных особей)
Исследования влияния токсикантов на выживаемость
Слайд 6: Исследования влияния токсикантов на поведение
Изучение влияния сточных вод, содержащих фармацевтические и косметические продукты, на поведение пресноводного ракообразного Gammarus pulex, чтобы оценить потенциальные экологические риски. Использованы сточные воды из очистных сооружений Chickenhall WwTW и Fullerton WwTW в южной Англии. Испытуемыми стали самцы G. pulex, готовые к спариванию. Исследование охватывало два периода: первый — 1 неделя, второй — 3 недели. • Ракообразные акклиматизировались в контролируемых условиях (температура 10 ± 0.5 °C) в течение 24 часов. • Разделение на три группы: контрольная, 50% и 100% сточных вод, разведенных с родниковой водой. • Животные содержались в статических контейнерах (50 мл) с условленным кормом (листья ольхи) и фотопериодом 12:12 (свет/темнота). Поведенческие параметры: скорость кормления, фототаксис, общая активность, скорость передвижения. Использована система DanionVision™ для анализа движения раков в течение 4 минут. Результаты: Смертность и линька. Низкий уровень смертности (0-10%) и отсутствие значительных изменений в частоте линьки (p > 0.05). Общая активность. Не наблюдалось существенного влияния на питание, скорость перемещения. Значительное снижение активности наблюдалось после трех недель воздействия сточных вод, что часто ассоциируется с токсичностью, это может быть связано с сенсорными или неврологическими нарушениями или метаболическими сбоями. Фототаксис. Условия освещения оказали значительное влияние на активность амфиподов: особи были более активны при свете, чем в темноте (до 23,9% более активны). Эта поведенческая реакция, вероятно, является адаптивным механизмом для избегания хищников. 6
Слайд 7: Исследования влияния токсикантов на репродуктивные функции
Оценка влияния 17α-этил эстрадиола (ЭЭ) на репродуктивные функции и численность популяции Gammarus pulex в контролируемых лабораторных условиях. Gammarus pulex были собраны из местного ручья методом «выбивания» и акклиматизированы в лаборатории в течение 10 дней. Создано 5 групп (контрольная, контроль растворителя и 3 группы с ЭЭ на концентрациях 100 нг /л, 1 мкг/л и 10 мкг/л). Рачки содержались в аквариумах объемом 11 л при температуре 16 ± 18 °C и режиме освещения 16:8. В течение 100 дней оценивались численность популяции, соотношение полов, количество пар прекопуляций и яйцекладущих самок. Численность популяции : • При 1 мкг/л: 385 особей • При 10 мкг/л: 411 особей • Контрольная группа: 169 особей (значительное различие p = 0,018). Соотношение полов: Уровни ЭЭ (100 нг, 1 мкг и 10 мкг/л) показали соотношение самок к самцам более 2:1, значительно больше самок по сравнению с контрольной группой (p = 0.008). Яйцекладущие самки и пары прекопуляций : Количество не изменилось в зависимости от концентрации ЭЭ (p > 0,05). Вторичные половые признаки: Длина антенн и гнатоподов у самцов была больше, чем у самок (p ≤ 0,001), но различий между группами не выявлено. 7
Слайд 8: Исследования воздействия токсикантов на морфологические характеристики G. pulex
Взрослые экземпляры Gammarus pulex длиной более 9 мм из лабораторных культур. Индивидуальное размещение 10 животных в пластиковых горшках с нейлоновой сеткой, подвешенных в 2 литрах контролируемой воды или растворов токсикантов. Используемые токсиканты и их концентрации : • 3,4-дихлорбензол (3,4-DCA): 5,0 и 10 мг/л • Линдан : 10–40 мг/л • Медь: 30–90 мг/л Извлечение гепатопанкреатических цекумов с использованием микрохирургических инструментов. • Фиксация в 3% глутаральдегиде, промывание, обезвоживание и критическая сушка. • Нанесение золотого покрытия для сканирующей электронной микроскопии (JEOL JSM 5200). Анализ морфологических изменений с увеличением ×350. Оценка повреждений по: 1. Частоте морфологических особенностей в тканях. 2. Степени организации миоэпителиальной ткани (от 0 — нормальный вид до 1 — максимальная дезорганизация). *Гепатопанкреатический цекум — это анатомическая структура некоторых ракообразных, представляет собой часть пищеварительной системы, которая объединяет функции печени (гепато-) и поджелудочной железы (панкреас). 8
Слайд 9
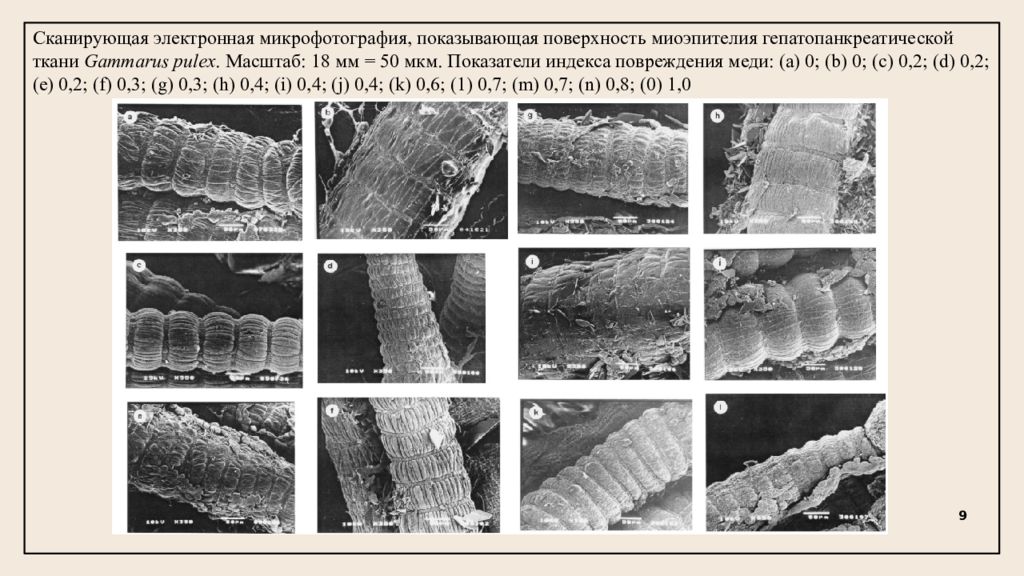
Сканирующая электронная микрофотография, показывающая поверхность миоэпителия гепатопанкреатической ткани Gammarus pulex. Масштаб: 18 мм = 50 мкм. Показатели индекса повреждения меди: (a) 0; (b) 0; (c) 0,2; (d) 0,2; (e) 0,2; (f) 0,3; (g) 0,3; (h) 0,4; (i) 0,4; (j) 0,4; (k) 0,6; (1) 0,7; (m) 0,7; (n) 0,8; (0) 1,0 9
Слайд 10
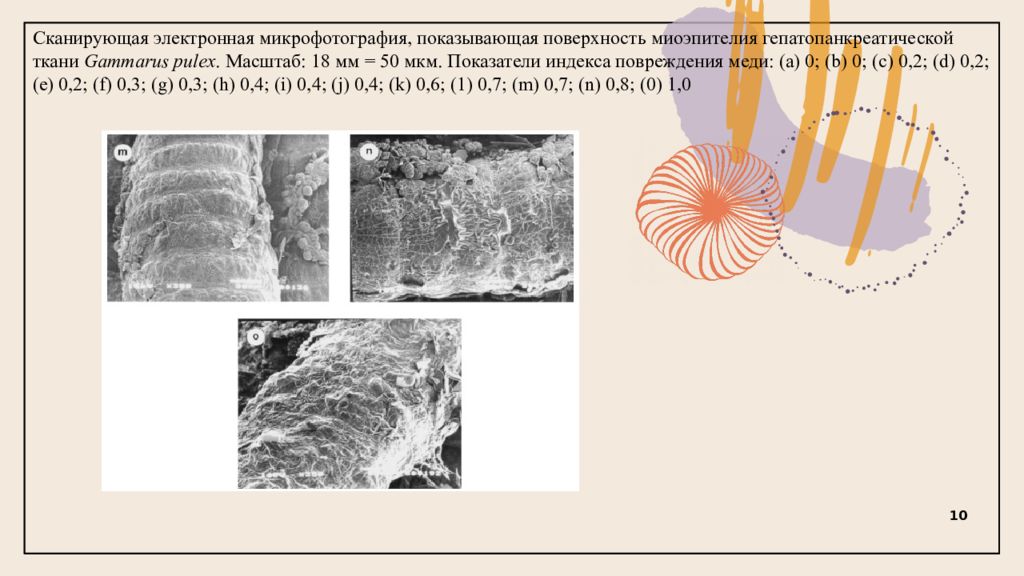
Сканирующая электронная микрофотография, показывающая поверхность миоэпителия гепатопанкреатической ткани Gammarus pulex. Масштаб: 18 мм = 50 мкм. Показатели индекса повреждения меди: (a) 0; (b) 0; (c) 0,2; (d) 0,2; (e) 0,2; (f) 0,3; (g) 0,3; (h) 0,4; (i) 0,4; (j) 0,4; (k) 0,6; (1) 0,7; (m) 0,7; (n) 0,8; (0) 1,0 10
Слайд 11: Определение реакции на окислительный стресс, вызванный наночастицами оксида алюминия (γ-Al 2 O 3 и α-Al 2 O 3 ), у Gammarus pulex
Целью этого исследования является изучение окислительного стресса, вызванного двумя отдельными формами оксида алюминия. G. pulex подвергался воздействию сублетальных концентраций наночастиц 24 и 96 часов с использованием ИФА. γ- Al 2 O 3 и α- Al 2 O 3 повышают активность супероксиддисмутазы. γ- Al 2 O 3 и α- Al 2 O 3 вызвали статистически значимые изменения в активности каталазы. ( γ за 24 часа понижалась, α за 96 ч повышался). γ- Al 2 O 3 и α- Al 2 O 3 вызывают повышение уровня глутатиона. γ- Al 2 O 3 и α- Al 2 O 3 снижают уровень тиобарбитуровой кислоты. В результате экспериментального исследования было обнаружено, что обе наночастицы влияют на окислительный стресс и антиоксидантные показатели через 96 часов по сравнению с контрольной группой.
Слайд 12: Преимущества и ограничения использования Gammarus pulex
Рачки могут реагировать на присутствие токсичных веществ изменением физиологических и поведенческих характеристик, что позволяет обнаружить загрязнение на ранних стадиях. В ысокая плотности популяции, простота идентификации вида и полового диморфизма. Gammarus pulex легко разводить и содержать в лабораторных условиях. Единственным важным условием для его культивирование является определенное содержание кислорода в воде. Скорость размножения можно назвать относительно быстрой по сравнению с другими пресноводными ракообразными. Д остигает половой зрелости в течение нескольких месяцев после рождения. М ожет производить несколько поколений в течение одного года. Этический вопрос и целесообразность. Альтернативные подходы, такие как химические тесты, позволяют проводить исследования без необходимости использования живых существ, что минимизирует потенциальные страдания животных. Также они могут быть более эффективными с точки зрения времени и ресурсов.
Последний слайд презентации: Применение Gammarus pulex в качестве тест-объекта биотестирования Выполнила:: Методические указания и протоколы
13 Стандарты ISO : ISO 16712:2005 - "Water quality — Determination of the toxicity of sediments to benthic invertebrates » ГОСТы, руководящие документы и методические указания: ГОСТ 31959-2012 (ISO 14669:1999) Вода. Методы определения токсичности по выживаемости морских ракообразных. Руководящий документ РД 52.24.868-2017 Использование методов биотестирования воды и донных отложений водотоков и водоемов. Руководящий документ РД 52.24.635-2002 Методические указания. Проведение наблюдений за токсическим загрязнением донных отложений в пресноводных экосистемах на основе биотестирования. Методические рекомендации МР 1.2.2566-09 Оценка безопасности наноматериалов in vitro и в модельных системах in vivo. Руководящий документ РД 64-085-89 Методические указания. Методические основы биотестирования и определения генетической опасности отходов, поступающих в окружающую среду. Рекомендуется для проведения исследований по аналогии: ГОСТ Р 56236-2014 Вода. Определение токсичности по выживаемости пресноводных ракообразных Daphnia magna Straus (ISO 6341:2012). Методические указания и протоколы