Первый слайд презентации: Про б лемные аспе к ты в
ОГПУ Фару с Окс а н а Анатоль е вна, доцент к а федры хи м ии и МП Х, к а ндида т хи м ическ и х нау к, доцент Про б лемные аспе к ты в химии желез а и хрома
Слайд 2: Ключевые аспек т ы
. 2 Проблемные зон ы в химии желез а и хрома Куд а и заче м п ереходят металлы? Многообрази е и неповторимость соединений Чем дополнит ь шко л ьный учебник
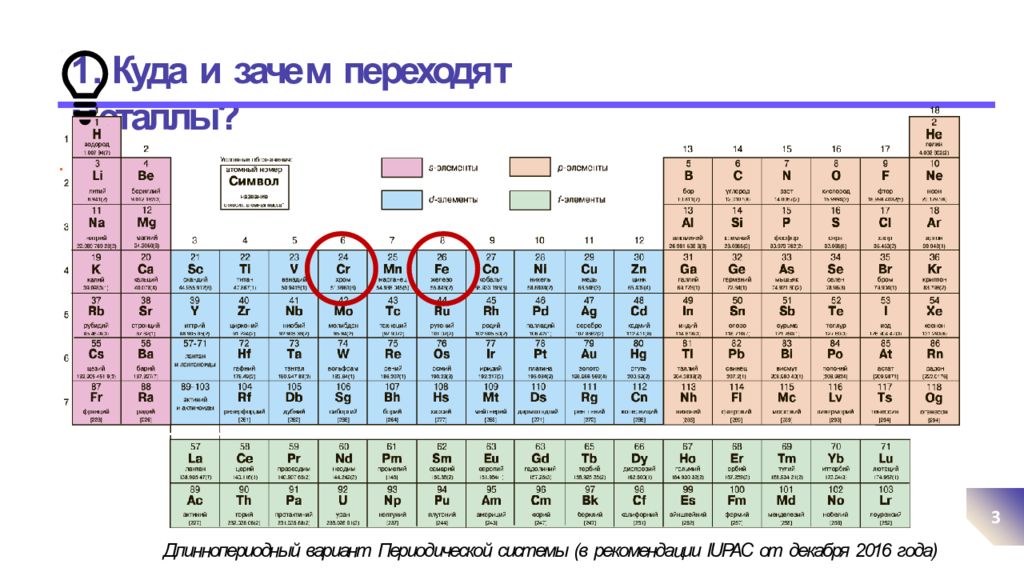
Слайд 3: 1. Куда и заче м переходя т м еталлы?
. 3 Длиннопериодный вариант Периодической системы (в рекомендации IUPAC от декабря 2016 года)
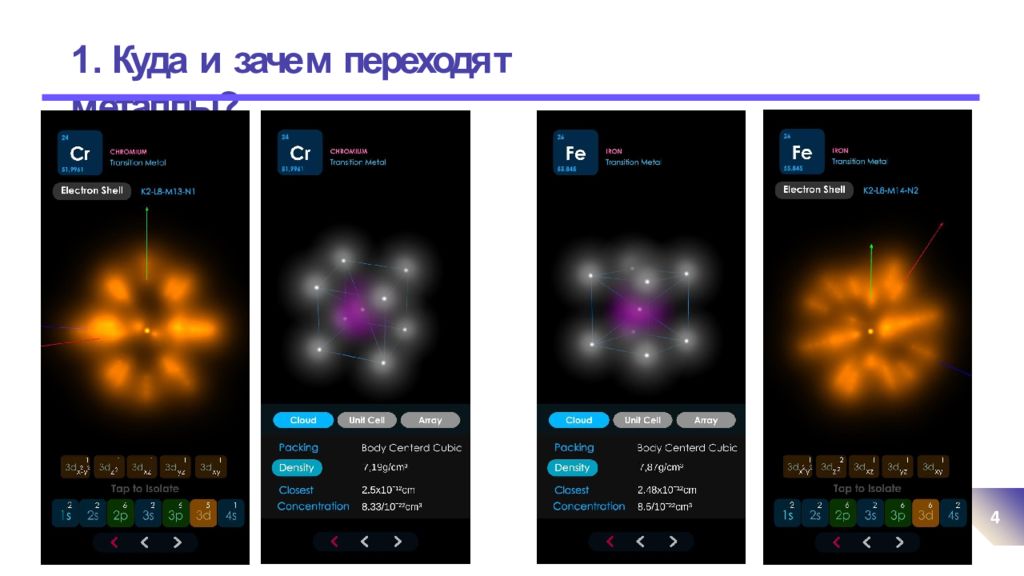
Слайд 5: 1. Куда и заче м переходя т м еталлы?
. 5 Важно! Не пута т ь понят и я валент н ые э л ектрон ы и электрон ы последн е го уровн я : Cr 1s 2 2 s 2 2p 6 3 s 2 3p 6 4 s 1 3d 5 валент ных эле к тр онов – 6 электронов на последнем уровне (s) – 1 (как у ЩМ ) Fe 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 валент ных эле к тр онов – 8 электронов на последнем уровне (s) – 2
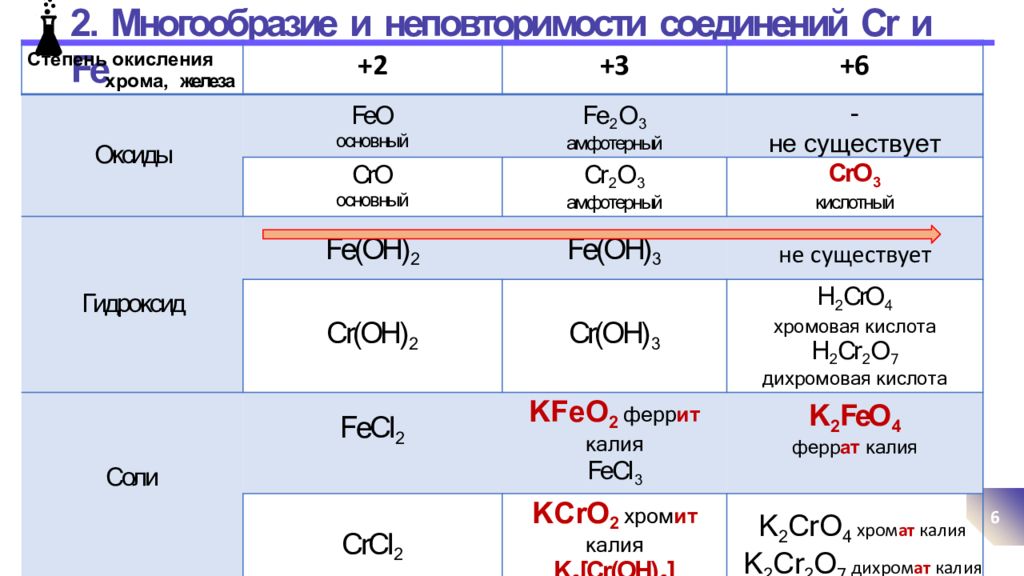
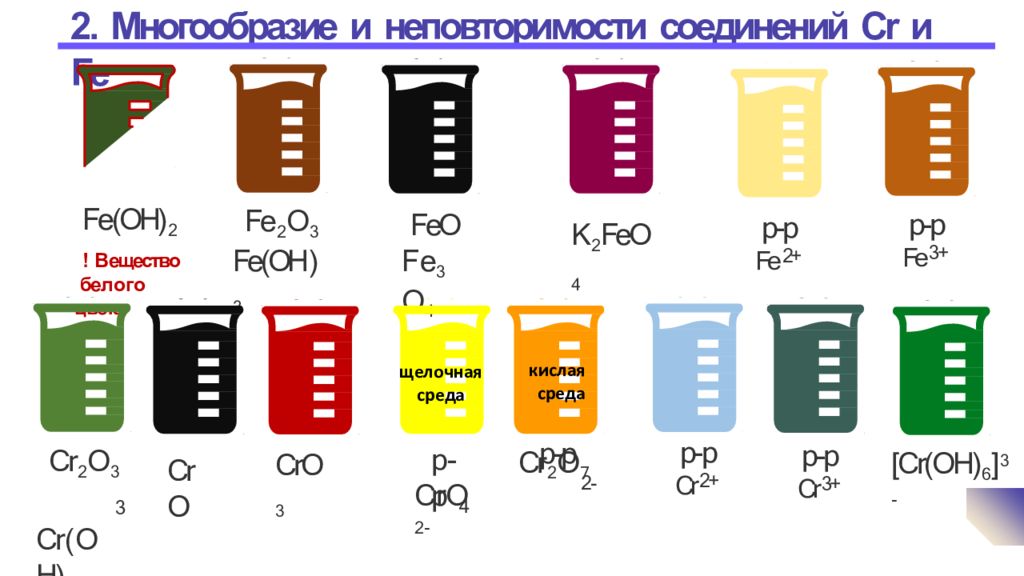
Слайд 6: 2. Многообразие и неповторимости соединений Cr и Fe
6 Ст еп е н ь ок и с л е н ия х р ома, железа +2 +3 +6 Оксиды FeO основный Fe 2 O 3 амфотерный - не существует CrO основный Cr 2 O 3 амфотерный CrO 3 кислотный Гидроксид Fe(OH) 2 Fe(OH) 3 - не существует Cr(OH) 2 Cr(OH) 3 H 2 CrO 4 х р о мов а я к ислота H 2 Cr 2 O 7 д и х р о мов а я к ислота Соли FeCl 2 KFe O 2 фер р и т кал и я FeCl 3 K 2 FeO 4 ф е р р а т кал ия CrCl 2 KCrO 2 х р ом и т кал и я K 3 [Cr(OH) 6 ] CrCl 3 K 2 Cr O 4 хром а т к а л ия K 2 Cr 2 O 7 дих р ом а т к а л ия
Слайд 7: 2. Многообразие и неповторимости соединений Cr и Fe
[Cr(OH) 6 ] 3- 7 FeO F e 3 O 4 Fe 2 O 3 Fe(OH ) 3 Fe(OH) 2 ! В ещество бе л о г о ц вета К 2 FeO 4 р-р Fe 2+ р-р Fe 3+ Cr 2 O 3 Cr ( O H) 3 Cr O CrO 3 р-р Cr 2+ р-р Cr 3+ р - р 4 C r O 2 - р-р Cr 2 O 7 2- щелочная среда кислая среда
Слайд 8
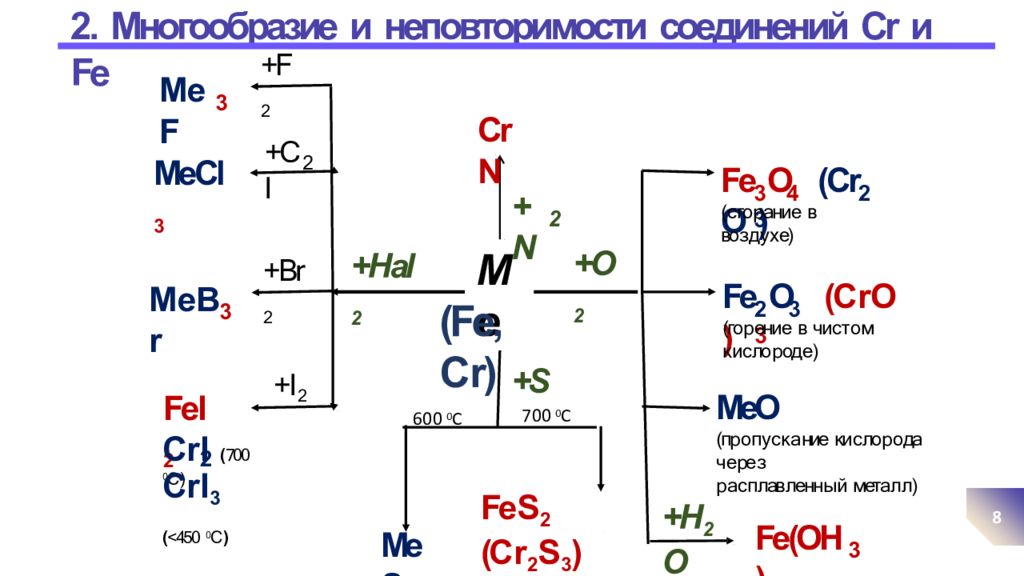
2. Многообразие и неповторимости соединений Cr и Fe 8 Me (Fe, C r) 3 4 2 3 Fe O (Cr O ) ( с го р ани е в во з д у х е) 2 3 3 Fe O (С r O ) (го р ени е в чи с т о м к и с ло р од е ) MeO (пр о п у с к а ние ки с ло р о да ч е ре з р а с п лав ленн ы й мета л л ) +O 2 +Hal 2 +Cl 2 MeCl 3 +Br 2 М е Br 3 +I 2 FeI 2 600 0 С MeS Fe S 2 (C r 2 S 3 ) +S 700 0 С +F 2 М eF 3 С r I ( 700 0 С ) 2 С r I 3 ( <450 0 С ) +H 2 O Fe(OH) 3 +N 2 СrN
Слайд 9: 2. Многообразие и неповторимости соединений Cr и Fe
Хром и желез о – амфот е рны е мета л лы! ! ! 2. Многообразие и неповторимости соединений Cr и Fe 9
Слайд 10: 2. Многообразие и неповторимости соединений Cr и Fe
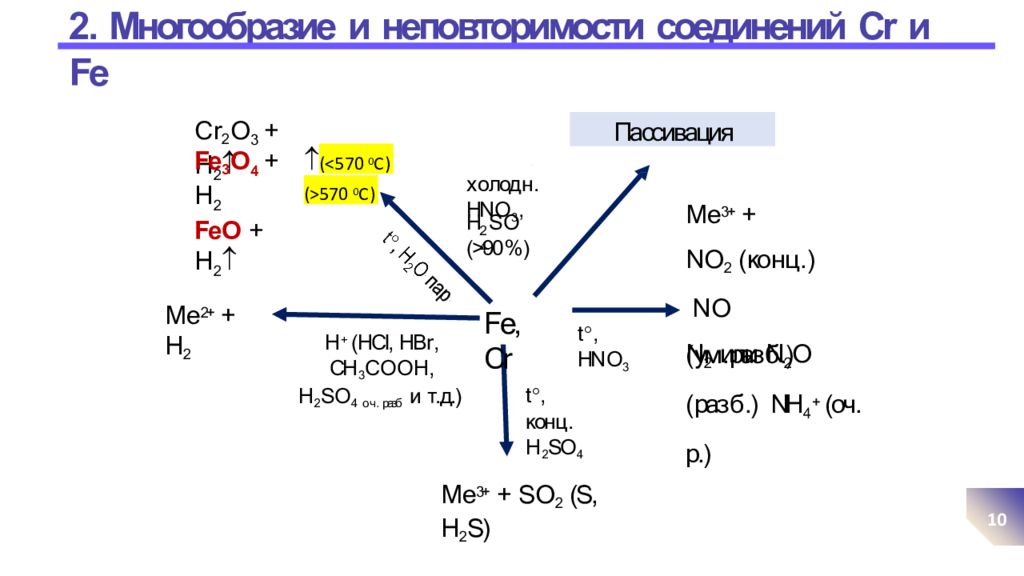
Пассивация х о лод н. HN O 3, 2 4 H S O (>90 % ) M e 3+ + S O 2 (S, H 2 S) t °, кон ц. H 2 SO 4 t °, HN O 3 M e 3+ + N O 2 ( ко н ц. ) N O ( ум. раз б.) N 2 или N 2 O ( раз б.) NH 4 + (оч. р.) Fe, Cr C r 2 O 3 + H 2 (<570 0 С) Fe 3 O 4 + H 2 Fe O + H 2 (>570 0 С) H + ( HCl, HB r, CH 3 C O O H, H 2 S O 4 о ч. разб и т.д.) M е 2+ + Н 2 2. Многообразие и неповторимости соединений Cr и Fe 10
Слайд 11: 2. Многообразие и неповторимости соединений Cr и Fe
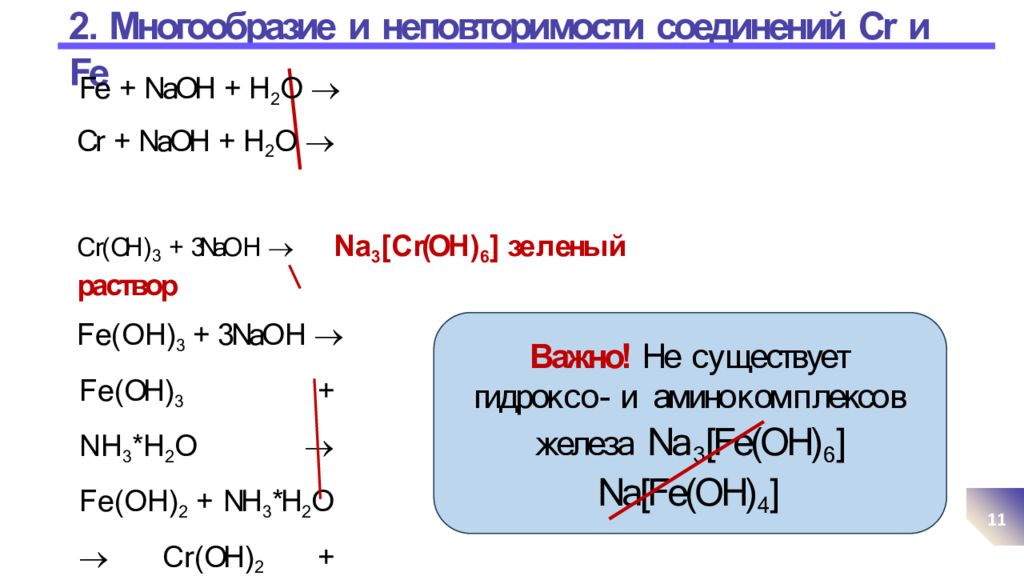
11 F e ( OH ) 3 + N H 3 * H 2 O F e ( O H ) 2 + NH 3 *H 2 O С r ( OH ) 2 + NH 3 * H 2 O Fe + NaOH + H 2 O Cr + NaOH + H 2 O С r( OH ) 3 + 3NaO H N a 3 [ С r(OH ) 6 ] зе л ены й раствор F e ( O H ) 3 + 3NaO H Важно! Не с у ществует гидрок с о - и амино к ом п лексо в железа Na 3 [Fe(OH) 6 ] Na[Fe(OH) 4 ]
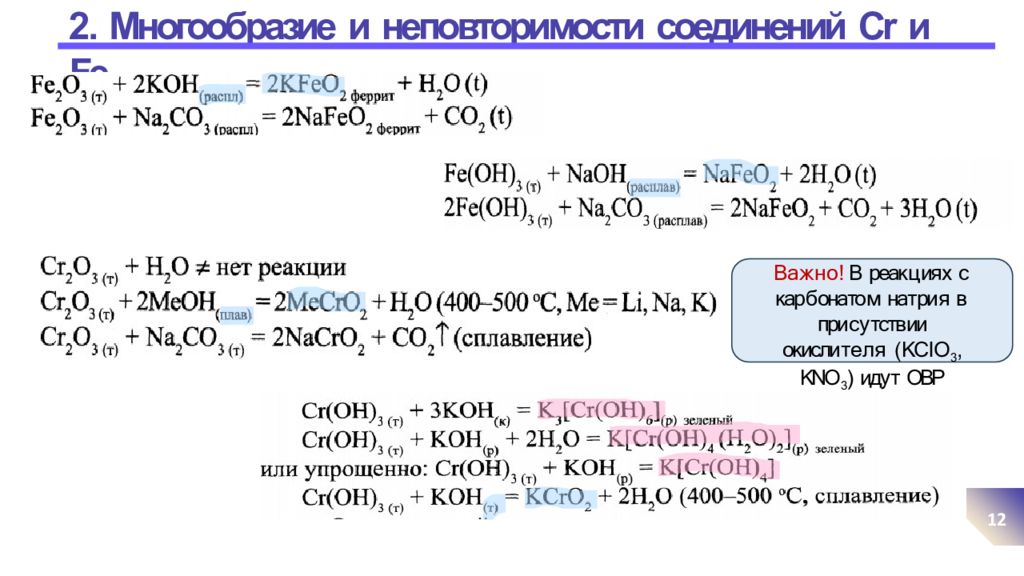
Слайд 12: 2. Многообразие и неповторимости соединений Cr и Fe
12 В а ж н о ! В реак ц ия х с кар б онато м нат ри я в при с у тств ии окисли т е л я ( KC l O 3, KNO 3 ) иду т ОВР
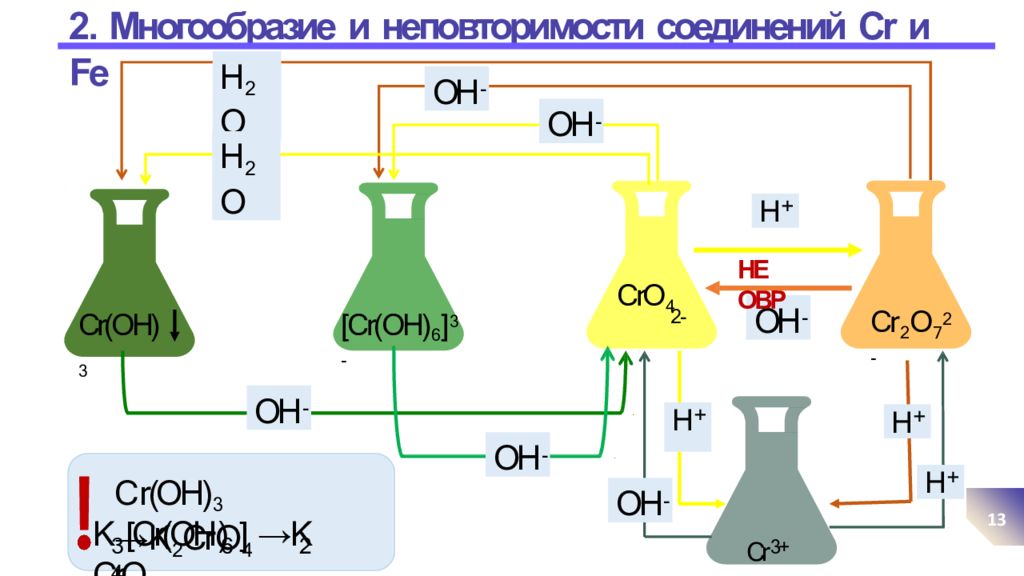
Слайд 13: 2. Многообразие и неповторимости соединений Cr и Fe
13 [Cr(OH) 6 ] 3- CrO 4 2- Cr(OH) 3 Cr 2 O 7 2- Cr 3+ H + H + H + OH - OH - OH - OH - OH - H 2 O OH - НЕ ОВР H + H 2 O С r(OH) 3 → K 2 Cr O 4 K [Cr(OH ) ] →K CrO 3 6 2 4
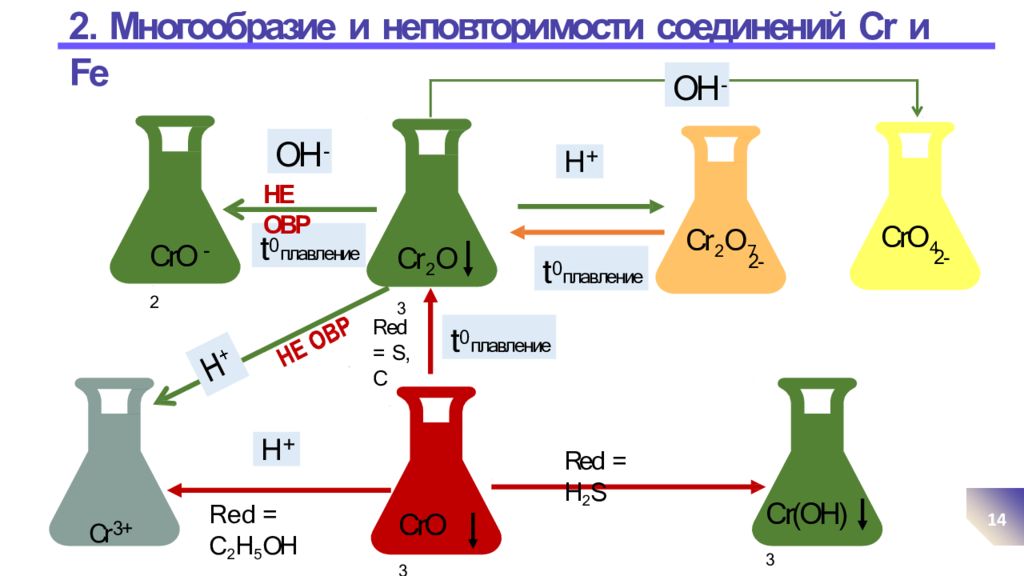
Слайд 14: 2. Многообразие и неповторимости соединений Cr и Fe
14 CrO 4 2- Cr(OH) 3 Cr 2 O 7 2- Cr 3+ H + t 0 плавление OH - OH - Cr 2 O 3 CrО 3 CrO 2 - t 0 плавление НЕ ОВР t 0 плавление H + Red = H 2 S R e d = C 2 H 5 OH Red = S, C
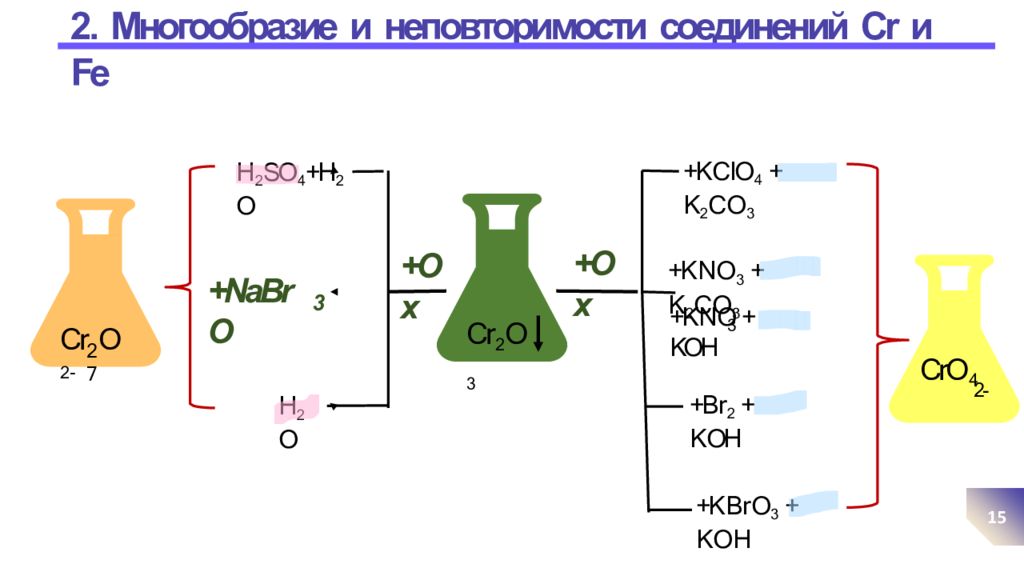
Слайд 15: 2. Многообразие и неповторимости соединений Cr и Fe
15 +K C lO 4 + K 2 C O 3 +Ox +NaBrO 3 H 2 SO 4 +H 2 O H 2 O +K N O 3 + K 2 C O 3 3 +K N O + KOH +B r 2 + K OH +K B r O 3 + K O H 2 7 Cr O 2 - Cr 2 O 3 +Ox CrO 4 2-
Слайд 16: 2. Многообразие и неповторимости соединений Cr и Fe
16 Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. А) KNO 2 + K 2 Cr O 4 + H 2 O → Б ) K 2 Cr O 4 + HN O 3 → В) KCr O 2 + HN O 3 ( изб.) → Г) K 3 [ C r( O H ) 6 ] ( р - р) + HN O 3 ( изб.) → K 3 [Cr ( O H ) 6 ] + NO KNO 3 + Cr ( O H ) 3 + KOH KNO 3 + Cr(N O 3 ) 3 + H 2 O K 2 Cr 2 O 7 + KN O 3 + H 2 O KNO 3 + Cr ( O H ) 3 + H 2 O KCr O 2 + HN O 2 А) KOH + Cr ( O H ) 3 ( t 0 ) → Б ) KOH ( тв. ) + KNO 3 ( тв. ) + C r 2 O 3 ( тв. ) → В) KCrO 2 + HNO 3 ( к онц. ) → Г) KCr O 4 + HN O 3 ( р - р) → 1 ) KCr O 2 2 ) K 3 [Cr ( O H ) 6 ] KNO 3 + К 2 C r 2 O 7 + H 2 O KN O 2 + K 2 Cr O 4 + H 2 O Cr(N O 3 ) 3 + KNO 3 + H 2 O Cr(NO 3 ) 2
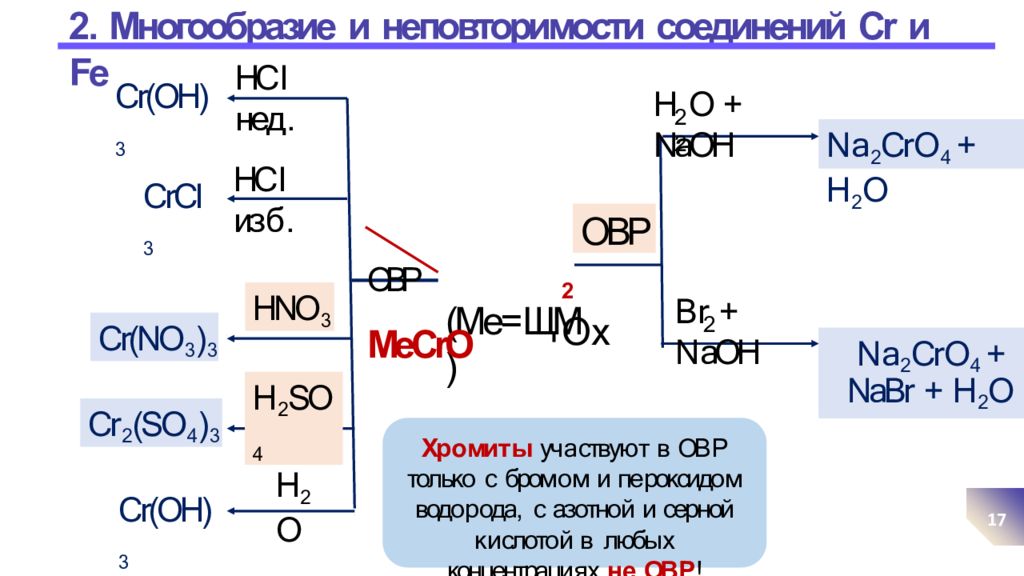
Слайд 17: 2. Многообразие и неповторимости соединений Cr и Fe
17 (Me= ЩМ) ОВР MeCrO HC l нед. HC l из б. HNO 3 H 2 SO 4 H 2 O Cr(OH) 3 CrCl 3 Cr(NO 3 ) 3 Cr 2 (SO 4 ) 3 Cr(OH) 3 ОВР 2 2 H O + NaOH N a 2 Cr O 4 + H 2 O 2 B r + N aOH N a 2 Cr O 4 + NaBr + H 2 O 2 О x Хр о ми т ы уч а ствую т в ОВ Р только с бром о м и пе роксидо м водо р ода, с азотно й и серной к и слото й в любы х концентраци я х н е ОВ Р !
Слайд 18: 2. Многообразие и неповторимости соединений Cr и Fe
18 Железо растворили в соляной кислоте. К полученному раствору добавили раствор карбоната натрия, при этом выпал белый осадок, а выделение газа не наблюдалось. Осадок отфильтровали и растворили в концентрированной азотной кислоте. Образовавшийся раствор темно-бурого цвета выпарили, а твердый остаток прокалили. Напишите уравнения четырех реакций, соответствующих опи с а н ным прев р ащ е ниям. Fe + 2HC l = FeCl 2 + H 2 FeC l 2 + N a 2 CO 3 = FeC O 3 ↓ + 2NaCl FeC O 3 + 4HN O 3 = Fe(NO 3 ) 3 + N O 2 + C O 2 + 2H 2 O 4. 4Fe(N O 3 ) 3 = 2Fe 2 O 3 + 12N O 2 + 3 O 2 ! 4Fe ( NO 3 ) 2 = 2 Fe 2 O 3 + 8N O 2 + 3 O 2
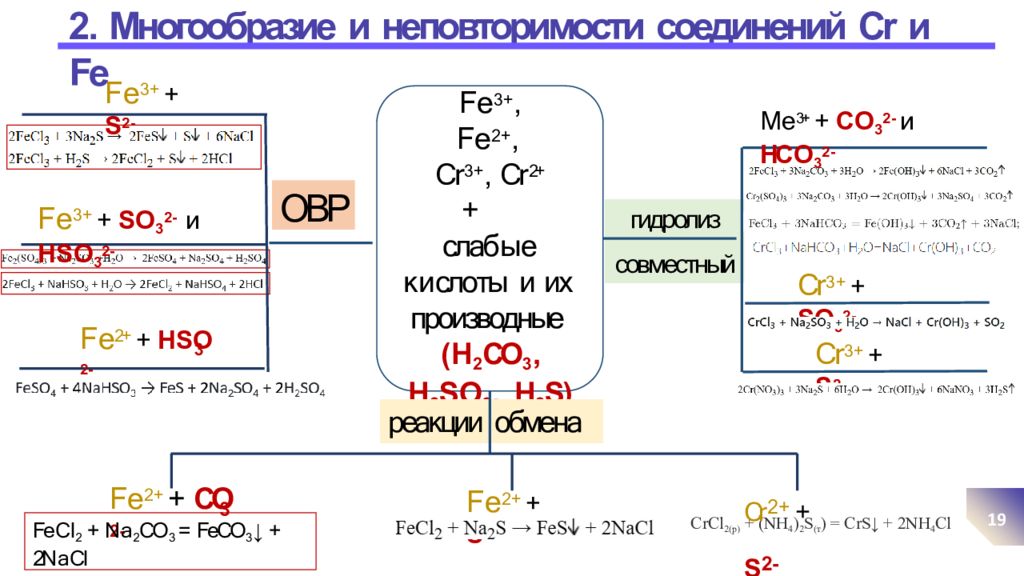
Слайд 19: 2. Многообразие и неповторимости соединений Cr и Fe
19 F e 3 +, F e 2 +, Cr 3 +, Cr 2+ + слаб ы е к и слоты и их производные ( H 2 CO 3, H 2 S O 3, H 2 S) ОВР F e 3 + + S 2 - F e 3 + + S O 3 2 - и Н S O 3 2 - 3 F e 2+ + Н S O 2 - реакции обмена 3 F e 2 + + CO 2 - Fe C l 2 + N a 2 CO 3 = FeCO 3 ↓ + 2N a Cl F e 2 + + S 2 - CrCl 2(р) + (NH 4 ) 2 S (т ) = CrS↓ + 2NH 4 Cl Cr 2 + + S 2 - гидролиз совместный M e 3+ + C O 3 2 - и НС О 3 2 - Cr 3 + + S O 3 2 - Cr 3 + + S 2 -
Слайд 20: 2. Многообразие и неповторимости соединений Cr и Fe
Оксид железа (III) растворили в расплаве смеси гидроксида калия и нитрата калия, полученный расплав охладили и растворили в воде. К образовавшемуся раствору прилили раствор нитрата бария, выпал фиолетовый осадок. К нему прилили концентрированную соляную кислоту. Выделившийся при этом газ пропустили через холодную известковую воду. Напишите уравнения четырех реакций, соответствующих описанным превращениям. F e 2 O 3 + 3KN O 3 + 4K O H = 2 K 2 Fe O 4 + 3KN O 2 + 2 H 2 O K 2 Fe O 4 + B a (N O 3 ) 2 = B aFe O 4 + 2KN O 3 2BaFeO 4 + 16HCl = 3Cl 2 + 2BaCl 2 + 2FeCl 3 +8H 2 O C l 2 +Ca(OH) 2 = CaC l ( OC l ) + H 2 O 20
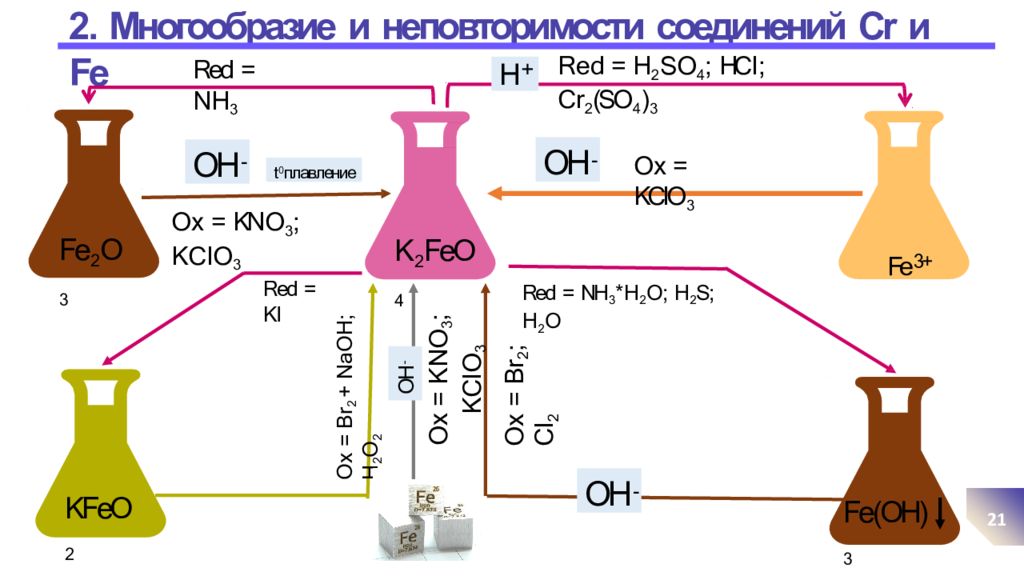
Последний слайд презентации: Про б лемные аспе к ты в: 2. Многообразие и неповторимости соединений Cr и Fe
21 K 2 FeO 4 OH - Fe 2 O 3 t 0 плавление O x = KN O 3 ; K C l O 3 Fe 3+ OH - O x = KClO 3 Red = KI H + R e d = H 2 S O 4 ; HC l ; C r 2 (SO 4 ) 3 Red = NH 3 * H 2 O ; H 2 S; H 2 O Red = N H 3 KFeO 2 O x = Br 2 + NaOH; H 2 O 2 Fe(OH) 3 O x = B r 2 ; C l 2 OH - OH - O x = KN O 3 ; K C l O 3