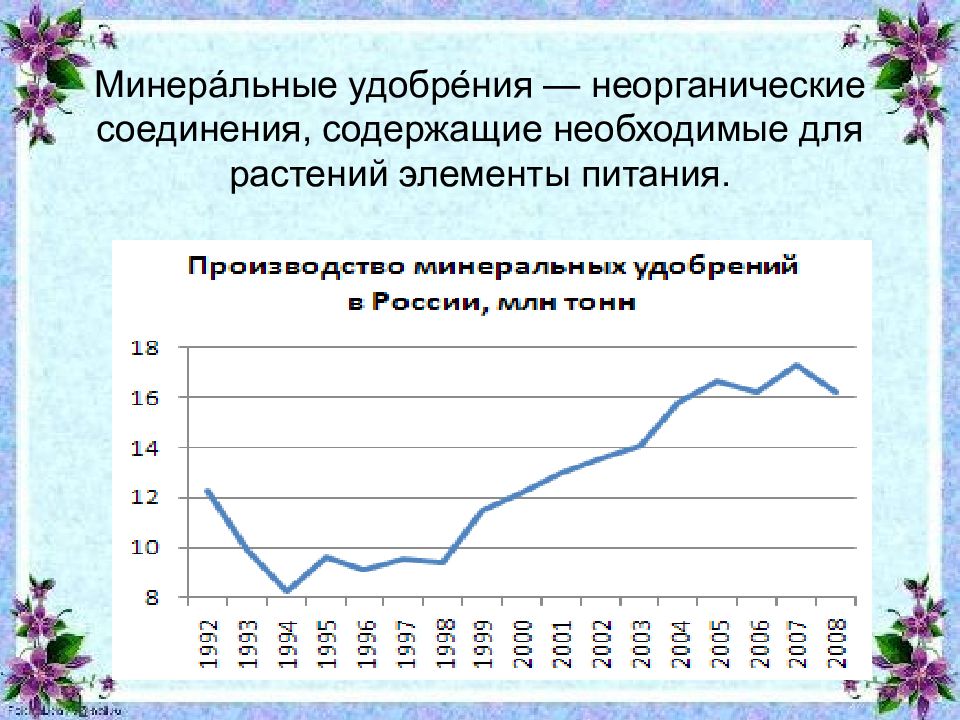
Слайд 2: Минера́льные удобре́ния — неорганические соединения, содержащие необходимые для растений элементы питания
Слайд 3: Классификация:
1) по происхождению (минеральные и органические); 2) по агрегатному состоянию (жидкие, полужидкие, твёрдые); 3) по способу действия (прямого и косвенного); 4) по способу их внесения в почву (основное, припосевное, подкормочное, внутрипочвенное, поверхностное); 5) по составу ( простые – азотистые фосфорные калийные, комплексные – 2 или более питательных элемента).
Слайд 4: Двойной суперфосфат
45-51% общей Р 2 О 5 : 42-49% в усвояемой форме в виде водорастворимых соединений (Ca(H 2 PO 4 ) 2 ; Mg(H 2 PO 4 ) и цитратнорастворимых соединений (CaHPO 4 ; MgHPO 4 ; фосфаты железа)
Слайд 6: Технология производства
производство фосфорной кислоты (реагент во второй стадии); фосфорнокислотное разложение фосфатов с получением двойного суперфосфата. Ca 5 (PO 4 ) 3 F+7H 3 PO 4 +5H 2 O→5Ca(H 2 PO 4 ) 2 +H 2 O+HF ∆H = 132 кДж
Слайд 7: Методы производства:
Камерный - использование суперфосфатных камер непрерывного действия → созревание продукта на складе; Камерно-поточный – использование суперфосфатных камер, без операции складского созревания; Поточный (бескамерный) - с использованием неупаренной кислоты концентрацией 30% P 2 O 5.
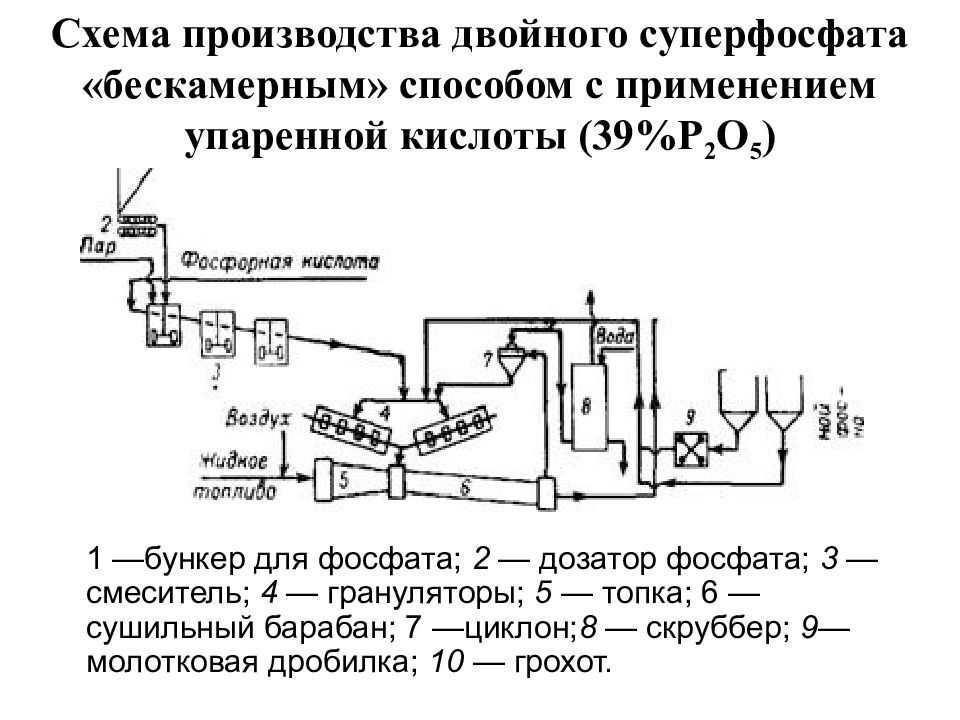
Слайд 8: Схема производства двойного суперфосфата «бескамерным» способом с применением упаренной кислоты (39%Р 2 О 5 )
1 —бункер для фосфата; 2 — дозатор фосфата; 3 — смеситель; 4 — грануляторы; 5 — топка; 6 —сушильный барабан; 7 —циклон; 8 — скруббер; 9— молотковая дробилка; 10 — грохот.
Слайд 10
Нитра́т аммо́ния (аммонийная (аммиачная) селитра) — химическое соединение NH 4 NO 3, соль азотной кислоты. Впервые получена Глаубером в 1659 году.
Слайд 11
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота: NH 3 + HNO 3 = NH 4 NO 3 + Q
Слайд 12
Реакция протекает бурно с выделением большого количества тепла. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. содержание нитрата аммония составляет 95—99,5 %
Слайд 15
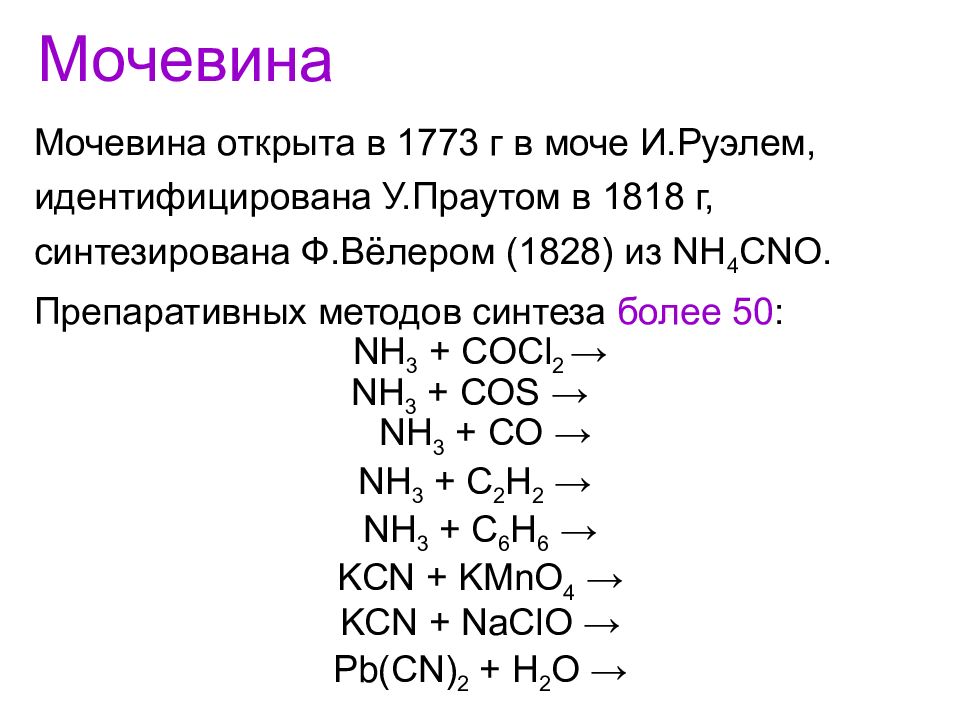
Мочевина открыта в 1773 г в моче И.Руэлем, идентифицирована У.Праутом в 1818 г, синтезирована Ф.Вёлером (1828) из NH 4 CNO. Препаративных методов синтеза более 50 : NH 3 + COCl 2 → NH 3 + COS → NH 3 + CO → NH 3 + C 2 H 2 → NH 3 + C 6 H 6 → KCN + KMnO 4 → KCN + NaClO → Pb(CN) 2 + H 2 O → Мочевина
Слайд 16
Использование мочевины (106 млн.т / год – 1984 ; 15,9 - 199 5 г. все азотные) удобрение; кормовые добавки; синтез гербицидов; органический синтез (меланин, циануровая кислота, карбамидные смолы); неорганический синтез ( NaCN, KCN, N 2 H 4 ) ; фармацевтическая химия (веронал, люминал, бромурал); нефтяная промышленность (для депарафинации масел);
Слайд 17
Достоинства карбамида : высокое содержание азота - 46,6%, негигроскопичность, небольшие потери за счёт вымывания из почвы Получение по реакции Базарова, суммарная реакция: 2 NH 3 + CO 2 CO(NH 2 ) 2 + H 2 O H = – 110,1 кДж / моль 1 стадия: 2 NH 3 (Г) + CO 2 (Г) NH 2 С OONH 4( Ж ), H = – 125,6 кДж / моль 2 стадия: NH 2 С OONH 4( Ж ) CO(NH 2 ) 2 (Ж) + H 2 O (Ж) H = 15,5 кДж / моль карбамат
Слайд 18
Условия : 1 стадия : Р >15-20 МПа (реакция идёт с уменьшением объёма), t = 150-190 о С (для повышения скорости, отрицательный эффект смещения равновесия компенсируется повышением давления) 2 стадия: t > 98 o С – эвтектическая точка CO(NH 2 ) 2 -H 2 COONH 4, иначе - кристаллизация Максимальное превращение при t = 220 o C и избытке NH 3 (аммиак – для связывания продукта реакции – H 2 O).
Слайд 19
Условия : Итак : t = 180-230 o C, P = 12-25 МПа, но превращение не полное, смесь содержит карбамид, карбамат, NH 3 и CO 2, поэтому: открытая схема; рецикл
Слайд 20: Открытая схема: отделение карбамида, а не прореагировавшие NH 3 и CO 2 – на синтез NH 4 NO 3. Для этого давление понижают до 1 атм., температура 140 – 150 0 С, NH 2 COONH 4 разлагается на NH 3 и CO 2. Закрытая схема (рецикл): используют только рецикл жидкой фазы, газовой - технологически сложно
Слайд 21: Рецикл жидкой фазы - стриппинг - процесс ( отдувка ) - разложение карбамата при высоком давлении вследствие продувки сжатым СО 2 и NH 3 NH 2 COONH 4 (Ж ) NH 3( Г) + СО 2(Г) При повышении парциального давления NH 3 ( CO 2 ), понижается парциальное давление CO 2 ( NH 3 ) и равновесие реакции смещается вправо
Слайд 22
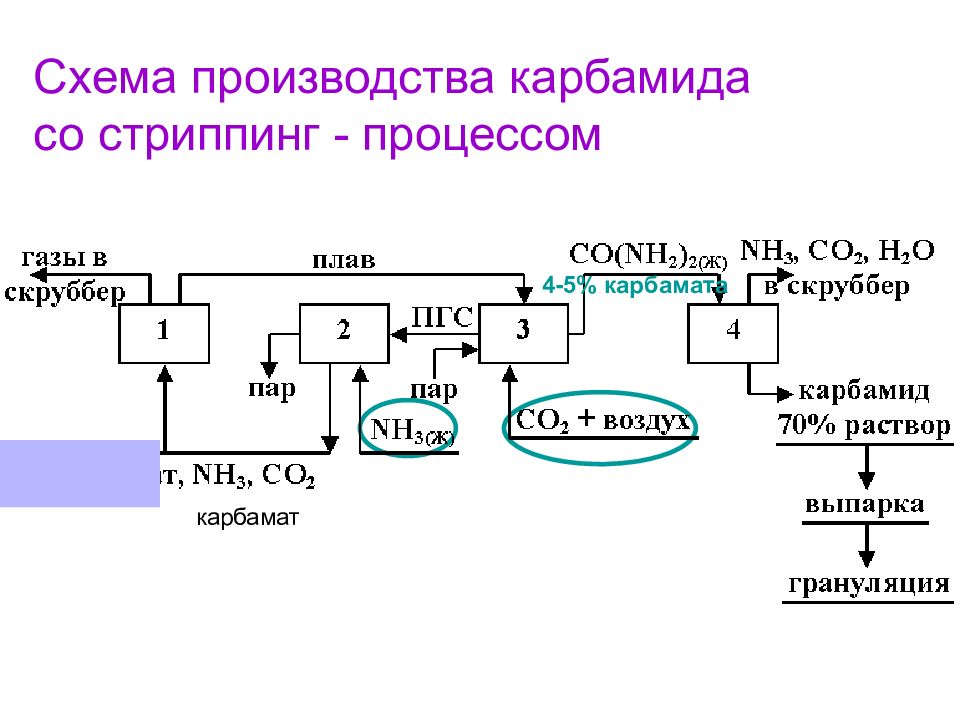
Схема производства карбамида со стриппинг - процессом карбамат 4-5% карбамата
Слайд 23: 1 – колонна синтеза карбамида (2-я стадия), 170 – 190 0 С, 13 – 15 МПа, NH 3 : CO 2 = 2,8 – 2,9; 2 – конденсатор высокого давления (1-я стадия); 3 – отдувочная колонна, сверху по трубкам идёт плав, снизу - CO 2 + воздух (0,5-0,8 об.%), 4 – ректификационная колонна (насадочная), 0,3 – 0,6 МПа; CO(NH 2 ) 2( Ж ) стекает вниз, паро–газовая смесь поднимается вверх. ПГС – паро–газовая смесь ( CO 2, NH 3, H 2 O, воздух)
Слайд 25: Жидкий аммиак
Бесцветная летучая жидкость с характерным резким запахом нашатырного спирта; Содержание азота - 82,3%; Получение - сжижением газообразного аммиака под давлением; Хранение - в закрытых специальных толстостенных цистернах, баллонах, рассчитанных на высокое давление; Внесение в почву специальными машинами на глубину 12-15 см на тяжелых, и 15-18 см на легких почвах.
Слайд 26: Аммиачная вода (водный аммиак)
Бесцветная или желтоватая жидкость с резким запахом нашатырного спирта; Два сорта - с содержанием азота 20% (или 25% аммиака) и 16% (или 20% аммиака); Хранение - в герметически закрывающихся резервуарах (цистернах, баках), рассчитанных на невысокое давление; Внесение в почву - специальными машинами на глубину не менее 12-15 см.
Слайд 27: Преимущество жидких азотных удобрений
Производство и применение дешевле, чем твердых; При производстве отсутствует строительство цехов азотной кислоты, кристаллизации, упарки, грануляции, сушки, что снижает капиталовложения на строительство азотно-тукового завода равноценной (по азоту) мощности; Стоимость единицы азота в жидком и водном аммиаке примерно в 1,5—2 раза меньше, чем в аммиачной селитре; В 2—3 раза сокращаются затраты труда на внесение жидких удобрений - все операции по их использованию полностью механизированы; Жидкие азотные удобрения дают такие же прибавки урожайности культур, как и равная доза азота в аммиачной селитре.
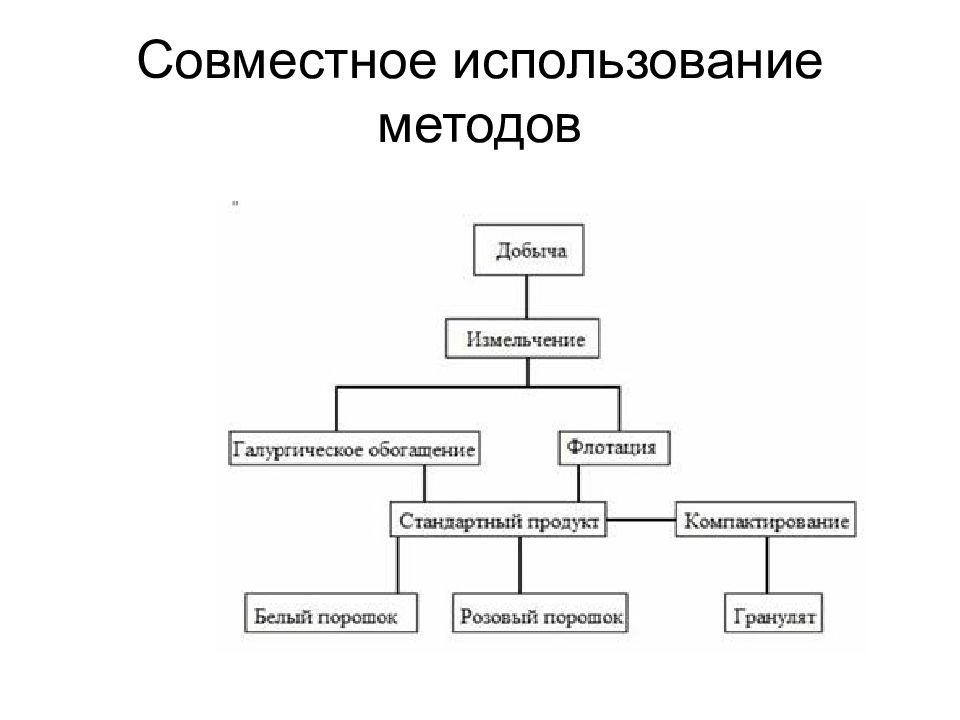
Слайд 29: Сырье для производства калийных удобрений
Карналлит Карналлит — минерал, двойная соль хлорида калия и хлорида магния KCl·MgCl2·6H2O. Кристаллизуется в ромбической системе, редко встречается в кристаллах, чаще встречается в сплошных массах. Высокогигроскопичен: легко растворяется в воде, переходит в раствор, находясь во влажной воздушной среде. Часто имеет включения микроагрегатов, кристаллов-зародышей (кристаллиты) и газово-жидкой субстанции. Твёрдость — 2,5, плотность — 1,6 г/см³. По происхождению хемогенный. Используется как сырье для производства магния, а магний в свою очередь необходим для производства стратегического продукта, - титано-магниевого сплава, - широко используемого в авиационной и космической промышленности.
Слайд 30
Сильвинит -осадочная горная порода, состоящая из чередующихся слоев галита и сильвина (nNaCl + mKCl) и некоторых примесей (гематит и др.)
Слайд 31: Полигалит — минерал из группы водных сернокислых соединений. Химический состав: 5CaSO4 + K2Mg(SO4)2 + 2H2O
Слайд 35: Хлористый калий (КCl)
Является концентрированным калийным удобрением. Представляет собой белое кристаллическое вещество и легко растворяется в воде. Содержание питательного вещества K 2 O находится на уровне 52-62 %. Основным сырьем для производства хлористого калия являются природные калийные соли (сильвинит и карналлит — соли с содержанием чистого вещества на уровне 12-15 % с примесями солей натрия и магния). Хлористый калий применяют на любых почвах как основное удобрение. Особенно эффективно при использовании под корнеплоды, картофель, подсолнечник, плодовые и др. культуры. Калийные удобрения, как правило, применяются в комплексе с азотными и фосфорными удобрениями.
Слайд 36: Калийная селитра (КNO 3 )
Комплексное калийно-азотное удобрение. Содержит калия 45 %, азота 14 %. В объеме 10 см3 содержится 12,5 г (1 г занимает 0,75 см3), то есть в стакане (200 мл) поместится 250 г, в спичечном коробке 25 г. Широко применяется в защищенном грунте: перед высадкой рассады вносят до 36 г/м2, для корневой подкормки 18-20 г/м2.
Слайд 37: Калимагнезия (K 2 SO 4 *MgSO 4 )
Комплексное калийно-магниевое удобрение, без содержания хлора. Применяется под хлорофобные культуры положительно отзывающиеся на магний. Содержание калия 26-32 %, магния 11-18 %. В объеме 10 см3 содержится 10 г (1 г занимает 1 см3), то есть в стакане (200 мл) поместится 200 г, в спичечном коробке 20 г. Не гигроскопична, не слеживается, рассеиваемость хорошая. Применяют в виде подкормки (10 г/м2) при низком содержании в почве подвижного магния. При основном внесении норма составляет 40 г/м2.
Слайд 38
Более 80 % запасов используемой для производства калия руды приходится всего на три страны — Канаду, Россию и Беларусь. Уралкалий, Сильвинит – основные производители в России.
Слайд 39: Метод флотации
Метод флотации основан на использовании различной смачиваемости водой минералов сильвина (КС1) и галита (NaCI). Флотацию с применением в качестве флотореагентов октадециламина, карбоновых кислот ведут из насыщенных растворов сырых калийных солей. Хлорид калия, получаемый флотационным разделением сильвинита, имеет гораздо более крупную кристаллическую структуру, чем полученный кристаллизацией, поэтому он меньше слеживается.
Слайд 40
Процесс флотации осуществляется во флотационных машинах, где пульпа перемешивается и насыщается воздухом, который диспергируется на мелкие пузырьки. По способу перемешивания и аэрации пульпы флотационные машины разделяются на механические, пневмомеханические и пневматические. Широкое применение имеют пневмомеханические флотационные машины
Слайд 41
Через полый вал 5, который вращает импеллер 3, подается сжатый воздух, который диспергируется с помощью импеллера и поддерживает во взвешенном состоянии частицы руды флотационной пульпы, находящейся в камере машины 1. Пенный продукт через сливной порог 4 подается на дальнейший передел на флотационный концентрат. Производительность таких машин по потоку может достигать 6 т/ч.
Слайд 42
Метод галургии основан на использовании различной растворимости хлоридов калия и натрия. С повышением температуры растворимость КСl резко возрастает, a NaCI меняется незначительно. При совместном присутствии обеих солей растворимость хлорида натрия с ростом температуры падает, а KCl - сильно возрастает. На этих различиях и построены галургические операции разделения.