Первый слайд презентации: Производство неорганических кислот
Серная кислота Соляная кислота Фосфорная кислота 1
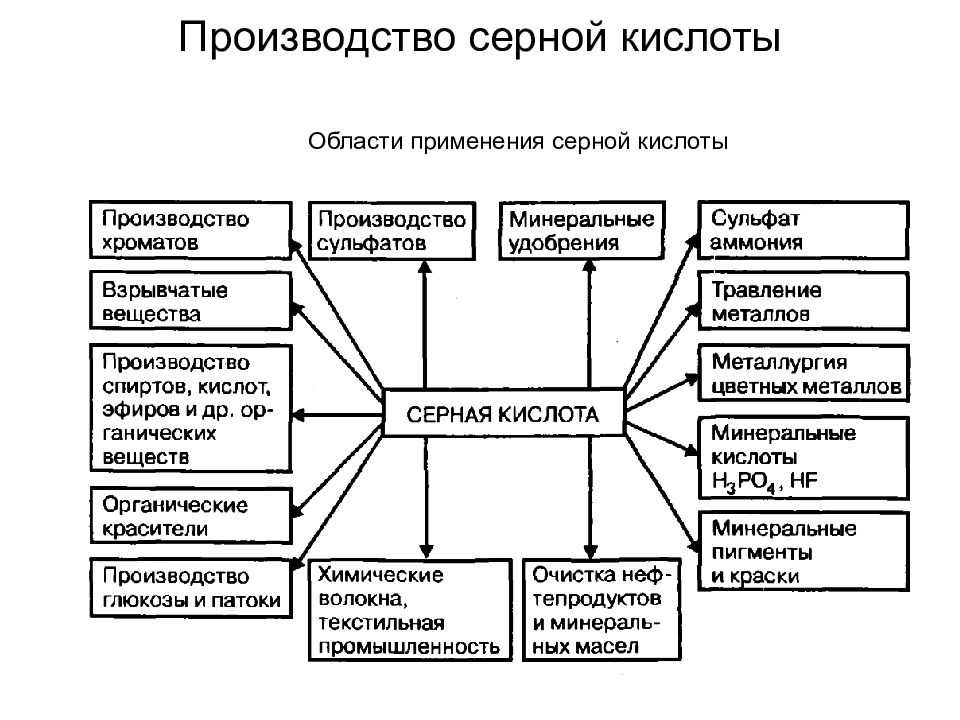
Слайд 3: Производство серной кислоты
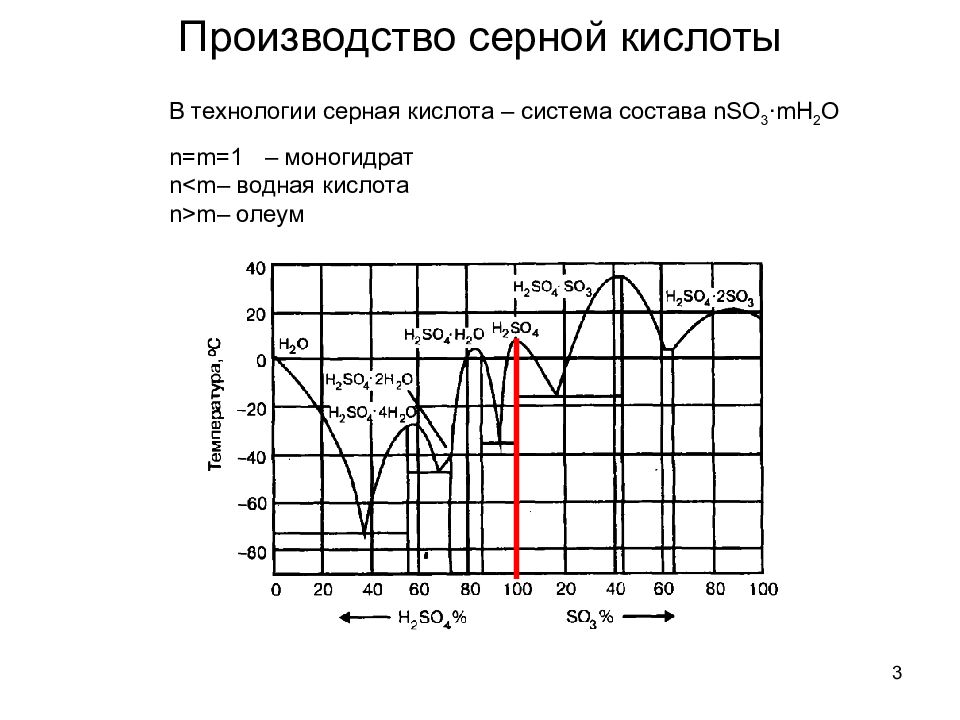
3 В технологии серная кислота – система состава nSO 3 ∙mH 2 O n=m=1 – моногидрат n<m – водная кислота n>m – олеум
Слайд 4: Производство серной кислоты
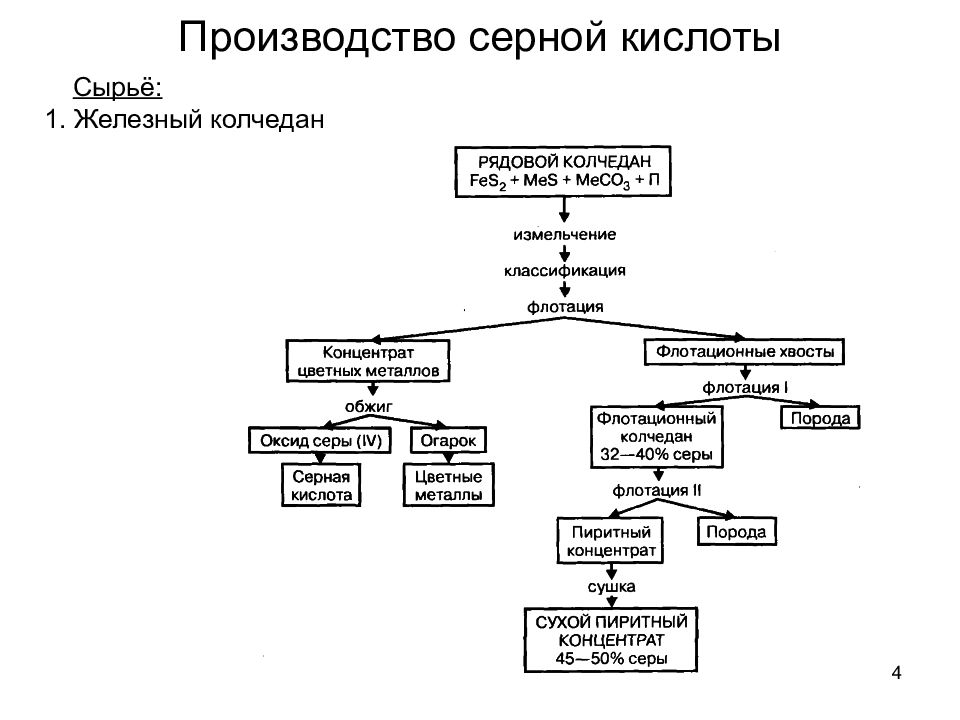
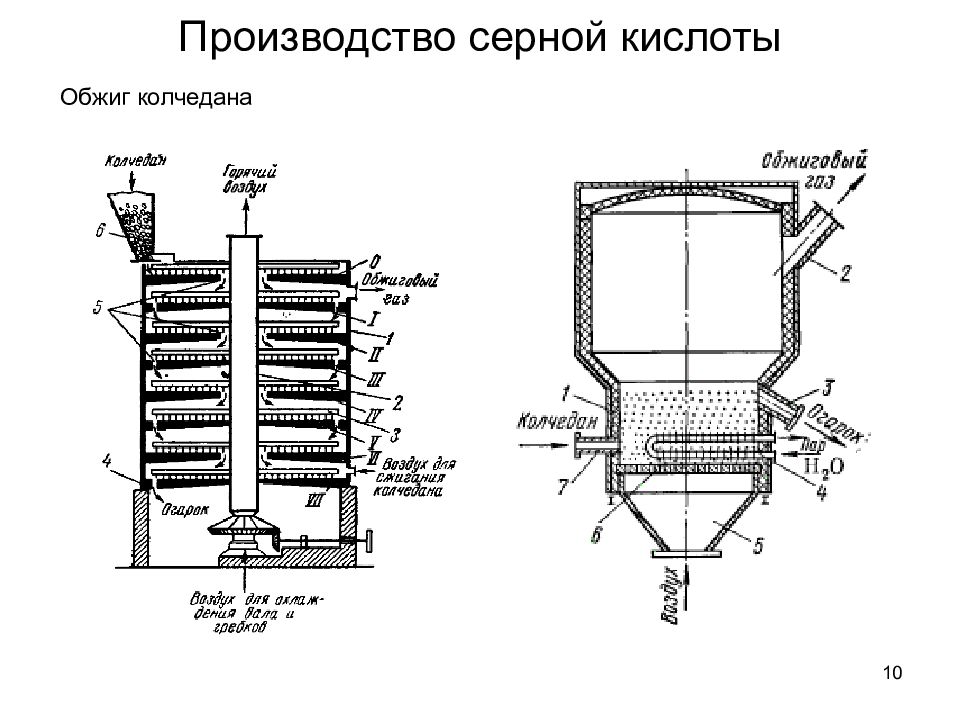
4 Сырьё: 1. Железный колчедан Производство серной кислоты
Слайд 6
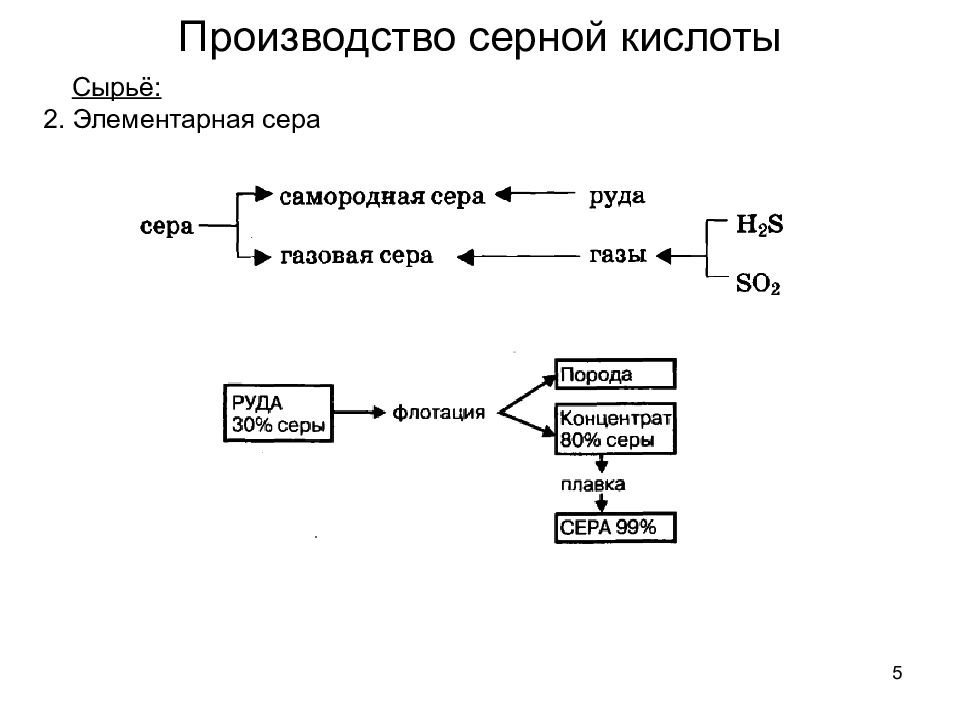
6 Сырьё: 3. Сероводород Производство серной кислоты Источник: горючие газы – коксовый, генераторный, попутный, газы нефтепереработки. Извлекается 90%-й сероводород 4. Обжиговые газы цветной металлургии Показатель Сырье Железный Самородная Газовая Сероводород колчедан сера сера Удельные капиталовложения в производство 100 57 57 63 Себестоимость кислоты 100 125 67 80 Приведенные затраты 100 118 75 72
Слайд 7
7 Производство серной кислоты Общая схема производства Сырьё Подготовка сырья Обжиг Очистка и контроль состава газа Контактирование (окисление до ангидрида) Абсорбция серного ангидрида Товарная серная кислота Содержание SO 2 7-9%, O 2 9-11%
Слайд 8
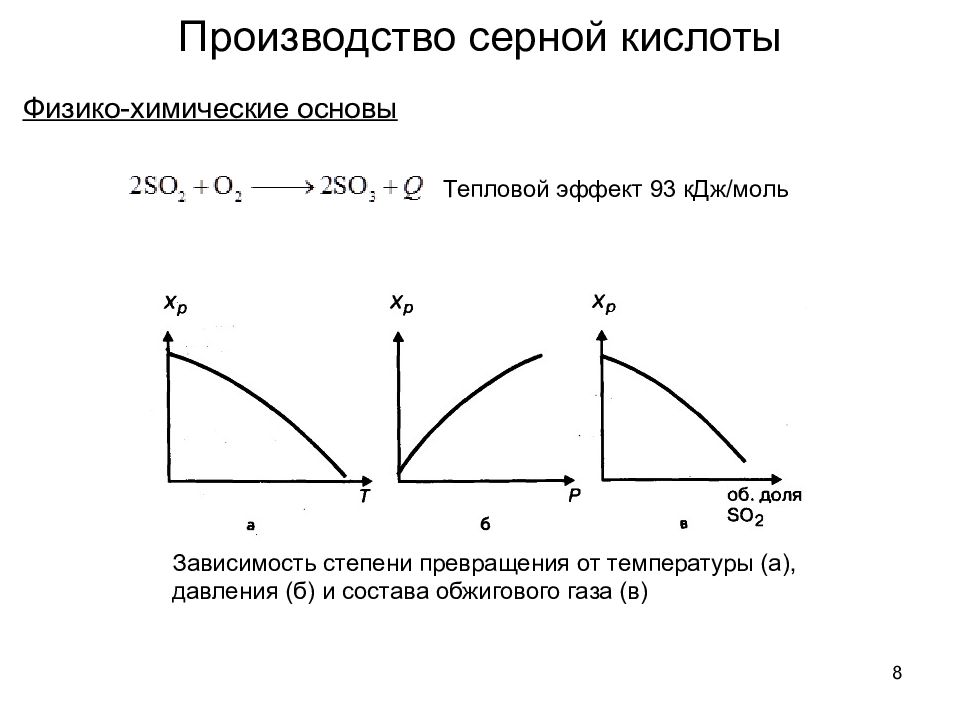
Физико-химические основы 8 Производство серной кислоты Тепловой эффект 93 кДж/моль Зависимость степени превращения от температуры (а), давления (б) и состава обжигового газа (в)
Слайд 9
Физико-химические основы Катализаторы: 9 Реакция 3 порядка с энергией активации 280 кДж/моль В присутствии катализатора – порядок 1,8; Е а =96 кДж/моль Каталитические яды: As, Se Температура зажигания 380-420 о С, возрастает с увеличением [SO 2 ] Слои I II III IV Температурный режим в контактном аппарате, °С 440—600 460—500 440-450 420—425 Температурный режим в теплообменнике, °С 600—460 500—440 450—420 420 Степень превращения 0,70 0,90 0,96 0,98 Начальные параметры режима контактирования: температура 400-440°С, давление 0,1 МПа, содержание оксида серы (IV) в газе 7%, содержание кислорода в газе 11%
Слайд 11
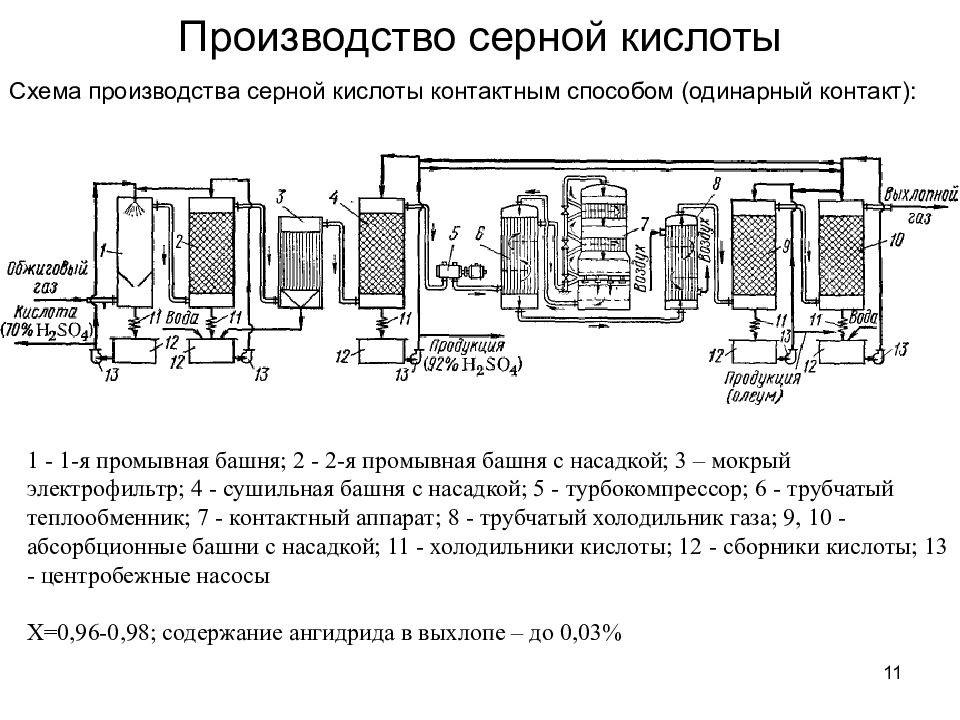
11 Производство серной кислоты Схема производства серной кислоты контактным способом (одинарный контакт): 1 - 1-я промывная башня; 2 - 2-я промывная башня с насадкой; 3 – мокрый электрофильтр; 4 - сушильная башня с насадкой; 5 - турбокомпрессор; 6 - трубчатый теплообменник; 7 - контактный аппарат; 8 - трубчатый холодильник газа; 9, 10 - абсорбционные башни с насадкой; 11 - холодильники кислоты; 12 - сборники кислоты; 13 - центробежные насосы Х=0,96-0,98; содержание ангидрида в выхлопе – до 0,03%
Слайд 12
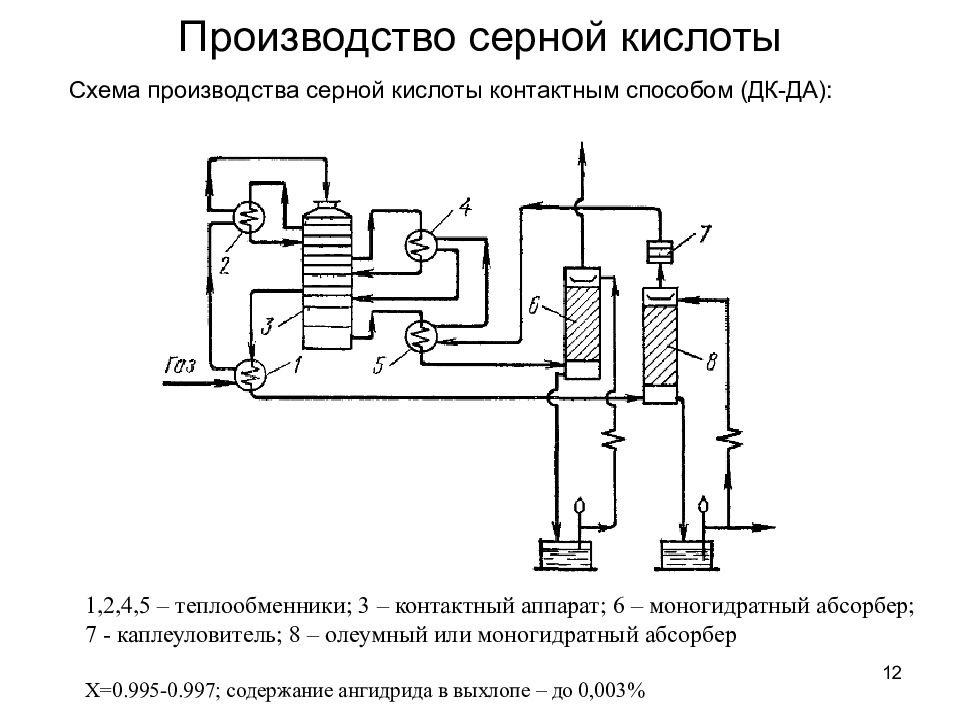
12 Производство серной кислоты Схема производства серной кислоты контактным способом (ДК-ДА): 1,2,4,5 – теплообменники; 3 – контактный аппарат; 6 – моногидратный абсорбер; 7 - каплеуловитель; 8 – олеумный или моногидратный абсорбер Х=0.995-0.997; содержание ангидрида в выхлопе – до 0,003%
Слайд 13
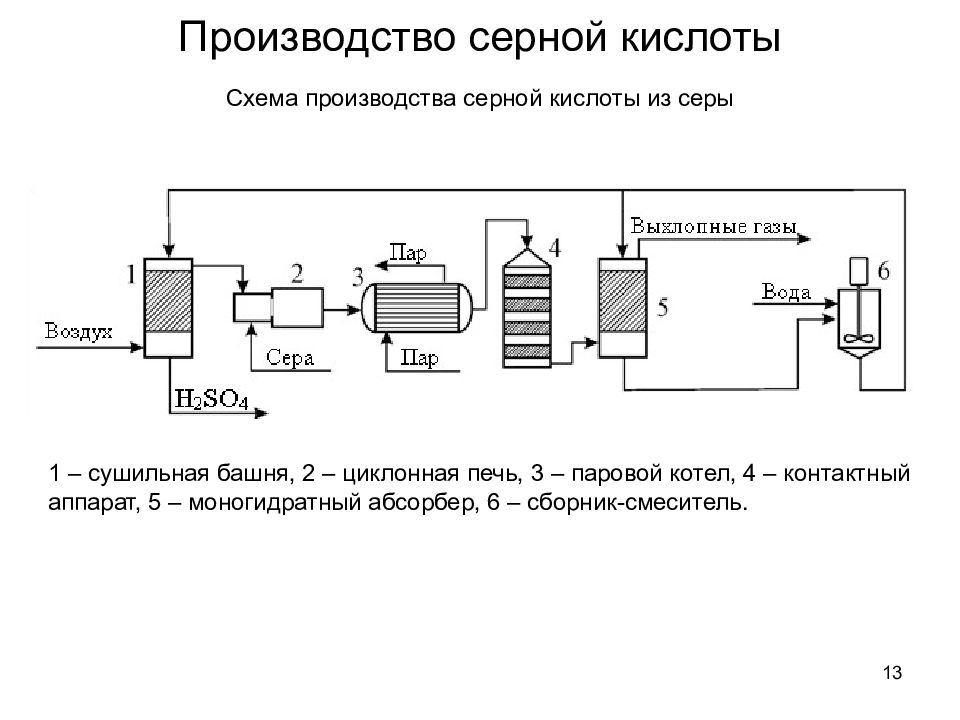
13 Производство серной кислоты Схема производства серной кислоты из серы 1 – сушильная башня, 2 – циклонная печь, 3 – паровой котел, 4 – контактный аппарат, 5 – моногидратный абсорбер, 6 – сборник-смеситель.
Слайд 14
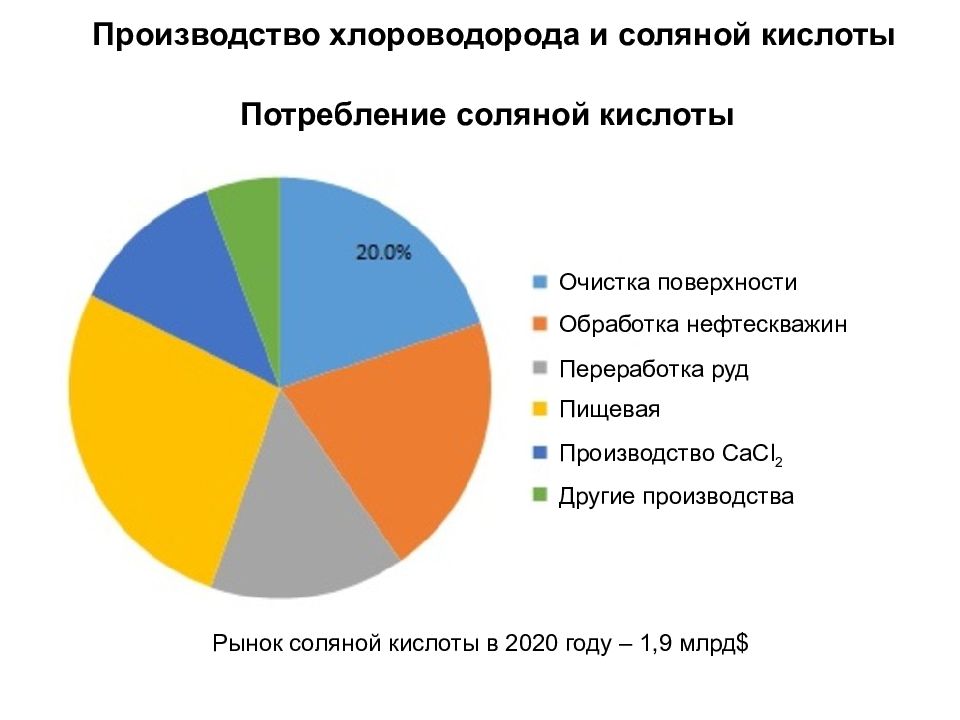
Производство хлороводорода и соляной кислоты Очистка поверхности металлов Обработка нефтескважин Переработка руд Пищевая промышленность Производство CaCl 2 Другие производства Рынок соляной кислоты в 2020 году – 1,9 млрд $ Потребление соляной кислоты
Слайд 15
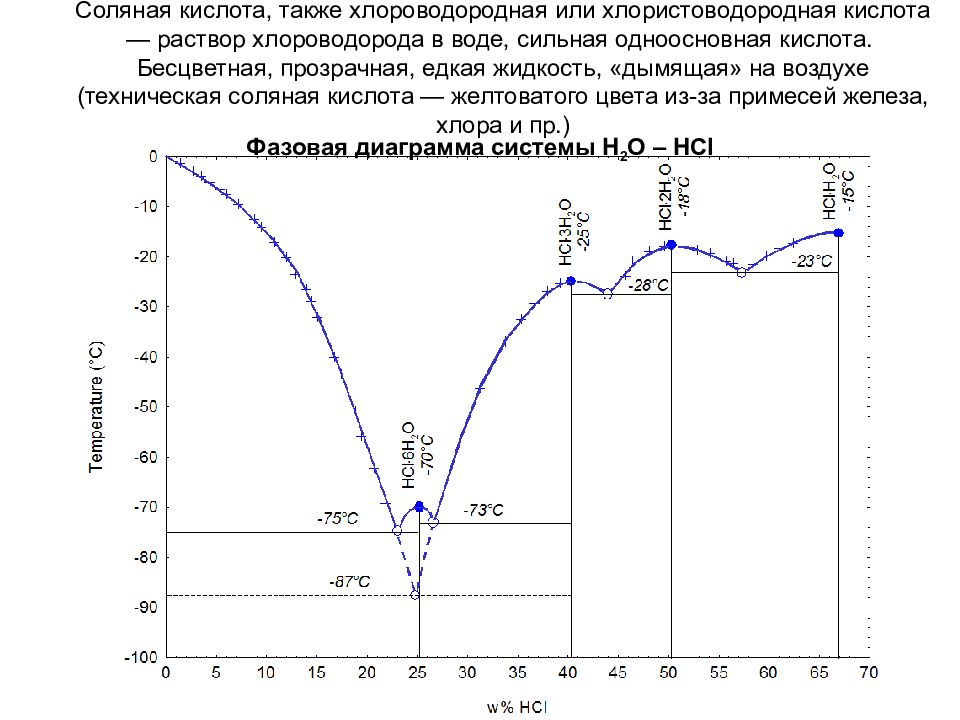
Соляная кислота, также хлороводородная или хлористоводородная кислота — раствор хлороводорода в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящая» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.) Фазовая диаграмма системы H 2 O – HCl
Слайд 16
Соляную кислоту получают В качестве побочного продукта при хлорировании углеводородов (т.н. абгазная кислота, основной способ, более 90% ) В результате прямого синтеза (синтетическая кислота) Сульфатным способом (H 2 SO 4(конц.) + NaCl при 500-550 о С, метод Мангейма, первый промышленный способ, не используется ) Около 40 химико-технологических процессов производят HC l в качестве побочного продукта, около 110 химических производственных процессов используют соляную кислоту в качестве сырья. Соляная кислота, полученная методом сжигания водорода в хлоре, содержит меньше примесей и применяется при необходимости высокой чистоты. Соляная кислота выпускается в растворах с содержанием HCl до 38% (концентрированная). Возможны концентрации до 45%, но при этом скорость испарения настолько высока, что при хранении и обращении требуются дополнительные меры предосторожности, такие как создание давления и охлаждение. В массовой продукции – от 30% до 35%, что позволяет сбалансировать эффективность транспортировки и потери продукта за счет испарения.
Слайд 17
Получение абгазной соляной кислоты Сырьё: газы, образующихся при хлорировании хлорировании и дегидрохлорировании органических соединений, пиролизе хлорорганических отходов, хлоридов металлов, получении калийных нехлорированных удобрений и др. Способ производства: адиабатическая абсорбция водой или разбавленной соляной кислотой в противотоке (теплота используется внутри абсорбера для испарения воды и увеличения концентрации кислоты). Примеси в абгазах : инертные примеси, малорастворимые в воде органические вещества (хлорбензол, хлорметаны), водорастворимые вещества (уксусная кислота, хлораль ), кислые примеси и вода. Изменение температуры (1) и концентрации HCl (2) по высоте абсорбера
Слайд 18
Получение абгазной соляной кислоты 1 – адиабатический абсорбер; 2 – конденсатор; 3 – газоотделитель ; 4 – сепаратор водной и органической фазы; 5 – холодильник; 6, 9 – сборники кислоты; 7 – насосы; 8 – изотермический абсорбер.
Слайд 19
Стадии процесса: Синтез HCl из хлора и водорода Абсорбция хлороводорода Получение синтетической соляной кислоты Сырьё: хлор и водород, полученные при электролизе водных растворов NaCl и другими способами ( Cl 2 – электролиз расплавов, H 2 – из коксового газа, крекинг природного газа) Способ производства: сжигание водорода в токе хлора с последующей абсорбцией водой
Слайд 20
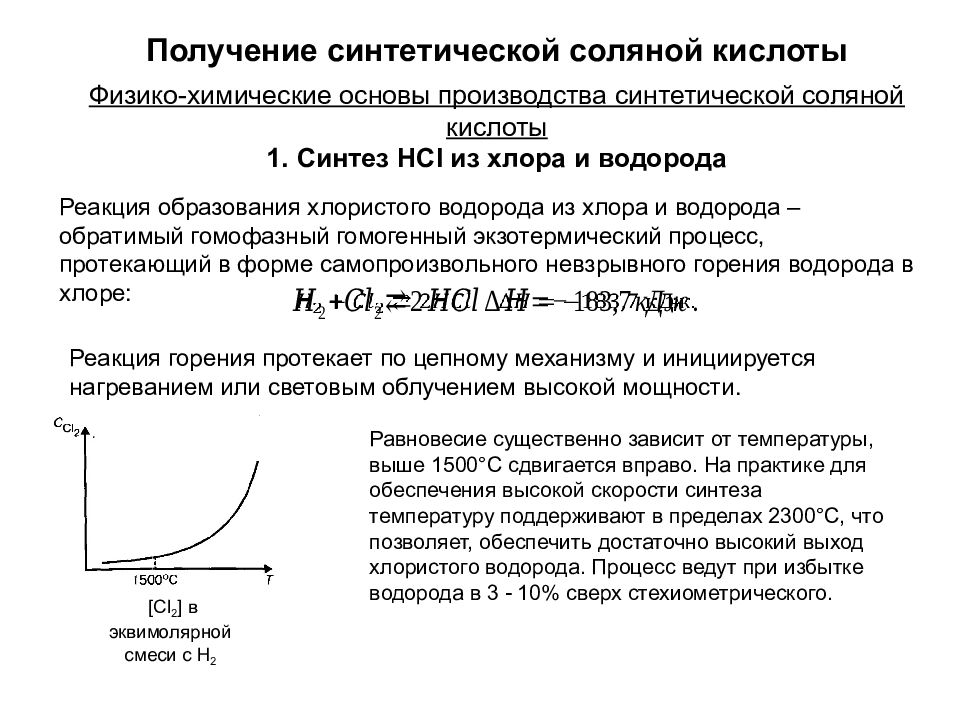
Синтез HCl из хлора и водорода Физико-химические основы производства синтетической соляной кислоты Получение синтетической соляной кислоты Реакция образования хлористого водорода из хлора и водорода – обратимый гомофазный гомогенный экзотермический процесс, протекающий в форме самопроизвольного невзрывного горения водорода в хлоре: Реакция горения протекает по цепному механизму и инициируется нагреванием или световым облучением высокой мощности. Равновесие существенно зависит от температуры, выше 1500°С сдвигается вправо. На практике для обеспечения высокой скорости синтеза температуру поддерживают в пределах 2300°С, что позволяет, обеспечить достаточно высокий выход хлористого водорода. Процесс ведут при избытке водорода в 3 - 10% сверх стехиометрического. [Cl 2 ] в эквимолярной смеси с H 2
Слайд 21
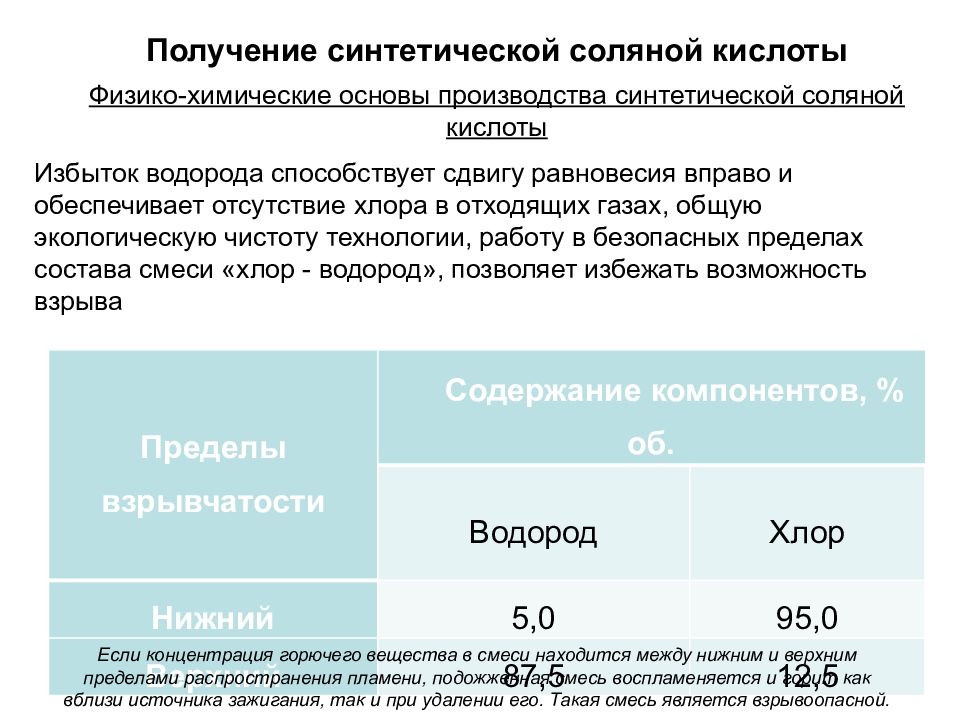
Физико-химические основы производства синтетической соляной кислоты Получение синтетической соляной кислоты Пределы взрывчатости Содержание компонентов, % об. Водород Хлор Нижний 5,0 95,0 Верхний 87,5 12,5 Избыток водорода способствует сдвигу равновесия вправо и обеспечивает отсутствие хлора в отходящих газах, общую экологическую чистоту технологии, работу в безопасных пределах состава смеси «хлор - водород», позволяет избежать возможность взрыва Если концентрация горючего вещества в смеси находится между нижним и верхним пределами распространения пламени, подожженная смесь воспламеняется и горит как вблизи источника зажигания, так и при удалении его. Такая смесь является взрывоопасной.
Слайд 22
2. Абсорбция хлороводорода Физико-химические основы производства синтетической соляной кислоты Получение синтетической соляной кислоты Абсорбция хлористого водорода водой – обратимый гетерофазный гетерогенный экзотермический процесс образования гидратов хлористого водорода и их растворения в воде Тепловой эффект абсорбции (растворения) хлороводорода зависит от значения n (от концентрации образующейся соляной кислоты) и при бесконечном разбавлении ∆ H= -75,1 кДж/моль. Состояние равновесия процесса абсорбции зависит от концентрации хлористого водорода в абсорбируемом газе и температуры.
Слайд 23
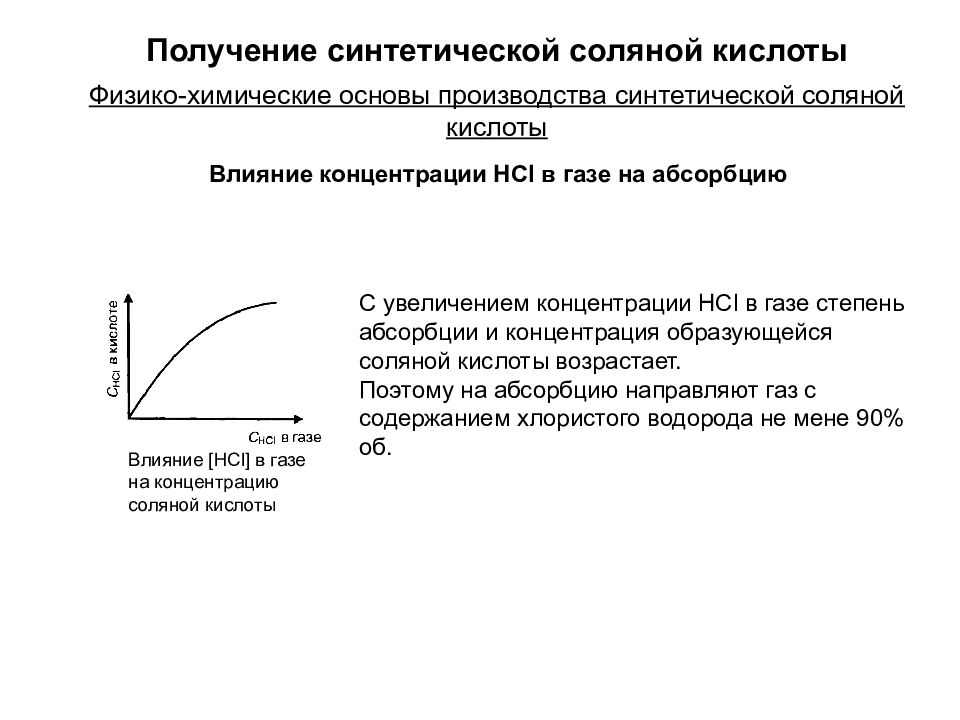
С увеличением концентрации HCl в газе степень абсорбции и концентрация образующейся соляной кислоты возрастает. Поэтому на абсорбцию направляют газ с содержанием хлористого водорода не мене 90% об. Влияние [HCl] в газе на концентрацию соляной кислоты Физико-химические основы производства синтетической соляной кислоты Получение синтетической соляной кислоты Влияние концентрации HCl в газе на абсорбцию
Слайд 24
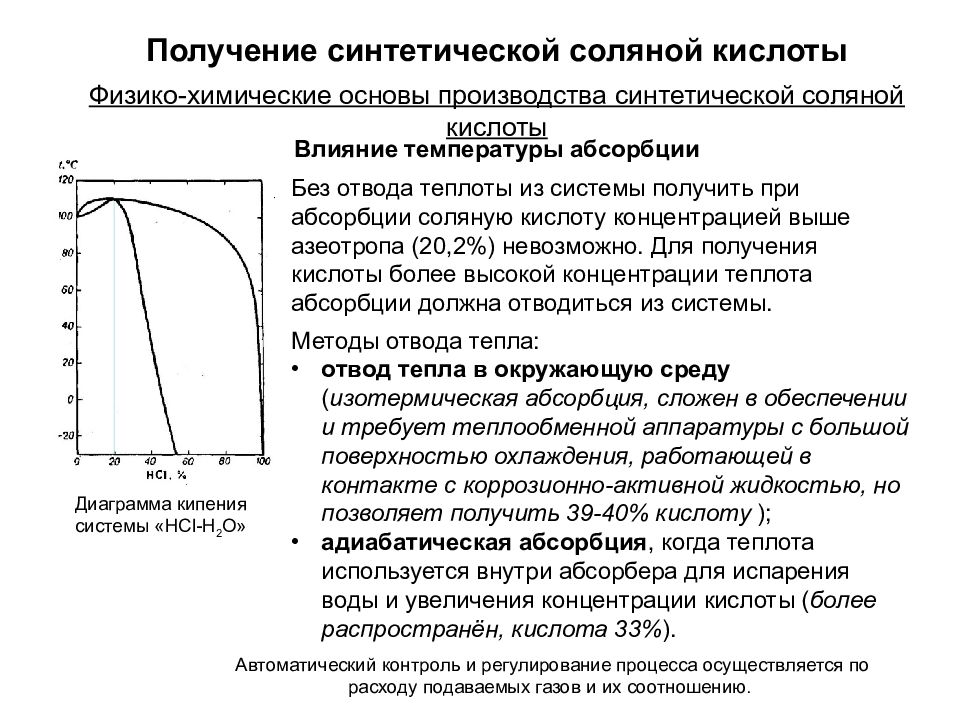
Автоматический контроль и регулирование процесса осуществляется по расходу подаваемых газов и их соотношению. Без отвода теплоты из системы получить при абсорбции соляную кислоту концентрацией выше азеотропа (20,2%) невозможно. Для получения кислоты более высокой концентрации теплота абсорбции должна отводиться из системы. Диаграмма кипения системы «HCl-H 2 O» Методы отвода тепла: отвод тепла в окружающую среду ( изотермическая абсорбция, сложен в обеспечении и требует теплообменной аппаратуры с большой поверхностью охлаждения, работающей в контакте с коррозионно-активной жидкостью, но позволяет получить 39-40% кислоту ); адиабатическая абсорбция, когда теплота используется внутри абсорбера для испарения воды и увеличения концентрации кислоты ( более распространён, кислота 33% ). Физико-химические основы производства синтетической соляной кислоты Получение синтетической соляной кислоты Влияние температуры абсорбции
Слайд 25
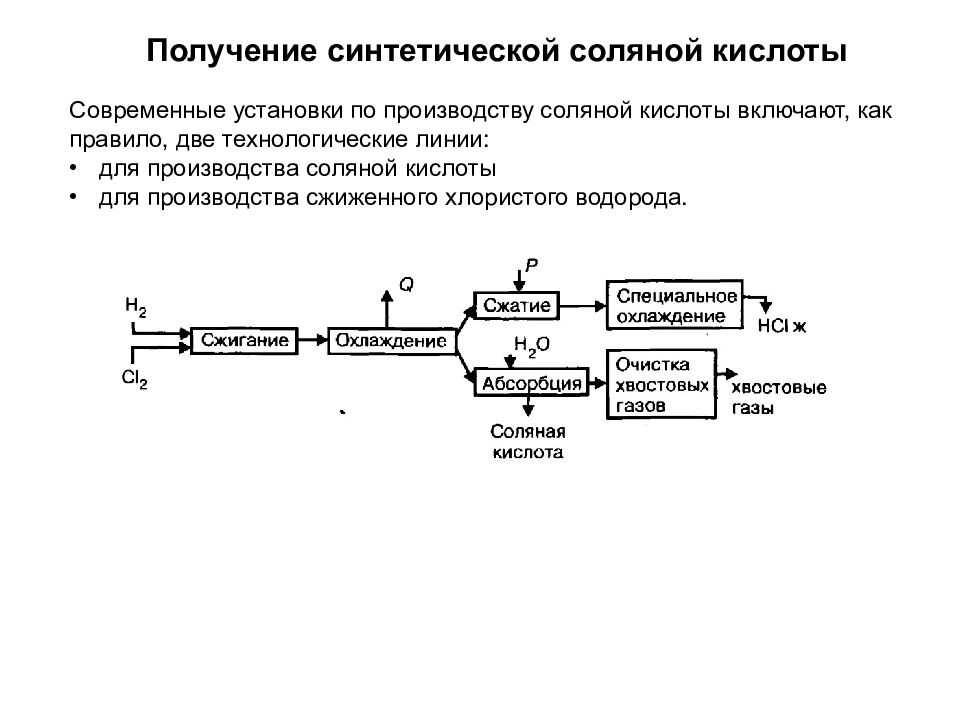
Получение синтетической соляной кислоты Современные установки по производству соляной кислоты включают, как правило, две технологические линии: для производства соляной кислоты для производства сжиженного хлористого водорода.
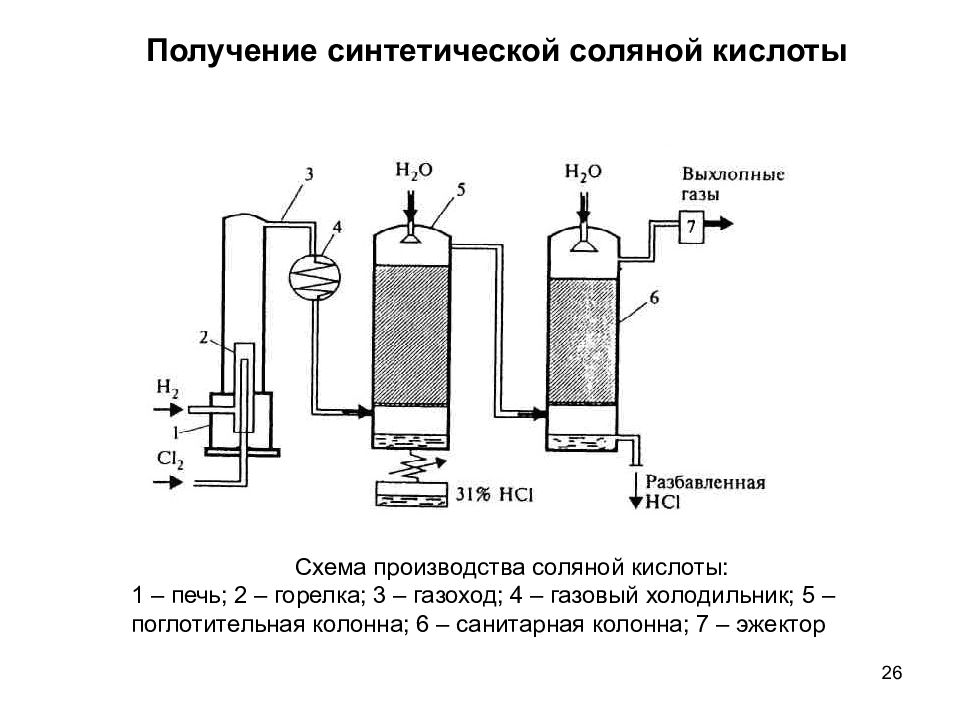
Слайд 26
26 Получение синтетической соляной кислоты Схема производства соляной кислоты: 1 – печь; 2 – горелка; 3 – газоход; 4 – газовый холодильник; 5 – поглотительная колонна; 6 – санитарная колонна; 7 – эжектор
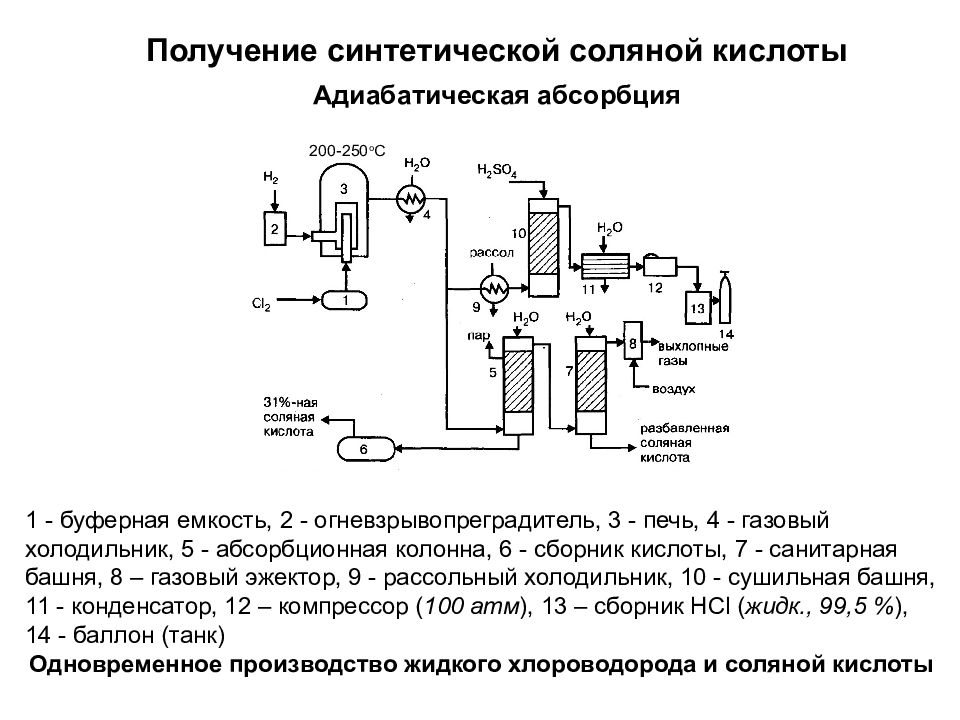
Слайд 27
Получение синтетической соляной кислоты Адиабатическая абсорбция 1 - буферная емкость, 2 - огневзрывопреградитель, 3 - печь, 4 - газовый холодильник, 5 - абсорбционная колонна, 6 - сборник кислоты, 7 - санитарная башня, 8 – газовый эжектор, 9 - рассольный холодильник, 10 - сушильная башня, 11 - конденсатор, 12 – компрессор ( 100 атм ), 13 – сборник HCl ( жидк., 99,5 % ), 14 - баллон (танк) Одновременное производство жидкого хлороводорода и соляной кислоты 200-250 o C
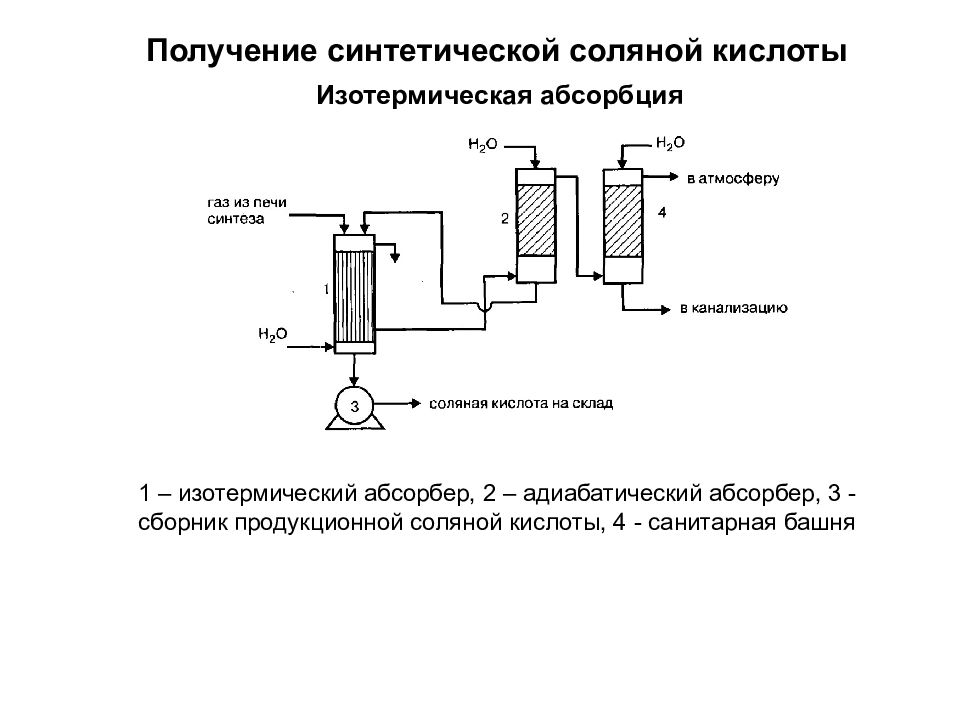
Слайд 28
Получение синтетической соляной кислоты Изотермическая абсорбция 1 – изотермический абсорбер, 2 – адиабатический абсорбер, 3 - сборник продукционной соляной кислоты, 4 - санитарная башня
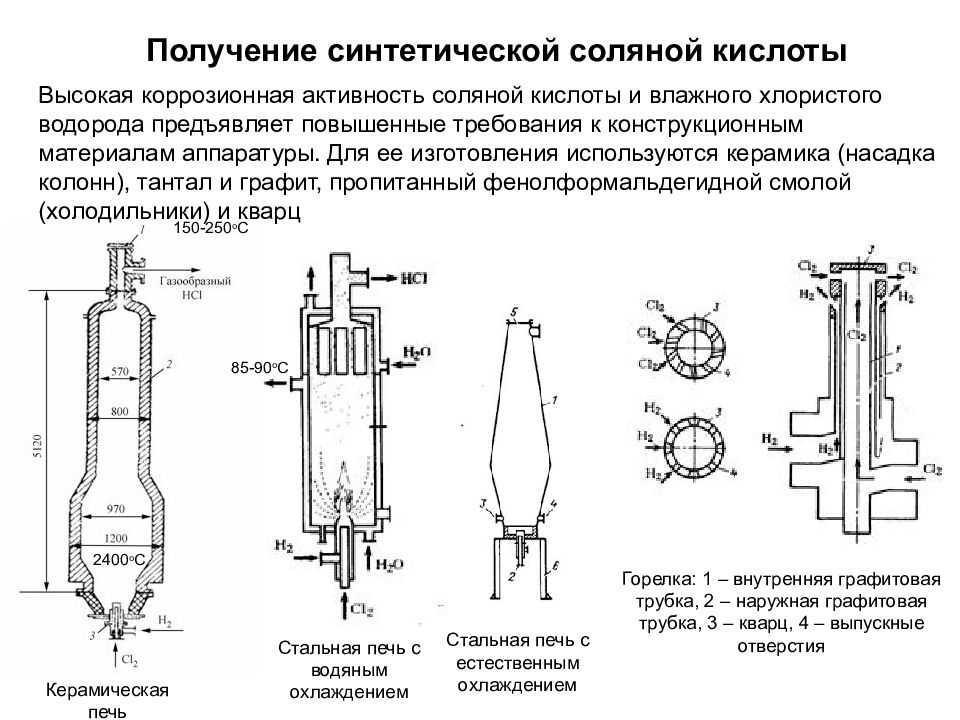
Слайд 29
Высокая коррозионная активность соляной кислоты и влажного хлористого водорода предъявляет повышенные требования к конструкционным материалам аппаратуры. Для ее изготовления используются керамика (насадка колонн), тантал и графит, пропитанный фенолформальдегидной смолой (холодильники) и кварц Получение синтетической соляной кислоты Горелка: 1 – внутренняя графитовая трубка, 2 – наружная графитовая трубка, 3 – кварц, 4 – выпускные отверстия Керамическая печь Стальная печь с водяным охлаждением 150 -250 o C 240 0 o C 85-9 0 o C Стальная печь с естественным охлаждением
Слайд 30
Фосфорная кислота. Товарный продукт: упаренная фосфорная кислота с содержанием P 2 O 5 42–53 %, на некоторых предприятиях — неупаренная фосфорная кислота с содержанием P2O5 24–37 %. Фосфорная кислота по объему производства является наиболее важной минеральной кислотой после серной кислоты. Основные потребители: производства фосфорсодержащих удобрений и кормовых фосфатов (более 95 % объема выпуска), для получения солей натрия, калия, кальция и аммония, для обработки поверхности металлов. В незначительных объемах фосфорная кислота пищевых марок потребляется для подкисления напитков и для получения пищевых фосфатных солей. Методы получения: термический процесс — используется элементный фосфор, получаемый из фосфатной руды, кокса и кремнезема в электрических печах; экстракционный процесс — природные фосфаты разлагаются азотной, соляной или серной (основной способ) кислотами. В России в настоящее время доля производства фосфорной кислоты экстракционным способом составляет 100 %.
Слайд 31
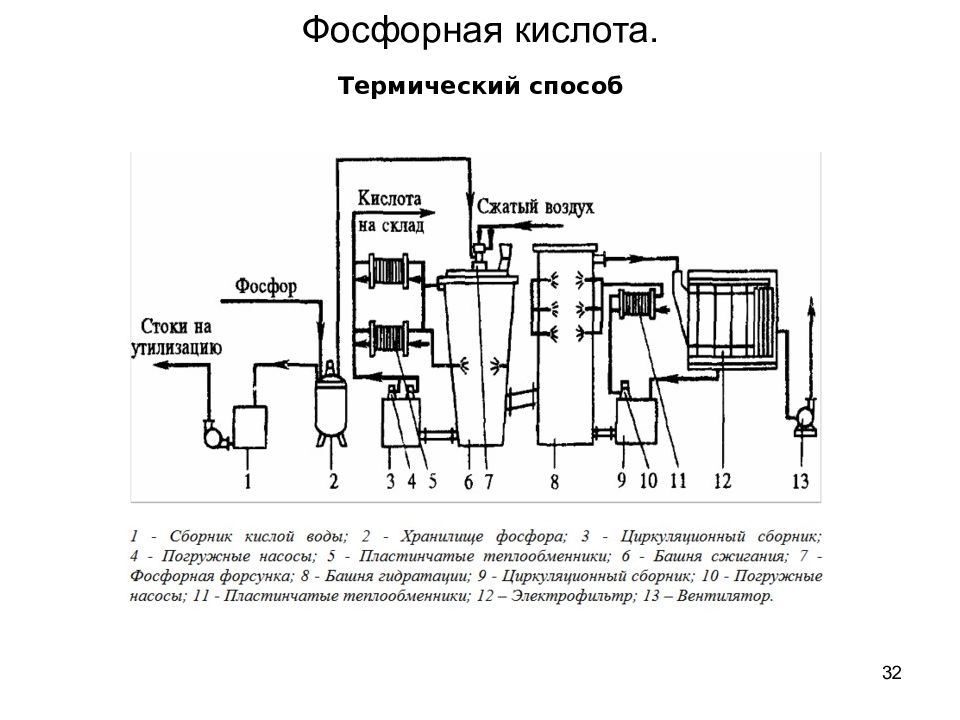
31 Термический способ Этапы получения ортофосфорной кислоты (ОФК): Высокотемпературное восстановление (отделение) фосфора в электрических печах в присутствии углерода и кремнезема (не показано): Са 3 (РО 4 ) 2 + 5С + 2SiO 2 = P 2 + 5CO + Ca 3 Si 2 O 7, где Р 2 — выделенный фосфор. 2. Окисление фосфора в печи (сжигание с подачей сжатого воздуха) до фосфорного ангидрида: 2Р 2 + 5О 2 = 2Р 2 О 5 Гидратация ангидрида водой (в башне гидратации) с получением ОФК в виде газовой фазы (туман): Р 2 О 5 + 3Н 2 О = 2Н 3 РО 4 Конденсация охлаждением в теплообменнике Н 3 РО 4 в жидкую фазу ОФК. В качестве хладагента применяют воду или оборотную (возвратную, не расходуемую) фосфорную кислоту. Практикуют комбинированные системы конденсации: теплообменные, циркуляционные и испарительные. Полученную ортофосфорную кислоту перекачивают погружными насосами. { Термический способ позволяет перерабатывать даже бедное сырьё с низким содержанием фосфатов и получить на выходе ОФК высокой чистоты. Способ энергозатратный, поэтому сейчас применяется редко. } Фосфорная кислота.
Слайд 33
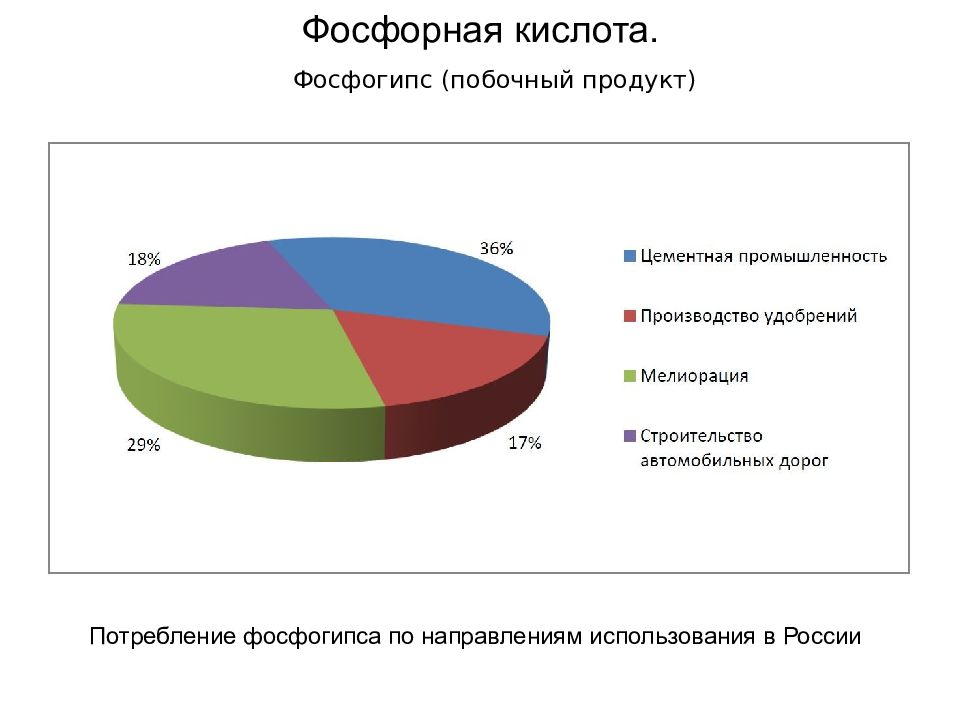
33 Экстракционный способ Фосфорная кислота. Способ основан на вытеснении ОФК из фосфатов сильными кислотами и не требует предварительного выделения фосфора из сырья. В качестве сильной кислоты чаще всего применяется серная кислота H 2 SO 4. Процесс производства экстракционной ортофосфорной кислоты (ЭФК) происходит в баковом экстракторе по следующей упрощенной формуле: Ca 5 F(PO 4 ) 3 + 5H 2 SO 4 = 5CaSO 4 + 3Н 3 РО 4 + HF, где Ca 5 F(PO 4 ) 3 – загружаемое подготовленное сырье, Н 3 РО 4 – ЭФК, CaSO 4 – фосфогипс (побочный продукт), HF – фтористый водород. Фтористый водород взаимодействует с H 2 SiO 3 (присутствует как примесь): 4HF + H 2 SiO 3 = SiF 4 + 3H 2 O Часть SiF 4 улетучивается в газовую среду, а часть остается в растворе ЭФК в виде H 2 SiF 6. Основной процесс происходит в баках экстракции, куда подаются дозированные сырье, серная кислота и оборотная часть ЭФК для разбавления концентрата-пульпы (в смешанном растворе серной и фосфорной кислот процесс идет активнее, повышается выход ЭФК). Дозирование имеет важное значение для активности химических процессов, повышения выхода ЭФК. Полученная ЭОФК имеет низкую концентрацию и небольшое количество примесей сырья, её необходимо упаривать. Из-за более низкой себестоимости экстракционный способ рентабельнее термического. { Недостаток способа — наличие небольшого количества примесей гипса, соединений фтора, окислов железа и алюминия }
Слайд 34
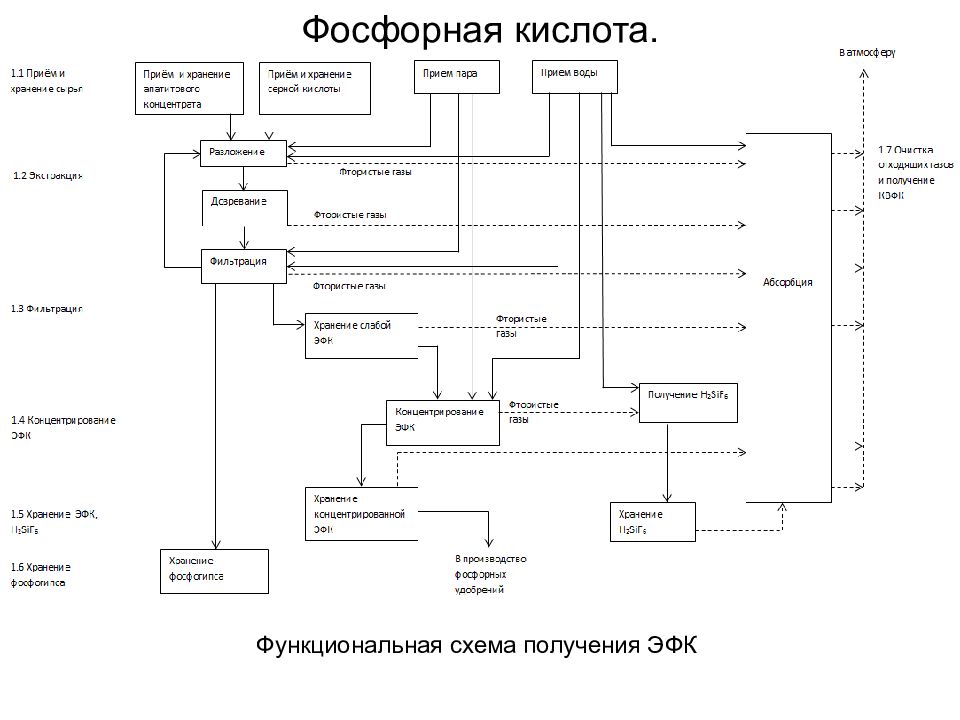
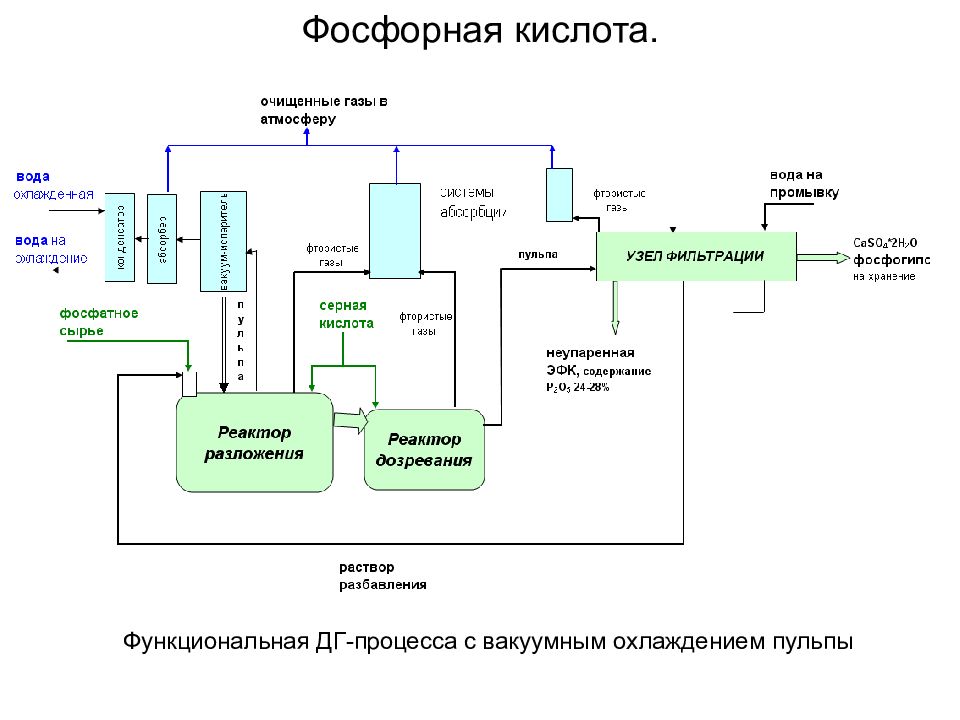
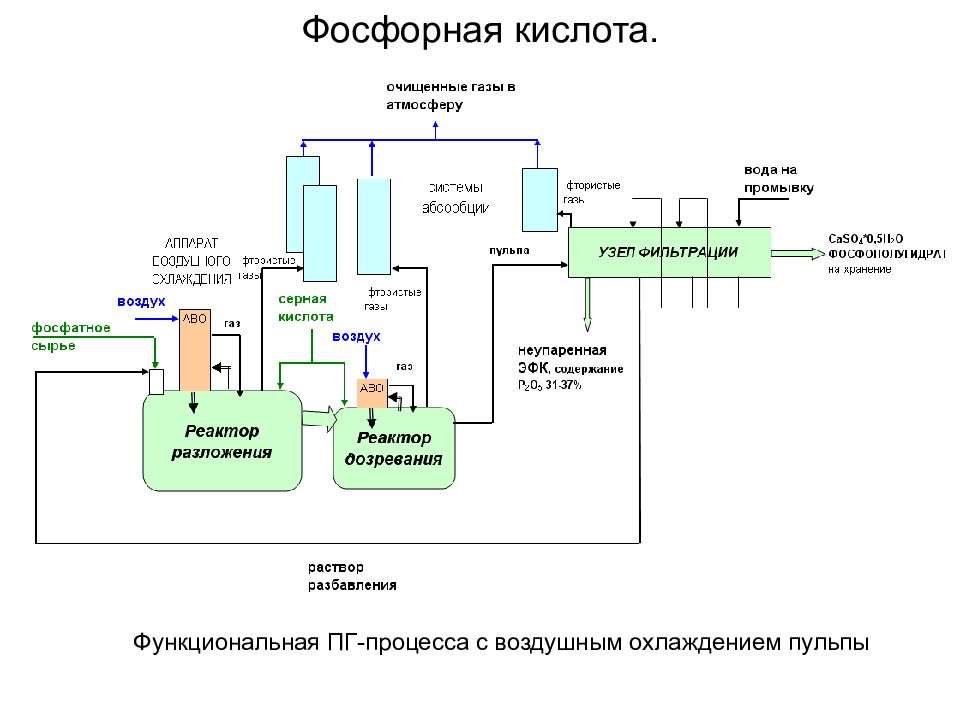
Основные стадии ХТПр получения экстракционной фосфорной кислоты (ЭФК): прием и хранение фосфатного сырья и серной кислоты; экстракция — разложение фосфатного сырья с кристаллизацией сульфата кальция в форме дигидрата либо полугидрата; фильтрация — разделение реакционной пульпы на вакуум-фильтрах с многократной противоточной промывкой осадка; концентрирование ЭФК; хранение ЭФК, кремнефтористоводородной кислоты; хранение фосфогипса; абсорбционная очистка образующихся в процессе производства и хранения ЭФК фторсодержащих газов перед выбросом в атмосферу с получением кремнефтористоводородной кислоты. Фосфорная кислота. В зависимости от способа кристаллизации CaSO 4 различают два процесса производства ЭФК с сернокислотным разложением фосфатного сырья: дигидратный (ДГ) полугидратный (ПГ)
Слайд 36
Функциональная ДГ-процесса с вакуумным охлаждением пульпы Фосфорная кислота.
Слайд 37
Функциональная ПГ-процесса с воздушным охлаждением пульпы Фосфорная кислота.