Первый слайд презентации
Раздел: 9.3А Элементы 17 (VII), 16 (VI), 15 (V), 14 (VІ) групп и их соединения Тема: Фосфор и его соединения 9 класс
Слайд 2
2 9.2.1.22 - сравнивать аллотропные модификации фосфора; 9.4.2.2 - называть месторождения соединений фосфора в Казахстане; 9.2.1.23 - объяснять общие химические свойства фосфора и его соединений. Цели обучения: Критерии оценивания: Знает аллотропные модификации фосфора и строения молекулы фосфора; Объясняет химическую активность фосфора и называет продукты горения фосфора; Прогнозирует свойства фосфора и соединений фосфора; Перечисляет месторождения соединений фосфора в Казахстане.
Слайд 3: Отгадайте металл
Вспомним рассказ «Собака Баскервиллей» Конан Дойла. Вот что увидел доктор Ватсон : “Это была собака, огромная, черная как смоль. Ее пасть светилась голубоватым пламенем, глубоко сидящие дикие глаза метали искры, по загривку вырывался мерцающий огонь. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. - В этом рассказе о каком элементе говорится? Отгадайте металл 3
Слайд 4
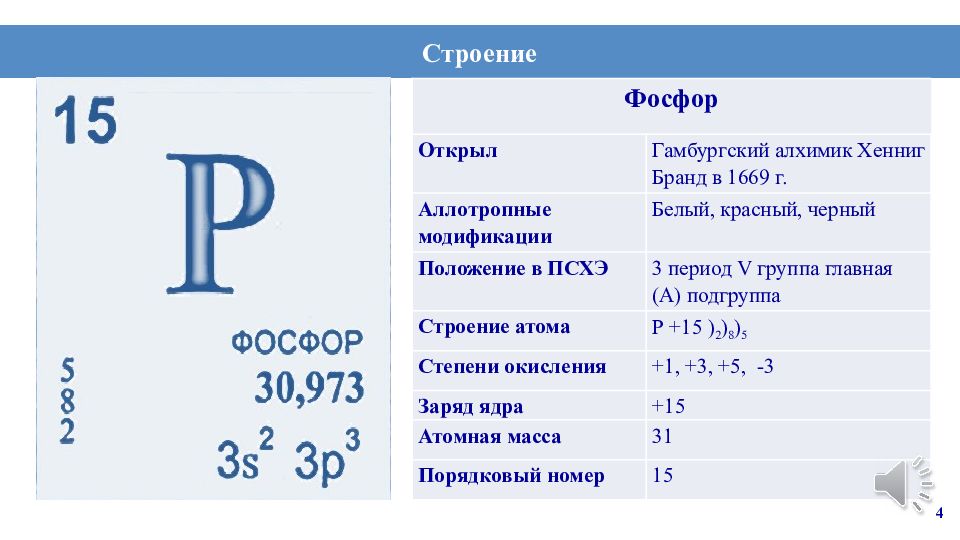
4 Строение Фосфор Открыл Гамбургский алхимик Хенниг Бранд в 1669 г. Аллотропные модификации Белый, красный, черный Положение в ПСХЭ 3 период V группа главная (А) подгруппа Строение атома Р +15 ) 2 ) 8 ) 5 Степени окисления +1, +3, +5, -3 Заряд ядра +15 Атомная масса 31 Порядковый номер 15
Слайд 5
5 Нахождение в природе Апатит Ca 3 (PO 4 ) 3 Фосфорит Ca 3 (PO 4 ) 2 Фосфор – весьма распространенный элемент на земле. Он занимает 13 место по распространенности. Вследствие высокой химической активности фосфор в свободном состоянии в природе не встречается. Он находится не менее чем в 190 минералах, из которых главнейшими являются апатиты и фосфориты. В Актюбинской области общие запасы достигают многих сотен миллионов тонн. Пласт фосфоритов в Каратау (Жамбылская область) достигает мощности 10-12 м, а в некоторых местах – 30м.
Слайд 6
6 Получение Образующиеся пары фосфора конденсируются под водой, при этом образуется белый фосфор, в узлах кристаллической решетки которого находятся молекулы Р 4.
Слайд 8
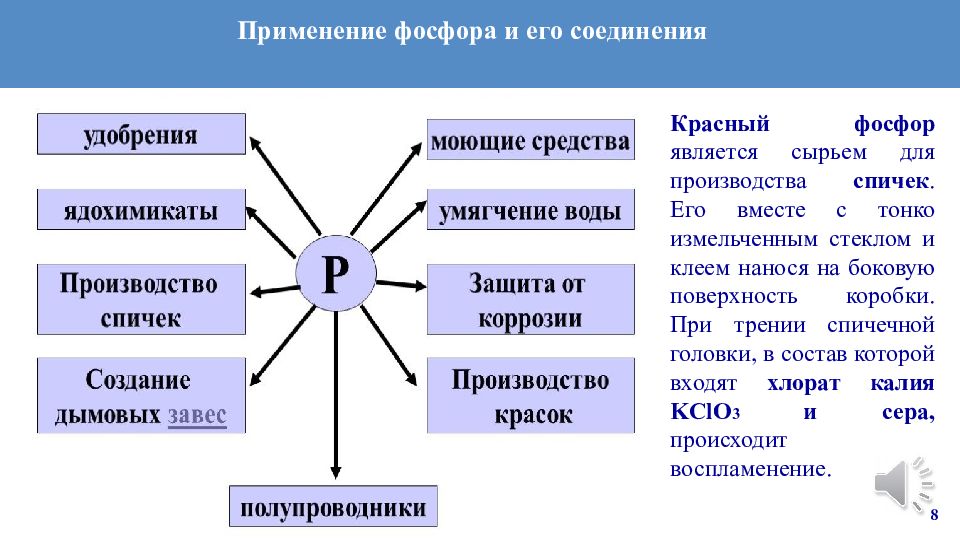
8 Красный фосфор является сырьем для производства спичек. Его вместе с тонко измельченным стеклом и клеем нанося на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия KClO 3 и сера, происходит воспламенение. Применение фосфора и его соединения
Слайд 11
11 Химические свойства фосфорной кислоты 1. С металлами, стоящими в ряду напряжения металлов до водорода: 3 Mg + 2H 3 PO 4 = Mg 3 (PO 4 ) 3 + 3H 2 ↑ 2. С основными оксидами: 3 CaO + 2H 3 PO 4 = Ca 3 (PO 4 ) 3 + 3H 2 O 3. С основаниями и аммиаком: H 3 PO 4 + NaOH = Na 3 PO 4 + 3H 2 O H 3 PO 4 + NH 3 = (NH 4 ) 2 HPO 4 4. С солями слабых кислот: H 3 PO 4 + Na 2 CO 3 = Na 3 PO 4 + 3H 2 O + 3CO 2 ↑ 5. При действии раствора нитрата серебра появляется желтый осадок: H 3 PO 4 + 3AgNO 3 = Ag 3 PO 4 ↓ + 3HNO 3 Это качественная реакция на фосфорную кислоту и ее соли – фосфаты.
Слайд 12
12 Соли фосфорной кислоты Фосфорная кислота может давать три ряда солей: кислые соли – гидрофосфаты и дигидрофосфаты, средние соли – фосфаты. Получение: Реакции неполной нейтрализации: H 3 PO 4 + 2 NaOH = Na 3 Н PO 4 + 2 H 2 O – гидрофосфат натрия H 3 PO 4 + NaOH = Na Н 2 PO 4 + 2 H 2 O – дигидрофосфат натрия 2. Реакция полной нейтрализации: H 3 PO 4 + NaOH = Na 3 PO 4 + 3 H 2 O – фосфат натрия
Слайд 13
13 Свойства солей фосфорной кислоты Физические свойства: Средние соли, или фосфаты, кроме фосфатов натрия, калия и аммония, нерастворимы в воде, например Ca 3 (PO 4 ) 2, кислые соли – дигидрофосфаты – большинство хорошо растворимы в воде, например С a (Н 2 PO 4 ) 2, гидрофосфаты – занимают промежуточное положение между фосфатами и дигидрофосфатами по растворимости. Химические свойства: Для средних солей фосфорной кислоты характерны все свойства солей. Кислые соли могут взаимодействовать со щелочами и разлагаться при нагревании на среднюю соль и H 3 PO 4 : Со щелочами: Na Н 2 PO 4 + NaOH = Na 3 PO 4 + H 2 O Разложение: 3 Na Н 2 PO 4 = Na 3 PO 4 + 2 H 3 PO 4
Слайд 14
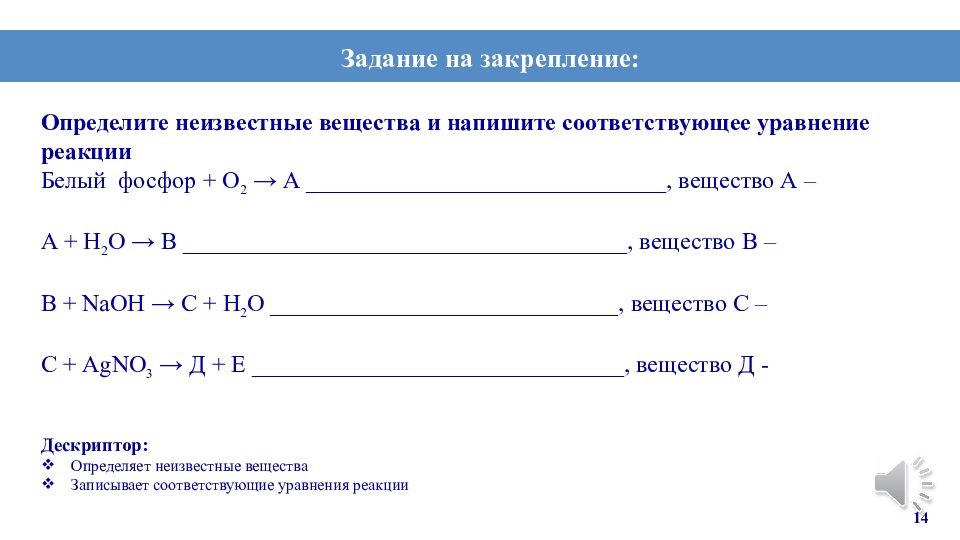
Определите неизвестные вещества и напишите соответствующее уравнение реакции Белый фосфор + О 2 → А ______________________________, вещество А – А + Н 2 О → В _____________________________________, вещество В – В + NаОН → С + Н 2 О _____________________________, вещество С – С + АgNО 3 → Д + Е _______________________________, вещество Д - Дескриптор: Определяет неизвестные вещества Записывает соответствующие уравнения реакции 14 Задание на закрепление:
Слайд 15
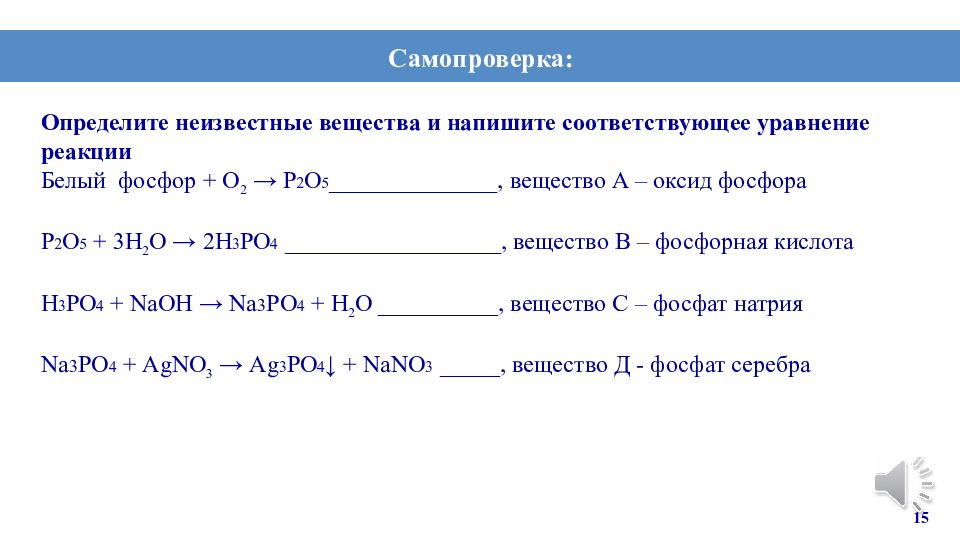
Определите неизвестные вещества и напишите соответствующее уравнение реакции Белый фосфор + О 2 → P 2 O 5 ______________, вещество А – оксид фосфора P 2 O 5 + 3 Н 2 О → 2H 3 PO 4 __________________, вещество В – фосфорная кислота H 3 PO 4 + NаОН → Na 3 PO 4 + Н 2 О _______ __ _, вещество С – фосфат натрия Na 3 PO 4 + АgNО 3 → Ag 3 PO 4 ↓ + NaNO 3 _____, вещество Д - фосфат серебра 15 Самопроверка:
Слайд 16
Какая реакция является качественной реакцией на фосфаты, что приводит к образованию осадка................. Запишите молекулярные, ионные, сокращенные ионные реакции. Дескриптор: Определяет качественную реакцию на фосфаты Записывает цвет образующегося осадка Записывает молекулярные, ионные, сокращенные ионные реакции 16 Задание на закрепление:
Слайд 18
Сегодня на уроке: рассмотрели аллотропные модификации фосфора; назвали месторождения соединений фосфора в Казахстане; объяснили общие химические свойства фосфора и его соединений. Итоги урока: 18
Слайд 19
Учебное задание: Дополнительные ресурсы: 19 Учебник Химия 9 класс. Авторы: М.К. Оспанова, К.С. Аухадиева, Т.Г. Белоусова. Алматы «Мектеп», 2019 https://bilimland.kz/ru/subject/ximiya/9-klass/fosfor-i-ego-soedineniya Работа будет успешной, если вы: Правильно будете составлять формулы соединении; Правильно проставлять коэффициенты перед формулами и уравнивать химические реакции