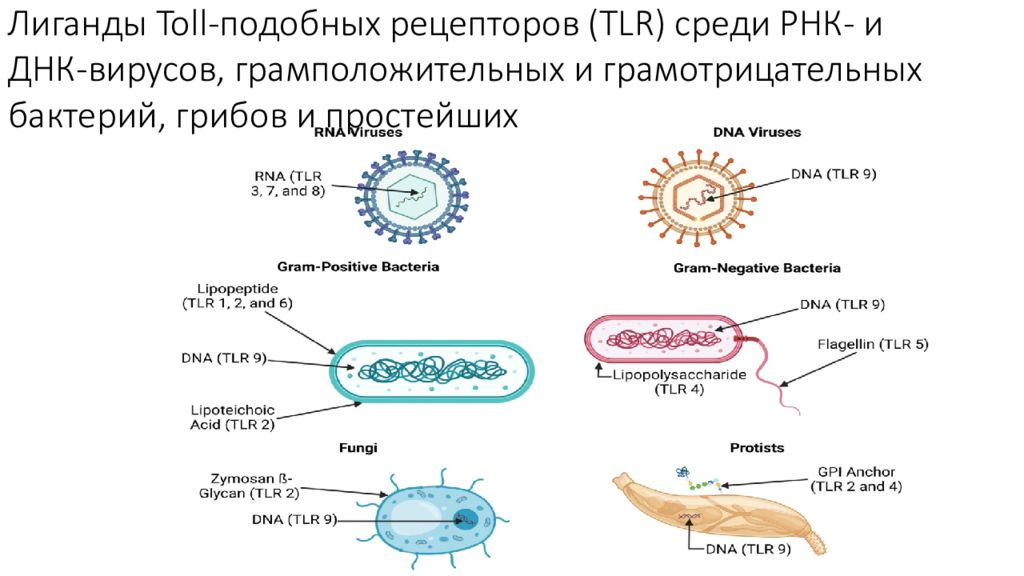
Слайд 2: Лиганды Toll-подобных рецепторов (TLR) среди РНК- и ДНК-вирусов, грамположительных и грамотрицательных бактерий, грибов и простейших
Слайд 4
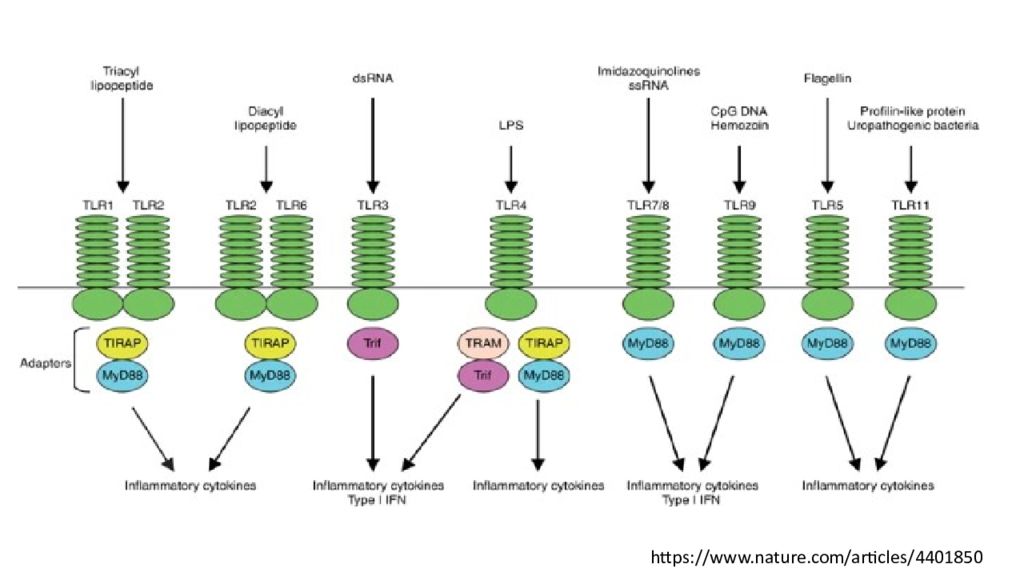
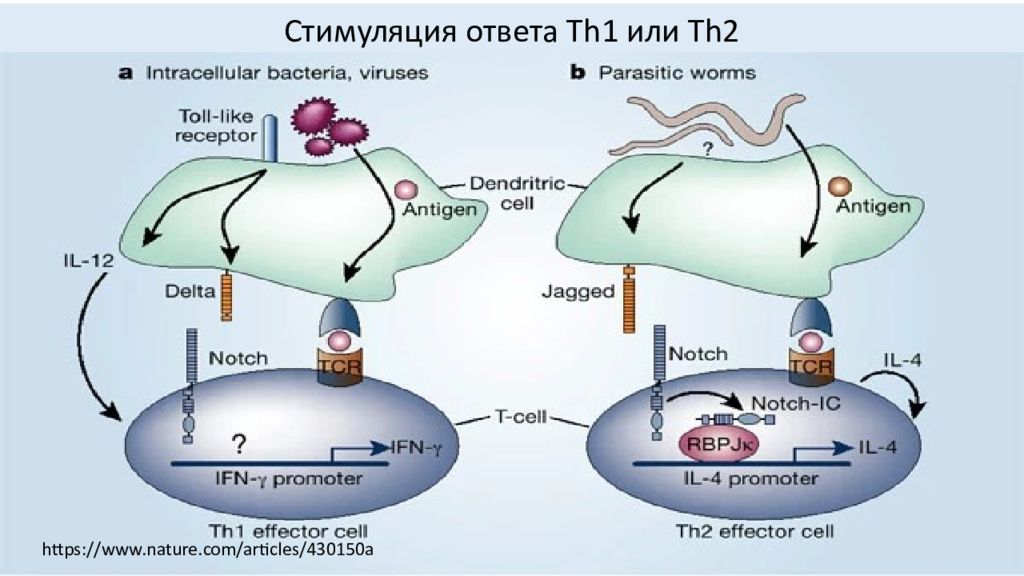
Иммунные реакции, опосредованные TLR. TLR2 совместно с TLR1 или TLR6 различает молекулярные паттерны триацил- и диациллипопептида соответственно. TLR3 распознает dsRNA. TLR4 распознает бактериальный LPS. TLR7/8 опосредует распознавание имидазохинолинов и ssRNA. TLR9 распознает CpG ДНК бактерий и вирусов. TLR5 распознает бактериальный флагеллин TLR1/2 и TLR2/6 используют MyD88 и TIRAP/MAL в качестве основных адаптеров. TLR3 использует Trif. TLR4 использует четыре адаптера, включая MyD88, TIRAP/MAL, Trif и TRAM. TLR7/8, TLR9, TLR5 используют только MyD88. Зависимый от MyD88 путь контролирует воспалительные реакции, в то время как Trif в основном опосредует реакции IFN типа I. Кроме того, TLR7/8 и TLR9 индуцируют IFN типа I в зависимом от MyD88 образе в pDC
Слайд 6
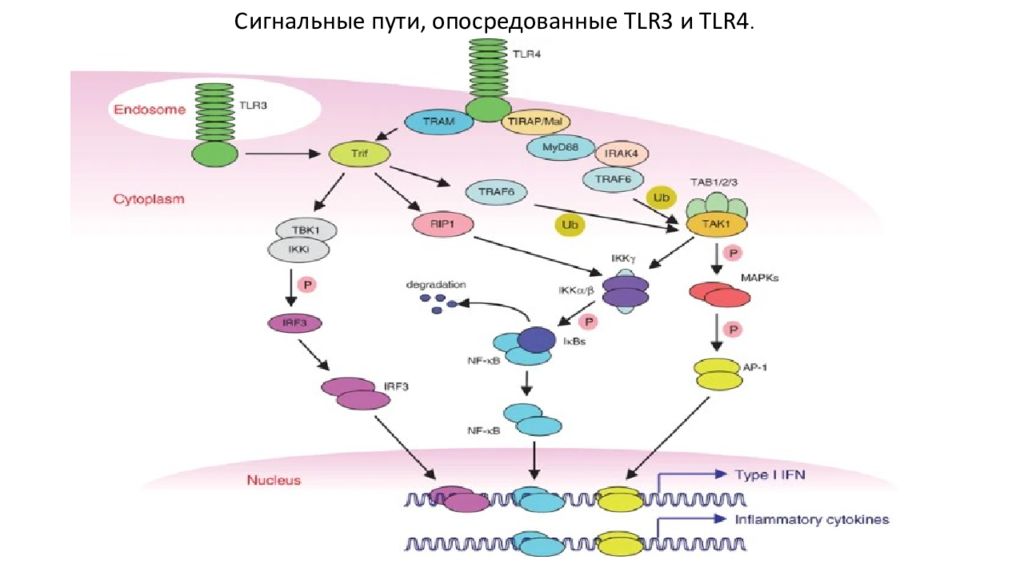
TLR4 активирует MyD88-зависимые и Trif-зависимые пути. MyD88 рекрутирует IRAK4 и TRAF6 при стимуляции лигандом. TRAF6 активирует комплекс TAK1/TAB1/TAB2/TAB3 через K63-связанное убиквитинирование (Ub). Активированный комплекс TAK1 затем активирует комплекс IKK, состоящий из IKK α, IKK β и IKK γ /Nemo, которые катализируют I κ Bs (P). I κ Bs разрушаются протеасомным путем, позволяя NF- κ B транслоцироваться в ядра. TAK1 одновременно активирует путь MAP-киназы, что приводит к фосфорилированию (P) и активации AP-1. NF- κ B и AP-1 контролируют воспалительные реакции, индуцируя провоспалительные цитокины. TLR4 также рекрутирует TRAM и Trif, которые взаимодействуют с TBK1. TBK1 вместе с IKKi опосредует фосфорилирование IRF3 (P). Фосфорилированный IRF3 димеризуется и транслоцируется в ядро для связывания ДНК. Trif также взаимодействует с TRAF6 и RIP1, которые опосредуют активацию NF- κ B. Активация IRF3, NF- κ B и AP-1 необходима для индукции IFN типа I, в частности IFNβ. TLR3, который находится в эндосомальных пузырьках, использует Trif, но не MyD88, TIRAP/Mal и TRAM для своей сигнализации. MAPK, MAP-киназы
Слайд 7
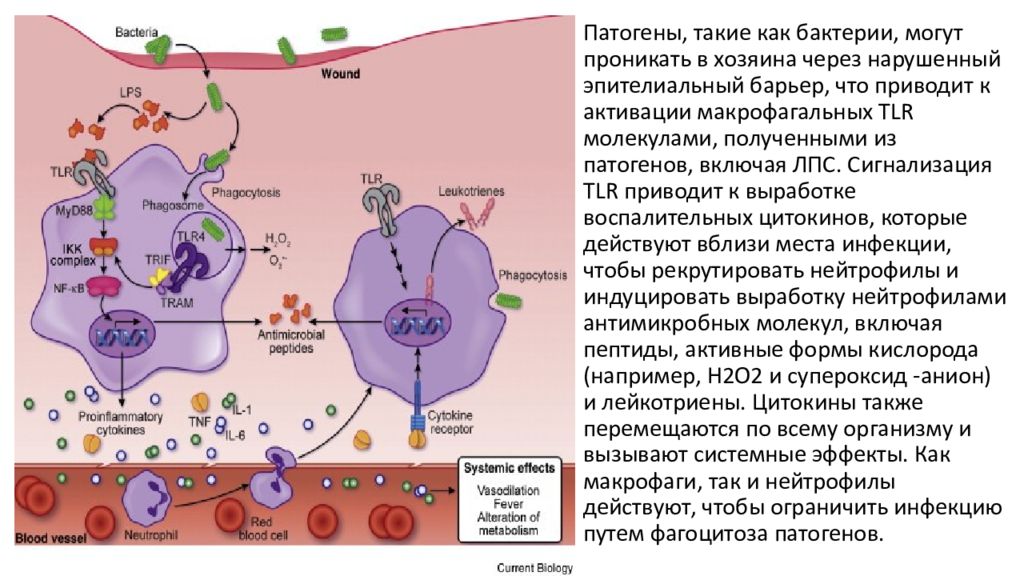
Патогены, такие как бактерии, могут проникать в хозяина через нарушенный эпителиальный барьер, что приводит к активации макрофагальных TLR молекулами, полученными из патогенов, включая ЛПС. Сигнализация TLR приводит к выработке воспалительных цитокинов, которые действуют вблизи места инфекции, чтобы рекрутировать нейтрофилы и индуцировать выработку нейтрофилами антимикробных молекул, включая пептиды, активные формы кислорода (например, H2O2 и супероксид -анион) и лейкотриены. Цитокины также перемещаются по всему организму и вызывают системные эффекты. Как макрофаги, так и нейтрофилы действуют, чтобы ограничить инфекцию путем фагоцитоза патогенов.
Слайд 8
IL-2, продуцируется CD4 + и CD8 + Т-клетками, активированными DC, а также NK- и NKT-клетками. IL-2 необходим для развития Treg-клеток. IL-2 является регулятором ILC и действует как фактор роста B-клеток, стимулирует синтез антител и способствует пролиферации и дифференцировке NK-клеток для повышения их цитолитических функций IL-4 вырабатывается клетками T H 2, ILC типа 2, базофилами, тучными клетками и эозинофилами. IL-4 регулирует аллергические состояния и защитный иммунный ответ против гельминтов и других внеклеточных паразитов. IL-4 является основным стимулом развития клеток T H 2 и вызывает переключение класса IgE в B-клетках. Он также подавляет развитие иммунитета типа 1, включая клетки T H 1 и макрофаги M1. IL-1 состоит из 2 основных белков: IL-1α и IL-1β. Хотя IL-1α и IL-1β обладают схожими биологическими свойствами; IL-1α транслируется в про-IL-1α, уже биологически активную форму, тогда как IL-1β транслируется в про-IL-1β, который не обладает биологической активностью, пока не будет обработан активацией инфламмасомы и каспазы-1. IL-1α и IL-1β оказывают схожие эффекты, связываясь с рецептором IL-1 типа I.- провоспалительный IL IL-10 — противовоспалительный интерлейкин, вырабатываемый в основном моноцитами, Т-клетками (Treg-клетками типа 1), В-клетками (Breg-клетками), небольшой фракцией NK-клеток, макрофагами и DC. https://www.jacionline.org/article/s0091-6749(16)30715-1/fulltext
Слайд 9
Биоактивная форма IL-12 (IL-12p70), впервые описанная как NK-стимулирующий фактор, представляет собой гетеродимер, состоящий из 2 субъединиц: легкой цепи 35 кДа (p35) и тяжелой цепи 40 кДа (p40). вырабатывается активированными моноцитами, макрофагами, нейтрофилами, микроглией и DC. Субъединица p40, называемая IL-12p40 и секретируемая в отсутствие p35 как мономер или гомодимер АПК, как было показано, ингибирует зависимые от IL-12 иммунные функции IL-12 опосредует развитие и поддержание клеток T H 1, индуцируя продукцию IFN-γ клетками T H 1 и NK. Кроме того, он играет важную роль в индукции ILC1. 116 IL-12 косвенно активирует антимикробную, противопаразитарную и противоопухолевую активность макрофагов и способствует цитолитической активности NK-клеток и лимфокин-активируемых клеток-киллеров IL-17A экспрессируется активированными клетками CD4 + T H 17 IL-17A привлекает нейтрофилы для опосредования защиты от различных патогенов. Клетки IL-17A и T H 17 участвуют в нескольких воспалительных заболеваниях, включая ревматоидный артрит Клетки врожденной (например, NK-клетки, NKT-клетки, макрофаги и миеломоноцитарные клетки) и адаптивной (например, клетки T H 1, цитотоксические Т-лимфоциты и В-клетки) иммунной системы продуцируют IFN-γ. Высокие уровни IFN-γ экспрессируются клетками T H 1, активируя макрофаги для уничтожения микробов
Слайд 10
Все ядросодержащие клетки могут вырабатывать и реагировать на IFN-αβ в контексте вирусной инфекции, но плазмоцитоидные ДК являются наиболее распространенным источником, вырабатывая до 1000 раз больше IFN-αβ IFN-αβ связывается как со специфическим комплексом рецепторов клеточной поверхности (IFNAR), так и на инфицированной вирусом клетке и на близлежащих неинфицированных клетках. TGF-β вырабатывается различными клетками, такими как эпителиальные клетки, фибробласты и иммунные клетки (например, макрофаги, эозинофилы и лимфоциты). TGF-β является одним из основных цитокинов для подавляющей функции Treg-клеток и дифференциации провоспалительных клеток T H 17 и T H 9 TNF-α является важным плейотропным цитокином, играет двойную роль в регуляции иммунных реакций, действуя как провоспалительный медиатор, инициируя сильную воспалительную реакцию, и иммуносупрессивный медиатор, ингибируя развитие аутоиммунных заболеваний и опухолегенеза, и играя жизненно важную роль в поддержании иммунного гомеостаза, ограничивая степень и продолжительность воспалительных процессов. TNF-α играет важную роль в защите хозяина от вирусных, бактериальных, грибковых и паразитарных патогенов, в частности от внутриклеточных бактериальных инфекций, таких как Mycobacterium tuberculosis и Listeria monocytogenes. Высокий системный уровень TNF-α может привести к септическому шоку. Локальное увеличение концентрации TNF-α вызывает 5 основных признаков воспаления: жар, отек, покраснение, боль и потерю функции. TNF-α участвует в развитии аллергических заболеваний, в частности астмы и атопического дерматита.
Слайд 11
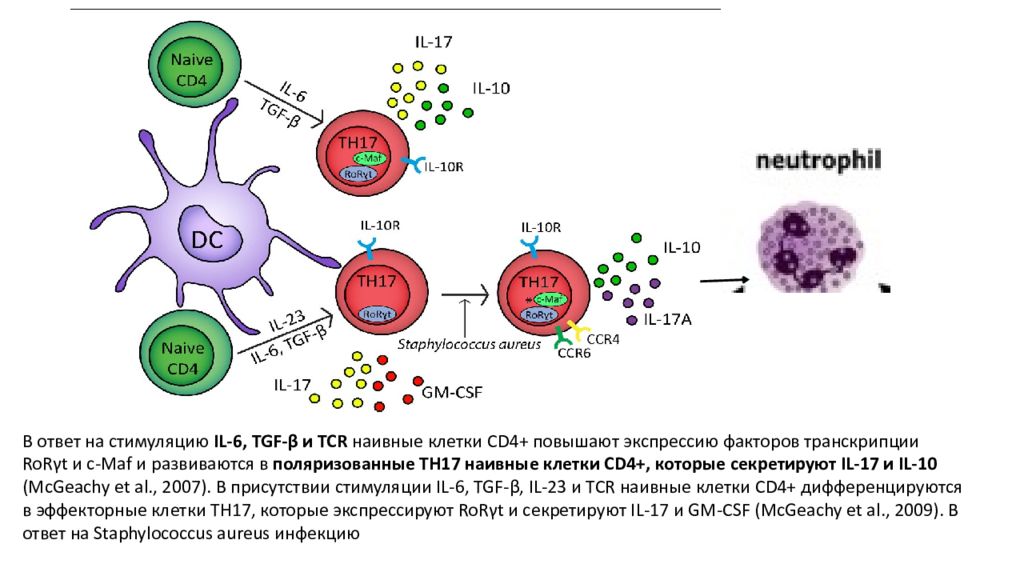
В ответ на стимуляцию IL-6, TGF- β и TCR наивные клетки CD4+ повышают экспрессию факторов транскрипции RoR γ t и c- Maf и развиваются в поляризованные TH17 наивные клетки CD4+, которые секретируют IL-17 и IL-10 ( McGeachy et al., 2007). В присутствии стимуляции IL-6, TGF- β, IL-23 и TCR наивные клетки CD4+ дифференцируются в эффекторные клетки TH17, которые экспрессируют RoR γ t и секретируют IL-17 и GM-CSF ( McGeachy et al., 2009). В ответ на Staphylococcus aureus инфекцию
Слайд 13: Дифференциация наивных Т-клеток в функциональные субпопуляции Т-клеток при аллергии
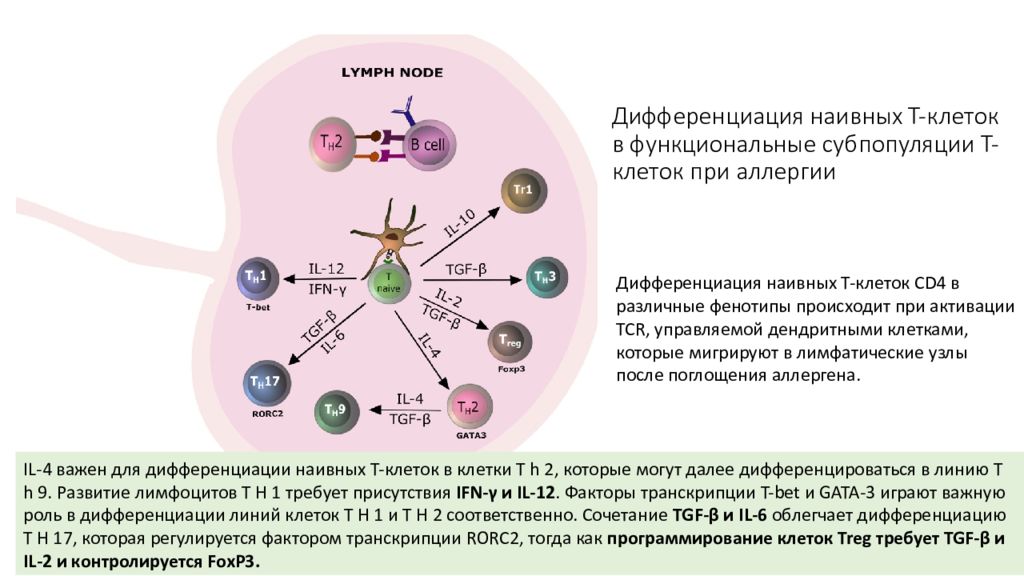
Дифференциация наивных Т-клеток CD4 в различные фенотипы происходит при активации TCR, управляемой дендритными клетками, которые мигрируют в лимфатические узлы после поглощения аллергена. IL-4 важен для дифференциации наивных Т-клеток в клетки T h 2, которые могут далее дифференцироваться в линию T h 9. Развитие лимфоцитов T H 1 требует присутствия IFN-γ и IL-12. Факторы транскрипции T-bet и GATA-3 играют важную роль в дифференциации линий клеток T H 1 и T H 2 соответственно. Сочетание TGF-β и IL-6 облегчает дифференциацию T H 17, которая регулируется фактором транскрипции RORC2, тогда как программирование клеток Treg требует TGF-β и IL-2 и контролируется FoxP3.
Слайд 15
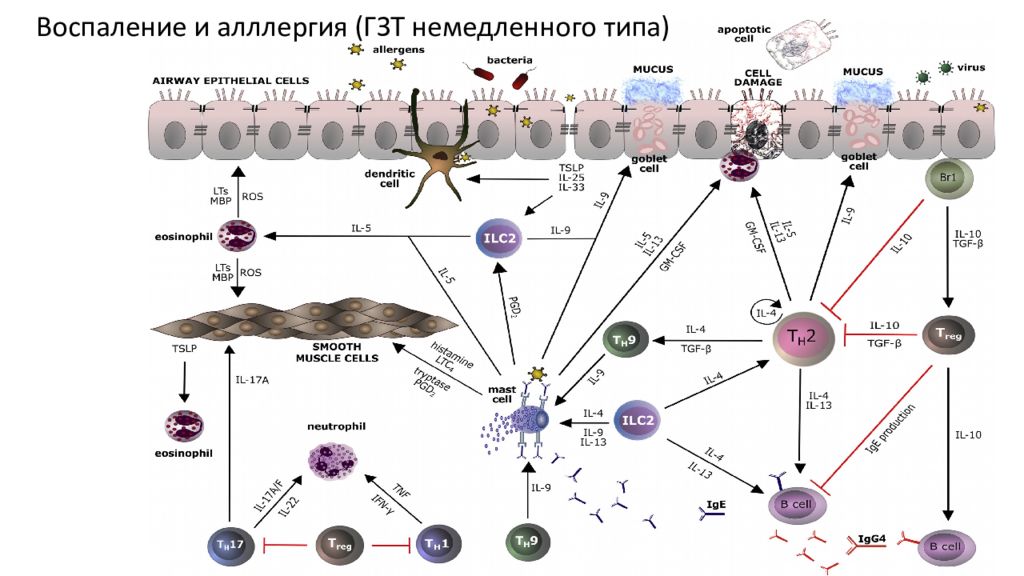
Цитокиновые и другие медиаторные сети при аллергическом воспалении. Нарушение эпителиального барьера во время воспаления может позволить аллергенам проникать через ткани. Аллергены с протеазной активностью могут расщеплять белки плотных контактов эпителиальных клеток и получать доступ к подслизистым ДК. После активации и загрузки антигенами ДК созревают и мигрируют в местные лимфатические узлы и представляют обработанные пептиды аллергена наивным Т-клеткам через молекулы MHC класса II. Наивные Т-клетки в присутствии IL-4 дифференцируются в клетки T H 2. Цитокины типа T H 2 IL-4 и IL-13, которые вырабатываются не только клетками T H 2, но и ILC2, участвуют в рекомбинации переключения класса иммуноглобулинов в В-клетках, что приводит к выработке IgE. IgE связывается с FcεRI на поверхности тучных клеток, находящихся в тканях, сенсибилизируя их. Последующее высвобождение медиаторов, связанных с тучными клетками, таких как гистамин, триптаза, простагландины, лейкотриены и цитокины, индуцирует гиперплазию бокаловидных клеток, сокращение гладких мышц, вазодилатацию, повышенную проницаемость сосудов и усиленную выработку слизи. Во время аллергического воспаления активированные эпителиальные клетки высвобождают TSLP, IL-25 и IL-33, которые также способствуют ответу T H 2. Высокоактивированные эпителиальные клетки подвергаются апоптозу. Клетки T H 17 и T H 1 опосредуют привлечение нейтрофилов, тогда как эозинофилия индуцируется IL-5, IL-25 и IL-33. Иммунорегуляторные цитокины, такие как IL-10 и TGF-β, высвобождаемые Treg-клетками, могут подавлять иммунные реакции типа T H 2 и контролировать воспаление и ремоделирование дыхательных путей. Клетки B R 1, продуцирующие IL-10, ингибируют эффекторные Т-клетки. LTs, лейкотриены; LTC4, лейкотриен C4 ; MBP, основной белок; PGD2, простагландин D2 ; ROS, активные формы кислорода. https://www.jacionline.org/article/s0091-6749(16)30715-1/fulltext
Слайд 16
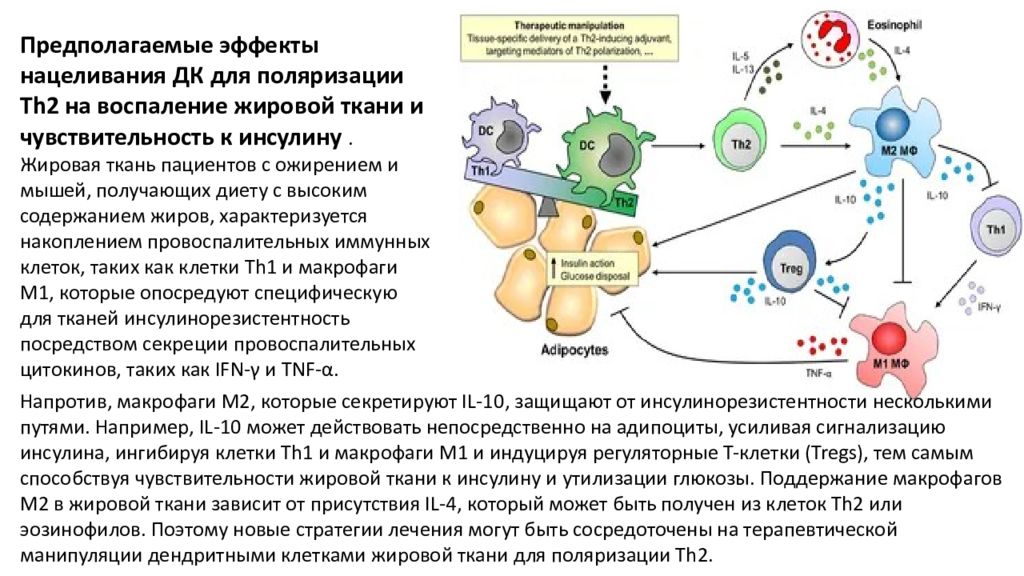
Предполагаемые эффекты нацеливания ДК для поляризации Th2 на воспаление жировой ткани и чувствительность к инсулину. Жировая ткань пациентов с ожирением и мышей, получающих диету с высоким содержанием жиров, характеризуется накоплением провоспалительных иммунных клеток, таких как клетки Th1 и макрофаги M1, которые опосредуют специфическую для тканей инсулинорезистентность посредством секреции провоспалительных цитокинов, таких как IFN-γ и TNF-α. Напротив, макрофаги M2, которые секретируют IL-10, защищают от инсулинорезистентности несколькими путями. Например, IL-10 может действовать непосредственно на адипоциты, усиливая сигнализацию инсулина, ингибируя клетки Th1 и макрофаги M1 и индуцируя регуляторные Т-клетки (Tregs), тем самым способствуя чувствительности жировой ткани к инсулину и утилизации глюкозы. Поддержание макрофагов M2 в жировой ткани зависит от присутствия IL-4, который может быть получен из клеток Th2 или эозинофилов. Поэтому новые стратегии лечения могут быть сосредоточены на терапевтической манипуляции дендритными клетками жировой ткани для поляризации Th2.
Слайд 17
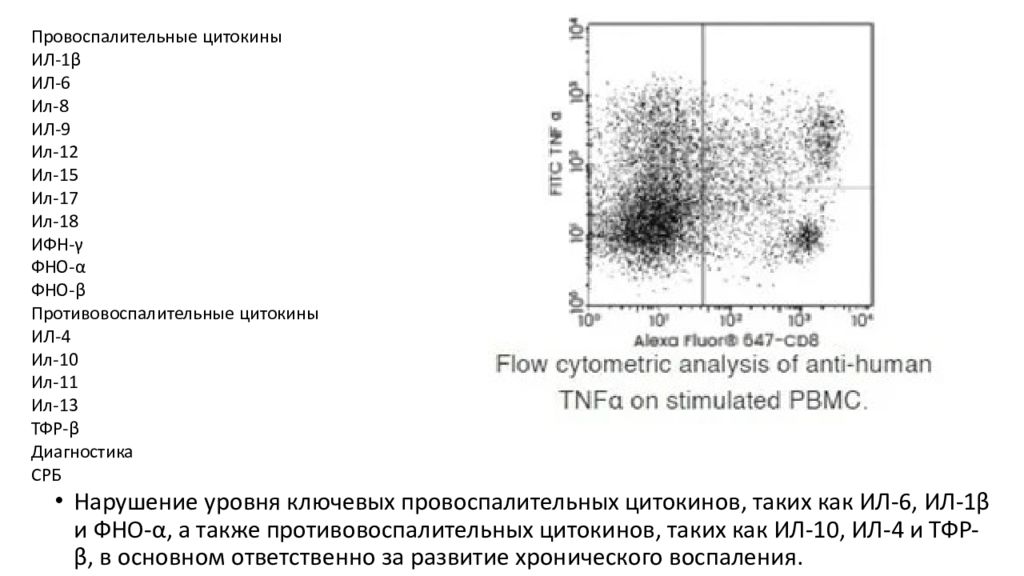
Нарушение уровня ключевых провоспалительных цитокинов, таких как ИЛ-6, ИЛ-1β и ФНО-α, а также противовоспалительных цитокинов, таких как ИЛ-10, ИЛ-4 и ТФР-β, в основном ответственно за развитие хронического воспаления. Провоспалительные цитокины ИЛ-1β ИЛ-6 Ил-8 ИЛ-9 Ил-12 Ил-15 Ил-17 Ил-18 ИФН-γ ФНО-α ФНО-β Противовоспалительные цитокины ИЛ-4 Ил-10 Ил-11 Ил-13 ТФР-β Диагностика СРБ
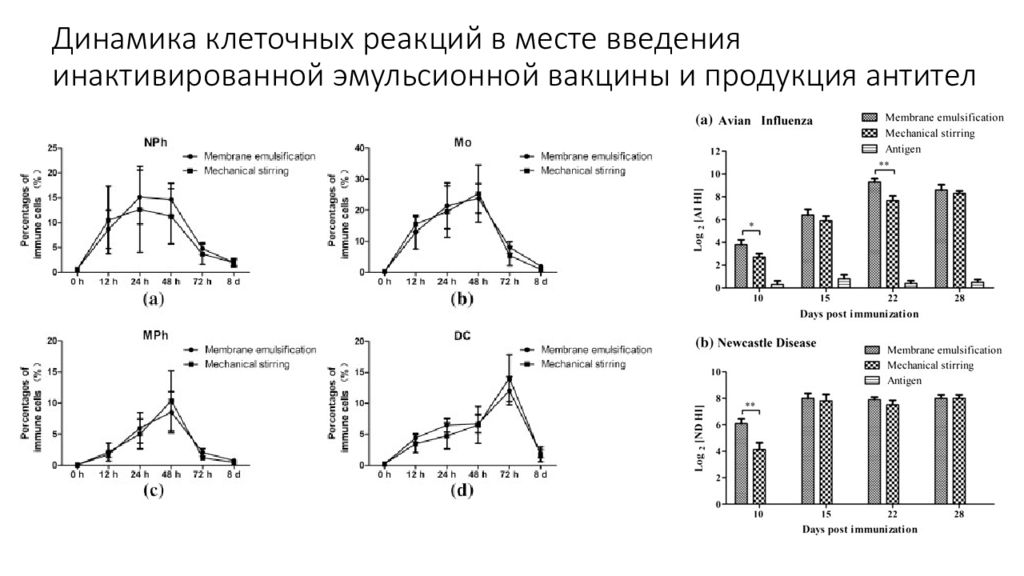
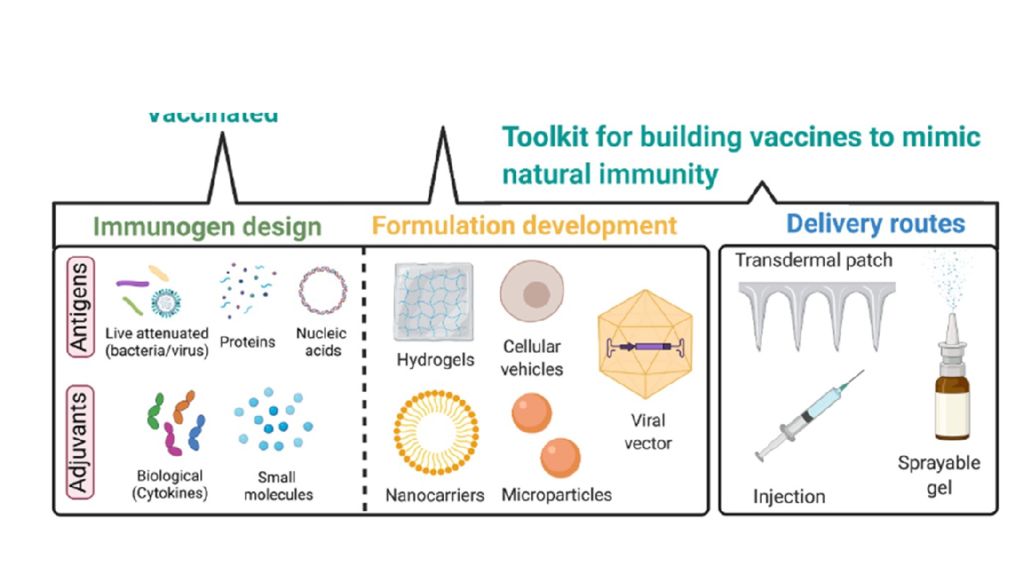
Слайд 18: Динамика клеточных реакций в месте введения инактивированной эмульсионной вакцины и продукция антител
Слайд 19
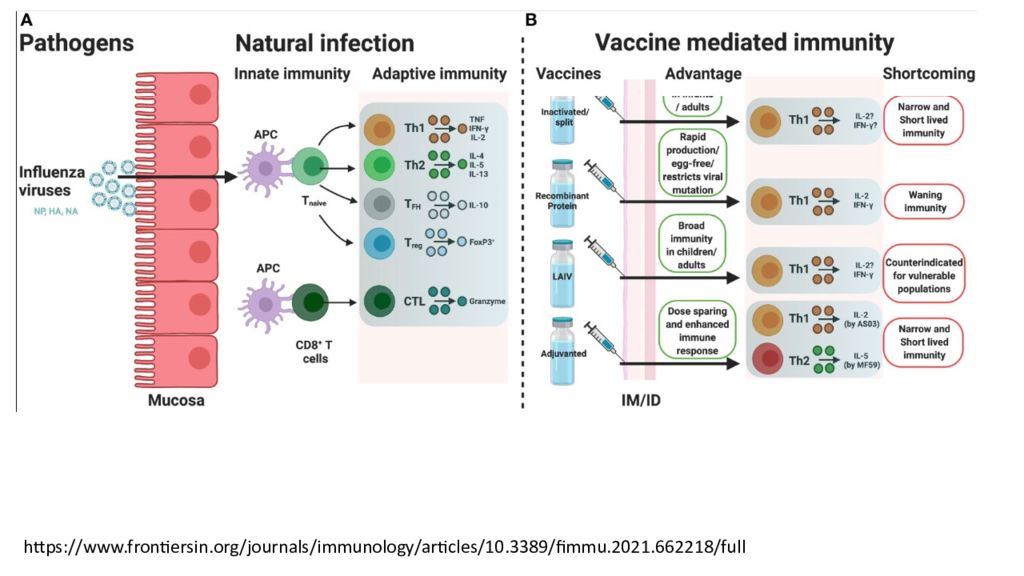
https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2021.662218/full