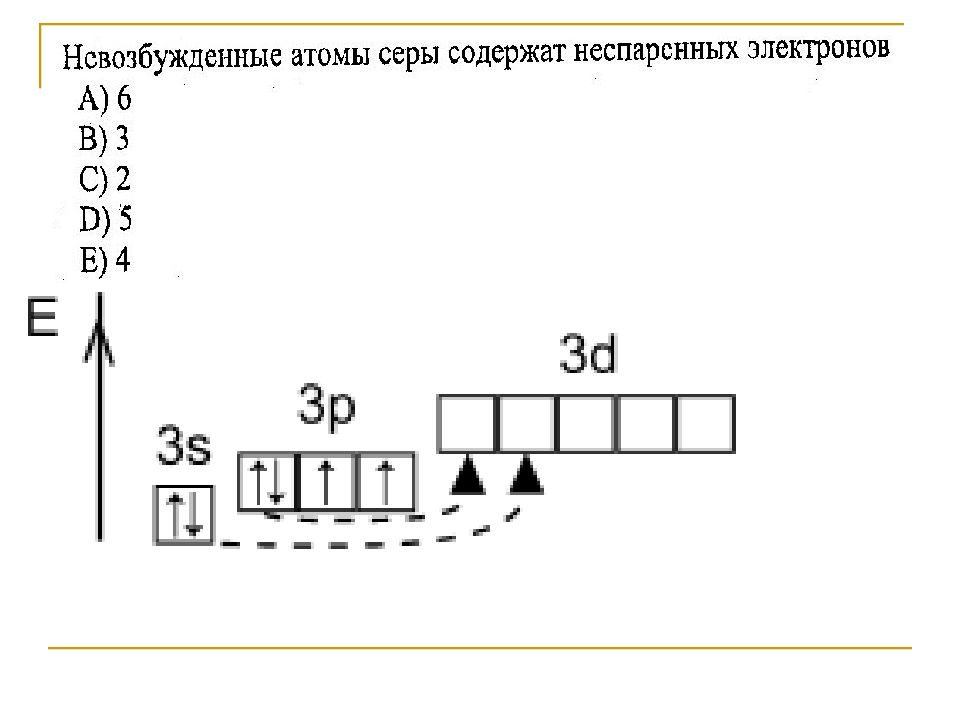
Слайд 3: Строение атома серы
1 s 2 2 s 2 2 p 6 3 s 2 3 p 4 3 d 0 Размещение электронов по орбиталям (последний слой) Степень окисления +2, -2 +4 +6
Слайд 4: Окислительно - восстановительные свойства
S -2 ⇄ S 0 ⇄ S +4 ⇄ S +6 S -2 → только восстановители S 0 → окислители, восстановители S +4 → окислители, восстановители S +6 → только окислители
Слайд 5
* В свободном виде (самородная сера). *В виде соединений: органических и неорганических (сульфиды и сульфаты). *В составе каменного угля, нефти и газа. Сера в природе
Слайд 6
Самородная сера, серный колчедан FeS 2, медный колчедан CuFeS 2, свинцовый блеск PbS с цинковой обманкой ZnS (Балхаш и Восточный Казахстан) Ангидрит CaSO 4, гипс CaSO 4 ∙2H 2 O и гипс пластинчатый
Слайд 7: Физические свойства серы
Агрегатное состояние ТВЕРДОЕ КРИСТАЛЛИЧЕСКОЕ Цвет ЖЕЛТЫЙ Запах БЕЗ ЗАПАХА Растворимость в воде НЕ РАСТВОРЯЕТСЯ Растворимость в сероуглероде ХОРОШО РАСТВОРЯЕТСЯ Теплопроводность НЕТ Электропроводность НЕТ
Слайд 8
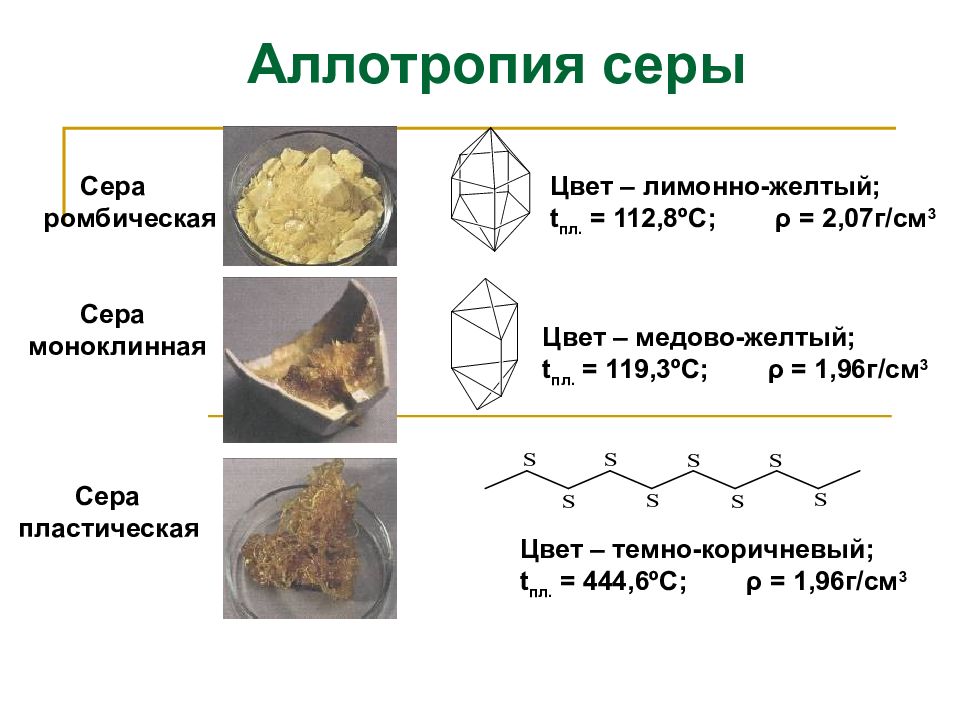
Сера ромбическая Сера пластическая Сера моноклинная Цвет – лимонно-желтый; t пл. = 112,8 º С; ρ = 2,07г/см 3 Цвет – медово-желтый; t пл. = 119,3 º С; ρ = 1,96г/см 3 Цвет – темно-коричневый; t пл. = 444,6 º С; ρ = 1,96г/см 3 Аллотропия серы
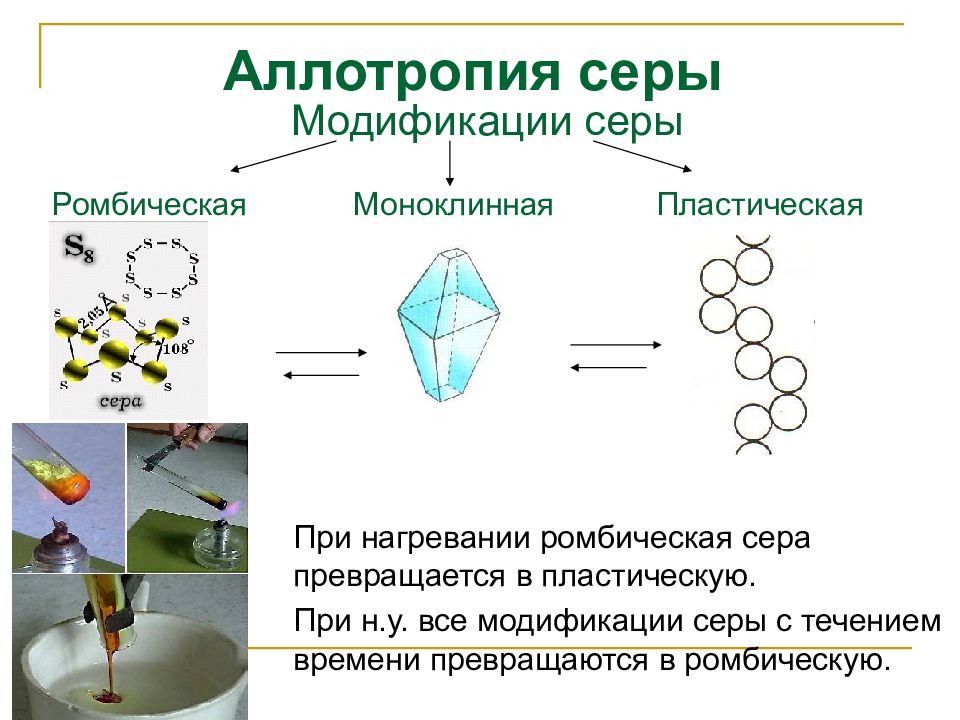
Слайд 9: Аллотропия серы
При нагревании ромбическая сера превращается в пластическую. При н.у. все модификации серы с течением времени превращаются в ромбическую. Модификации серы Ромбическая Моноклинная Пластическая
Слайд 10: Химические свойства серы
Реагирует с неметаллами (искл. азот N 2 и иод I 2 ): S + O 2 = SO 2 оксид серы ( IV ) H 2 + S = H 2 S сероводород Химические свойства серы
Слайд 11: Химические свойства серы
Реагирует с металлами ( искл. золото А u, платина Р t) : 2 Na + S = Na 2 S – сульфид натрия Fe + S = FeS 2Al + 3S = Al 2 S 3 Н g + S = HgS ( демеркуризация ) Химические свойства серы
Слайд 12: Химические свойства серы
Реагирует со сложными веществами: S + 2 H 2 SO 4 ( конц. ) = 3 SO 2 + 2 H 2 O S + 6 HNO 3( конц ) = H 2 SO 4 + 6 NO 2 + 2 H 2 O 3 S + 6 KOH = K 2 SO 3 + 2 K 2 S + 3 H 2 O 3S + 2KClO 3 = 2KCl + 3SO 2 ; Химические свойства серы
Слайд 13: Получение серы
1. Неполное окисление сероводорода: 2H 2 S + O 2 = 2S ↓ + 2H 2 O (недостаток O 2 ) 2. 2H 2 S + SO 2 = 3S ↓ + 2H 2 O 3. SO 2 + 2С = 2СО + S ↓
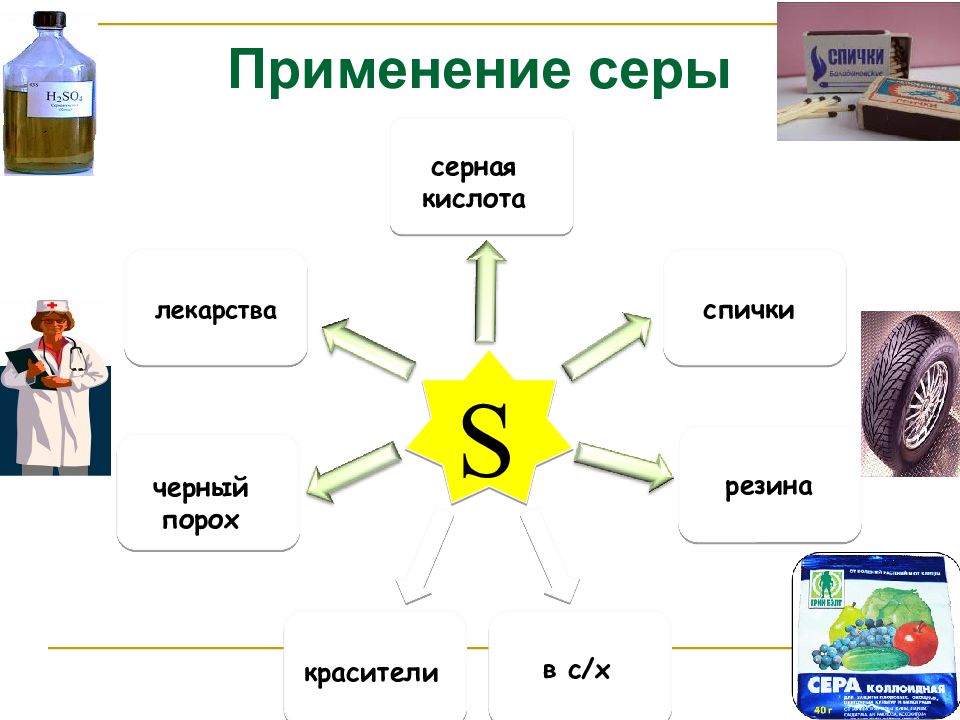
Слайд 14
S серная кислота лекарства черный порох спички резина красители в с/х Применение серы
Слайд 15
Сероводород Бесцветный газ с запахом тухлых яиц, тяжелее воздуха, яд Получение 1) H 2 + S → H 2 S↑ 2) FeS + 2HCl → H 2 S↑ + FeCl 2 Горение Полное сгорание ( при избытке O 2 ) 2H 2 S -2 + 3O 2 → 2S +4 O 2 + 2H 2 O Неполное сгорание (недостаток O 2 ) 2H 2 S -2 + O 2 → 2S 0 + 2H 2 O
Слайд 16
Взаимодействие H 2 S с водой Раствор H 2 S в воде – слабая двухосновная кислота (сероводородная кислота) Диссоциация происходит в две ступени: I ст. H 2 S⇄ H + + HS - (гидросульфид -ион) II ст. HS - ⇄ H + + S 2- (сульфид-ион) Средние соли (сульфиды): Na 2 S – сульфид натрия CaS – сульфид кальция Кислые соли (гидросульфиды): NaHS – гидросульфид натрия Ca(HS) 2 – гидросульфид кальция
Слайд 17
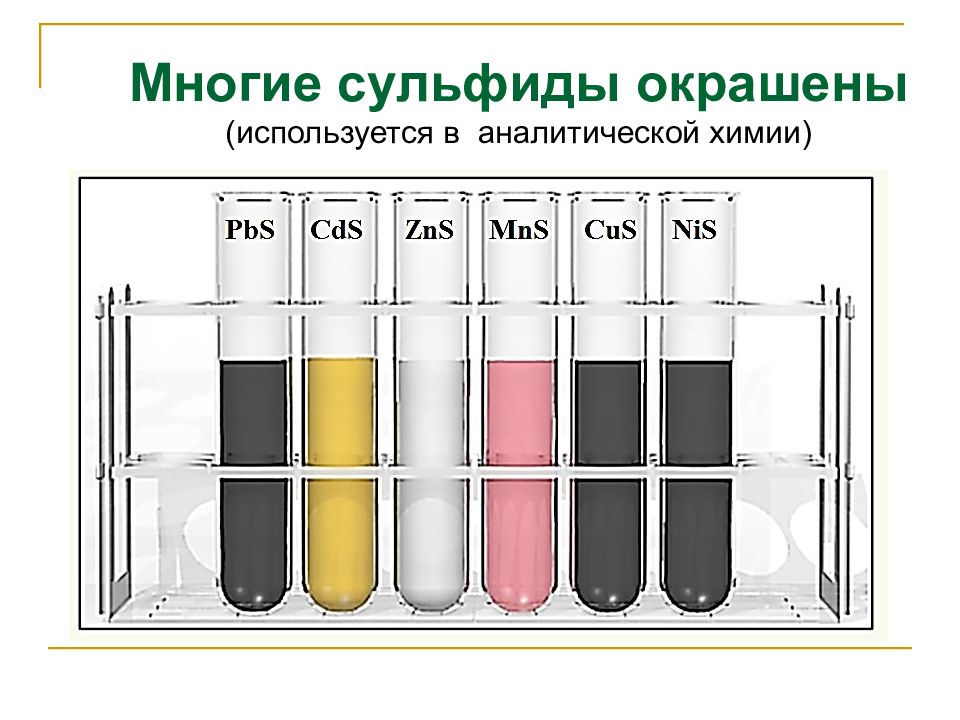
. H 2 S + Ме, основные оксиды, основания: H 2 S + 2NaOH изб. → Na 2 S + 2H 2 O H 2 S изб. + NaOH → NaHS + H 2 O сульфид натрия гидросульфид натрия Кислотные свойства сероводородной кислоты Качественная реакция на сульфид-ион Н 2 S + Pb(NO 3 ) 2 → PbS↓ + 2HNO 3 Pb 2+ + S 2- → PbS↓ черный
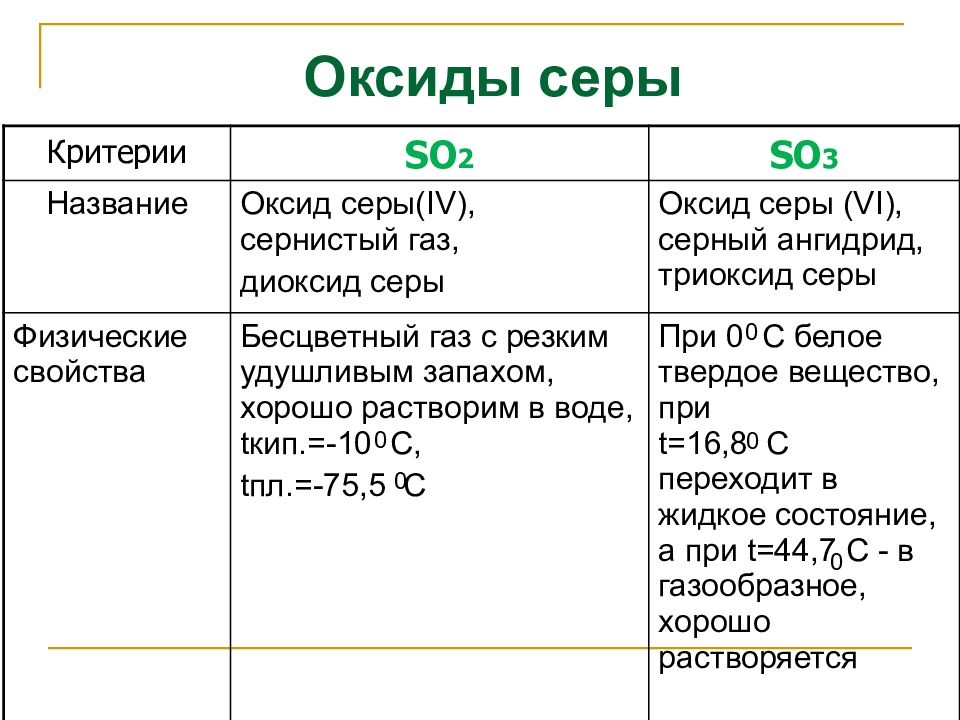
Слайд 19: Оксиды серы
Критерии SO 2 SO 3 Название Оксид серы( IV), сернистый газ, диоксид серы Оксид серы (VI), серный ангидрид, триоксид серы Физические свойства Бесцветный газ с резким удушливым запахом, хорошо растворим в воде, t кип.=-10 С, t пл.=-75,5 С При 0 С белое твердое вещество, при t =16,8 С переходит в жидкое состояние, а при t =44,7 С - в газообразное, хорошо растворяется 0 0 0 0 0
Слайд 20
SO 2 SO 3 Химические свойства Кислотный оксид SO 2 +H 2 O H 2 SO 3 SO 2 +CaO CaSO 3 SO 2+ 2NaOH Na 2 SO 3 +H 2 O Обладает ОВ двойственностью: 2SO 2 +O 2 2SO 3 восстановитель SO 2+ C S + CO 2 окислитель Обесцвечивает раствор КМ nO 4 и некоторые красители. Кислотный оксид SO 3 +H 2 O H 2 SO 4 SO 3 +CuO CuSO 4 SO 3+ 2KOH K 2 SO 4 +H 2 O Кислотные свойства сильнее, чем у SO 2 : Na 2 SO 3 +SO 3 SO 2 + Na 2 SO 4 В ОВР только окислитель
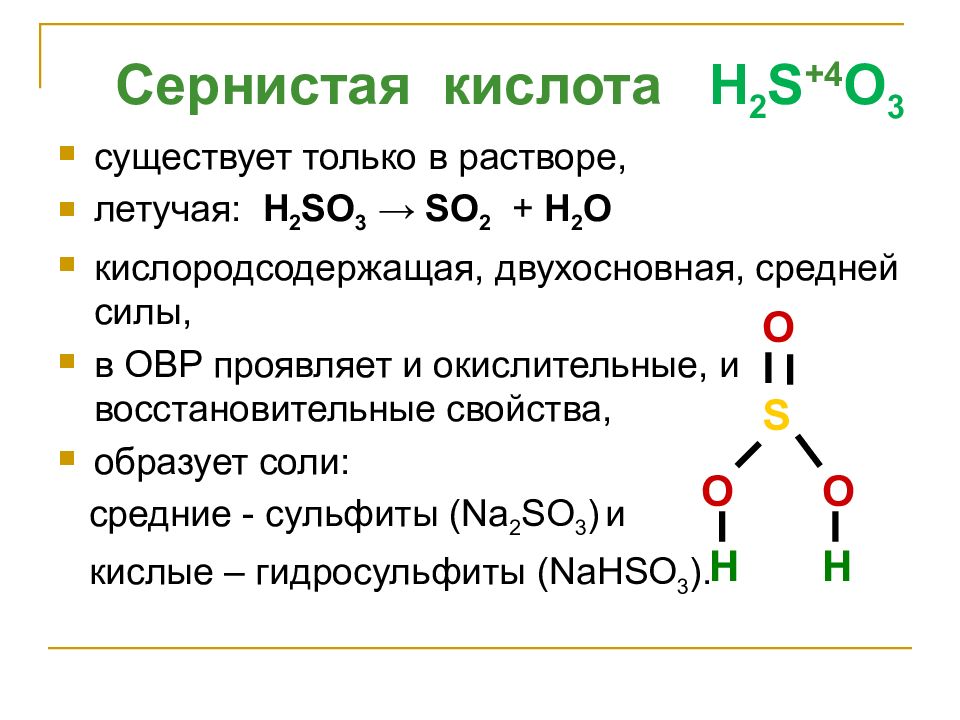
Слайд 21
Сернистая кислота H 2 S +4 O 3 существует только в растворе, летучая: H 2 SO 3 → SO 2 + H 2 O кислородсодержащая, двухосновная, средней силы, в ОВР проявляет и окислительные, и восстановительные свойства, образует соли: средние - сульфиты ( Na 2 SO 3 ) и кислые – гидросульфиты ( Na Н SO 3 ). S O O O H H
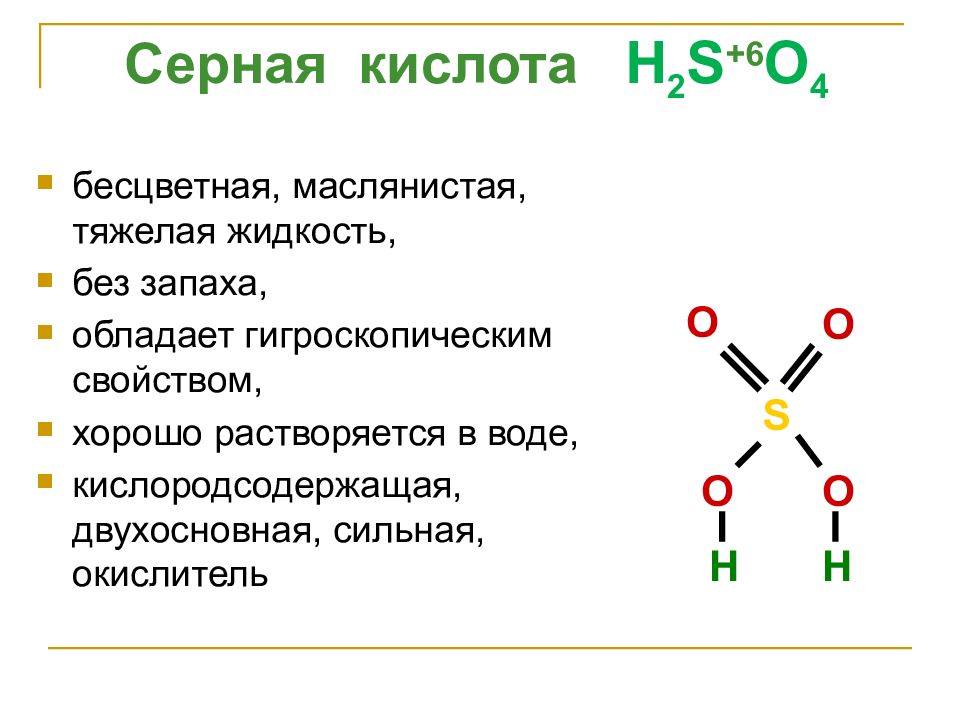
Слайд 22
бесцветная, маслянистая, тяжелая жидкость, без запаха, обладает гигроскопическим свойством, хорошо растворяется в воде, кислородсодержащая, двухосновная, сильная, окислитель Серная кислота H 2 S + 6 O 4 S O O O O H H
Слайд 23
S, H 2 S, FeS 2 → SO 2 → SO 3 → H 2 SO 4 1-я стадия. Печь для обжига колчедана. Получение оксида серы ( II ) : 4FeS 2 + 11O 2 2Fe 2 O 3 + 8SO 2 + Q 2-я стадия. Получение серного ангидрида (450°С - 500°С; кат. V 2 O 5 ): 2SO 2 + O 2 ⇄ 2SO 3 3-я стадия. Поглотительная башня: Получение олеума nSO 3 + H 2 SO 4 ( конц ) ( H 2 SO 4 ·nSO 3 ) ( олеум ) Получение серной кислоты
Слайд 24
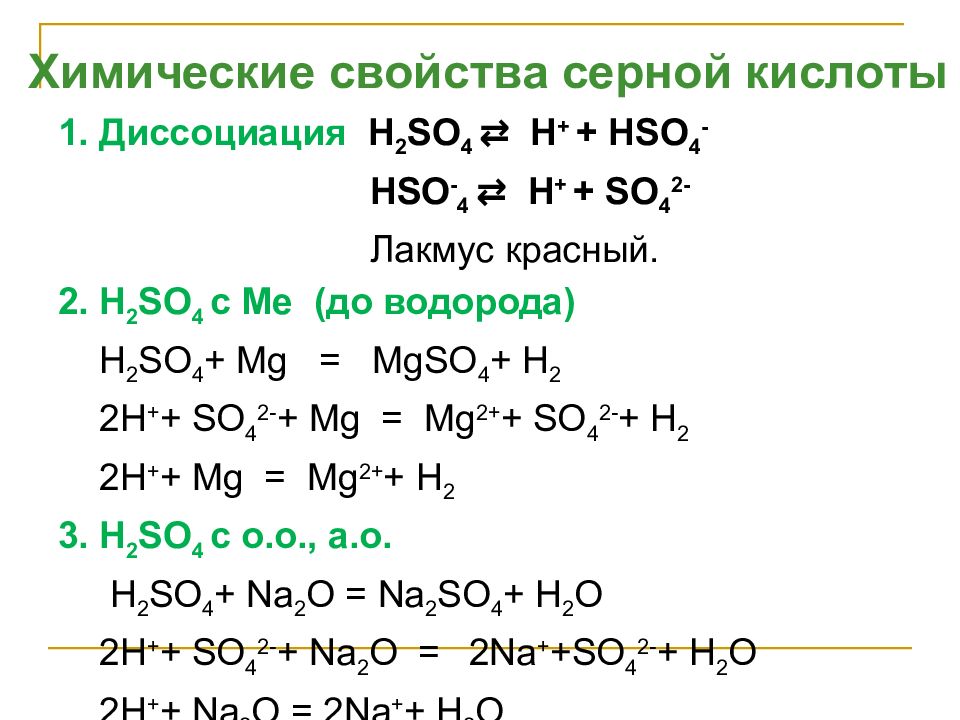
1. Диссоциация H 2 SO 4 ⇄ H + + Н SO 4 - HSO - 4 ⇄ H + + SO 4 2- Лакмус красный. 2. H 2 SO 4 с Ме (до водорода) H 2 SO 4 + Mg = MgSO 4 + H 2 2H + + SO 4 2- + Mg = Mg 2+ + SO 4 2- + H 2 2 H + + Mg = Mg 2+ + H 2 3. H 2 SO 4 с о.о., а.о. H 2 SO 4 + Na 2 O = Na 2 SO 4 + H 2 O 2H + + SO 4 2- + Na 2 O = 2Na + +SO 4 2- + H 2 O 2 H + + Na 2 O = 2 Na + + H 2 O Химические свойства серной кислоты
Слайд 25
4. H 2 SO 4 с основаниями H 2 SO 4 +2NaOH = Na 2 SO 4 + 2H 2 O 2H + + SO 4 2- + 2Na + + 2OH - = 2Na + +SO 4 2- + 2H 2 O 2H + + 2OH - = 2H 2 O 5. H 2 SO 4 с солями H 2 SO 4 + CaCO 3 = CaSO 4 + H 2 O + CO 2 2H + + SO 4 2- + CaCO 3 = CaSO 4 + H 2 O + CO 2 Качественная реакция на сульфат-ион H 2 SO 4 + BaCl 2 = BaSO 4 + 2HCl 2H + + SO 4 2- + Ba 2+ +2Cl - = BaSO 4 + 2H + + 2Cl - SO 4 2- + Ba 2+ = BaSO 4 белый молочный осадок Химические свойства серной кислоты
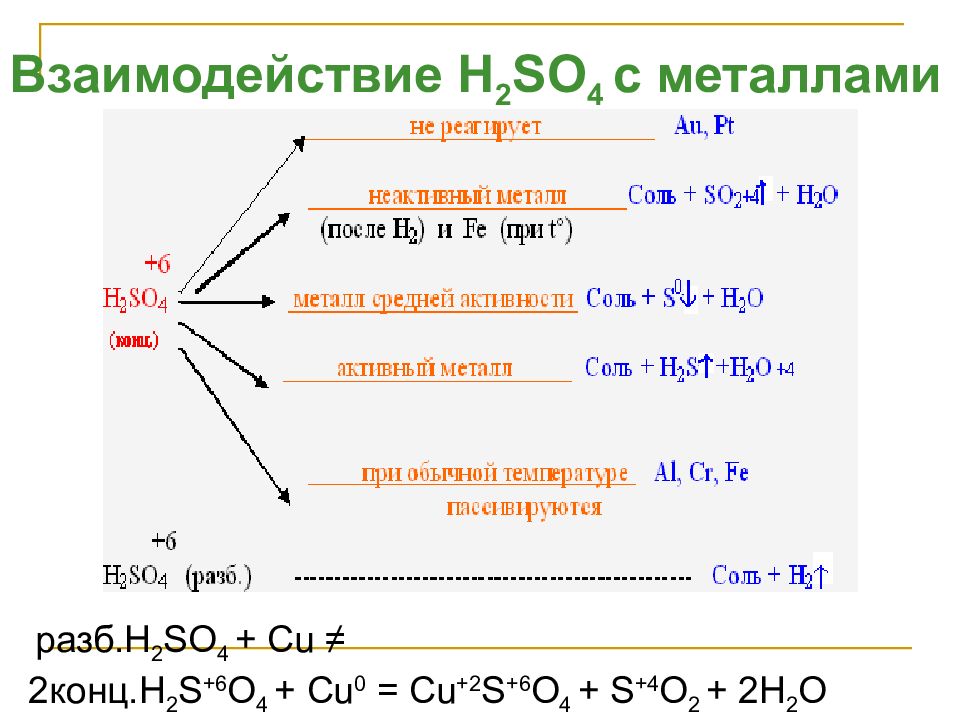
Слайд 26
Взаимодействие H 2 SO 4 с металлами разб. H 2 SO 4 + Cu ≠ 2 конц. H 2 S +6 O 4 + Cu 0 = Cu +2 S +6 O 4 + S +4 O 2 + 2H 2 O
Слайд 27
C 12 H 22 O 11 ( сахароза )+H 2 SO 4 →12С (уголь) +H 2 SO 4 *11H 2 O Органические вещества обугливаются !!! C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O S + 2H 2 SO 4 = 3SO 2 + 2H 2 O 2P + 5H 2 SO 4 = 2H 3 PO 4 + 5SO 2 + 2H 2 O Свойства конц. H 2 SO 4
Слайд 28: Применение серной кислоты
- в производстве минеральных удобрений; - как электролит в свинцовых аккумуляторах; - в металлургии при прокате стали; - для получения различных минеральных кислот и солей; - в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ; - в текстильной, кожевенной отраслях промышленности; - в металлообрабатывающей промышленности; - используется как осушитель воздуха; - в нефтяной промышленности; - в пищевой промышленности; - в промышленном органическом синтезе в реакциях.
Слайд 30: Сумма всех электронов ( SO 3 ) = 16+8*3= 40 Сумма всех электронов (Н 2 SO 4 )= 1*2+16+8*4= 50
Слайд 33: S -2 → только восстановители S 0 → окислители, восстановители S +4 → окислители, восстановители S +6 → только окислители S +4 О 2 обладает двойственными ОВ свойствами S +6 О 3 обладает окислительными свойствами
Слайд 35: H 2 SO 4 ⇄ H + + Н SO 4 - гидросульфат-ион HSO - 4 ⇄ H + + SO 4 2- сульфат-ион Соли: гидросульфаты, сульфаты
Слайд 36: Са (ОН) 2 ⇄ СаОН + + ОН - 2Са(ОН) 2 + Н 2 S О 4 = ( СаОН ) 2 S О 4 + 2Н 2 О 2 + 1+ 1 + 2 = 6
Слайд 37: Серная кислота реагирует с металлами (до Н), основными и амфотерными оксидами, основаниями. Ответ: А
Слайд 38
2H 2 SO 4 + Cu = CuSO 4 + SO 2 + 2H 2 O Сумма коэффициентов 2 + 1 + 1 + 1 + 2 = 7