Слайд 2: Сабақтың мақсаты
Топ бойынша галогендердің физикалық және химиялық қасиеттерінің өзгеру заңдылықтарын түсіндіру ; Галогендердің тотығу-тотықсыздану реакция теңдеулерін құрастыру; Галогенид-иондарды тәжірибе жүзінде анықтауды жоспарлау және анықтау; Галогендер және олардың қосылыстарының қолданылуы.
Слайд 4
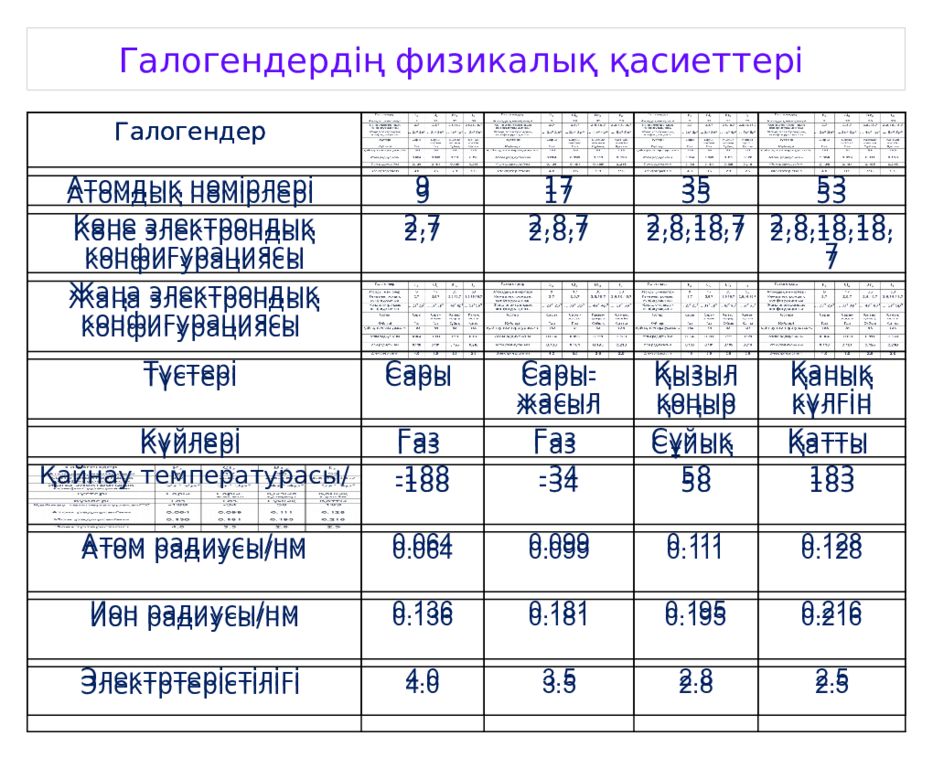
Галогендердің физикалық қасиеттері Галогендер Атомдық нөмірлері 9 17 35 53 Көне электрондық конфигурациясы 2,7 2,8,7 2,8,18,7 2,8,18,18,7 Жаңа электрондық конфигурациясы Түстері Сары Сары-жасыл Қызыл қоңыр Қанық күлгін Күйлері Газ Газ Сұйық Қатты Қайнау температурасы/ -188 -34 58 183 Атом радиусы/нм 0.064 0.099 0.111 0.128 Ион радиусы/нм 0.136 0.181 0.195 0.216 Электртерістілігі 4.0 3.5 2.8 2.5 Галогендер Атомдық нөмірлері 9 17 35 53 Көне электрондық конфигурациясы 2,7 2,8,7 2,8,18,7 2,8,18,18,7 Жаңа электрондық конфигурациясы Түстері Сары Сары-жасыл Қызыл қоңыр Қанық күлгін Күйлері Газ Газ Сұйық Қатты -188 -34 58 183 Атом радиусы/нм 0.064 0.099 0.111 0.128 Ион радиусы/нм 0.136 0.181 0.195 0.216 Электртерістілігі 4.0 3.5 2.8 2.5
Слайд 5
Галогендердің тотықтырғыштық және тотықсыздандырғыштық қасиеттері Галогендердің химиялық белсенділігі өте жоғары. Соның ішіндегі фтор бейметалдардың ішіндегі бейметалдық қасиеті ең жоғары элемент. Оны төмендегі реакциялар арқылы білуге болады: O Бұл реакциялардан фтордың оттектен де белсенді бейметалдық қасиет көрсететіндігін көруге болады.
Слайд 6
Галогендердің тотықтырғыштық және тотықсыздандырғыштық қасиеттері Галогендер металдармен әрекеттескенде күшті тотықтырғыштық қасиет көрсетеді. Фтор барлық металдармен әрекеттеседі. Көпшілігімен қыздырмай-ақ әрекеттеседі. Фтор оттекпен, азотпен және көміртекпен тікелей әрекеттеспейді. Ал басқа галогендер металдармен қыздырған жағдайда әрекеттеседі:
Слайд 7
Галогендердің тотықтырғыштық және тотықсыздандырғыштық қасиеттері Галогендердің сутекпен әрекеттесу қабілеті жоғарыдан төменге қарай әлсірейді: Бұл реакциялар галоген жай заттарының жоғарыдан төменге қарай тотықтырғыш қасиеттерінің әлсірейтіндігін көрсетеді.
Слайд 8
Галогендердің тотықтырғыштық және тотықсыздандырғыштық қасиеттері Хлордың су және сілтілермен реакциясы әдетте маңызды болып келеді. Бұл реакцияларда хлор ерекше қасиет көрсетеді. Яғни тек хлордың тотығу дәрежелерінде ғана өзгеріс болады. Хлор диспрпорциялану реакциясына қатысады. Сілтілердің суық ерітіндісімен: Сілтілердің ыстық ерітіндісімен:
Слайд 9
Галогендер мен олардың қосылыстарының қолданылуы Ауызсуды залалсыздандырудың заманауи әдістері оны бактериялардан, саңырауқұлақтардан және вирустардан тазартады. Хлорлау – суды залалсыздандырудың кең тараған әдісі. Ол тиімді, қарапайым және шығыны аз әдіске жатады. Галогендер – адамдар мен жануарлар организімдерінде түрлі биологиялық қызметтер атқаратын элементтер. Тірі организмдерде галогендер микроэлементтерге жатады. Микроэлементтердің қалыптан аздап ауытқуы ауыр сырқаттарға душар етеді. Мысалы, Хлор – тір организімдердің толық қанды тіршілік етуін қаматмасыз етеді. Фтор – тіс эмалін бұзылудан сақтайды. Йод – қалқанша бездің оған қатысты гормондардың метаболизміне қатысады. Бром – орталық жүйке жүйенің қозу және тежелу процестерін реттеп отырады.