Первый слайд презентации: СПО ИП 2 курс Лекция Организация приемки и хранения товаров аптечного ассортимента
СОЛОНИНИНА АННА ВЛАДИМИРОВНА зав. кафедрой управления и экономики фармации, доктор фарм. наук, профессор
Слайд 2: Часть 1. Организация приемки товаров аптечного ассортимента
Приемочный контроль 4 Нормативные документы 1 2 Алгоритм приемки 3 Оформление результатов приемки 5 Работа с несоответствующим товаром 6 Организационные мероприятия по обеспечению приемки Зона приемки
Слайд 3: Организация приемки товаров в аптеке. Приемочный контроль
В соответствии с требованиями надлежащей аптечной практики (НАП) в АО все процессы деятельности, влияющие на качество, эффективность и безопасность товаров аптечного ассортимента, осуществляются в соответствии с утвержденными стандартными операционными процедурами (СОП), в которых должен быть описан порядок необходимых действий с целью недопущения попадания фальсифицированных, недоброкачественных, контрафактных товаров аптечного ассортимента к покупателю. Стандартные операционные процедуры (СОП / SOP/ Standard Operation Procedures ) - это документально оформленный набор инструкций или пошаговых действий, которые надо осуществить, чтобы выполнить ту или иную работу. СОП устанавливает требования к приемке ТАА для п редупрежде ния поступления несоответствующих товаров аптечного ассортимента. Соблюдение требований СОП позволяет обеспечить качеств о фармацевтических услуг. В аптеке должны быть разработаны документы, регламентирующие прием, транспортировку, размещение товаров аптечного ассортимента, в т.ч. СОП «Организация приемки товаров аптечного ассортимента. Приемочный контроль» При приемке товаров следует пользоваться НД, регламентирующими порядок обращения ЛП разных товарных групп (ИЛП, подлежащие ПКУ, включенные в перечни НС, ПВ, прекурсоров, СД и Яд веществ, ЖНВЛП, ЛРС и ЛРП,,) и других товаров аптечного ассортимента, перечисленных в ст. 55 ФЗ № 61-ФЗ «Об обращении ЛС».
Слайд 4: Перечень товаров, которые можно продавать в аптечной организации ( ст.55 ФЗ от 12 апреля 2010 г. № 61-ФЗ «Об обращении ЛС» )
Аптечные организации, индивидуальные предприниматели, имеющие лицензию на ФД, наряду с ЛП имеют право приобретать и продавать: медицинские изделия дезинфицирующие средства предметы и средства личной гигиены посуду для медицинских целей предметы и средства, предназначенные для ухода за больными, новорожденными и детьми, не достигшими возраста трех лет очковую оптику и средства ухода за ней минеральные воды, продукты лечебного, детского и диетического питания, биологически активные добавки парфюмерные и косметические средства медицинские и санитарно-просветительные печатные издания, предназначенные для пропаганды здорового образа жизни 4
Слайд 5: Нормативные документы
Об обращении ЛС : ФЗ от 12.04.2010 № 61-ФЗ Хранение лекарственных средств : ОФС. 1.1.0010 – Хранение лекарственных средств (взамен ОФС.1.1.0010.18)/ ГФ XV (утв. Приказом Минздрава России от 20.07.2023 № 377), действует с 01.09.2023 Хранение лекарственного растительного сырья и лекарственных растительных препаратов : ОФС 1.1.0011 - ГФ XV Об утверждении Правил надлежащей аптечной практики ЛП для медицинского применения : приказ Минздрава России от 31 августа 2016 г. №647н Об утверждении правил надлежащей практики хранения и перевозки ЛП для медицинского применения : приказ Минздрава России от 31.08.2016 № 646н Об утверждении правил хранения ЛС : Приказ Министерства здравоохранения и социального развития РФ от 23.08.10 №706н (в последней ред.) Об утверждении санитарных норм и правил СанПиН 3.3686-21 «Санитарно эпидемиологические требования по профилактике инфекционных болезней: Постановление главного гос.сан.врача от 28.01.2021 № 4», раздел XLVIII. п.4252. Условия транспортирования и хранения иммунобиологических препаратов
Слайд 6: Нормативные документы
О наркотических средствах и психотропных веществах : ФЗ от 08.01.1998 (в посл. ред.) № 3 Об утверждении перечня НС, ПВ и их прекурсоров, подлежащих контролю в РФ : ПП РФ от 30 июня 1998 г. N 681 О хранении наркотических средств, психотропных веществ и их прекурсоров " (вместе с "Правилами хранения наркотических средств, психотропных веществ и их прекурсоров "): ПП РФ от 30.04.2022 N 809 " Об утверждении специальных требований к условиям хранения наркотических и психотропных лекарственных средств, предназначенных для медицинского применения » : Приказ Минздрава России от 26 ноября 2021 г. N 1103н О порядке представления сведений о деятельности, связанной с оборотом наркотических средств и психотропных веществ …. ПП РФ от 30.11.2021 № 2117 О представлении сведений о деятельности, связанной с оборотом прекурсоров наркотических средств и психотропных веществ …ПП РФ от 28.10.2021. N 1846 О б утверждении инструкции по организации хранения в аптечных учреждениях различных групп ЛС и ИМН : Приказ МЗ РФ от 13 ноября 1996 г. N 377 (действует в части хранения медицинских изделий )
Слайд 7: Нормативные документыы
Об утверждении перечня ЛС для медицинского применения, подлежащих предметно-количественному учету : Приказ Минздрава России от 1 сентября 2023 г. N 459н Об утверждении правил регистрации операций, связанных с обращением ЛС для медицинского применения, включенных в перечень ЛС для медицинского применения, подлежащих ПКУ в специальных журналах учета операций, связанных с обращением ЛС для медицинского применения, и правил ведения и хранения специальных журналов учета операций, связанных с обращением ЛС для медицинского применения: Приказ Минздрава России от 17 июня 2013 г. № 378н Об утверждении списков сильнодействующих и ядовитых веществ для целей статьи 234 и других статей УК РФ, а также крупного размера СД веществ для целей статьи 234 УК РФ: ПП РФ от 29 декабря 2007 г. N 964 Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств«: Приказ Федеральной службы по надзору в сфере здравоохранения от 16 сентября 2022 года N 8700 "
Слайд 8: Регламентирующие документы
Технический регламент « О безопасности парфюмерно-косметической продукции » -ТР ТС 009/2011, утв. Решением Комиссии Таможенного Союза от 23.09.2011г. № 799 Технический регламент Таможенного союза « О безопасности пищевой продукции » ТР ТС 021/2011, утв. Решением Комиссии Таможенного союза от 09.12.2011 г. № 880. Технический регламент Таможенного союза « О безопасности продукции, предназначенной для детей и подростков » ТР ТС 007/2011, утв. Решением Комиссии Таможенного союза от 23.09.2011г. № 797 ЕДИНЫЙ ПЕРЕЧЕНЬ товаров, подлежащих санитарно-эпидемиологическому надзору (контролю) на таможенной границе и таможенной территории таможенного союза, утв. Решением Комиссии таможенного союза от 28 мая 2010 г. № 299 « Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю )» Об утверждении единого перечня продукции, подлежащей обязательной сертификации и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии… : ПП РФ от 23 декабря 2021 г. № 2425 Об утверждении Правил государственной регистрации медицинских изделий : ПП РФ от 30 ноября 2024 г. N 1684 О федеральном государственном контроле (надзоре) за обращением медицинских изделий : ПП РФ N 1066 от 30 июня 2021 г.
Слайд 9: Организационные мероприятия по обеспечению приемки
Выбор поставщика и заключение договора поставки Приемка товаров производится в специально оборудованной зоне - зоне приемки. Для приемки товаров создается постоянно-действующая комиссия. Состав комиссии утверждается приказом (распоряжением) руководителя аптечной организации. Как правило, в комиссию включают МОЛ. Члены комиссии должны быть ознакомлены со всеми законодательными и иными нормативными правовыми актами Российской Федерации, определяющими основные требования к товарам аптечного ассортимента, оформлению сопроводительных документов, их комплектности. Кроме МОЛ, в состав комиссии включаются компетентные представители общественности аптечной организации, не осуществляющие учет, хранение, приемку и отпуск материальных ценностей. Представителю, уполномоченному для участия в приемке продукции по количеству и качеству, выдается надлежаще оформленное и заверенное печатью организации разовое удостоверение за подписью руководителя организации. Приказом руководителя может назначаться ответственный за конкретную приемку товара
Слайд 10: Зона приемки
Маркированный стол для приемки товаров Компьютер с выходом в Интернет Фармацевтические холодильники для размещения ЛП, требующих хранения в холодильнике (2-8 о, 8-15 о ) Фармацевтический холодильник для размещения ИЛП Сейф для размещения наркотических средств и психотропных веществ на время приемки Металлический шкаф для размещения сильнодействующих и ядовитых веществ на время приемки Термометры, терморегистраторы (при приемке ИЛП) Термоконтейнеры
Слайд 11: Порядок приемки :
При проведении погрузочно-разгрузочных работ при приемке или отгрузке лекарственных препаратов и других товаров, разрешенных к отпуску из аптечных организаций, должна быть обеспечена защита поступающих ЛП от атмосферных осадков, воздействия низких и высоких температур. Приемка товара осуществляется на первом этапе по количеству мест и массе брутто. Факт предварительной приемки подтверждается указанием количества мест, подписью МОЛ и печатью аптеки (с отметкой – «принято по количеству мест без пересчета количества единиц и без проверки качества »). Окончательная приемка товара (приемочный контроль ) в аптеке осуществляется комиссией по числу единиц (упаковок) и качеству в сроки, указанные в договоре поставки Приемка осуществляется по определенному алгоритму 11
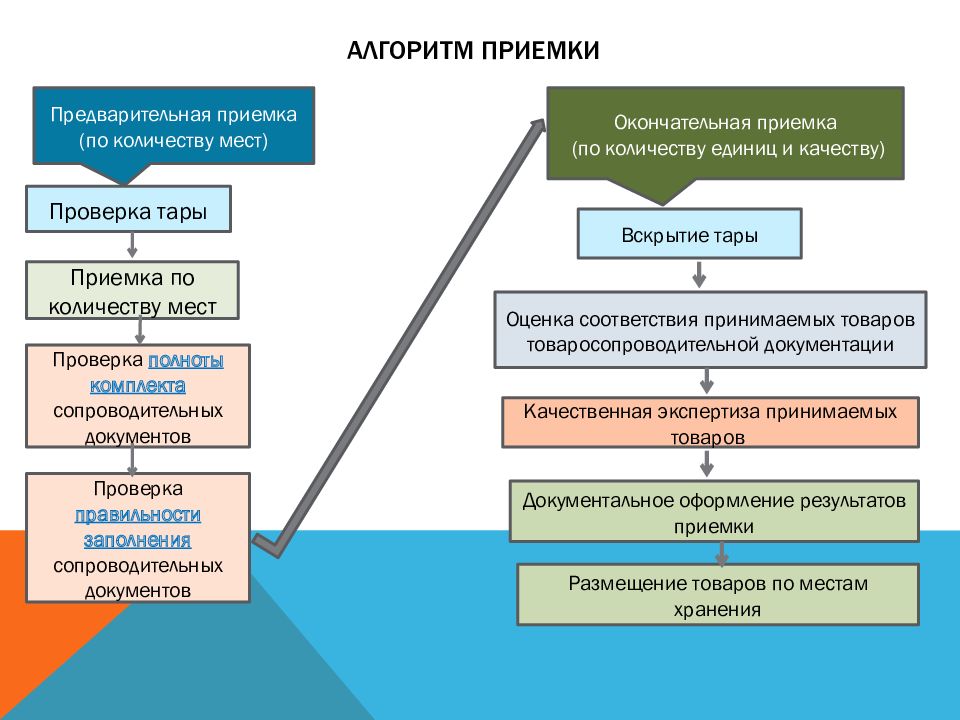
Слайд 12: Алгоритм приемки
Проверка тары Приемка по количеству мест Проверка полноты комплекта сопроводительных документов Проверка правильности заполнения сопроводительных документов Вскрытие тары Оценка соответствия принимаемых товаров товаросопроводительной документации Качественная экспертиза принимаемых товаров Документальное оформление результатов приемки Предварительная приемка (по количеству мест) Окончательная приемка (по количеству единиц и качеству) Размещение товаров по местам хранения
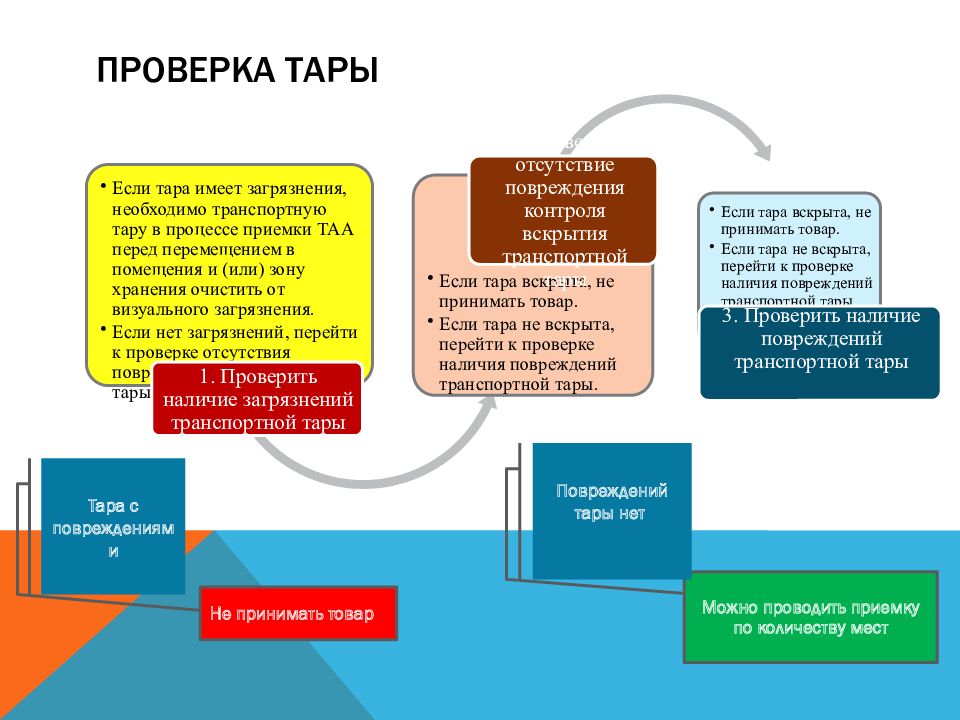
Слайд 13: Проверка тары
Можно проводить приемку по количеству мест Тара с повреждениями Повреждений тары нет Не принимать товар
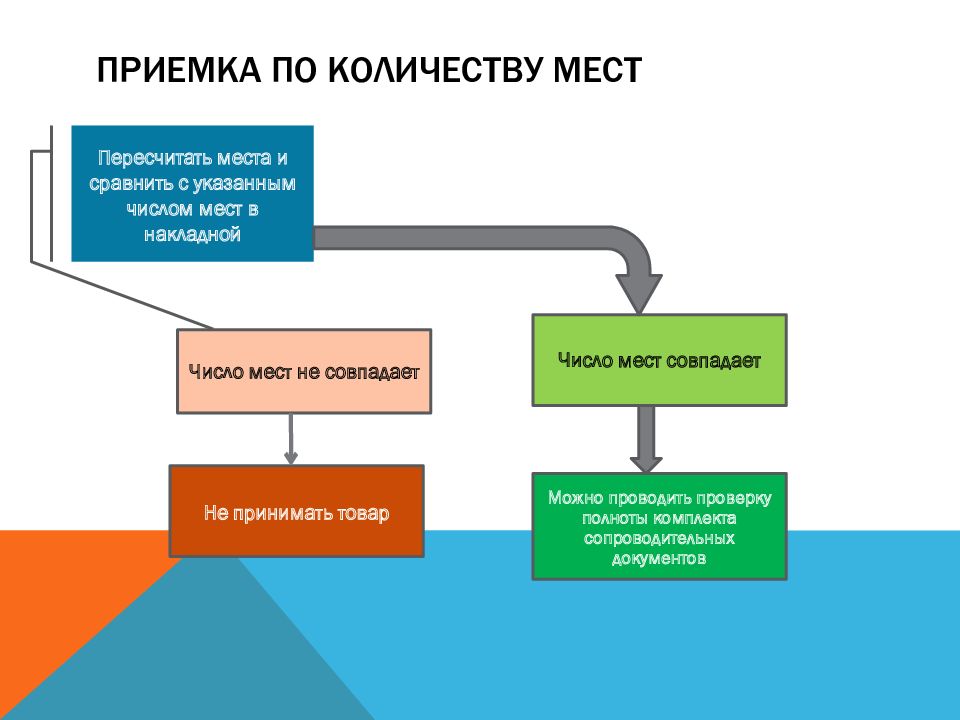
Слайд 14: Приемка по количеству мест
Пересчитать места и сравнить с указанным числом мест в накладной Число мест совпадает Число мест не совпадает Можно проводить проверку полноты комплекта сопроводительных документов Не принимать товар
Слайд 15: Сопроводительные документы
Товарная накладная (форма ТОРГ-12) или товарно-транспортная накладная (товарный документ). Накладная содержит информацию о товаре и является первичным документом, который служит доказательством передачи товара и основанием для постановки его на учет Реестр (документы) для подтверждения качества товара Счет-фактура ( для учета налога на добавленную стоимость – налоговый документ ) Счет (основание для оплаты поступивших товаров – расчетный документ ) Протокол согласования цен поставки ЛП, включенных в перечень жизненно необходимых и важнейших ЛП (для формирования розничных цен ) 15
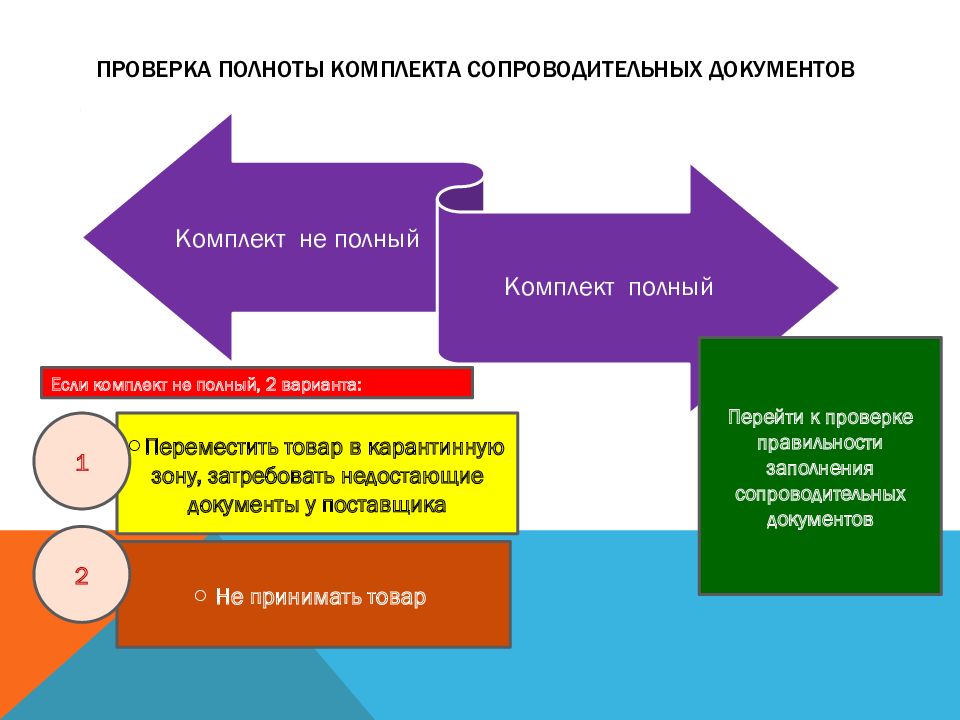
Слайд 16: Проверка полноты комплекта сопроводительных документов
Перейти к проверке правильности заполнения сопроводительных документов Если комплект не полный, 2 варианта: Переместить товар в карантинную зону, затребовать недостающие документы у поставщика Не принимать товар 1 2
Слайд 17: Проверка правильности заполнения сопроводительных документов
Проверить сопроводительные документы на наличие обязательных реквизитов и правильность их заполнения НА ЛС ОФОРМЛЯЕТСЯ СОПРОВОДИТЕЛЬНЫЙ ДОКУМЕНТ, СОДЕРЖАЩИЙ ИНФОРМАЦИЮ : о дате оформления сопроводительного документа; о наименовании ЛС (МНН ЛС и ТН ЛП), сроке годности и номере серии ; о производителе ЛС с указанием наименования и местонахождения производителя ; о количестве упаковок ; о поставщике (ИНН, полное наименование поставщика, его местонахождение); о покупателе (ИНН, полное наименование покупателя, его местонахождение); о должностном лице, составившем сопроводительный документ (должность, Ф.И.О.). Документ заверяется подписью должностного лица, составившего сопроводительный документ, печатью организации или информационным штрих-кодом и печатью организации
Слайд 18: Проверка правильности заполнения сопроводительных документов
Если обязательные реквизиты в наличии и верно заполнены, поставить на накладной отметку о приемке товара: штамп приемки с указанием: количество мест подпись материально-ответственного лица дату приемки товара пометку о времени приемки товара печать аптечной организации (с отметкой – «принято по количеству мест без пересчета количества единиц и без проверки качества) Экземпляры поставщика отдать экспедитору. Затем перейти к вскрытию тары. Если какой-либо из обязательных реквизитов отсутствует или неправильно заполнен, не принимать товар.
Слайд 19: Вскрытие тары
Вскрыть тару таким образом, чтобы не повредить ее содержимое. Товары, требующие специальных условий хранения и мер безопасности, поместить в надлежащие условия хранения в зоне приемки товара. При повреждении содержимого транспортной тары во время вскрытия, поместить поврежденный товар в карантинную зону и проинформировать ответственного за приемку товара о наличии несоответствующего товара. Перейти к оценке соответствия принимаемых товаров товаросопроводительной документации Для ИЛП: Вскрыть термоконтейнер и проверить показания терморегистратора на соответствие условиям хранения находящегося внутри ИЛП.
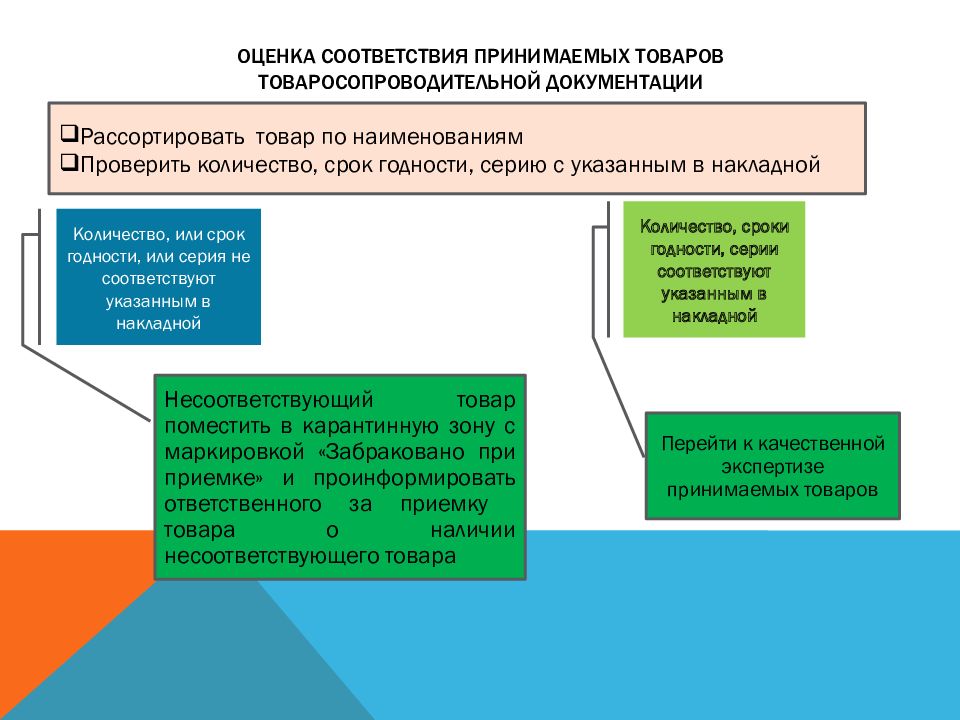
Слайд 20: Оценка соответствия принимаемых товаров товаросопроводительной документации
Рассортировать товар по наименованиям Проверить количество, срок годности, серию с указанным в накладной Количество, или срок годности, или серия не соответствуют указанным в накладной Количество, сроки годности, серии соответствуют указанным в накладной Перейти к качественной экспертизе принимаемых товаров Несоответствующий товар поместить в карантинную зону с маркировкой «Забраковано при приемке» и проинформировать ответственного за приемку товара о наличии несоответствующего товара
Слайд 21: Качественная экспертиза принимаемых товаров (приемка по качеству, приемочный контроль)
Лекарственные препараты независимо от источника их поступления подвергаются приемочному контролю с целью предупреждения поступления в продажу фальсифицированных, недоброкачественных, контрафактных ЛП Приемочный контроль заключается в проверке поступающих лекарственных препаратов путем оценки: внешнего вида, цвета, запаха целостности упаковки соответствия маркировки ЛП требованиям, установленным законодательством об обращении ЛС правильности оформления сопроводительных документов наличия документов (реестра), подтверждающих качество ЛС в соответствии с действующими нормативными документами.
Слайд 22: Документы о качестве
На лекарственные препараты : Декларация о соответствии (на ЛП, введенные в гражданский оборот до 29.11.2019г. ) 2 документа, в соответствии со ст. 52.1 (Ввод в ГО ЛП)ФЗ № 61-ФЗ (см. лекцию 1): Документ производителя (паспорт, сертификат) Подтверждение уполномоченного лица производителя ЛС соответствия ЛП требованиям, установленным при его государственной регистрации Иные товары- в соответствии с ПП РФ от 23 декабря 2021 г. № 2425 ( Об утверждении единого перечня продукции, подлежащей обязательной сертификации и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии) Сертификат соответствия Декларация о соответствии
Слайд 23: Статья 52.1. Ввод в гражданский оборот ЛП для медицинского применения (ФЗ от 12.04.2010 № 61-ФЗ «Об обращении ЛС»)
Статья 52.1 вступает в силу с 29.11.2019. ЛП для медицинского применения, введенные в гражданский оборот до 29.11.2019, подлежат хранению, перевозке, отпуску, реализации, передаче, применению до истечения срока их годности 1. Перед вводом в гражданский оборот каждой серии или каждой партии произведенного в РФ ЛП для медицинского применения, за исключением иммунобиологических ЛП, производитель представляет в федеральный орган исполнительной власти, осуществляющий функции по контролю и надзору в сфере здравоохранения, Росздравнадзор) : документ производителя ЛС, подтверждающий качество ЛП, и подтверждение уполномоченного лица производителя ЛС соответствия ЛП требованиям, установленным при его государственной регистрации. 2. Перед вводом в гражданский оборот каждой серии или каждой партии ввозимого в РФ ЛП для медицинского применения, за исключением иммунобиологических ЛП, организация, осуществляющая ввоз ЛП, представляет в федеральный орган исполнительной власти, осуществляющий функции по контролю и надзору в сфере здравоохранения сертификат производителя ЛС, удостоверяющий соответствие ввозимого ЛП требованиям фармакопейной статьи, а в случае отсутствия фармакопейной статьи требованиям нормативной документации, и подтверждение представителя организации, осуществляющей ввоз ЛП в РФ и уполномоченной иностранным производителем ЛС, соответствия ввозимого ЛП требованиям, установленным при его государственной регистрации. 23
Слайд 24: Документальное подтверждение результатов приемки
Если фактическое количество и качество товаров аптечного ассортимента соответствует указанному в сопроводительных документах, то на сопроводительных документах проставляется штамп приемки, подтверждающий факт соответствия принятых товаров аптечного ассортимента данным, указанным в сопроводительных документах « Штамп приемки » (форма АП-1) (на обороте товарной накладной), в котором указывается: сумма принятых товаров, дата приемки подпись материально ответственного лица и заверяет ее печатью субъекта розничной торговли (при наличии) Либо оформляется « Акт о приемке товаров » (форма № ТОРГ-1) Не подлежат приемке ЛП и другие товары, разрешенные к реализации из аптечных организаций, не соответствующие требованиям к качеству, стандартам и без документов (информации), удостоверяющих их качество
Слайд 25: Сроки приемки
Окончательная приемка товаров осуществляется в сроки, указанные в договоре поставки При этом ядовитые и сильнодействующие вещества, наркотические средства, психотропные вещества, термолабильные ЛП необходимо немедленно размещать в местах хранения в соответствии с установленными требованиями 25
Слайд 26: В случае обнаружения расхождений при приемке това ра
26 В случае обнаружения расхождений при приемке това ра 1 ) приемку необходимо приостановить 2) о выявленных расхождениях сообщить поставщику 3) при неявке представителя поставщика по вызову получателя (покупателя) в установленный срок и в случаях, когда вызов представителя поставщика не является обязательным (согласно договору поставки), приемка товаров может быть продолжена приемной комиссией в прежнем составе с участием представителя другой организации или представителя общественности аптечной организации. Материально ответственные и подчиненные им лица, а также лица, осуществляющие учет, хранение, приемку и отпуск материальных ценностей, в качестве представителей общественности аптечной организации привлекаться не должны. Для участия в приемке товара представитель должен иметь разовое удостоверение. если во время поступления товаров документы поставщика отсутствуют, приемная комиссия может составить « Акт о приемке товаров, поступивших без счета поставщика» (форма № ТОРГ- 4), а товар перемещается в карантинную зону
Слайд 27: Документирование выявленных несоответствий при приемке товаров
В случае несоответствия товаров аптечного ассортимента условиям договора, данным сопроводительных документов, выявления при приемке боя, порчи, недостачи товаров, обнаружения недоброкачественных, фальсифицированных и контрафактных товаров Оформляются: Акт об установленном расхождении по количеству и качеству при приемке товарно-материальных ценностей (форма ТОРГ-2) в 2-х экз. с подписями всех членов приемной комиссии, который является юридическим основанием для предъявления претензии поставщику Претензия поставщику (в письменном виде с подписью руководителя аптечной организации. В ней отражается предмет претензии, ожидаемые действия поставщика по устранению установленных расхождений при приемке товара, указывается, в какой срок поставщик должен рассмотреть претензию и ответить на нее. Обычно этот срок стороны определяют в договоре. Журнал регистрации результатов приемочного контроля, где нужно указать выявленные несоответствия при приемке товара с указанием наименования ЛП, серии и срока годности, количества, причины несоответствия, ФИО ответственного и подпись 27
Слайд 28: Акт об установленном расхождении по количеству и качеству при приемке товарно-материальных ценностей
составляется: на лекарственные препараты (лекарственные средства) в поврежденной упаковке не имеющие необходимой сопроводительной документации забракованные при приемке не соответствующие заказу недоброкачественные, фальсифицированные ЛП, с истекшим сроком годности Эти препараты должны быть соответствующим образом промаркированы и помещены в специально выделенную зону (карантинную) отдельно от других ЛП до их идентификации, возврата поставщику или передачи для уничтожения в установленном порядке 28
Слайд 29: Документальное оформление поступившего товара
29 Документальное оформление поступившего товара Учет первичных документов по приходу товаров материально ответственные лица ведут: " Журнал поступления товаров " (произвольной формы), в котором указываются: по ставщик, название, дата и номер приходного документа, дата поступления товаров, сроки оплаты и др. «Журнал регистрации результатов приемочного контроля», где нужно указать выявленные несоответствия при приемке товара с указанием наименования ЛП, серии и срока годности, количества, причины несоответствия, ФИО ответственного и подпись Принятые товары регистрируются ( приходуются ) в день окончания их приемки по фактическому количеству и сумме. В сумме (денежном измерителе) в ценах поступления (оптовых) и ( или) в розничных ценах учет товаров осуществляется материально ответственным лицом в приходной части « Товарного отчета » (форма № ТОРГ-29) По ф актическому количеству – в соответствующих журналах (предметно-количественный учет)
Слайд 30: ФЗ от 12 апреля 2010 г. № 61-ФЗ «Об обращении ЛС»
Статья 58.1. ПРЕДМЕТНО-КОЛИЧЕСТВЕННЫЙ УЧЕТ ЛС ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ Перечень ЛС для медицинского применения, подлежащих предметно-количественному учету (ПКУ ), утвержден приказом Минздрава России от 1 сентября 2023 г. N 459н " Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учету»: I. ЛС- фармацевтические субстанции и ЛП, содержащие наркотические средства, психотропные вещества и их прекурсоры (их соли, изомеры, стереоизомеры) и включенные в списки II, III, IV перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ, утвержденного постановлением Правительства РФ от 30 июня 1998 г. N 681в сочетании с фармакологически неактивными веществами, а также ЛС, являющиеся комбинированными ЛП, которые содержат кроме НС, ПВ и их прекурсоров другие фармакологически активные вещества и в отношении которых в соответствии с пунктом 4 статьи 2 Федерального закона от 8 января 1998 г. N 3-ФЗ "О НС и ПВ" предусмотрены меры контроля, аналогичные тем, которые установлены в отношении НС, ПВ и их прекурсоров, содержащихся в них : а также ЛП, содержащие НС, ПВ и их прекурсоры в сочетании с фармакологически активными веществами (по списку) II. ЛС- фармацевтические субстанции и ЛП, включенные в списки сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса РФ, утвержденные ПП РФ от 29 декабря 2007 г. N 964 "Об утверждении списков сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса РФ, а также крупного размера сильнодействующих веществ для целей статьи 234 Уголовного кодекса Российской Федерации" (далее - сильнодействующие и ядовитые вещества), в сочетании с фармакологически неактивными веществами, а также ЛП, содержащие сильнодействующие и ядовитые вещества в сочетании с фармакологически активными веществами (при условии включения их в перечень отдельной позицией): III. Комбинированные ЛП, перечисленные в подпункте 2 пункта 9 Порядка назначения ЛП, утвержденного приказом Минздрава России от 24 ноября 2021 г. N 1094н "Об утверждении Порядка назначения ЛП, форм рецептурных бланков на ЛП, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение НС или ПВ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов " IV. Иные ЛС, подлежащие предметно-количественному учету ( Мизопростол,Мифепристон, Циклопентолат )
Слайд 31: ПРЕДМЕТНО-КОЛИЧЕСТВЕННЫЙ УЧЕТ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Предметно-количественный учет ЛС для медицинского применения ведут: производители лекарственных средств, организации оптовой торговли лекарственными средствами, аптечные организации, ИП, имеющие лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность, медицинские организации, осуществляющие обращение ЛС для медицинского применения, путем регистрации любых связанных с их обращением операций, при которых изменяется их количество и (или) состояние, в специальных журналах учета операций, связанных с обращением ЛС для медицинского применения
Слайд 32: Специальные журналы учета операций, связанных с обращением ЛС для медицинского применения
ЖУРНАЛ регистрации операций, связанных с оборотом наркотических средств и психотропных веществ, в результате которых изменяются количество и состояние наркотических средств и психотропных веществ ( ПП РФ от 30.11.2021 № 2117 «О порядке представления сведений о деятельности, связанной с оборотом наркотических средств и психотропных веществ….) ЖУРНАЛ регистрации операций, при которых изменяется количество прекурсоров наркотических средств и психотропных веществ, ( ПП РФ от 28.10.2021. N 1846 "О представлении сведений о деятельности, связанной с оборотом прекурсоров наркотических средств и психотропных веществ,…) « Журнал учета операций, связанных с обращением лекарственных средств для медицинского применения » (правила ведения и форма утв. Приказ Минздрава России № 378н от 17 июня 2013 г. ) « Журнал учета движения ИЛП » (иммунобиологические ЛП) ( регл. Пост. Гл. сан. Врача РФ №4 от 28.01.2021-СанПиН 3.3686-21 ) «Журнал учета ЛП с ограниченным сроком годности » – на бумажном носителе или в электронном виде с архивацией. В помещениях для хранения лекарственных средств оформляются также стеллажные карты, предназначенные для идентификации хранящихся лекарственных средств, с указанием наименования, формы выпуска и дозировки, номера серии, срока годности, производителя лекарственных средств. 32
Слайд 33: Документальное подтверждение приемки товара
33 Документальное подтверждение приемки товара Если фактическое количество и качество товаров соответствует указанному в сопроводительных документах, то оформляется документ унифицированной формы Штамп приемки » (форма АП-1) (на обороте товарной накладной), в котором указывается: сумма принятых товаров, дата приемки подпись материально ответственного лица. либо « Акт о приемке товаров » (форма № ТОРГ-1) Не подлежат приемке ЛП и другие товары, разрешенные к реализации из аптечных организаций, не соответствующие требованиям к качеству, стандартам и без документов (информации), удостоверяющих их качество
Слайд 34: Зоны хранения
В соответствии с Правилами надлежащей практики хранения и перевозки лекарственных препаратов, утвержденных приказом Минздрава России от 31.08.2016 №646н Площадь помещений должна быть разделена на зоны, предназначенные для выполнения следующих функций: приемки ЛП хранения ЛП, требующих специальных условий хранения выявленных фальсифицированных, недоброкачественных, контрафактных ЛП, а также ЛП с истекшим сроком годности карантинного хранения ЛП ( предназначена для изолированного размещения ЛП, обращение которых приостановлено, либо не принято решение об их дальнейшем обращении). 34 Минздрав обязывает выделить отдельную зону карантинного хранения для товаров нелекарственного ассортимента (подп. «б» п. 24 приказа Минздрава от 31.08.2016 № 647н). Но лучше не объединять в этих зонах МИ, БАД и другие товары. Представители Росздравнадзора настойчиво рекомендуют аптечным организациям выделять для медицинских изделий отдельные карантинные зоны, такие же, как для лекарственных препаратов. Прислушаться к таким рекомендациям — значит избежать ненужных проблем при проверках.
Слайд 35: ОСОБЕННОСТИ ПРИЕМКИ, ТРАНСПОРТИРОВАНИЯ И ХРАНЕНИЯ ИММУНОБИОЛОГИЧЕСКИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Нормативная база, регулирующая обращение иммунобиологических лекарственных препаратов в аптечных организациях: Об утверждении санитарных норм и правил СанПиН 3.3686-21 «Санитарно эпидемиологические требования по профилактике инфекционных болезней: Постановление главного гос.сан.врача от 28.01.2021 № 4», раздел XLVIII. п.4252. Условия транспортирования и хранения иммунобиологических препаратов Уровни холодовой цепи, роль аптечных организаций в обеспечении контроля на каждом уровне холодовой цепи. Приемочный контроль, хранение и отпуск иммунобиологических лекарственных препаратов. Регистрация операций с иммунобиологическими лекарственными препаратами в аптечной организации. Требования к холодильному оборудованию и оборудованию контроля температурного режима.
Слайд 36: Иммунобиологические ЛП
Иммунобиологические лекарственные препараты - лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества (ФЗ от 12.04.2010 № 61-ФЗ «Об обращении ЛС»). К иммунобиологическим лекарственным препаратам относятся вакцины, анатоксины, токсины, сыворотки, иммуноглобулины и аллергены Для сохранения высокого качества и безопасности ИЛП проводится комплекс организационных, санитарно-противоэпидемических (профилактических), технических, контрольных и надзорных, учебно-методических и иных мероприятий по обеспечению оптимальных условий транспортирования и хранения ИЛП на всех этапах (уровнях) их движения от производителя до потребителя (" холодовая цепь").
Слайд 37: Уровни « холодовой цепи»
Первый уровень - доставка ИЛП от организации-изготовителя до организаций оптовой торговли ЛС, включая этап таможенного оформления. Второй уровень - хранение ИЛП организациями оптовой торговли ЛС и доставка ИЛП до других организаций оптовой торговли ЛС, городских и районных (сельских ) аптечных организаций, медицинских организаций, ИП, имеющих лицензию на фармацевтическую или медицинскую деятельность. Третий уровень - хранение ИЛП городскими и районными (сельскими) аптечными организациями, медицинскими организациями, ИП, имеющими лицензию на фармацевтическую или медицинскую деятельность, и доставка ИЛП до медицинских организаций или их обособленных подразделений (например, участковых больниц, амбулаторий, поликлиник, родильных домов) или иных организаций (например, медицинских кабинетов образовательных и других организаций), использующих ИЛП, а также розничная реализация ИЛП. Четвертый уровень - хранение ИЛП в медицинских организациях или их обособленных подразделениях (например, участковых больницах, амбулаториях, поликлиниках, родильных домах), иных организациях (медицинских кабинетах образовательных и других организаций ), где используются ИЛП.
Слайд 38: Приемка ИЛП
При приемке ИЛП следует учитывать Условия транспортирования и хранения иммунобиологических препаратов: Постановление главного гос.сан.врача от 28.01.2021 № 4», раздел XLVIII. п.4252. Об утверждении санитарных норм и правил СанПиН 3.3686-21 «Санитарно эпидемиологические требования по профилактике инфекционных болезней: Так, при транспортировании и хранении ИЛП должны соблюдаться условия, обеспечивающие сохранность качества препарата и защиту его от воздействия вредных факторов окружающей среды (температуры, влажности, света), от повреждения групповой, первичной и вторичной упаковки ИЛП. Транспортирование и хранение большинства ИЛП, в том числе содержащих в упаковке растворитель, осуществляется при температуре в пределах от +2 °C до +8 °C включительно. При определении режима транспортирования и хранения ИЛП необходимо руководствоваться инструкцией по его применению.
Слайд 39: Требования к температурному режиму транспортирования и хранения ИЛП
При транспортировании и хранении ИЛП должны соблюдаться условия, обеспечивающие сохранность качества препарата и защиту его от воздействия вредных факторов окружающей среды от повреждения групповой, первичной и вторичной упаковки ИЛП. Не допускается замораживание : адсорбированных препаратов, содержащих адъюванты (коклюшно-дифтерийно-столбнячной вакцины, дифтерийно-столбнячного анатоксина, вакцин против гепатита В и А, субъединичных гриппозных вакцин, инактивированной вакцины против полиомиелита), а также растворителей для вакцин при их транспортировании и хранении. На четвертом уровне " холодовой цепи" все ИЛП, в том числе растворители для вакцин, должны храниться в холодильнике при температуре в пределах от +2°С до +8°С включительно. При определении режима транспортирования и хранения ИЛП необходимо руководствоваться инструкцией по его применению.
Слайд 40: Требования к оборудованию для " холодовой цепи"
В системе " холодовой цепи" используются следующие виды оборудования: оборудование для транспортирования ИЛП; оборудование для хранения ИЛП; оборудование для контроля температурного режима хранения и транспортирования ИЛП. 4261. Покрытие внутренних и внешних поверхностей оборудования, используемого в системе " холодовой цепи", должно быть устойчиво к действию моющих и дезинфицирующих средств. 4262. Для бесперебойной работы холодильного оборудования и электрических приборов для контроля температурного режима необходимо обеспечить стабильность напряжения в электросетях, осуществляющих энергоснабжение данного оборудования, а также возможность электроснабжения по резервным схемам или автоматическое подключение системы автономного электропитания (электрогенераторов или аккумуляторов). 4263. Запрещается использовать оборудование " холодовой цепи" для совместного с ИЛП хранения и транспортирования продукции, которая может повлиять на качество ИЛП и (или) повредить их упаковку.
Слайд 41: Требования к оборудованию для транспортирования ИЛП
В системе " холодовой цепи" для транспортирования ИЛП используется следующее оборудование: термоконтейнеры, в том числе сумки-холодильники; хладоэлементы ; авторефрижераторы. При транспортировании ИЛП в термоконтейнере используется оборудование для контроля температурного режима, которое позволяет установить, были ли нарушения температурного режима в течение всего цикла транспортирования. Оборудование для контроля температурного режима размещается в каждом термоконтейнере в месте, рекомендованном производителем согласно термокарте, между упаковками с ИЛП. Контроль показаний приборов осуществляется после окончания цикла транспортирования во время выгрузки препаратов. Водители автотранспорта, используемого для транспортирования ИЛП, и (или) экспедиторы должны пройти обучение мерам и способам сохранения ИЛП при транспортировании и погрузке/выгрузке, а также в случае поломки или аварии в пути, и проведению дезинфекционных мероприятий.
Слайд 42: Требования к оборудованию для хранения ИЛП
Для хранения ИЛП используется следующее оборудование: холодильные камеры и комнаты; морозильные камеры; холодильники, в том числе холодильники-прилавки; морозильники, в том числе морозильники-прилавки; холодильники со встроенной морозильной камерой; термоконтейнеры, в том числе сумки-холодильники; хладоэлементы.
Слайд 43: Требования к оборудованию для хранения ИЛП
Холодильное оборудование необходимо размещать в отапливаемом помещении для предотвращения замораживания лекарственных средств при отрицательных температурах воздуха окружающей среды. В помещении также предусматривается подводка воды с установкой раковины. Площадь помещения определяется в соответствии с габаритами используемого оборудования. При размещении холодильного оборудования в подвальных и полуподвальных помещениях должны предусматриваться пути надежной эвакуации ИЛП в экстренной ситуации и защита оборудования от возможного затопления водопроводной водой или сточными водами. Холодильное оборудование должно размещаться таким образом, чтобы обеспечить свободный доступ к нему и выполнение загрузки и выгрузки ИЛП с использованием, при необходимости, средств механизации.
Слайд 44: Требования к оборудованию для хранения ИЛП
На первом, втором и третьем уровнях " холодовой цепи" для распаковывания, хранения, упаковки и подготовки для дальнейшего транспортирования ИЛП используются холодильные камеры (комнаты). Холодильные камеры (комнаты) должны оснащаться складским оборудованием, а также приборами измерения и контроля температуры. Морозильные камеры используются на первом и втором уровнях " холодовой цепи" для ИЛП, которые согласно инструкции по их применению должны храниться в замороженном состоянии. Холодильная (морозильная) камера (комната) не должна иметь оконных проемов, дверной проем оборудуется изотермической дверью (автоматическими воротами) шириной не менее 70 см. Дверь холодильной (морозильной) камеры (комнаты) должна открываться наружу по ходу пути аварийной эвакуации ИЛП и оборудована запирающим устройством, которое должно открываться как снаружи, так и изнутри. Холодильная (морозильная) камера (комната) оборудуется температурной сигнализацией. Текущая уборка в холодильных камерах (комнатах) осуществляется по мере необходимости ; генеральная уборка проводится не реже одного раза в месяц. Морозильные камеры оборудуются терморегистратором, термоиндикатором, встроенным и автономными термометрами. Все средства температурного контроля должны иметь возможность фиксировать низкие (до -25°С и ниже) отрицательные температуры.
Слайд 45: Требования к оборудованию для контроля температурного режима в системе " холодовой цепи"
Для контроля температурного режима в системе " холодовой цепи" используются средства измерения температуры и средства выявления (индикации) нарушений температурного режима. В качестве средства измерения температуры используются термометры в том числе электронные датчики температуры; термографы; терморегистраторы. Допускается использовать термометры, не являющиеся средствами измерения, но обладающие заявленными точностными характеристиками. Для выявления нарушений температурного режима (выход за пределы заданных температурно-временных условий ) используются средства контроля - термоиндикаторы для " холодовой цепи". Средства измерения температуры (термометры, термографы, терморегистраторы ) и средства выявления нарушений температурного режима ( термоиндикаторы ) должны обеспечивать сквозной непрерывный контроль температурного режима от момента закладки ИЛП в упаковочную тару до их получения пользователями на всех этапах транспортирования и в течение всего периода хранения. Оборудование для контроля температурного режима в системе " холодовой цепи", регистрирующее и отображающее конкретные значения температуры в конкретный момент времени ( термометры, датчики температуры, термографы, терморегистраторы ), должно подвергаться периодической поверке в соответствии с законодательством Российской Федерации. Периодичность поверки и калибровки определяется при регистрации конкретного устройства.
Слайд 46: Контроль температурного режима
Поставщик (перевозчик) ИЛП по требованию получателя ИЛП обязан предоставить документальное подтверждение своевременных поверок указанных приборов. При хранении ИЛП документы, подтверждающие своевременное проведение поверок средств измерения, используемых для контроля температурного режима, должны храниться у должностного лица, ответственного за " холодовую цепь". В системе " холодовой цепи" для измерения и отображения температуры (в пределах погрешности) используются электронные термометры (далее - термометры). Термометры используются во всех типах холодильного оборудования для хранения ИЛП и авторефрижераторах для транспортирования ИЛП. Контроль показаний каждого термометра осуществляется два раза в день ( в начале и в конце рабочего дня). Показания термометров регистрируются в специальном журнале мониторинга температуры, который заполняется отдельно на каждую единицу холодильного оборудования ( приложение 39 к Санитарным правилам ). В случае, если контроль температуры в холодильном оборудовании осуществляется с помощью системы мониторинга температурного режима, учет показаний приборов регистрации температурного режима осуществляется в электронном виде с архивацией. При хранении ИЛП в холодильниках и морозильниках как основное средство контроля температурного режима используют термоиндикатор Контроль показаний каждого термоиндикатора в оборудовании для хранения ИЛП осуществляется два раза в день. Показания каждого термоиндикатора или терморегистратора с указанием его персонифицированного номера регистрируются в журнале мониторинга температуры, который заполняется отдельно на каждую единицу холодильного оборудования ( приложение 39 к Санитарным правилам ) или в электронном виде.
Слайд 47: Общие требования к организации транспортирования и хранения ИЛП на всех уровнях " холодовой цепи"
На всех уровнях " холодовой цепи" в журнале ( приложение 40 к Санитарным правилам – Журнал учета движения ИЛП ) проводится регистрация поступления и отправления ИЛП в организации с указанием наименования производителя препарата, адреса производства, количества препарата (для вакцин и растворителей к ним - в дозах), серии, даты истечения срока годности, даты поступления (отправления), организации-поставщика, показаний термоиндикаторов и их идентификационных номеров, фамилии, имени, отчества (при наличии) ответственного работника, осуществляющего регистрацию. Если в оборудовании для транспортирования ИЛП имеется терморегистратор, его показания за все время транспортирования распечатываются на бумажном носителе или в электронном виде и прилагаются к приемочным документам на ИЛП. При наличии термоиндикатора на флаконе (ампуле) с ИЛП, контроль температурного режима хранения ИЛП осуществляется по показаниям имеющегося термоиндикатора на флаконе (ФТИ ). Сотрудник, осуществляющий регистрацию поступления и отправления ИЛП, должен пройти инструктаж (на рабочем месте) по вопросам соблюдения условий хранения и транспортирования ИЛП, работе с холодильным оборудованием и работе с приборами, регистрирующими изменения температурного режима (термометры, термоиндикаторы, терморегистраторы ), о чем должна быть сделана соответствующая запись в журнале инструктажа. На первом, втором и третьем уровнях " холодовой цепи" ежедневно два раза в день, а на четвертом уровне - в рабочие дни в журнале ( приложение 39 к Санитарным правилам ) или в электронном виде отмечаются показания термометров в холодильных (морозильных) камерах (комнатах), холодильниках (морозильниках), в которых хранятся ИЛП. В том же журнале регистрируются факты планового или аварийного отключения холодильного оборудования от энергоснабжения, поломок и факты нарушения температурного режима с указанием даты и времени отключения.
Слайд 48: Выявление нарушений температурного режима
Для выявления нарушений температурного режима (выход за пределы заданных температурно-временных условий) используются средства контроля - термоиндикаторы для " холодовой цепи". Каждый термоиндикатор должен иметь собственный идентификационный номер в целях предотвращения возможности фальсификации его показаний. Термоиндикатор должен иметь возможность визуальной индикации/сигнализации о нарушении температурного режима. При транспортировании ИЛП контроль показаний каждого термоиндикатора производится при загрузке (отправлении) и выгрузке (получении) препаратов. Показания каждого термоиндикатора с указанием его персонифицированного номера регистрируются в специальном журнале учета движения ИЛП.
Слайд 49: ИЛП
Сотрудник, осуществляющий регистрацию поступления и отправления ИЛП, должен пройти инструктаж (на рабочем месте) по вопросам соблюдения условий хранения и транспортирования ИЛП, работе с холодильным оборудованием и работе с приборами, регистрирующими изменения температурного режима (термометры, термоиндикаторы, терморегистраторы ), о чем должна быть сделана соответствующая запись в журнале инструктажа. Отпуск ИЛП при розничной реализации разрешается осуществлять при условии доставки до места непосредственного их использования в термоконтейнере или термосе с соблюдением требований " холодовой цепи". Каждая реализуемая населению доза ИЛП снабжается инструкцией по применению препарата на русском языке, в которой указаны условия его хранения и транспортирования. Работник аптеки, осуществляющий розничную продажу ИЛП, проводит инструктаж покупателя о необходимости соблюдения " холодовой цепи" при транспортировании ИЛП, о чем делается отметка на упаковке препарата, или рецепте, или в другом сопроводительном документе, заверенная подписью покупателя и продавца, проставляется дата и время отпуска ИЛП.
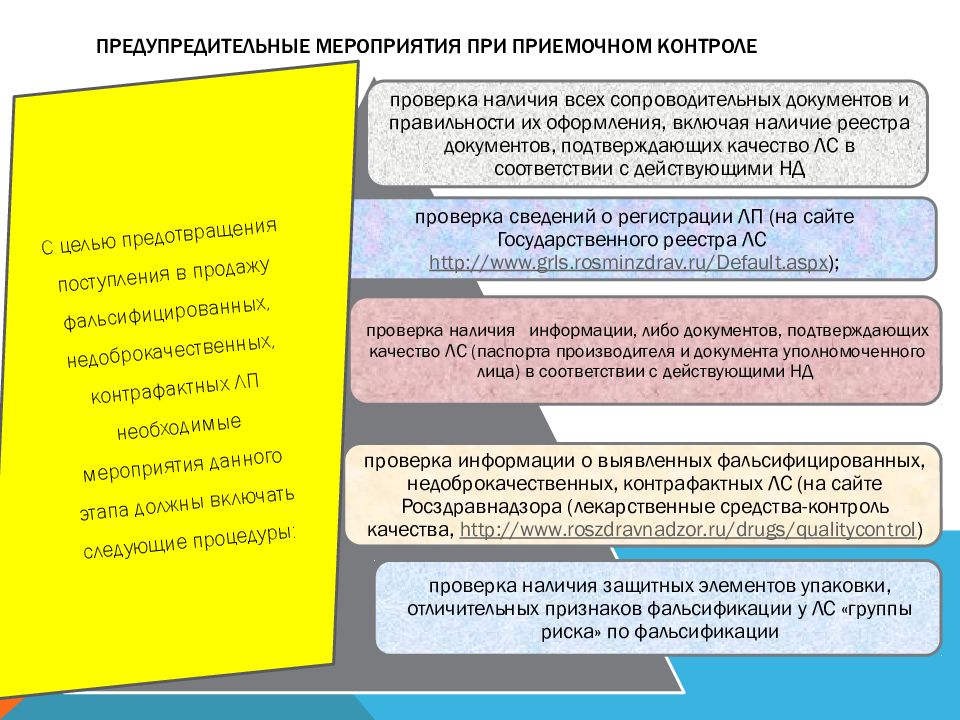
Слайд 50: Предупредительные мероприятия при приемочном контроле
С целью предотвращения поступления в продажу фальсифицированных, недоброкачественных, контрафактных ЛП необходимые мероприятия данного этапа должны включать следующие процедуры:
Слайд 51: Часть 2. Организация хранения товаров аптечного ассортимента
Температура и влажность 4 Нормативные документы 1 Состав и отделка помещений 2 Оборудование и оснащение 3 Особенности хранения отдельных групп ЛС 5
Слайд 52: Нормативные документы
Общая фармакопейная статья ОФС. 1.1.0010 «Хранение лекарственных средств», утвержденная приказом Минздрава РФ от 20.07.2023 № 377 «Об утверждении общих фармакопейных статей и фармакопейных статей » (содержит общую информацию по хранению ЛС, требования к помещениям, оборудованию, контролю, а также по режимам хранения для различных групп ЛС). Приказ Министерства здравоохранения и социального развития РФ от 23.08.2010 № 706н «Об утверждении правил хранения лекарственных средств » Устанавливает требования к помещениям для хранения ЛС и регламентирует условия хранения ЛС. Приказ Министерства здравоохранения РФ от 31.08.2016 № 646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения». Приказом утверждены требования к условиям хранения и перевозки ЛП, в том числе минимизирующие риск проникновения фальсифицированных, недоброкачественных, контрафактных лекарственных препаратов в гражданский оборот. СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней »: Постановление главного гос.сан.врача от 28.01.2021 № 4», раздел XLVIII. п.4252. Условия транспортирования и хранения иммунобиологических препаратов
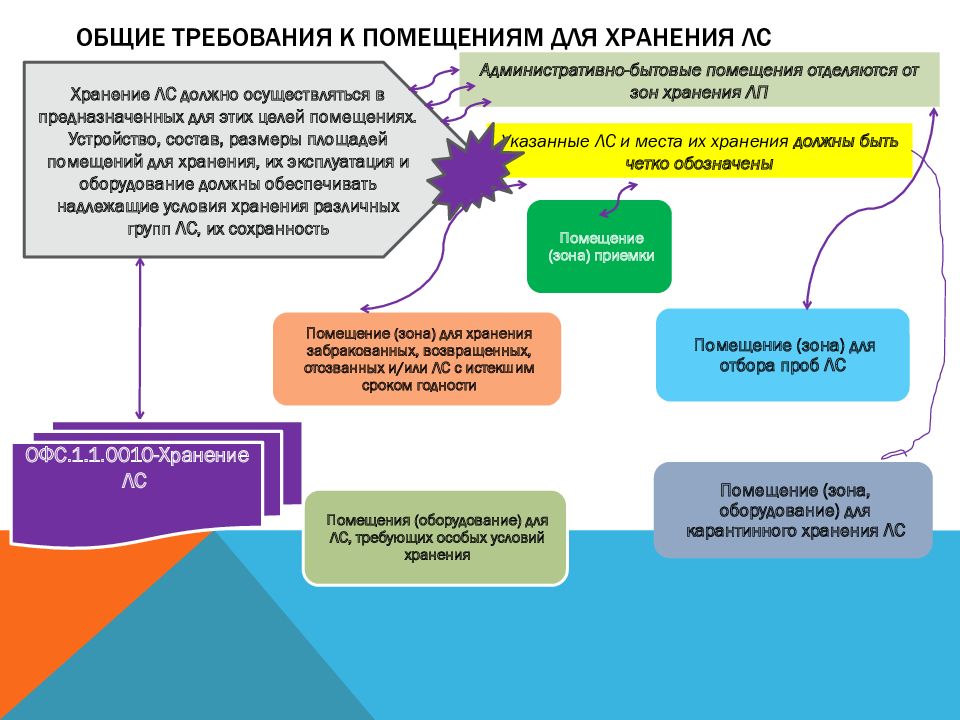
Слайд 53: Общие требования к помещениям для хранения ЛС
Хранение ЛС должно осуществляться в предназначенных для этих целей помещениях. Устройство, состав, размеры площадей помещений для хранения, их эксплуатация и оборудование должны обеспечивать надлежащие условия хранения различных групп ЛС, их сохранность Указанные ЛС и места их хранения должны быть четко обозначены Административно-бытовые помещения отделяются от зон хранения ЛП ОФС.1.1.0010-Хранение ЛС
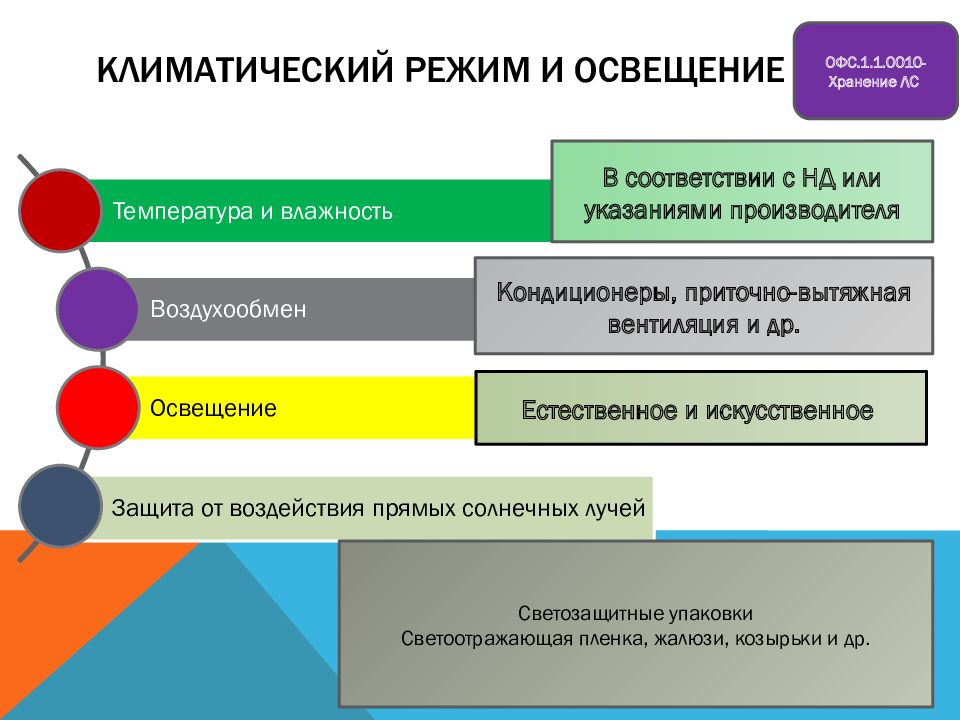
Слайд 54: Климатический режим и освещение
В соответствии с НД или указаниями производителя Кондиционеры, приточно-вытяжная вентиляция и др. Естественное и искусственное Светозащитные упаковки Светоотражающая пленка, жалюзи, козырьки и др. ОФС.1.1.0010-Хранение ЛС
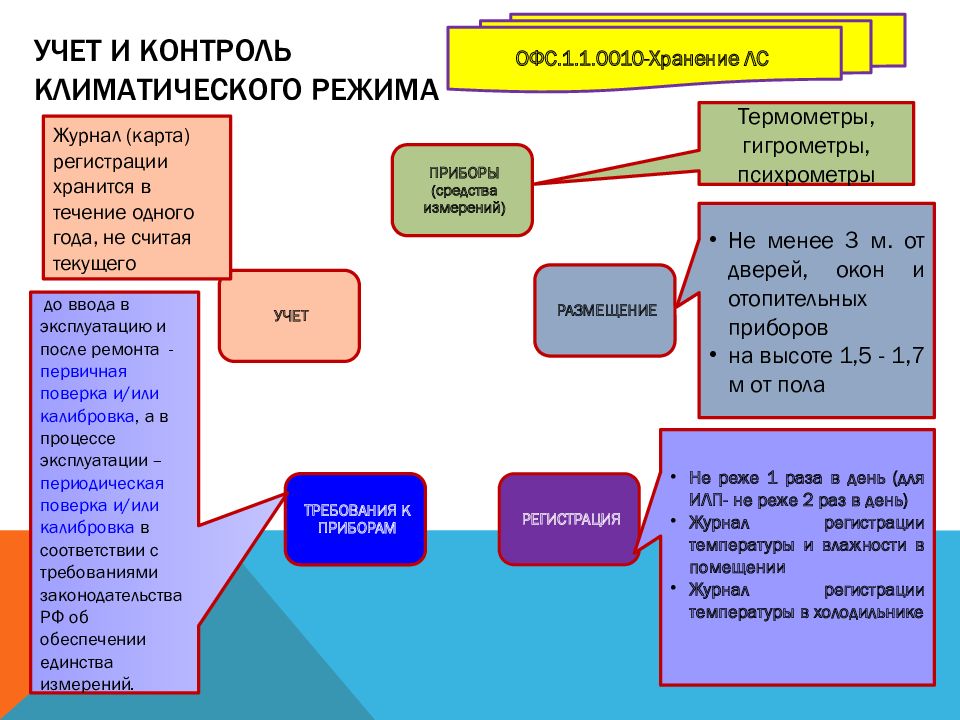
Слайд 55: Учет и контроль климатического режима
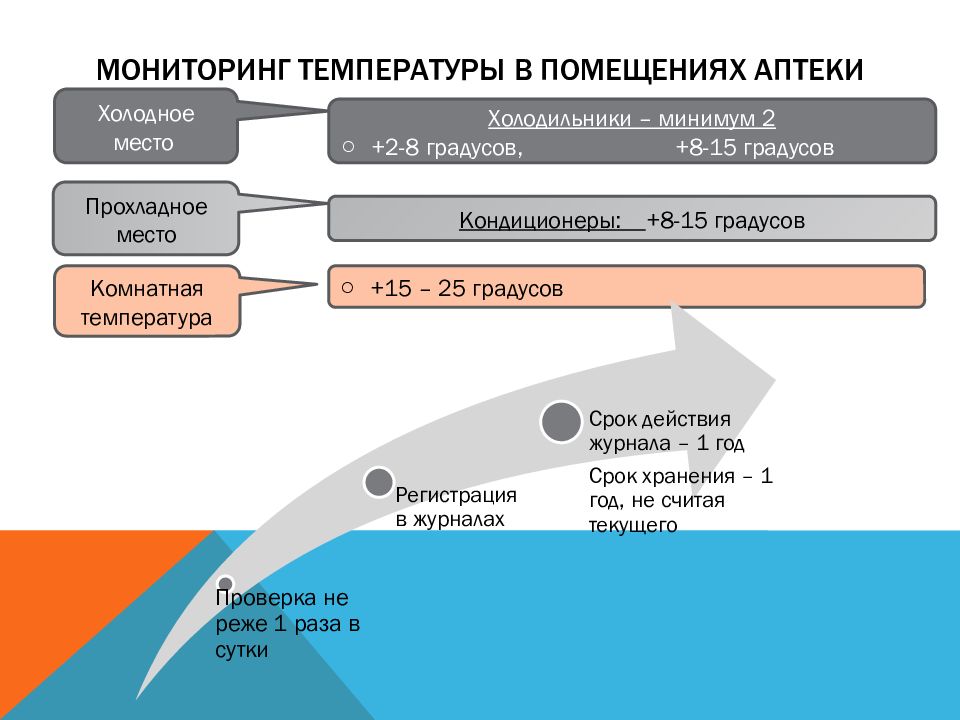
Термометры, гигрометры, психрометры Не менее 3 м. от дверей, окон и отопительных приборов на высоте 1,5 - 1,7 м от пола Не реже 1 раза в день (для ИЛП- не реже 2 раз в день) Журнал регистрации температуры и влажности в помещении Журнал регистрации температуры в холодильнике до ввода в эксплуатацию и после ремонта - первичная поверка и/или калибровка, а в процессе эксплуатации – периодическая поверка и/или калибровка в соответствии с требованиями законодательства РФ об обеспечении единства измерений. Журнал (карта) регистрации хранится в течение одного года, не считая текущего ОФС.1.1.0010-Хранение ЛС
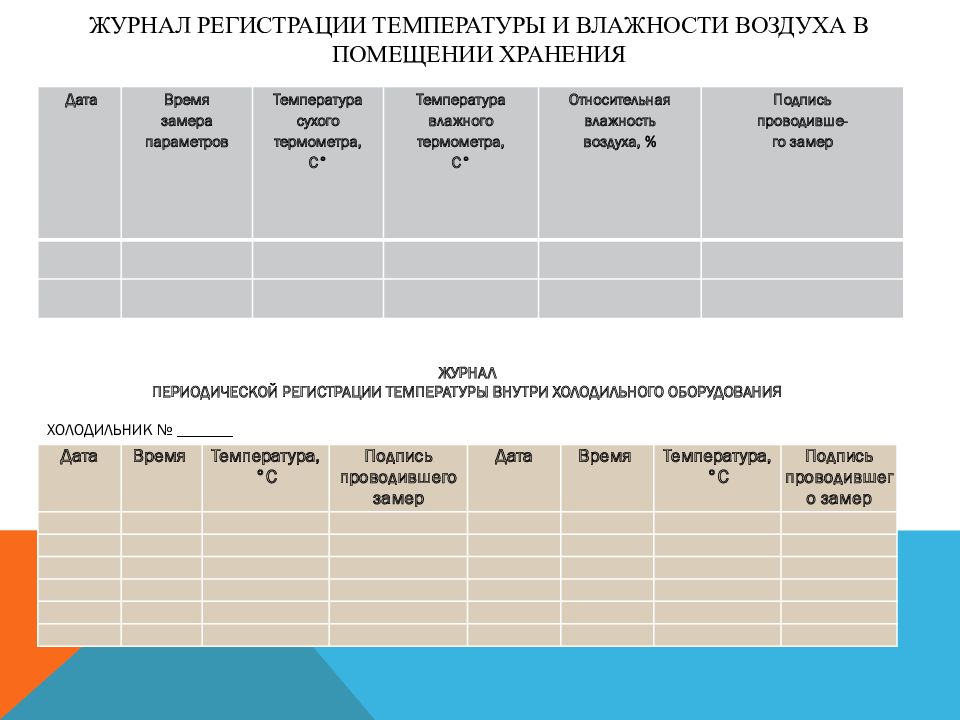
Слайд 56: Журнал регистрации температуры и влажности воздуха в помещении хранения
Дата Время замера параметров Температура сухого термометра, С° Температура влажного термометра, С° Относительная влажность воздуха, % Подпись проводивше- го замер ЖУРНАЛ ПЕРИОДИЧЕСКОЙ РЕГИСТРАЦИИ ТЕМПЕРАТУРЫ ВНУТРИ ХОЛОДИЛЬНОГО ОБОРУДОВАНИЯ ХОЛОДИЛЬНИК № _______ Дата Время Температура, °С Подпись проводившего замер Дата Время Температура, °С Подпись проводившего замер
Слайд 57: Мониторинг температуры в помещениях склада
Температурное картирование склада ( temperature mapping ) – изучение распределения температуры воздуха по объему помещения (зоны). С вступлением в силу приказа №646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения » температурное картирование должны проводить производители ЛС и организации оптовой торговли ЛС. Проведение температурного картирования склада позволяет: оценить пригодность помещения для хранения ЛП в заданных условиях выявить места с наиболее значительными колебаниями температуры определить горячие и холодные точки. В результате анализа полученных данных во время проведения измерений определяются места для установки постоянных приборов контроля температуры и (или) относительной влажности воздуха ( для системы мониторинга, регистрации и контроля параметров микроклимата ). Результат должен быть документально оформлен и храниться в течение двух лет. При изменении конструкции помещения (зоны) или установке оборудования, которое может повлиять на микроклимат требуется повторить изучение распределения температуры. Важно провести температурное картирование с учетом сезонных колебаний температуры ( минимум два раза ).
Слайд 58: Термины
Защищенное от света место Если указано, что хранить "в защищенном от света месте", то это означает, что следует принять меры во избежание попадания прямого солнечного света, любого другого яркого света, а также ультрафиолетовых лучей, например, путем использования посуды из специального стекла, работы в затемненной комнате и т.д. Сухое место Под термином "сухое место" понимают влажность не более 50 %. Хранение. Термин "не требует особых условий " означает хранение при комнатной температуре. Температура. Помимо конкретного указания температуры используют также следующие термины: В холодном месте, в холодильнике, холодный от +2 до +8 °С В прохладном месте, прохладный от +8 до +15 °С При комнатной температуре от +15 до +25 °С ОФС.1.1.0001- Общие положения (ГФ РФ XV)
Слайд 59: Мониторинг температуры в помещениях аптеки
Холодное место Кондиционеры: +8-15 градусов Холодильники – минимум 2 +2-8 градусов, + 8-15 градусов Прохладное место Комнатная температура +15 – 25 градусов
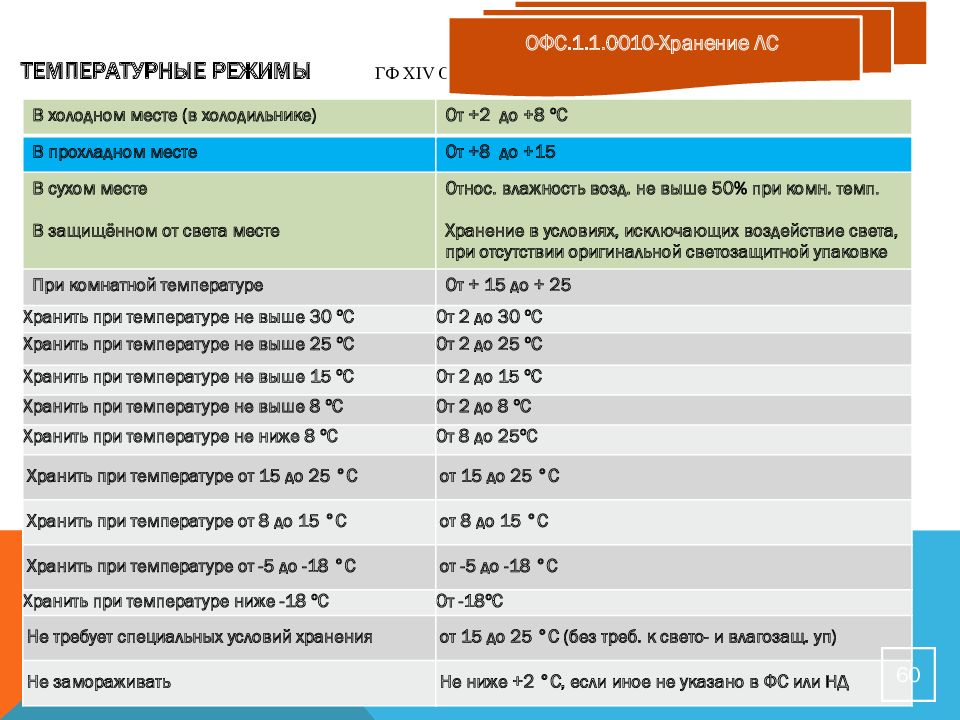
Слайд 60: Температурные режимы ГФ Х IV ОФС. 1.1.0010.18
В холодном месте ( в холодильнике) От +2 до +8 ºС В прохладном месте От +8 до +15 В сухом месте В защищённом от света месте Относ. влажность возд. не выше 50% при комн. темп. Хранение в условиях, исключающих воздействие света, при отсутствии оригинальной светозащитной упаковке При комнатной температуре От + 15 до + 25 Хранить при температуре не выше 30 ºС От 2 до 30 ºС Хранить при температуре не выше 25 ºС От 2 до 25 ºС Хранить при температуре не выше 15 ºС От 2 до 15 ºС Хранить при температуре не выше 8 ºС От 2 до 8 ºС Хранить при температуре не ниже 8 ºС От 8 до 25ºС Хранить при температуре от 15 до 25 °С от 15 до 25 °С Хранить при температуре от 8 до 15 °С от 8 до 15 °С Хранить при температуре от -5 до -18 °С от -5 до -18 °С Хранить при температуре ниже -18 ºС От -18ºС Не требует специальных условий хранения от 15 до 25 ° С (без треб. к свето- и влагозащ. уп ) Не замораживать Не ниже +2 °С, если иное не указано в ФС или НД 60 ОФС.1.1.0010-Хранение ЛС
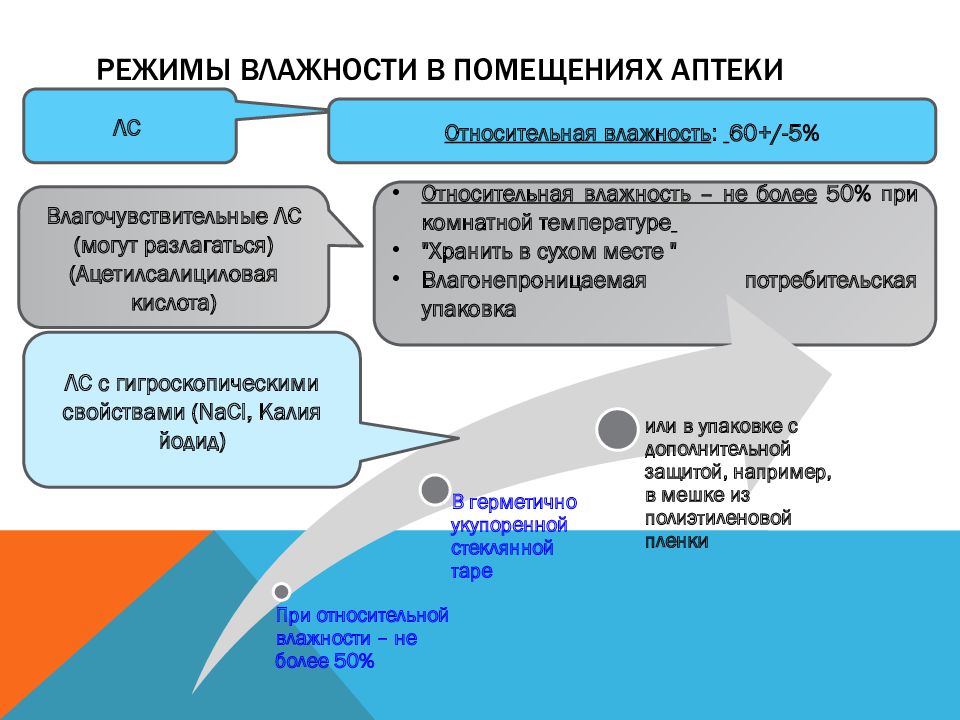
Последний слайд презентации: СПО ИП 2 курс Лекция Организация приемки и хранения товаров аптечного: Режимы влажности в помещениях аптеки
ЛС Относительная влажность – не более 50% при комнатной температуре "Хранить в сухом месте " Влагонепроницаемая потребительская упаковка Относительная влажность : 60 +/-5% Влагочувствительные ЛС (могут разлагаться) (Ацетилсалициловая кислота) ЛС с гигроскопическими свойствами ( NaCl, K алия йодид)