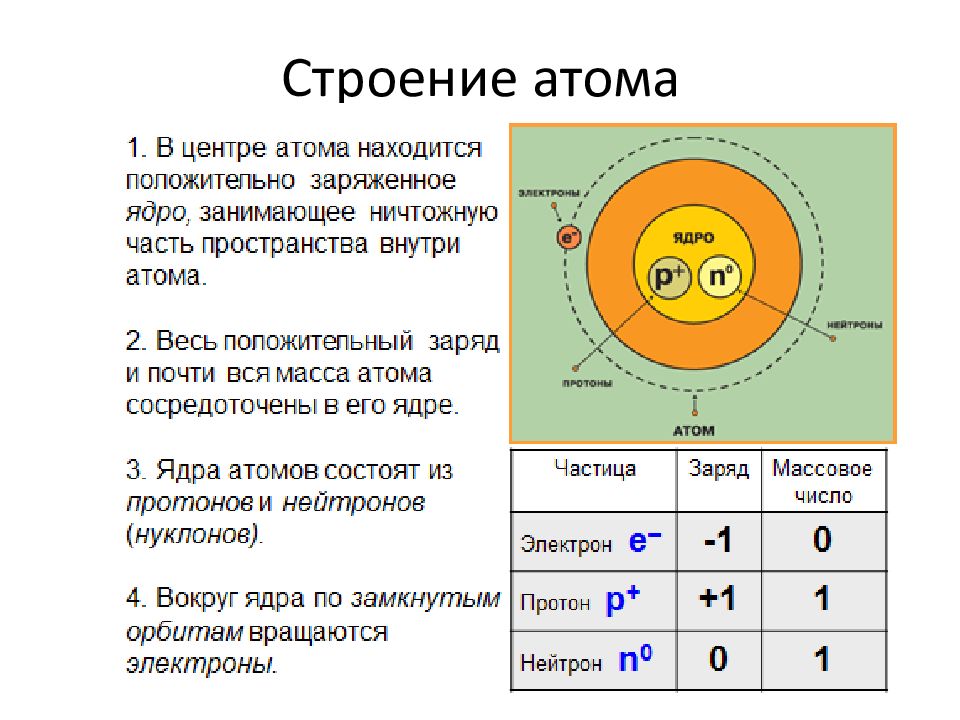
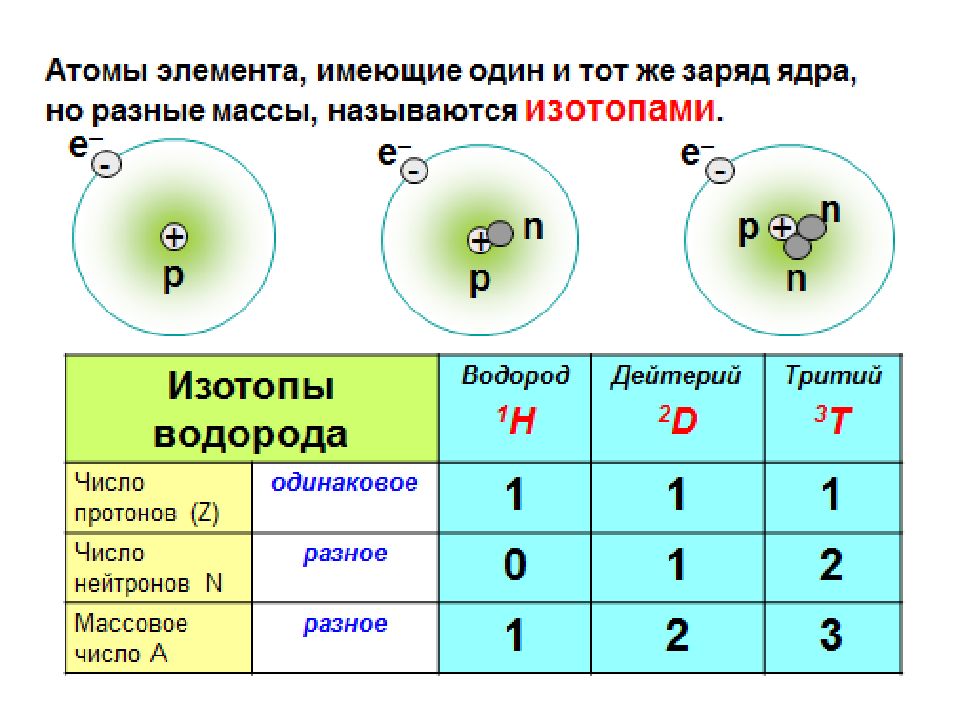
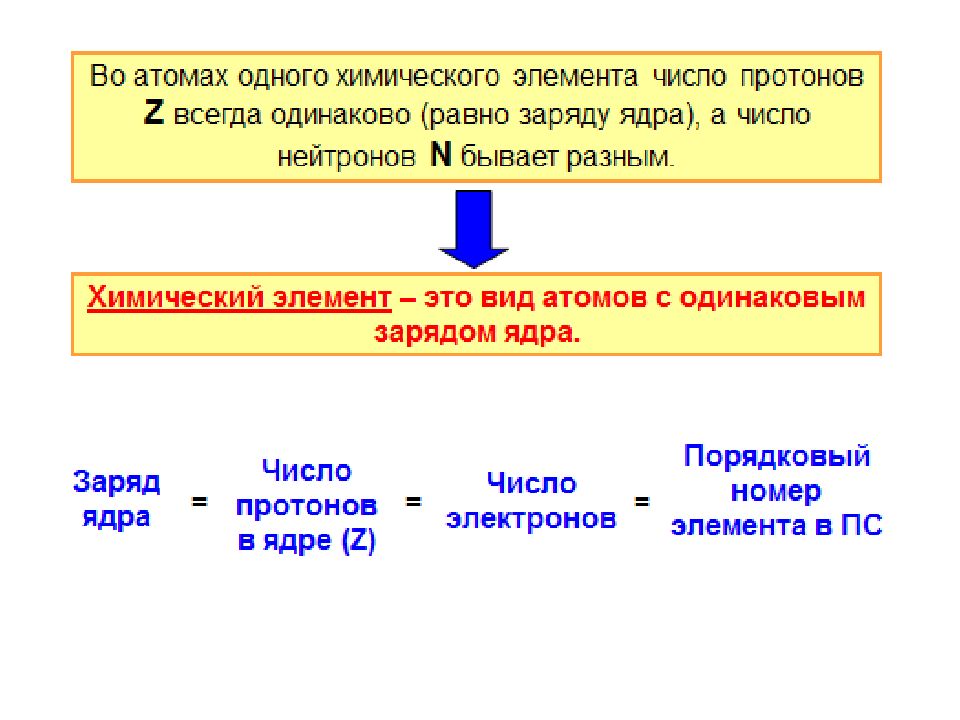
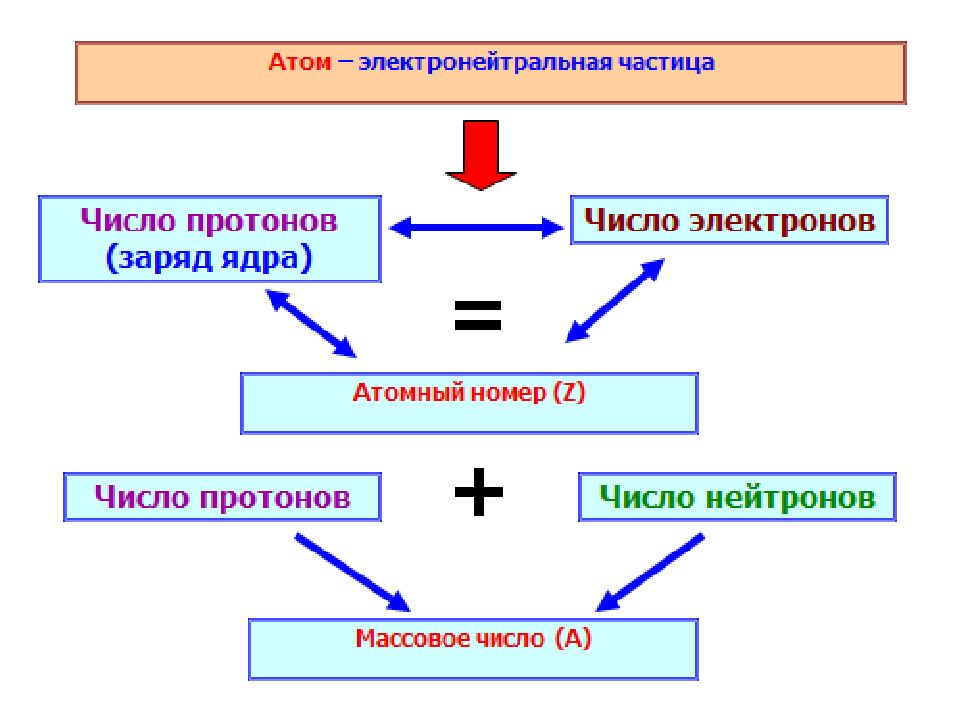
Первый слайд презентации: Строение атома
Подготовила преподаватель общей и неорганической химии Попова А.С. БПОУ ВО « Борисоглебскмедколледж » 2017 уч.год
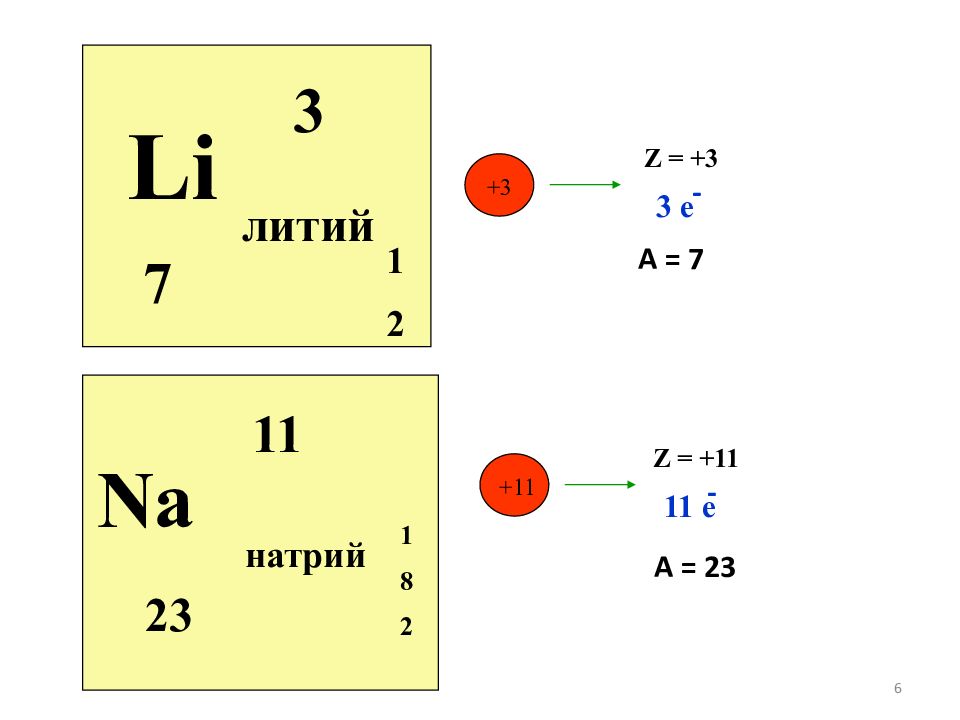
Слайд 6
6 Li 3 литий 7 1 2 Na 11 натрий 23 1 8 2 +11 Z = +11 3 е - 11 е - А = 7 А = 23 +3 Z = +3
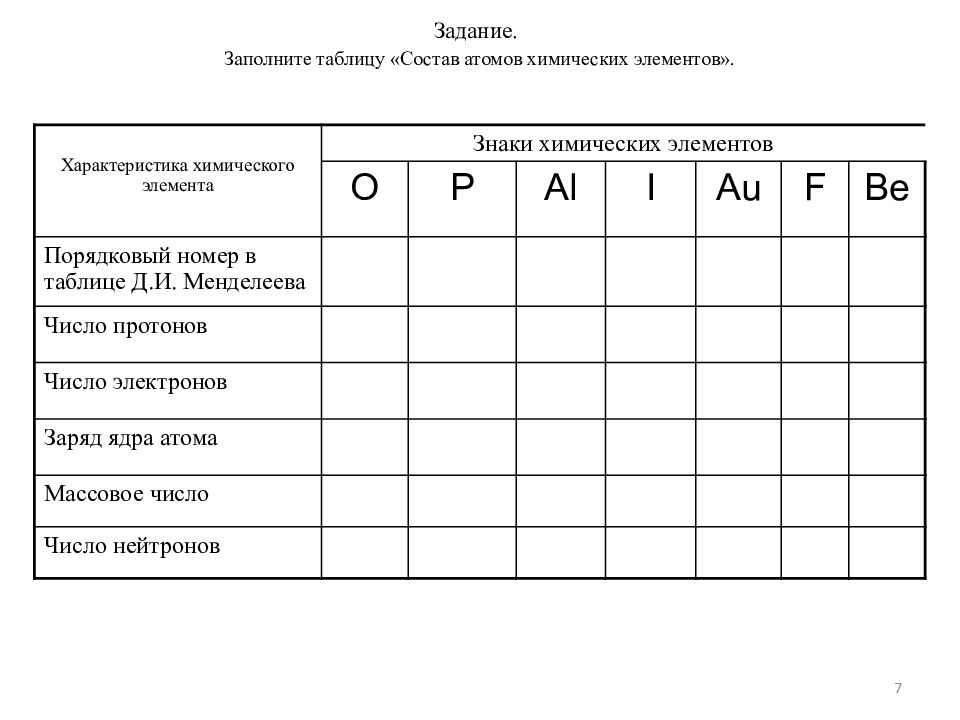
Слайд 7: Задание. Заполните таблицу «Состав атомов химических элементов»
7 Задание. Заполните таблицу «Состав атомов химических элементов». Характеристика химического элемента Знаки химических элементов O P Al I Au F Be Порядковый номер в таблице Д.И. Менделеева Число протонов Число электронов Заряд ядра атома Массовое число Число нейтронов
Слайд 8: Понятие об электронном облаке и s -, p -, d -, f - электронах
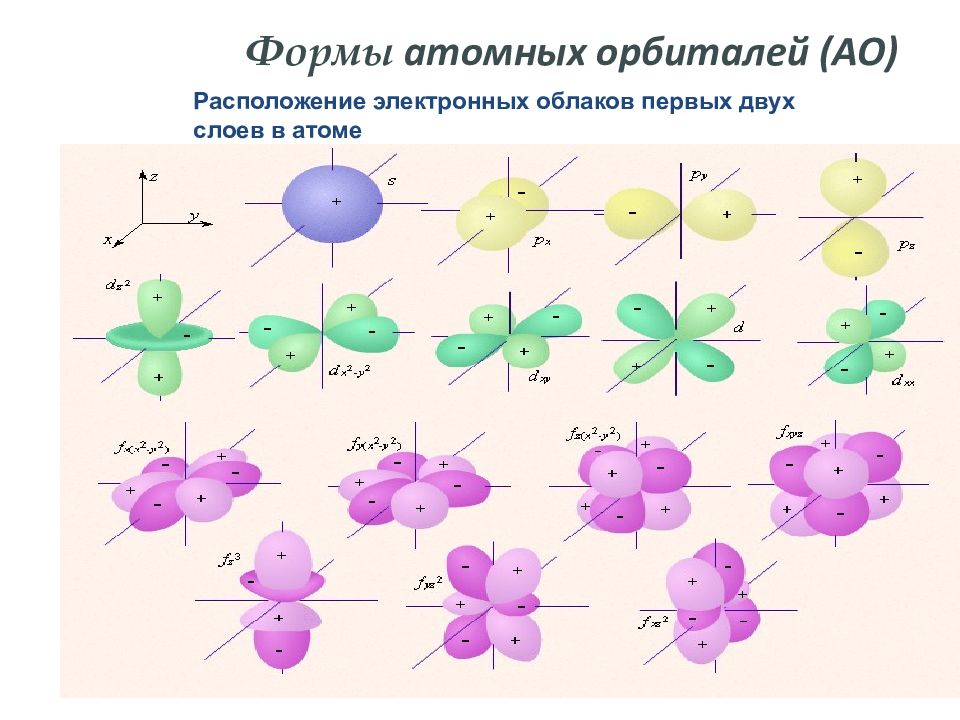
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называют атомной орбиталью. Атомные орбитали имеют различные формы, размеры и ориентацию в пространстве.
Слайд 9: Формы атомных орбиталей (АО)
Расположение электронных облаков первых двух слоев в атоме
Слайд 10: Состояние электронов в пространстве описывают с помощью четырех квантовых чисел
Главное квантовое число n – соответствует номеру энергетического уровня, на котором расположен электрон. (Количество энергетических уровней в атоме соответствует номеру периода, в котором расположен элемент.). Энергетический уровень – это совокупность энергетических состояний электрона в атоме, характеризующихся одним и тем же значением квантового числа n. Максимальное число электронов на каждом энергетическом уровне равно 2n 2.
Слайд 11
Побочное (орбитальное) квантовое число L – определяет форму атомной орбитали. Принимает значения: для s - орбитали= 0, для p -орбитали=1, для d =2, а для f = 3 Совокупность орбиталей одной формы (с одинаковым значением орбитального квантового числа) на данном энергетическом уровне образует энергетический подуровень. Число подуровней равно номеру уровня. На первом уровне один подуровень s. На втором – два s и p. На третьем – три s, p, d. На четвертом – четыре s, p, d, f.
Слайд 12: Магнитное квантовое число
Магнитное квантовое число m может принимать значения любых целых чисел, как положительных, так и отрицательных, от – L до + L, включая 0, т.е. всего ( 2 L + 1) значений. Например, s - орбиталь в форме шара имеет 1 направление в пространстве, р-орбиталь («гантель») в магнитном поле может ориентироваться в пространстве в 3-х направлениях, d - орбиталь – в 5 направлениях, f - орбиталь – в 7.
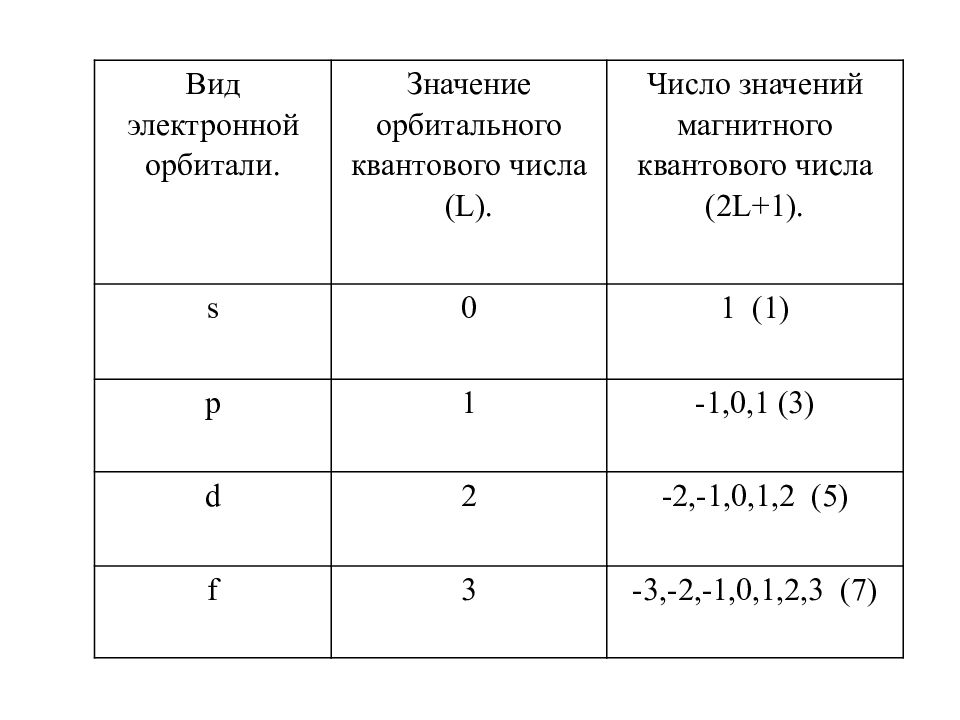
Слайд 13
Вид электронной орбитали. Значение орбитального квантового числа ( L ). Число значений магнитного квантового числа ( 2 L +1 ). s 0 1 (1) p 1 -1,0,1 (3) d 2 -2,-1,0,1,2 (5) f 3 -3,-2,-1,0,1,2,3 (7)
Слайд 14: S - спиновое квантовое число
Для объяснения всех свойств атома в 1925 г. была выдвинута гипотеза о наличии у электрона так называемого спина (сначала — для наглядности — считалось, что это явление аналогично вращению Земли вокруг своей оси при движении ее по орбите вокруг Солнца). На самом деле, спин — это чисто квантовое свойство электрона, не имеющее классических аналогов. Строго говоря, спин — это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = 1/2. Проекция спина на ось может иметь лишь два значения: S = +1/2 или S = -1/2. На каждой орбитали могут одновременно находиться не более двух электронов, они будут отличаться друг от друга значением спинового квантового числа.
Слайд 15
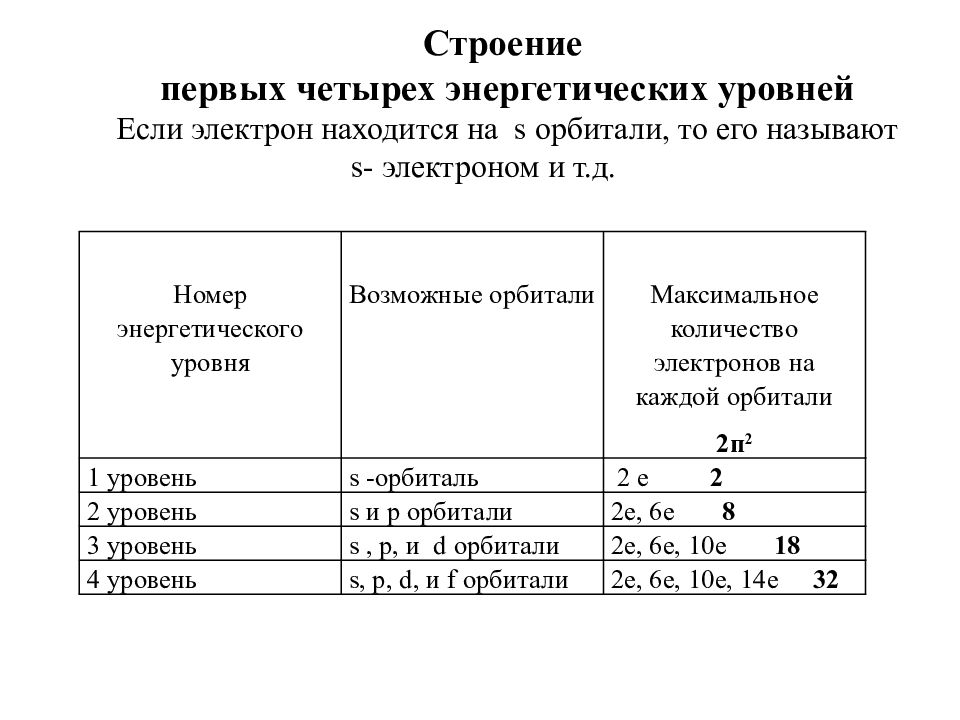
Номер энергетического уровня Возможные орбитали Максимальное количество электронов на каждой орбитали 2п 2 1 уровень s -орбиталь 2 е 2 2 уровень s и p орбитали 2е, 6е 8 3 уровень s, p, и d орбитали 2е, 6е, 10е 18 4 уровень s, p, d, и f орбитали 2е, 6е, 10е, 14е 32 Строение первых четырех энергетических уровней Если электрон находится на s орбитали, то его называют s - электроном и т.д.
Слайд 16
Электроны, как и люди, стремятся занять более комфортные места. Порядок заполнения подуровней в атомах химических элементов следующий: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … Примеры : S 1 s 2 2 s 2 2 p 6 3 s 2 3 p 4 p – элемент (т.к. последней заполняемой орбиталью является p-орбиталь ); Ca 1s 2 2s 2 2p 6 3s 2 3p 6 4 s 2 s – элемент ; V 1s 2 2s 2 2p 6 3s 2 3p 6 4s 4 3 d 3 d – элемент ; Pr 1s 2 2s 2 2p 6 3s 2 3p 6 4s 4 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4 f 3 5d 0 f - элеме нт
Слайд 17
Строение электронной оболочки атома напрямую зависит от положения элемента в Периодической системе. Число электронов в атоме химического элемента равно его порядковому номеру в Периодической системе Д. И. Менделеева. Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3… Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне. Для элементов побочных подгрупп количество электронов на внешнем энергетическом уровне равно двум, так как большая часть электронов расположена на предвнешнем уровне. Исключениями являются медь, хром и некоторые другие элементы. Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем d-подуровне.
Слайд 18
В зависимости от положения «последнего электрона» бывают s -, p -, d -, f-элементы : s-элементы — это элементы IA и IIA групп, в их атомах последний электрон занимает место на s-подуровне внешнего энергетического уровня; p-элементы — это элементы IIIA-VIIA групп, в их атомах последний электрон занимает место на p-подуровне внешнего энергетического уровня; d-элементы — это элементы побочных подгрупп, в их атомах последний электрон занимает место на d-подуровне предвнешнего энергетического уровня; f-элементы — это лантаноиды и актиноиды, 4f- и 5f-элементы соответственно, в их атомах последний электрон занимает место на f-подуровне предпредвнешнего энергетического уровня. У s - и p-элементов валентные электроны находятся на внешнем уровне. У d-элементов — на внешнем s - и на предвнешнем d-подуровнях.
Слайд 19
Электронная конфигурация титана Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме: четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены; четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне; всего двадцать два электрона (порядковый номер). В соответствии с порядком заполнения орбиталей распределим электроны: 22 Ti 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше. Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома титана составлена верно.
Слайд 20: Проскок электрона
Провал (проскок) электрона — переход электрона с внешнего энергетического уровня на предвнешний (нижележащий ). Например, у меди электронная оболочка должна выглядеть как..3d 9 4s 2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон «перепрыгивает» на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d 10 4s 1. Иметь конфигурацию 3d 5 более энергетически выгодно, чем 3d 4, поэтому у хрома происходит проскок электрона: электрон с верхнего «этажа» как будто проваливается на «этаж» ниже. Иметь конфигурации nd 5 и nd 10 более энергетически выгодно, чем nd 4 и nd 9.
Слайд 21: Порядок заполнения уровней и подуровней электронами
Можно рассмотреть порядок заполнения уровней и подуровней электронами основываясь на Запрете Паули, Правилах Хунда и Клечковского. Запрет Паули: в атоме не может быть двух электронов, четыре квантовых числа которых одинаковы (т.е. каждая атомная орбиталь не может быть заполнена более чем двумя электронами, причем с антипараллельными спинами.) Правило Хунда : электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарное спиновое число их было максимальным, т.е. наиболее устойчивому состоянию атома соответствует максимально возможное число неспаренных электронов с одинаковыми спинами. Правила Клечковского : А) Заполнение электронных слоев электронами начинается с уровней и подуровней, обладающими самыми низкими значениями n и l, и идет в порядке возрастания n+l ;