Слайд 2: Основные положения атомно-молекулярного учения
Вещества состоят из молекул, а молекулы из атомов. Молекула –мельчайшая частица вещества, сохраняющая состав и свойства данного вещества, физически неделимая. Атом - мельчайшая частица вещества, химически неделимая. При физических явлениях состав веществ не изменяется, при химических явлениях- изменяется, из одних веществ получаются другие. Молекулы и атомы находятся в постоянном, хаотическом движении.
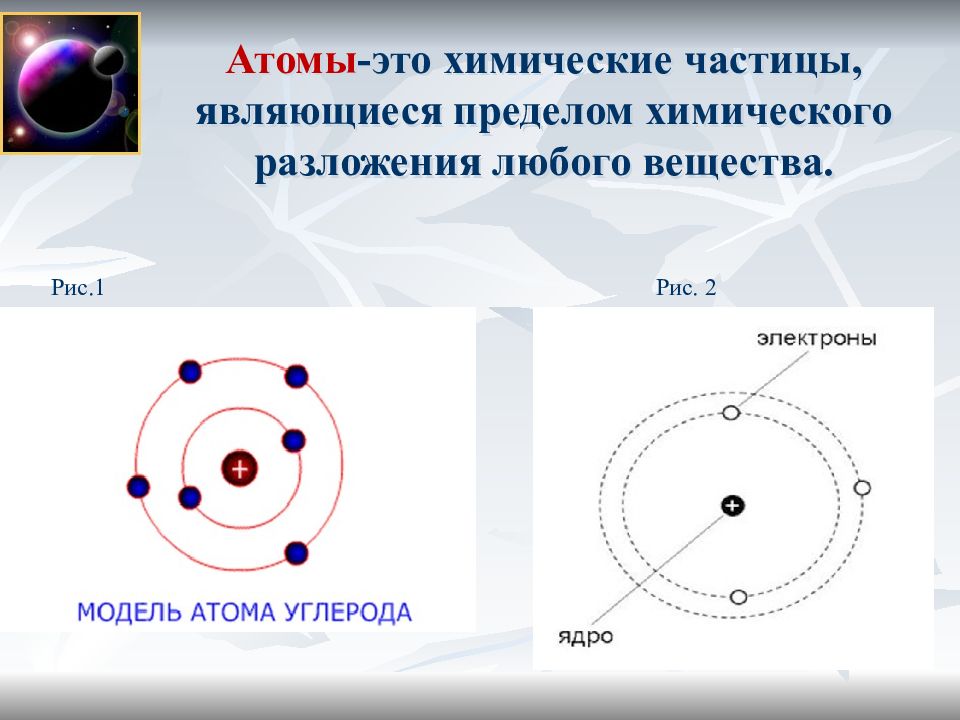
Слайд 3: Атомы -это химические частицы, являющиеся пределом химического разложения любого вещества
Рис. 2 Рис.1
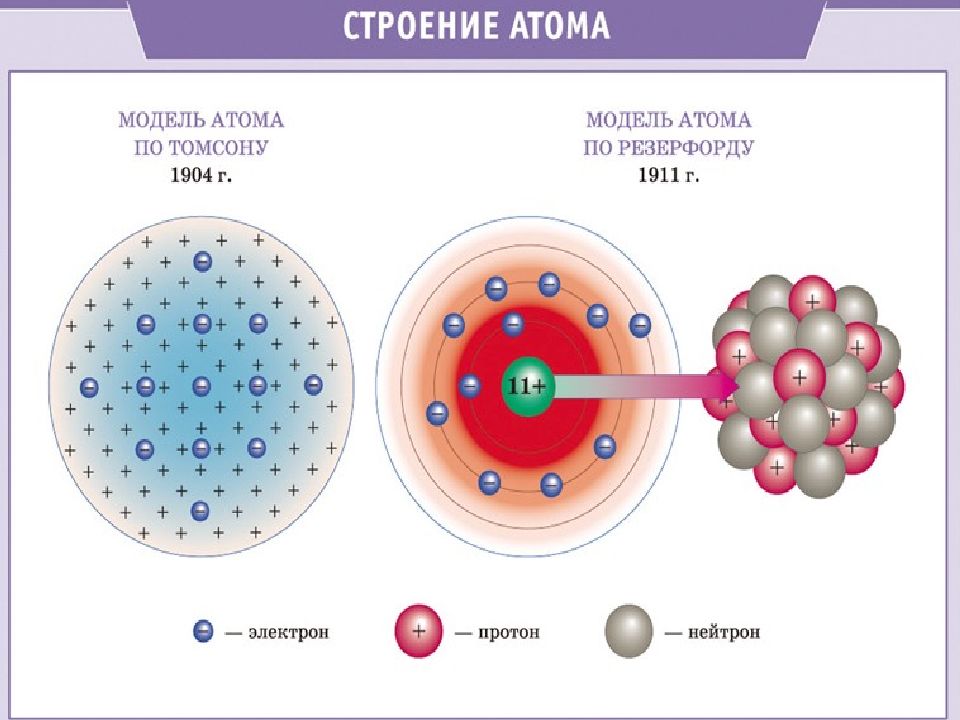
Слайд 8: Планетарная модель атома
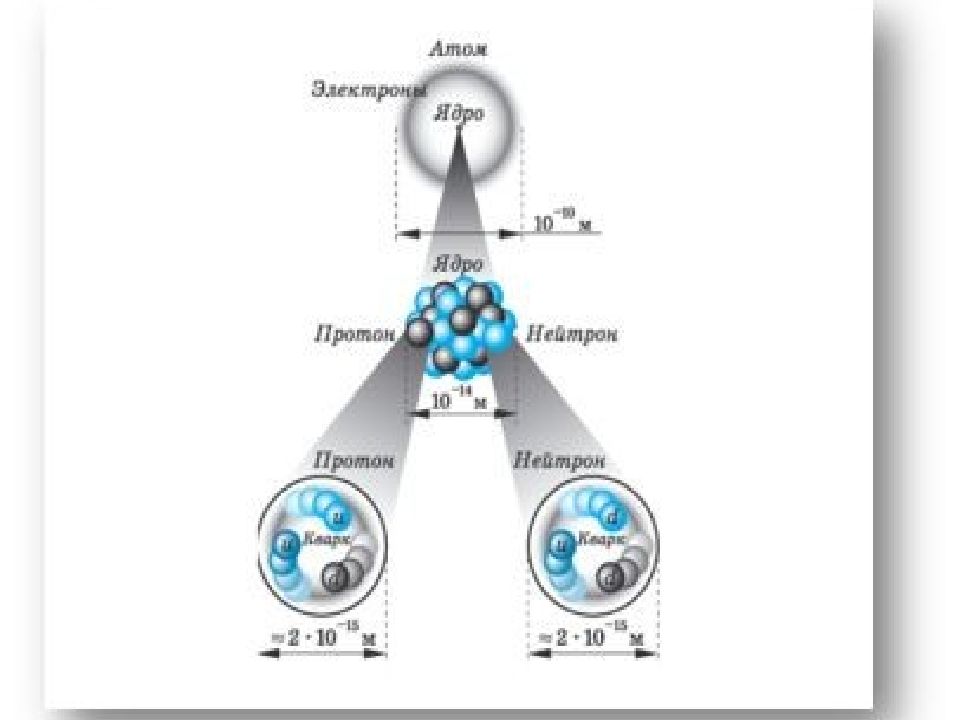
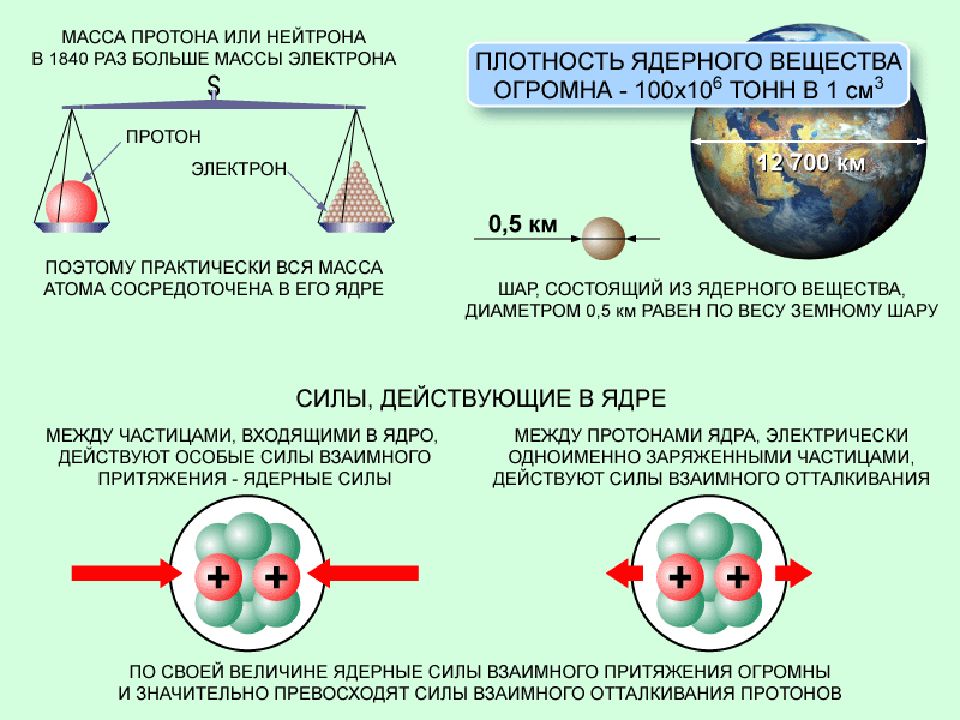
Атом –это микрочастица, которая имеет форму шара. Атом –сложная система, состоящая из ядра и электронов. Ядро находится в центре атома и имеет очень маленький размер, но почти вся масса атома сосредоточена в ядре. Ядро имеет положительный заряд, величина которого определяется числом протонов в нем. Электроны движутся вокруг ядра, имеют ничтожно малую массу и размеры, обладают отрицательным зарядом. Атом –нейтральная частица, поэтому число протонов и электронов в атоме одинаково. Порядковый номер элемента показывает: положение элемента в периодической системе, количество протонов и электронов в атоме химического элемента.
Слайд 9: Изотопы
состав изотопов хлора: 35 С l и 37 С l 17 35 С l( 17 p + + 18 n 0 ) 17е - А=35 17 37 С l( 17 p + + 20 n 0 ) 17е - А=37 Атомы изотопов одного элемента имеют одинаковое число протонов и электронов, но разное число нейтронов. Химический элемент- это совокупность атомов с одинаковым зарядом ядер атомов.
Слайд 11: Строение атома с точки зрения квантовой механики
В квантовой механике электрон рассматривается и как частица, и как волна.
Слайд 12
Строение энергетического уровня(электронной оболочки) атома Орбиталь – это пространство вокруг ядра атома, где наиболее часто бывает электрон. Каждой орбитали соответствует электронное облако. Различают 4 формы( типа) орбиталей ( в невозбужденном состоянии) : s ( 1 шт. ), p ( 3 шт. ), d ( 5 шт. ) и f ( 7 шт. ). Задание: зарисовать s и p ( Р х, Р у, Р z ) Энергетический уровень – близкие по размеру орбитали образуют один энергетический уровень ( электронный слой).
Слайд 13
Для описания положения электронов в атоме используют 4 квантовых числа : Главное квантовое число n определяет уровень энергии, которому отвечает данная орбита, и ее удаленность от ядра. Орбитальное, побочное l (или азимутальное квантовое число) характеризует момент количества движения электрона относительно центра орбиты. Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве. Спиновое квантовое число s определяет направление вращения электрона, может принимать только два значения: 1/2 и -1/2.
Слайд 14: Строение энергетического уровня( электронной оболочки ) атома 1. Номер Энергетического уровня равен номеру химического элемента в таблице Д.И. Менделеева. 2. Число электронов в атоме равно порядковому номеру химического элемента в таблице. Пример :Х имический элемент кислород- № 8 (в таб. Д.И.Менделеева) распололожен во 2 периоде. Значит, все 8 эектронов атома кислорода распределены по 2 энергетическим уровням. 3. Каждый энергетический уровень делится на ПОДУРОВНИ. (Подуровень- это форма орбитали : S, P, D, F ). Подуровней( форм орбиталей ) в уровне столько, каков номер уровня( каков номер периода элемента в таблице) т.е.- число подуровней в уровне равно номеру уровня и равно номеру периода элемента в таблице Д.И. Менделеева Пример :Х имический элемент кислород- № 8 расположен во 2 периоде.Зачит, на 1 энергетическом уровне 1 подуровень ( т.е. 1 форма орбитали - s).На 2 энергетическом уровне 2 подуровня (т.е. 2 формы орбиталей - s и р.А всего орбиталей на 2 уровне -4: 1 шт. s + 3 шт.р )
Слайд 15
1 период таблицы - 1 энергетический уровень в атоме - 1 подуровень(1 форма орбитали - S ) 2 период таблицы - 2 энергетических уровня- 2 подуровня (2 формы орбиталей - S, P ) 3 период таблицы - 3 энергетических уровня- 3 подуровня ( 3 формы орбиталей - S, P d ) 4 период таблицы -4 энергетических уровня- 4 подуровня (4 формы орбиталей - S P d f ) 1 - 3 - 5 - 7 Число орбиталей 1 - 3 - 5 - 7
Слайд 16
Порядок заполнения электронами орбиталей атома определяется тремя законами природы: 1. Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей. 2. Принцип Паули - на одной орбитали не может быть больше двух электронов. 3. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Слайд 17
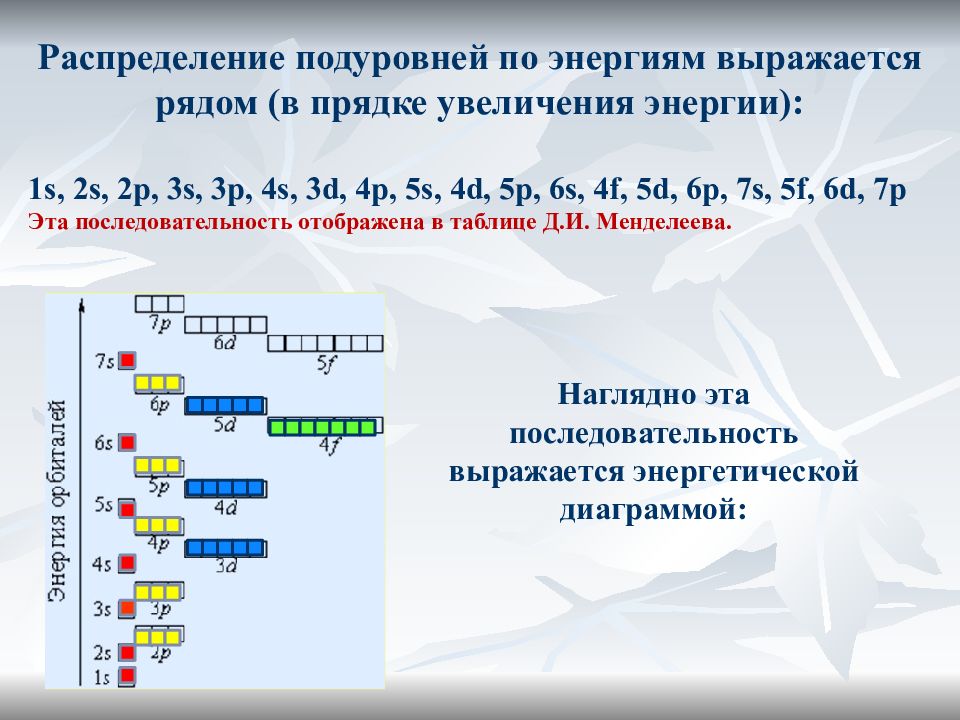
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p Эта последовательность отображена в таблице Д.И. Менделеева. Наглядно эта последовательность выражается энергетической диаграммой:
Слайд 18: 1.вещество состоит из огромного количества частиц(атомов и молекул), между которыми есть промежутки; 2.молекула вещества состоит из атомов одного или нескольких химических элементов; 3.атомы одного химического элемента одинаковы, молекулы одного в ещества одинаковы; 4.при увеличении температуры тела промежутки между частицами увеличиваются; 5.молекулы и атомы имеют очень маленькие размеры, их можно сфотографировать с помощью электронного микроскопа;
Запомни:
Последний слайд презентации: Строение атома. Элементы квантовой механики: 1.Вещества состоят из атомов, ионов, молекул ; 2.атомы имеют сложное строение, определенный вид атомов называют химическим элементом; 3.Атомы химических элементов отличаются по физическим и химически м свойствам ; 4. атомы, взаимодействуя друг с другом, образуют соединения- простые и сложные вещества ; 5. частицы вещества находятся в непрерывном хаотическом движении и, в зависимости от энергии, могут придавать веществу то или иное агрегатное состояние; 6. вещества отличаются друг от друга по физическим и химическим свойствам
Выводы: